La relación entre la enfermedad inflamatoria intestinal (EII) y los trastornos linfoproliferativos (TL) se ha reportado previamente.
ObjetivosEstablecer la incidencia de TL en una unidad de EII y describir sus características clínicas.
Material y métodosSe utilizaron el registro de datos de la consulta monográfica de EII y las historias clínicas. En todos los casos, el diagnóstico de EII se realizó mediante los criterios habituales.
ResultadosSe identificaron 7 casos de TL en 911 pacientes con EII. Cinco eran varones, 4 tenían colitis ulcerosa y 3, enfermedad de Crohn. El tiempo medio entre el diagnóstico de la EII y el TL fue de 4,82 años (rango [r]: 0–20). La edad media al diagnóstico del TL fue de 53 años (r: 33–76). Cuatro de los TL estaban limitados al tracto gastrointestinal. Sólo uno fue linfoma de Hodgkin. Cinco pacientes habían recibido tiopurinas y 4 habían recibido, además, agentes biológicos. Tres de los casos se encontraron asociados a infección por el virus de Epstein Barr (VEB). La incidencia estimada de TL en esta serie de pacientes fue de 81,74/100.000. Tras un tiempo medio de 32,3 meses (r: 5–57) después del último tratamiento para el TL, todos los pacientes menos uno se encuentran en remisión de su enfermedad hematológica.
DiscusiónLa incidencia de TL en pacientes con EII fue más elevada que la esperada para la población general (81,74 versus 22). Posiblemente en su patogénesis participen la inflamación crónica, el uso de medicamentos modificadores de la respuesta inmunitaria y la infección por el VEB.
The relationship between inflammatory bowel disease (IBD) and lymphoproliferative disorders (LD) has been previously reported.
AimsTo establish the local incidence of LD in an IBD unit, and to describe the clinical characteristics of observed cases.
Material and methodsAll the clinical records of patients with ulcerative colitis (UC) or Crohn's disease (CD) followed-up in a tertiary center were reviewed. In all cases, IBD had been diagnosed according to standard criteria.
ResultsOf 911 patients with IBD, we identified seven with lymphoma. Five of the patients were men, four had been diagnosed with UC and three with Crohn's disease. The mean time from IBD to lymphoma diagnosis was 4.82 years (r: 0–20). The mean age at lymphoma diagnosis was 53 years (r: 33–76). Four were colorectal lymphomas. There was only one case of Hodgkin's disease. Five patients had been treated with thiopurines, and four of these had also been treated with biological agents. Three cases were associated with Epstein-Barr (EBV) virus infection. The estimated incidence of LD in these IBD patients was 81.74/100,000/year. After a mean follow-up of 32.3 months (r: 5–57) following the last treatment for LD, all patients except one are in remission.
DiscussionThe incidence rate of LD was much higher than the expected rate for the general population (81.74 vs. 22). Chronic inflammation, immune-modifying drugs and Epstein Barr virus infection may be implicated in the pathogenesis of this disease.
En 1928 se describió el primer caso de linfoma en el contexto de enfermedad inflamatoria intestinal (EII)1. A partir de ahí se comunicaron varios casos que generaron controversia en cuanto a la asociación entre linfomas y EII. El motivo por el que los pacientes con EII tendrían un riesgo aumentado de presentar trastornos linfoproliferativos (TL) es desconocido, y se postula que éstos podrían aparecer secundariamente a la reacción inflamatoria crónica. Por otro lado, se trata a los pacientes con EII con múltiples agentes, incluyendo inmunodepresores, como azatioprina (AZA) y 6-mercaptopurina (6-MP), y agentes biológicos. La mejor comprensión de los mecanismos fisiopatológicos de la EII ha llevado a que el uso de medicamentos modificadores de la respuesta inmunitaria sea un pilar fundamental de tratamiento. Si bien los beneficios de estas terapias son incuestionables, han traído aparejada la aparición de complicaciones que en algunos casos pueden ser graves, como los TL asociados a la inmunodepresión2.
Un tercer factor que entra en el escenario es el virus de Epstein Barr3 (VEB), factor de riesgo reconocido para el desarrollo de TL asociados a la inmunodepresión y al postrasplante4–6.
Teniendo en cuenta estas consideraciones, el objetivo de nuestro trabajo fue establecer la incidencia de TL en una consulta monográfica de EII y describir las características clínicas de los casos observados.
Material y métodosLa información se obtuvo del registro prospectivo informatizado de la Unidad de EII del Hospital Universitario Ramón y Cajal, Madrid (hospital terciario) y de las historias clínicas de los pacientes. En todos los casos, el diagnóstico de EII se realizó de acuerdo con los criterios de Lennard-Jones7 y se confirmó con el seguimiento. Las características de estos pacientes se encuentran resumidas en la tabla 1.
Características de los pacientes seguidos en la unidad de enfermedad inflamatoria intestinal
| EC: 507 pacientes |
| CU: 386 pacientes |
| Colitis indeterminada: 18 pacientes |
| Tiempo medio de seguimiento: 9,4 años |
| Uso de inmunosupresores: 41,5% |
| Resección quirúrgica: 24,6% |
| Uso de agentes biológicos: 12,5% |
CU: colitis ulcerosa; EC: enfermedad de Crohn.
Cuando se utilizaron tiopurinas, la dosis fue de 2-2,5mg/kg/día de AZA y 1-1,5mg/kg/día de 6-MP. Los pacientes que recibieron infliximab lo hicieron a una dosis de 5mg/kg en las semanas 0, 2 y 6, seguido de mantenimiento cada 8 semanas. Un paciente recibió adalimumab con pauta de inducción (160/80mg), seguido de mantenimiento con 40mg subcutáneos cada 2 semanas.
En los casos que se realizó estudio del VEB, éste se hizo mediante inmunohistoquímica sobre el material histológico.
El comité ético de investigación clínica del centro aprobó el presente trabajo.
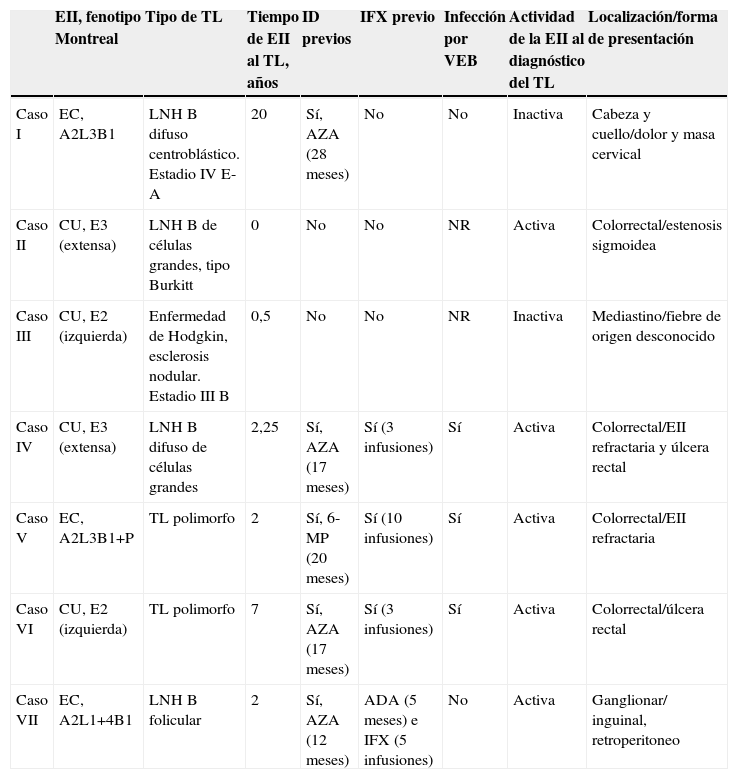
ResultadosSe identificaron 7 casos de linfoma (tabla 2) entre 911 pacientes durante un tiempo medio de seguimiento de 9,4 años (rango [r]: 1–53), equivalente a 8563 años-paciente. Cinco de los pacientes eran varones, 4 tenían diagnóstico de colitis ulcerosa y 3 de enfermedad de Crohn (EC). Cuatro fueron linfomas colorrectales y 3 linfomas ganglionares. Uno de los casos fue un linfoma de Hodgkin, mientras que los 6 restantes fueron linfomas no hodgkinianos. El tiempo medio desde el diagnóstico de la EII al diagnóstico del linfoma fue de 4,82 años. Tres de los pacientes presentaron infección por el VEB en la mucosa cólica, en 2 no se estudió la infección por VEB y en 2 fue negativa.
Características clínicas de los pacientes con trastornos linfoproliferativos
| EII, fenotipo Montreal | Tipo de TL | Tiempo de EII al TL, años | ID previos | IFX previo | Infección por VEB | Actividad de la EII al diagnóstico del TL | Localización/forma de presentación | |
| Caso I | EC, A2L3B1 | LNH B difuso centroblástico. Estadio IV E-A | 20 | Sí, AZA (28 meses) | No | No | Inactiva | Cabeza y cuello/dolor y masa cervical |
| Caso II | CU, E3 (extensa) | LNH B de células grandes, tipo Burkitt | 0 | No | No | NR | Activa | Colorrectal/estenosis sigmoidea |
| Caso III | CU, E2 (izquierda) | Enfermedad de Hodgkin, esclerosis nodular. Estadio III B | 0,5 | No | No | NR | Inactiva | Mediastino/fiebre de origen desconocido |
| Caso IV | CU, E3 (extensa) | LNH B difuso de células grandes | 2,25 | Sí, AZA (17 meses) | Sí (3 infusiones) | Sí | Activa | Colorrectal/EII refractaria y úlcera rectal |
| Caso V | EC, A2L3B1+P | TL polimorfo | 2 | Sí, 6-MP (20 meses) | Sí (10 infusiones) | Sí | Activa | Colorrectal/EII refractaria |
| Caso VI | CU, E2 (izquierda) | TL polimorfo | 7 | Sí, AZA (17 meses) | Sí (3 infusiones) | Sí | Activa | Colorrectal/úlcera rectal |
| Caso VII | EC, A2L1+4B1 | LNH B folicular | 2 | Sí, AZA (12 meses) | ADA (5 meses) e IFX (5 infusiones) | No | Activa | Ganglionar/ inguinal, retroperitoneo |
6-MP: 6-mercaptopurina; ADA: adalimumab; AZA: azatioprina; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; ID: inmunodepresores; IFX: infliximab; LNH: linfoma no hodgkiniano; NR: no reportada; TL: trastorno linfoproliferativo; VEB: virus de Epstein Barr.
La edad media al diagnóstico del TL fue de 53 años (r: 33–76). Se había tratado previamente a 5 de los pacientes con tiopurinas; de éstos, 3 recibieron infliximab y uno, infliximab y adalimumab. La incidencia estimada de linfomas fue de 81,74 casos por 100.000 pacientes por año.
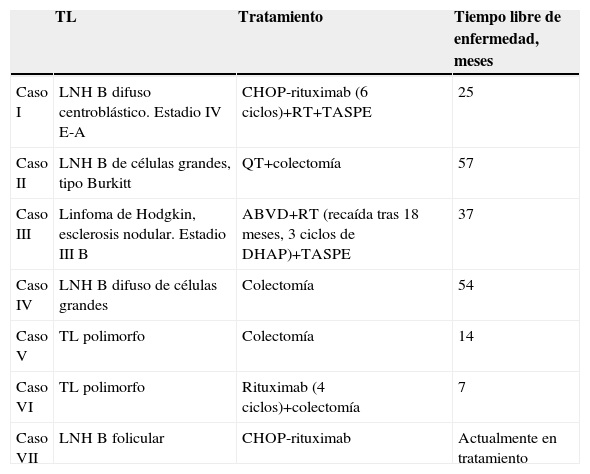
En la tabla 3 se muestra el tratamiento recibido tras el diagnóstico del TL.
Tratamiento recibido tras el diagnóstico del trastorno linfoproliferativo
| TL | Tratamiento | Tiempo libre de enfermedad, meses | |
| Caso I | LNH B difuso centroblástico. Estadio IV E-A | CHOP-rituximab (6 ciclos)+RT+TASPE | 25 |
| Caso II | LNH B de células grandes, tipo Burkitt | QT+colectomía | 57 |
| Caso III | Linfoma de Hodgkin, esclerosis nodular. Estadio III B | ABVD+RT (recaída tras 18 meses, 3 ciclos de DHAP)+TASPE | 37 |
| Caso IV | LNH B difuso de células grandes | Colectomía | 54 |
| Caso V | TL polimorfo | Colectomía | 14 |
| Caso VI | TL polimorfo | Rituximab (4 ciclos)+colectomía | 7 |
| Caso VII | LNH B folicular | CHOP-rituximab | Actualmente en tratamiento |
ABVD: adriamicina-bleomicina-vincristina-dexametasona (adriamycin-bleomycin-vinblastine-dacarbazine); CHOP: ciclofosfamida-doxorrubicina-vincristina-prednisona (cyclophosphamide-hydroxydoxorubicin-oncovin [vincristine]-prednisone); DHAP: dexametasona-altas dosis de citarabina-cisplatino (dexamethasone-high dose cytarabine [ara-C]-cisplatin); LNH: linfoma no hodgkiniano; QT: quimioterapia; RT: radioterapia; TASPE: trasplante autólogo de precursores hematopoyéticos; TL: trastorno linfoproliferativo.
En los pacientes con linfoma colorrectal el diagnóstico se confirmó en la pieza quirúrgica en 3 de los casos, mientras que el restante, ya publicado previamente8, tras la suspensión del tratamiento inmunosupresor y biológico, en la pieza quirúrgicase objetivó remisión del TL.
Luego de un seguimiento medio de 32,3 meses (r: 5–57) tras el último tratamiento, todos los pacientes se encuentran en remisión de su enfermedad hematológica, a excepción de uno, que al momento de la elaboración de este manuscrito se encontraba en tratamiento quimioterapéutico.
DiscusiónActualmente se postula que las EII ocurren como resultado de la predisposición genética a la iniciación de una respuesta inflamatoria que se mantiene en el tiempo en forma aberrante a algún tipo de antígeno de la luz intestinal9. Como complicación, esta inflamación crónica puede llevar a la transformación neoplásica10. A esto debemos agregar que los pacientes con EII frecuentemente están expuestos a medicamentos que aumentan el riesgo de TL.
Basados en estudios poblacionales, los datos disponibles actualmente son contradictorios en cuanto a la hipótesis de que la EII sea por sí misma un factor de riesgo para el desarrollo de linfomas11,12. Sin embargo, no está claro si los pacientes con EII más grave y prolongada presentan un riesgo aumentado con respecto a los pacientes con enfermedad más leve.
A 5 de los 7 casos aquí descritos se los había tratado con inmunosupresores y a 4 de éstos, además, con agentes biológicos, lo que pone de manifiesto que en su mayoría se trataba de pacientes con EII de difícil control. De hecho, todos los pacientes con linfoma colorrectal presentaban una EII activa al momento del diagnóstico del TL.
Debemos tener en cuenta que los inmunodepresores y los agentes biológicos se utilizan en los casos más graves de EII. Esto dificulta establecer si el aumento del riesgo de TL se debe exclusivamente a inflamación crónica producida por la EII, a la inmunodepresión o a la combinación de ambas sumadas a algún agente externo, como el VEB.
En un metaanálisis, Kandiel et al13 demostraron un incremento de 4 veces en el riesgo de linfomas en pacientes con EII tratados con AZA o 6-MP. Estos hallazgos coinciden con los reportados en nuestro trabajo, en el que la incidencia estimada de linfomas fue de 81,74 casos por 100.000 pacientes por año, casi 4 veces más elevada que la esperada para la población sin EII, que se encuentra en torno a 2214.
Otros modificadores de la respuesta inmunitaria, como los anti-TNF, también parecen incrementar el riesgo de TL15. En el registro TREAT (Crohn's Therapy Resource, Evaluation and Assessment Tool) se informó de un riesgo relativo de 1,3 de desarrollar TL16.
La presencia de ADN del VEB en el genoma de pacientes con TL postrasplante o en tratamiento inmunodepresor17 se ha documentado bien, al igual que la asociación entre EII y el desarrollo de TL relacionados con el VEB18. En pacientes trasplantados, el valor de la carga viral del VEB, es considerado un predictor positivo independiente del riesgo de linfoma no hodgkiniano19. Un estudio realizado para evaluar si en la EC se hallaban valores más altos de carga viral de VEB no encontró diferencia en los resultados obtenidos comparados con pacientes libres de enfermedad ni tampoco aumento significativo de la carga viral en relación con el tratamiento con infliximab. Sin embargo, sí se encontraron casos con carga viral muy elevada en algunos pacientes con EC grave refractaria con requerimiento de inmunosupresores20,21. De estos datos se podría inferir que la inflamación activa local, sumada a una carga viral muy elevada favorecida por la inmunodepresión, podría sembrar el campo para la posterior transformación linfomatosa.
Los casos de los 3 pacientes aquí publicados que presentaron VEB en la mucosa cólica desarrollaron TL colorrectales y los 3 casos habían tenido exposición a tratamiento combinado con tiopurinas y agentes biológicos. Con todas las limitaciones, nuestros hallazgos indican una posible relación entre el uso combinado de tiopurinas y agentes biológicos y el desarrollo de TL asociados a VEB.
Recientemente se ha reportado una forma rara de TL: el linfoma hepatoesplénico de células T. Este tipo de linfoma afecta predominantemente a varones de 10 a 30 años22, principalmente en tratamiento combinado con inmunodepresores y agentes biológicos, y no se ha visto en pacientes tratados en monoterapia con infliximab23.
Es difícil describir unas características generales del paciente que desarrolla un TL, aunque se debería al menos sospechar en casos de EII refractaria, ante la aparición de úlceras cólicas o de intestino delgado de características atípicas a pesar de biopsias negativas, la aparición de adenopatías o de fiebre de origen desconocido.
Dada la frecuencia de la EII en la población general y el uso creciente de medicamentos que pueden favorecer la aparición de TL en estas entidades, el médico clínico debe conocer las dimensiones de esta posible complicación, el marco en el que ocurre así como la necesidad de un tratamiento interdisciplinario para su resolución.