El trasplante hepático permite la supervivencia a largo plazo (10 años o más) en el 75% de los niños que recibieron trasplantes antes de 2000. El riesgo de mortalidad pasado el primer año es del 4–10% en los siguientes 10–20 años. El rechazo crónico afecta a un 6%. La necesidad de retrasplante tardío es del 3–5%. El seguimiento de los pacientes precisa, sin embargo, abordar diversos problemas en el injerto (inmunológicos, biliares, vasculares) y otros derivados del empleo de inmunosupresores (disfunción renal, síndrome linfoproliferativo). El traslado de los cuidados a especialistas de adultos ocasiona necesidades especiales en la fase de transición. La edad adolescente y de adulto joven asocia problemas de incumplimiento terapéutico. Los especialistas de adulto deben conocer las particularidades del diagnóstico original y de las técnicas quirúrgicas empleadas en el trasplante de niños. La calidad de vida final es globalmente buena pero inferior a la de jóvenes sanos.
Liver transplantation allows long-term survival (10 years or more) in 75% of children receiving transplants before 2000. The risk of mortality after the first year is 4–10% in the next 10–20 years. Chronic rejection affects 6%. The need for late retransplantation is 3–5%. However, the follow-up of these patients involves the management of diverse problems in the graft (immunological, biliary, vascular) and others related to the use of immunosuppressants (renal dysfunction, lymphoproliferative syndrome). The transition from pediatric to adult care generates special needs. Adolescence and young adulthood are associated with a lack of compliance. Adult specialists should be aware of the special features of the original diagnosis and the surgical techniques used in childhood transplantation. Final quality of life is good overall but is lower than that in healthy young persons.
En 1963, Thomas Starzl realizó por primera vez el trasplante hepático en niños. En 1967 un niño sobrevivió más de un año. En la era anterior a la ciclosporina (1967 a 1979) la supervivencia a 2 años en 84 niños trasplantados en Denver era del 30%. A principios de la década de 1980, en coincidencia con la disponibilidad de ciclosporina (el primer fármaco que permitió una inmunosupresión eficaz), el procedimiento comenzó a realizarse en otros centros europeos y americanos. Obtenía un 57–83% de supervivencia1. A mediados de la década de 1980 alcanzó el reconocimiento de terapéutica útil, y los programas de trasplante pediátrico se establecieron en casi todos los países desarrollados. En España, el trasplante en niños empezó en el Hospital Vall d′Hebron de Barcelona (en 1985) y en el Hospital Infantil La Paz de Madrid (en 1986).
Las enfermedades hepáticas graves de los niños tienen generalmente un comienzo neonatal; la progresión rápida de la enfermedad motiva que cerca del 50% de los candidatos sean lactantes y niños menores de 2 años de edad. La accesibilidad al trasplante de los niños, sobre todo de los más pequeños, estuvo muy limitada en la época inicial del procedimiento, en la que solamente era posible el implante de un injerto entero. La discrepancia de tamaño entre donante y receptor se resolvió mediante innovaciones técnicas con diferentes modalidades de reducción del injerto2, una práctica que se generalizó desde mediados de la década de 1990. Además, la escasez de donantes se palió con la realización de trasplantes de donante vivo. El trasplante de donante vivo se aplicó a todos los niños en Japón, a muchos niños en países con especiales dificultades de organización para la obtención de injertos de cadáver, y se introdujo más selectivamente y más recientemente en los programas europeos y americanos.
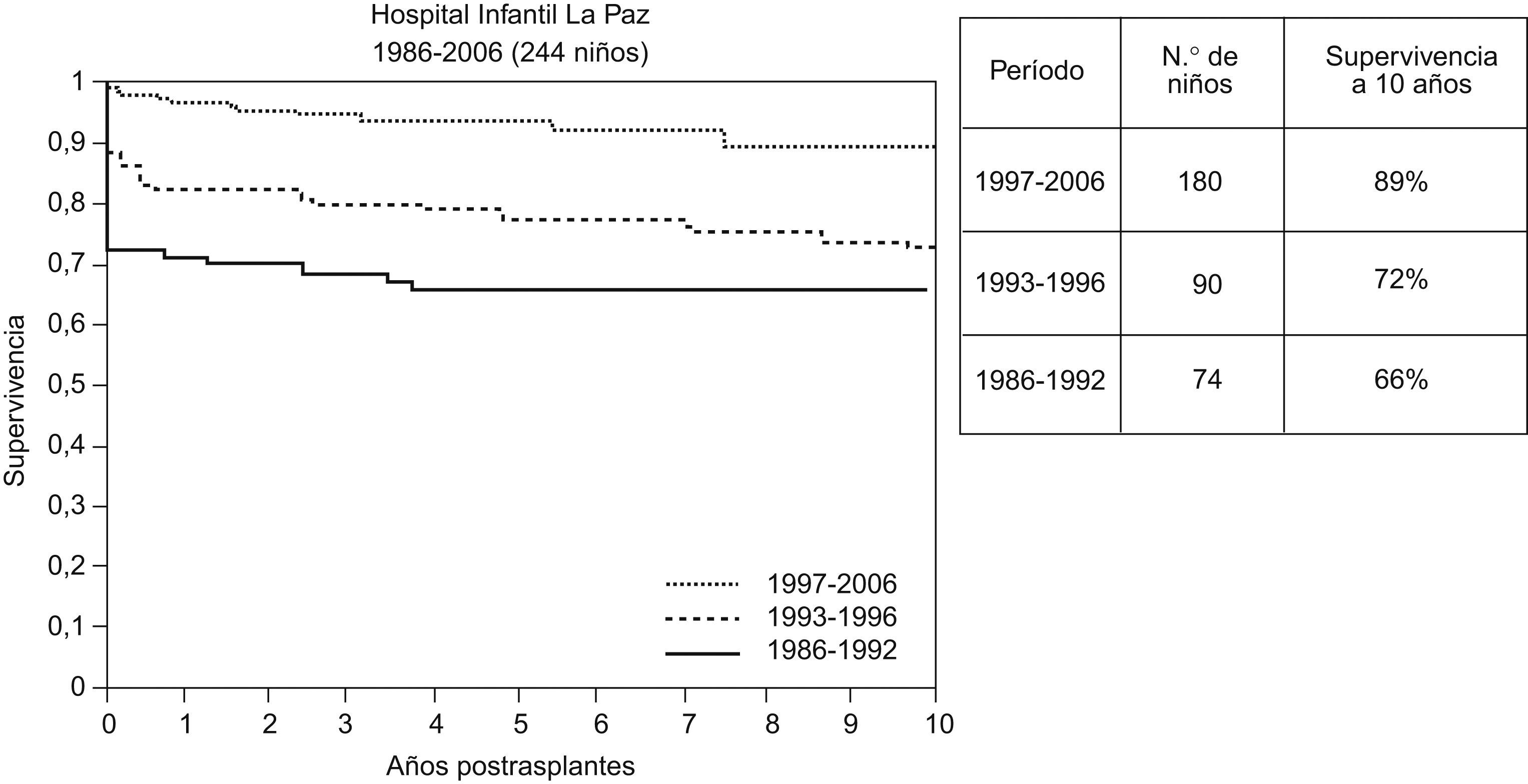
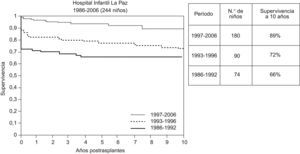
Desde principios de la década de 1990 la disponibilidad del tacrolimus contribuyó a mejorar la supervivencia postrasplante. En los centros pediátricos principales la supervivencia obtenida a largo plazo es mayor del 80%. En la experiencia del Hospital Infantil La Paz la supervivencia a 10 años fue del 89% en la época de 1997–2006 (fig. 1).
Supervivencia de 344 niños trasplantados en el Hospital Infantil La Paz durante 1986–2006, según períodos de actividad: 1986–1992, n=74 (injerto entero, ciclosporina); 1993–1996, n=90 (injerto reducido, ciclosporina y posible tacrolimus de rescate), y 1996–2006, n=180 (todas las modalidades técnicas, tacrolimus). Mejoría en la supervivencia precoz. En todos los períodos hay alta supervivencia a 10 años en los supervivientes un año después del trasplante.
Una característica notable es que la mejoría obtenida en los resultados a lo largo del tiempo radica en la disminución de la mortalidad en el postrasplante inmediato. En todas las épocas de la historia del trasplante, los niños supervivientes un año son, en el 90% de los casos, supervivientes a muy largo plazo.
Actualmente, el número de niños trasplantados atendidos en el largo plazo es 10 veces mayor que los trasplantados recientes. La transición del cuidado a especialistas de adultos forma parte de la actividad habitual, y los especialistas de adulto deben conocer cada vez más las especiales características de estos pacientes, en muchos aspectos distintas a las de los que reciben trasplante en edad adulta. Una de las características que deben chequearse siempre es la anatomía del injerto y de la reconstrucción biliar. En el trasplante pediátrico, el 95% de los casos tiene un asa en Y de Roux anastomosada al conducto hepático común o al hepático izquierdo, lo que hace imposible realizar CPRE; la terapéutica no invasiva de la vía biliar se realiza por vía transhepática. En otras ocasiones hay más de un conducto biliar anastomosado de forma independiente al asa yeyunal. En los injertos reducidos, la zona de corte de parénquima queda cicatricial, en una posición posterolateral, y es ahí donde se encuentra el hilio hepático, con las anastomosis arteriales y venosas, por lo que una biopsia solamente debe realizarse con control ecográfico y las exploraciones no invasivas para evaluar fibrosis deben asegurar que no exista interposición del asa o la zona de corte. La cava original del paciente es preservada en el caso de emplear un injerto reducido, la anastomosis de suprahepáticas es terminolateral a la cava propia, de forma que una posible enfermedad de retorno venoso debe buscarse en la unión suprahepática-cava.
El trasplante hepático en niños tiene el reto de lograr una expectativa de vida muy larga con buena calidad. El estado de los pacientes a muy largo plazo es uno de los aspectos necesarios para evaluar. La enfermedad pediátrica primaria que motiva el trasplante no recurre en el injerto. Muchas de las complicaciones que inciden a corto y largo plazo están relacionadas con la necesidad de inmunosupresión.
Los estudios a largo plazo sobre la situación del injerto y del paciente en su globalidad corresponden a los trasplantados antes de 1995. En esa época, la inmunosupresión primaria estaba generalmente basada en ciclosporina, los niños recibían mayoritariamente injertos enteros y había menos proporción de niños muy pequeños. Algunos aspectos de los resultados a largo plazo, como la inteligencia y la talla final, probablemente sean mejores para los niños trasplantados en épocas más recientes, porque se han beneficiado de tratamientos nutricionales y de una indicación de trasplante más precoz en el curso de su enfermedad. Por otra parte, el trasplante actual, con inmunosupresión primaria basada en tacrolimus, necesita evaluarse específicamente en sus complicaciones tardías.
Descripción general de problemas tardíos y estado a largo plazoUna visión general de la evolución a largo plazo de niños trasplantados es necesaria antes de abordar aspectos concretos. La experiencia en el Hospital Infantil Universitario La Paz (HULP) es en número y resultados semejante a otros centros europeos y americanos, y permite evaluar el conjunto de los problemas aparecidos en el seguimiento y el estado final de los pacientes3.
En el HULP, 164 niños recibieron un primer trasplante hepático en el período 1/1986 a 12/1996. Estos pacientes se evaluaron en 2006. El 70% sobrevivía a los 10 años del trasplante. En la cohorte de 74 niños trasplantados entre 1986 y 1992, la supervivencia a 10 años era del 66% y a 20 años era del 60%. En la cohorte de 90 niños trasplantados entre 1993 y 1996 la supervivencia a 10 años era del 72% (fig. 1).
Hubo 127 niños supervivientes un año después del trasplante. En el seguimiento posterior a un año (1 a 20 años) fue necesario retrasplante en 4 casos (3,1%) y hubo mortalidad tardía (entre 1 y 20 años postrasplante) en 14 casos (11%) (tabla 1). Los problemas del injerto, especialmente por rechazo crónico, fueron importantes determinantes de retrasplante y de mortalidad. Tres de los niños retrasplantados y 4 de los niños fallecidos presentaban rechazo crónico, uno de ellos debido a la retirada de inmunosupresión para el tratamiento de un síndrome linfoproliferativo postrasplante (PTLD). Otros motivos de mortalidad tardía fueron infecciosos, neurológicos o por PTLD3.
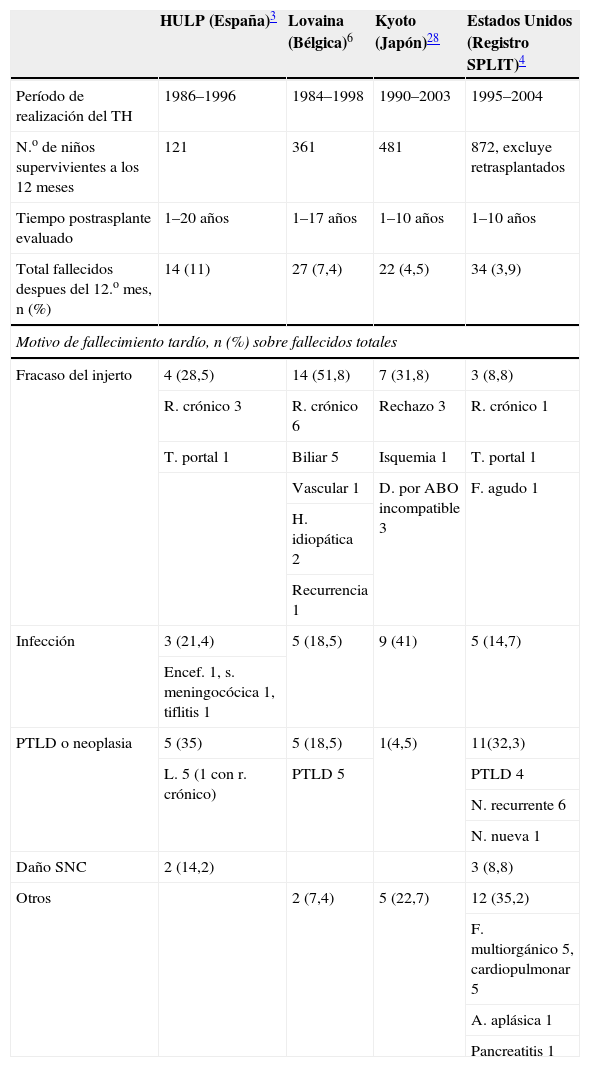
Riesgo de mortalidad tardía en diferentes series pediátricas
| HULP (España)3 | Lovaina (Bélgica)6 | Kyoto (Japón)28 | Estados Unidos (Registro SPLIT)4 | |
| Período de realización del TH | 1986–1996 | 1984–1998 | 1990–2003 | 1995–2004 |
| N.o de niños supervivientes a los 12 meses | 121 | 361 | 481 | 872, excluye retrasplantados |
| Tiempo postrasplante evaluado | 1–20 años | 1–17 años | 1–10 años | 1–10 años |
| Total fallecidos despues del 12.o mes, n (%) | 14 (11) | 27 (7,4) | 22 (4,5) | 34 (3,9) |
| Motivo de fallecimiento tardío, n (%) sobre fallecidos totales | ||||
| Fracaso del injerto | 4 (28,5) | 14 (51,8) | 7 (31,8) | 3 (8,8) |
| R. crónico 3 | R. crónico 6 | Rechazo 3 | R. crónico 1 | |
| T. portal 1 | Biliar 5 | Isquemia 1 | T. portal 1 | |
| Vascular 1 | D. por ABO incompatible 3 | F. agudo 1 | ||
| H. idiopática 2 | ||||
| Recurrencia 1 | ||||
| Infección | 3 (21,4) | 5 (18,5) | 9 (41) | 5 (14,7) |
| Encef. 1, s. meningocócica 1, tiflitis 1 | ||||
| PTLD o neoplasia | 5 (35) | 5 (18,5) | 1(4,5) | 11(32,3) |
| L. 5 (1 con r. crónico) | PTLD 5 | PTLD 4 | ||
| N. recurrente 6 | ||||
| N. nueva 1 | ||||
| Daño SNC | 2 (14,2) | 3 (8,8) | ||
| Otros | 2 (7,4) | 5 (22,7) | 12 (35,2) | |
| F. multiorgánico 5, cardiopulmonar 5 | ||||
| A. aplásica 1 | ||||
| Pancreatitis 1 | ||||
A. aplásica: anemia aplásica; D. por ABO incompatible: daño por ABO incompatible; Encef.: encefalitis; F. agudo: fallo agudo; F. multiorgánico: fallo multiorgánico; H. idiopática: hepatitis idiopática; HULP: Hospital Infantil Universitario La Paz; L. 5: linfoma 5; N. recurrente: neoplasia recurrente; N. nueva: neoplasia nueva; PTLD: síndrome linfoproliferativo postrasplante; R. crónico: rechazo crónico; T. portal: trombosis portal; S. meningocócicas: sepsis meningocócica; SNC: sistema nervioso central; SPLIT: Studies of Pediatric Liver Transplantation; TH: trasplante hepático.
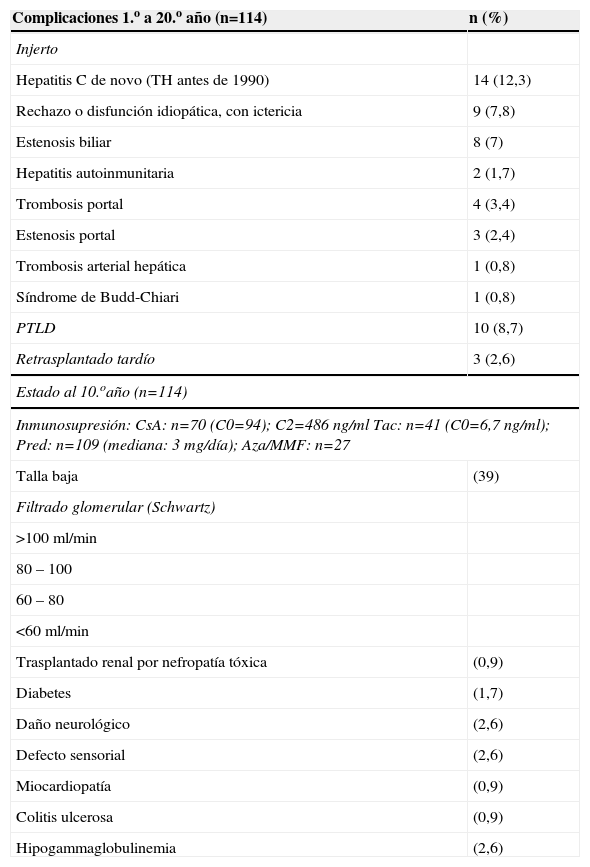
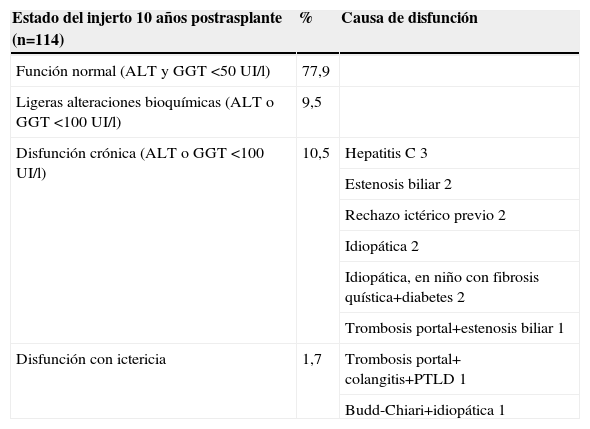
Al evaluar a los supervivientes a los 10 años (114 pacientes) y 15 años (33 pacientes), en estos niños habían ocurrido hasta entonces las siguientes complicaciones tardías: PTLD (9,6%), estenosis biliar (8,7%), disfunción ictérica del injerto, idiopática o atribuible a rechazo (8,7%), hepatitis autoinmune (HAI) de novo (1,7%), trombosis portal (3,4%), estenosis portal (2,4%), estenosis de cava o suprahepáticas (0,8%) y trombosis arterial hepática (0,8%) (tabla 2). El estado del injerto era excelente, con bioquímica rigurosamente normal, en el 78% de los casos evaluados a los 10 años, y en el 67% de los casos evaluados a los 15 años (tabla 3)3.
Complicaciones ocurridas en el seguimiento tardío (posterior a un año) en 114 niños supervivientes 10–20 años después del trasplante
| Complicaciones 1.o a 20.o año (n=114) | n (%) |
| Injerto | |
| Hepatitis C de novo (TH antes de 1990) | 14 (12,3) |
| Rechazo o disfunción idiopática, con ictericia | 9 (7,8) |
| Estenosis biliar | 8 (7) |
| Hepatitis autoinmunitaria | 2 (1,7) |
| Trombosis portal | 4 (3,4) |
| Estenosis portal | 3 (2,4) |
| Trombosis arterial hepática | 1 (0,8) |
| Síndrome de Budd-Chiari | 1 (0,8) |
| PTLD | 10 (8,7) |
| Retrasplantado tardío | 3 (2,6) |
| Estado al 10.oaño (n=114) | |
| Inmunosupresión: CsA: n=70 (C0=94); C2=486ng/ml Tac: n=41 (C0=6,7ng/ml); Pred: n=109 (mediana: 3mg/día); Aza/MMF: n=27 | |
| Talla baja | (39) |
| Filtrado glomerular (Schwartz) | |
| >100ml/min | |
| 80–100 | |
| 60–80 | |
| <60ml/min | |
| Trasplantado renal por nefropatía tóxica | (0,9) |
| Diabetes | (1,7) |
| Daño neurológico | (2,6) |
| Defecto sensorial | (2,6) |
| Miocardiopatía | (0,9) |
| Colitis ulcerosa | (0,9) |
| Hipogammaglobulinemia | (2,6) |
Aza: azatioprina; C0: nivel valle; C2: nivel 2h postdosis; CsA: ciclosporina A; MMF: micofenolato de mofetilo; Tac: tacrolimus; Pred: prednisolona; PTLD: síndrome linfoproliferativo postrasplante; TH: trasplante hepático.
Estado funcional del injerto evaluado al 10.o año postrasplante en 114 niños
| Estado del injerto 10 años postrasplante (n=114) | % | Causa de disfunción |
| Función normal (ALT y GGT <50UI/l) | 77,9 | |
| Ligeras alteraciones bioquímicas (ALT o GGT <100UI/l) | 9,5 | |
| Disfunción crónica (ALT o GGT <100UI/l) | 10,5 | Hepatitis C 3 |
| Estenosis biliar 2 | ||
| Rechazo ictérico previo 2 | ||
| Idiopática 2 | ||
| Idiopática, en niño con fibrosis quística+diabetes 2 | ||
| Trombosis portal+estenosis biliar 1 | ||
| Disfunción con ictericia | 1,7 | Trombosis portal+ colangitis+PTLD 1 |
| Budd-Chiari+idiopática 1 |
ALT: alaninaminotransferasa; GGT: gammaglutamiltranspeptidasa; PTLD: síndrome linfoproliferativo postrasplante.
Además de los problemas del injerto referidos, hubo en los supervivientes insuficiencia renal crónica (filtrado <60ml/min=7,8%), diabetes (1,7%), secuelas neurológicas (2,6%), déficit visual o auditivo (2,6%), enfermedad inflamatoria intestinal (0,9%), adenocarcinoma de colon (0,9%) o miocardiopatía (0,9%). La talla de la evaluación final eratabla 2).
En conjunto, la evolución de los niños muestra que ocurren complicaciones puntuales, no determinadas por un tiempo mayor de seguimiento postrasplante, que inciden en el injerto y pueden solventarse mediante actuación médica, radiología intervencionista o cirugía, de forma que el estado final de los pacientes es predominantemente de función normal del injerto o de leves alteraciones bioquímicas. La complicación que tiene peor respuesta al tratamiento es la disfunción idiopática que motiva ictericia, presumiblemente rechazos tardíos, difíciles de certificar mediante histología, y motivo principal de un retrasplante en el seguimiento prolongado de un paciente trasplantado. El PTLD en niños tiene una frecuencia relevante, pero es baja la proporción de afectados de diabetes e insuficiencia renal grave.
Factores relacionados con fracaso del injerto y mortalidad tardíaLa infección, el síndrome linfoproliferativo y el rechazo crónico son las principales causas de pérdida del injerto y mortalidad tardía en los niños trasplantados.
El registro Studies of Pediatric Liver Transplantation (SPLIT) de Estados Unidos acumula datos de la mayoría de los niños trasplantados en el país desde 1995. En un estudio del período 1995 a 2004 (1.611 niños trasplantados) pudieron evaluar 872 pacientes seleccionados por ser supervivientes más de un año con el primer injerto4. En el 43% el diagnóstico original era atresia biliar. El 34% eran menores de un año de edad al recibir el trasplante. La puntuación de PELD, el score utilizado en niños para estimar el riesgo de fallecimiento por la hepatopatía a corto plazo, era alto (>20) en un 30% de los casos. En el 56% el injerto fue entero.
El seguimiento de esos niños supervivientes un año sin haber necesitado retrasplante osciló entre 12 y 98 meses (mediana de 36 meses) desde el trasplante. En el seguimiento posterior a un año en esta población, la supervivencia del paciente a 5 años fue del 94%; la supervivencia del injerto fue del 89,2%4.
Los motivos de fracaso tardío del injerto (35 casos) fueron diversos; el principal, que supuso el 48% de las pérdidas, fue el rechazo (crónico: 37%, agudo: 11%). Otro 20% se debió a secuelas tras una trombosis de la arteria hepática o a estenosis biliares.
Los niños con más de un episodio de rechazo desde el trasplante tuvieron un riesgo doble de pérdida de injerto. En este estudio no se observaron diferencias en la tasa de fracaso por rechazo tardío, comparado con niños que recibieron inmunosupresión primaria basada en ciclosporina o tacrolimus. Tampoco hubo diferencias en el riesgo de pérdida tardía de injerto global en niños que recibieron injertos reducidos, comparado con injertos enteros, aunque el tipo de injerto sí había condicionado la evolución precoz5.
El análisis de variables relacionadas con pérdida tardía del injerto mostró los siguientes datos predictores significativos independientes: tumor como diagnóstico original, antecedente de rechazo resistente a corticoides, reoperación en los primeros 30 días postrasplante y más de 5 hospitalizaciones en el primer año postrasplante.
Respecto a la mortalidad tardía (34 casos), el 62% de los fallecimientos se debió a recurrencia de la neoplasia que indicó el trasplante (el motivo principal), sepsis, fallo multiorgánico y PTLD (tabla 1). Los factores relacionados con mortalidad pasado un año del trasplante fueron un peso bajo para la edad (<−2 DE) en el momento del trasplante, el diagnóstico original de tumor o de fallo fulminante y la necesidad de hospitalización frecuente en el primer año4.
El riesgo de fallecimiento tardío en niños trasplantados por tumores es 10 veces mayor que en niños trasplantados por atresia biliar; en dos tercios de los casos se debe a recurrencia tumoral y a miocardiopatía tóxica por la quimioterapia recibida en los demás. La indicación de trasplante por neoplasia hepática supuso el 4,6% de esta serie, y hubo recaída con fallecimiento en 6/40 casos supervivientes un año.
Los motivos de fallecimiento tardío en los niños que recibieron un trasplante por fallo agudo fueron infecciosos y por fallo multiorgánico, y su relación con la enfermedad original es oscura. También se desconocen los mecanismos implicados en la menor supervivencia a largo plazo de los niños con mayor alteración nutricional (peso <−2 DE) antes del trasplante.
Los resultados en otras cohortes de niños trasplantados, en épocas anteriores a la evaluada en el registro SPLIT, muestran también que la recurrencia de tumor y el rechazo son los factores más importantes de fracaso tardío. En Lovaina, de la actividad de trasplante entre 1984 y 1998, hubo 376 niños supervivientes más de 3 meses, que se observaron una media de 7,3 años6. La tasa de pérdida de injertos tardía fue del 12,5% (47 injertos). De estos injertos perdidos, 20 lo hicieron entre los 4 y los 12 meses postrasplante y 27 lo hicieron más allá del año postrasplante. La pérdida de injertos descendió del 5,3% (20/376) entre 4 y 12 meses postrasplante al 3,1% (11/356) durante el segundo año y al 1,2% (4/345) durante el tercer año postrasplante. Las tasas de supervivencia al año, a los 5 años y a los 10 años fueron del 95,7, el 91,4 y el 90,4% para pacientes, y del 94,6, el 87,3 y el 86,3% para injertos. La supervivencia de los niños con tumor hepático como indicación del trasplante fue significativamente más baja que en el resto de las indicaciones. El rechazo resistente a corticoides y la enfermedad linfoproliferativa fueron también factores independientes de riesgo para el fallecimiento tardío.
En esa casuística de Lovaina, las causas más frecuentes de pérdida tardía de injertos, con o sin fallecimiento del paciente, fueron la infección (21,2%), el PTLD (21,2%), el rechazo crónico (17%), las complicaciones biliares (14,8%) y la recurrencia tumoral (8,5%) (tabla 1). No se encontraron diferencias en cuanto a las causas de pérdida de injertos entre los diferentes tipos de éstos (entero versus resto de variantes)6.
Procesos patológicos del injerto: inmunológicosDe lo expuesto anteriormente se obtiene como conclusión que la pérdida de injertos y la mortalidad afectan a pocos pacientes que sobreviven al postoperatorio inicial (3–12 meses). El principal motivo es la recurrencia tumoral, pero son cuantitativamente pocos los niños que reciben trasplante por neoplasias. El problema principal para el paciente común es el rechazo refractario a tratamiento. El diagnóstico no es nítido en el comienzo de muchos de esos pacientes.
El reconocimiento inmunitario de antígenos del injerto es presumiblemente el origen de la mayor parte de los procesos de disfunción crónica en niños, puesto que solo de forma excepcional hay infección por virus hepatotropos antes o después del trasplante. Hay unas lesiones histológicas semejantes a hepatitis crónica en muchos pacientes a los que se les realiza biopsia habitual; otras series describen fibrosis progresiva sin inflamación; además, hay pacientes con rechazo agudo, rechazo ductopénico, o HAI de novo.
Histología del injerto: biopsias protocolizadasLa práctica de biopsias protocolizadas en tiempos fijos después del trasplante tiene el objetivo de detectar procesos subclínicos que pueden mejorarse con tratamiento. A pesar de que se han realizado en muchos centros pediátricos, solo recientemente se han publicado los hallazgos. Las diferentes series describen la presencia de inflamación y fibrosis. Hay dificultad para la propia descripción de las lesiones y es desconocido el proceso patológico que tiene lugar. Sorprende la discordancia entre la frecuencia (y a veces gravedad) de las lesiones encontradas en la biopsia y el estado funcional del injerto, que es normal en el 70–80% de los casos.
Recientemente, un grupo de expertos ha establecido unos criterios de consenso para el diagnóstico histológico en las enfermedades del injerto que afectan en el postoperatorio tardío, y reconocen la dificultad de interpretación de la biopsia por la superposición de rasgos entre entidades7.
La primera descripción de hallazgos histológicos en biopsias seriadas se publicó en 2006. Corresponde a 158 niños trasplantados en Birmingham entre 1983 y 1996 que sobrevivieron 5 años8. Los niños recibían inmunosupresión con ciclosporina (nivel valle 60–90ng/ml), y se les había retirado esteroides y azatioprina al tercer mes y 12 mes postrasplante, respectivamente. Las enfermedades que motivaron el trasplante eran las habituales en niños, ningún caso por hepatitis crónica viral. Un 9,5% recibió trasplante por fallo agudo noA noB noC, y un 5% recibió trasplante por enfermedad hepática autoinmunitaria. El 44% tenía un injerto entero, el 56% tenía un injerto reducido de cadáver. El protocolo de seguimiento histológico incluyó biopsia al año, al 5.o año y al 10.o año. En cada evaluación histológica se realizó una determinación de bioquímica hepática, inmunoglobulinas, autoanticuerpos ANA, antimúsculo liso, antimitocondriales y anti-LKM, serología de CMV y EBV y ,en caso de apreciar lesiones de hepatitis crónica, serología de hepatitis B, C y G. El mismo patólogo revisó las biopsias, y las clasificó en las siguientes categorías diagnósticas: normal, cambios leves inespecíficos, hepatitis crónica, rechazo agudo, rechazo crónico, obstrucción biliar, recurrencia de enfermedad previa u otros (tabla 4).
Hallazgos histológicos al 10.o año postrasplante observados en una biopsia de protocolo a todos los supervivientes
| Biopsia protocolo al 10.o año | Birmingham (Reino Unido)8n=64IS=monoterapia con ciclosporina | Bicetre (Francia)11n=215IS=78% ciclosporina, 21% tacrolimus 84% esteroides |
| Normal | 31,3% | 35% |
| Hepatitis crónica | 64%, el 15% de ellos con fibrosis grave | 7% |
| Ninguno hepatitis B o C, el 80%, autoanticuerpos+ | ||
| Rechazo agudo | 0 | 5% |
| Rechazo crónico | 0 | 38%, el 64% de ellos: bioquímica normal |
| Obstrucción biliar | 1,6% | 12%, el 64%: vía biliar dilatada en ECO |
| Recurrencia enfermedad original | 1,6% | 0 |
| Otras | 3,2% (esteatosis, fibrosis, inespecífica) |
Este estudio encontró histología normal o casi normal en el 68, el 45 y el 31% al año, a los 5 años y a los 10 años, respectivamente.
La hepatitis crónica idiopática fue la observación más frecuente; su incidencia aumentó con el tiempo postrasplante y se reportó en 25/113 (22%), 58/135 (43%) y 41/64 (64%) al año, a los 5 años y a los 10 años de seguimiento, respectivamente. Las lesiones de hepatitis crónica se definieron por la presencia de inflamación portal con infiltrado mononuclear, asociado a hepatitis de interfase. El diagnóstico requería que los cambios ductales o vasculares propios de rechazo fueran mínimos o ausentes. La actividad fue leve en el 59%, moderada en el 33% y grave en el 8% de los casos. En los afectados de hepatitis crónica hubo fibrosis en 13/25 (52%), 47/58 (81%) y 37/41 (91%) al año, a los 5 años y a los 10 años, y tras 10 años el 15% tenía cirrosis8.
Los niños con hepatitis crónica no tuvieron cifras de AST significativamente más altas que los niños con histología normal. Los valores mediana de AST en los afectados fueron 52UI/l, 63UI/l, y 48UI/l (1, 5 y 10 años, respectivamente). La causa de esa hepatitis crónica es desconocida, aunque se interpreta como una forma hepatítica de rechazo crónico. En el análisis multivariado, el único dato diferencial fue la positividad de autoanticuerpos, significativamente más frecuente en los niños con hepatitis crónica que en los niños con histología normal (el 72 versus el 13% al 5.o año, el 80 versus el 10% al 10.o año). Solamente 4 pacientes tenían HAI, un diagnóstico que requiere elevación de aminotransferasas y aumento de IgG, además de la positividad de autoanticuerpos y la presencia de lesión histológica.
Otras experiencias publicadas son diferentes a las de la serie de Birmingham. En Chicago efectuaron un estudio conjunto de biopsias realizadas a niños con problemas clínicos del injerto y a un grupo de niños que aceptaron biopsia habitual a pesar de mostrar función hepática normal9. En Groningen analizaron las biopsias al 10.o año de seguimiento en 55 casos, pero su pauta inmunosupresora había sido peculiar, sin emplear inhibidores de calcineurina a partir del 2.o año, la mayoría solamente recibían esteroide y azatioprina10. En Chicago y Groningen, el hallazgo más llamativo fue la fibrosis del injerto no asociada a inflamación. En la serie de Groningen la fibrosis se comprobó progresiva (el 31, el 65 y el 69% a 1, 5 y 10 años) con un 10 y un 29% de casos con fibrosis grave al 5.o y al 10.o año, respectivamente. Según los autores, la fibrosis no tuvo relación con la retirada de la ciclosporina y guardó relación con factores tempranos del trasplante, como el tiempo de isquemia, la edad menor del receptor y el empleo de injerto reducido10. En el estudio de Chicago observaron fibrosis en el 97% de los 63 niños analizados; la fibrosis avanzada (el 22% de los casos, sin llegar a cirrosis en ninguno) guardó relación con un tiempo postrasplante superior a 6 años y presencia de inflamación, sin que factores iniciales, como el tiempo de isquemia o la edad del donante, tuvieran influencia9.
Una serie importante, de 215 pacientes trasplantados entre 1986–1996 en Bicetre (París), se investigó con biopsia habitual al 10.o año de evolución11. En el momento de la biopsia, el 78% recibía ciclosporina (nivel valle de 50ng/ml), el 21% recibía tacrolimus (nivel 4–5ng/ml), y el 84% recibía también esteroide. Un 32% de ellos siempre había mostrado función normal del injerto. En el momento de la biopsia, el 68% de los pacientes tenía bioquímica hepática normal. En la biopsia, el 70% del total de los pacientes tuvo alguna alteración histológica. Hubo función normal con histología normal en 57 pacientes y función normal con histología anormal en 88 casos. El diagnóstico histológico en los 215 casos fue de normalidad en el 35%, rechazo agudo leve en el 5%, rechazo crónico en el 38%, obstrucción biliar en el 12% y hepatitis crónica activa en el 7%.
En conclusión, los resultados de las biopsias protocolizadas han sido diversos en cada serie, pero tienen en común la observación de daño del injerto en muchos pacientes con función normal. Los procesos se han conceptuado como hepatitis crónica idiopática, fibrosis portal progresiva o rechazo crónico incipiente, e indican un deterioro del hígado con el paso del tiempo postrasplante. Es posible que procesos aloinmunitarios sean determinantes de fibrosis del injerto, como sucede en el trasplante renal12.La actitud en los diferentes centros ha sido la de revaluar la inmunosupresión a largo plazo y revisar el cumplimiento terapéutico.
RechazoEl rechazo «agudo» es difícil de demostrar histológicamente en el seguimiento a largo plazo y es más frecuente un diagnóstico de probable rechazo al observar la evolución tras un aumento de la inmunosupresión. La presencia de inflamación centrolobular, necrosis o endotelitis en la vena centrolobular debe hacer pensar en un rechazo tardío13.
La tasa de rechazo agudo tardío comprobado en biopsia o de disfunción con cambios histológicos no completamente específicos que se trata como un rechazo es del 10% anual en diferentes series13–16. La tasa de rechazo tardío no difiere en centros que mantienen o retiran los esteroides.
La tasa de rechazo crónico acumulada, en supervivientes 5 años después del trasplante (realizado en el período 1996–2001), fue del 5% en una serie de 465 niños del registro SPLIT americano17. Similar frecuencia de rechazo crónico tardío se observa en otras series con pautas de inmunosupresión diversas, según la época del trasplante: el 5% en monoterapia con tacrolimus18, el 6% en ciclosporina combinada con esteroide3.
El rechazo crónico es definido como «inicial» o «temprano» en los que presentan ductopenia o distrofia del epitelio biliar en menos de la mitad de los espacios porta o fibrosis centrolobular, perisinusoidal o perivenosa extensas. Un estadio «avanzado» de rechazo crónico se caracteriza por ductopenia en más del 50% de los espacios porta.
Con frecuencia, el rechazo crónico se desarrolla en pacientes con disfunción del injerto inicialmente de etiología oscura. Los cambios histológicos iniciales no son los incluidos en la definición de rechazo crónico precoz en muchos pacientes.
En el HULP, durante el seguimiento de 1 a 20 años en 114 niños trasplantados entre 1986 y 1996, hubo un 11% que desarrolló disfunción ictérica del injerto, sin evidencia de enfermedad biliar o vascular. Se trataron como rechazo, aunque en las biopsias iniciales del proceso los cambios eran de citólisis lobulillar o colestasis, inespecíficos. En el 43% de los afectados (6 casos) progresó y fue motivo de retrasplante tardío (3 pacientes) o fallecimiento (3 pacientes). Un 21% de los afectados por disfunción mantuvo disfunción crónica hasta el final del seguimiento. El otro 36% recuperó la función hepática a normalidad3.
En el Hospital Kings College detectaron una lesión consistente en la pérdida de perivenular cell dropout (PVCD, ‘hepatocitos perivenulares’) muy prevalente (40/88) en biopsias de niños con disfunción del injerto en el largo plazo. Esta lesión puede formar parte de las características de un rechazo tardío, según los criterios de Banff. Era visible en un 66% de los niños que además tenían rasgos histológicos de rechazo, pero el 40% de las biopsias con PVCD sucedía sin signos de rechazo. El tratamiento con aumento de la inmunosupresión obtuvo normalización de la función en el 65% de los casos con PVCD y en el 73% de los casos que no tenían esta lesión19.
Otra experiencia, en Montreal, observó una lesión de hepatitis crónica activa en el 24% de un grupo de 119 niños con disfunción del injerto; los autores concluyeron que la hepatitis de interfase es un hallazgo histológico precedente a cambios de rechazo crónico20.
Otro aspecto importante es que el proceso de rechazo crónico puede ser clínicamente asintomático. En Bicetre, la biopsia habitual al 10.o año en 215 niños observó rechazo crónico en un 38% de los casos11. Los autores refieren que el 64% de los niños con rechazo crónico mostraba función hepática normal. Generalmente, las biopsias a largo plazo coinciden en edad adolescente o de adulto joven, un período de la vida con especiales características que con frecuencia asocian una falta de adherencia al tratamiento inmunosupresor. El problema del incumplimiento hace prever que a pesar de disponer de tacrolimus en las series recientes, las lesiones del hígado a largo plazo puedan ser similares.
Hepatitis autoinmune de novoEn 1998 se describió por primera vez la HAI aparecida postrasplante en pacientes con otra enfermedad original21. Los rasgos son los de la HAI clásica, y el tratamiento eficaz es el habitual para la HAI (esteroide y azatioprina). En 2001 se observó HAI de novo con anticuerpos frente a glutatión-S-transferasa T1 del injerto en pacientes con ausencia de esta enzima en el hígado original, un cambio genético que presenta uno de cada 5 sujetos en la población caucásica22. Las infecciones virales y la medicación continuada con inmunosupresores son otros posibles factores implicados en el desarrollo de HAI postrasplante. La HAI de novo afecta a un 2,3–5,2% de niños, en ambos sexos, y en todos los grupos raciales.
Bajo diferentes pautas inmunosupresoras (ciclosporina o tacrolimus, con o sin esteroide) la tasa de niños trasplantados que tienen autoanticuerpos de algún tipo (ANA, AML, LKM, anti-GPC, etc.) en el seguimiento a largo plazo es muy alta (15–41%)23. La HAI ocurre en un porcentaje bajo de los que tienen autoanticuerpos detectables. Aunque presentar autoanticuerpos aumenta el riesgo de HAI, estos marcadores pueden también indicar un proceso de rechazo crónico, o coexistir con normalidad persistente del injerto.
Un estudio en Toronto de 68 niños trasplantados por enfermedades no autoinmunitarias detectó autoanticuerpos en el 26% de los casos24. Un tiempo postrasplante superior a 4 años fue el único factor asociado a la positividad de esos marcadores. Cinco de los 18 niños con autoanticuerpos desarrolló en el seguimiento un rechazo crónico o una HAI (2 y 3 casos, respectivamente), mientras que estos problemas no aparecieron en ninguno de los niños sin autoanticuerpos. En Birmingham también resultó evidente la mayor incidencia de marcadores de autoinmunidad en chequeos más alejados del trasplante; estos autores llamaron la atención sobre su asociación con hepatitis crónica del injerto, aunque pocos casos cumplían el diagnóstico de HAI8.
En un estudio del grupo de Los Ángeles, 41 de 619 niños (6,6%) tuvieron HAI de novo tras 7 años postrasplante como media25. La alteración analítica consistió en elevación de AST y ALT, con valores medios de 291 y 317UI/l, respectivamente, sin ictericia en la mayoría (la cifra de bilirrubina total media fue de 1,5mg/dl). Comparando los pacientes con HAI con un grupo control sin HAI observaron que en los afectados de HAI había una proporción significativamente mayor de niños que no habían podido seguir una inmunosupresión con monoterapia anticalcineurínica, y que seguían necesitando esteroide en el momento precedente al diagnóstico de HAI. El porcentaje de niños sin corticoide era del 46 versus el 81% en controles, y el porcentaje en monoterapia con ciclosporina o tacrolimus era del 29 versus el 63% en controles. Esas diferencias se debían a que habían presentado episodios de rechazo con más frecuencia, con una media de 2,8 episodios versus un episodio en controles. Otra peculiaridad de los niños con HAI fue el diagnóstico pretrasplante de hepatitis fulminante (32%)25.
El tratamiento de HAI de novo consiste en el aumento de esteroide a 1–2mg/kg/día (máximo: 40mg/día) durante 4–6 semanas, seguido de un descenso gradual a 5–10mg/día, asociación de azatioprina de 1,5–2mg/kg/día o de micofenolato de mofetilo, y descenso o mantenimiento del nivel habitual de anticalcineurínico23. En la serie de Los Ángeles, 3 de 39 niños requirieron retrasplante, los demás mejoraron significativamente y mantenían el injerto funcionante tras una mediana de 4 años desde el diagnóstico25.
En conclusión, la HAI de novo es un diagnóstico posible en niños con disfunción en el largo plazo. Es diferente de la HAI clásica en la escasa preponderancia de mujeres y en la ausencia de otras enfermedades autoinmunitarias en el paciente. No se debe a una pauta de inmunosupresión en particular, pero muchos casos han recibido más esteroide y un nivel más alto de tacrolimus o ciclosporina para el control de rechazo antes de desarrollar HAI.
Procesos patológicos del injerto: biliares y vascularesEl trasplante en niños es técnicamente complicado, por el tamaño reducido de los vasos y de la vía biliar. Es usual la discrepancia de diámetro de porta o arteria hepática entre el donante y el receptor. Los problemas biliares y vasculares predominan en el postrasplante precoz. En el seguimiento a largo plazo pueden recurrir o apreciarse por primera vez trombosis o estenosis de la porta, trombosis arterial, estenosis biliares o estenosis de cava. En el registro SPLIT, la complicación biliar y la trombosis de arteria hepática motivaron un 23% del total de las pérdidas de injerto tardías4.
En el HULP, entre 127 niños supervivientes más de un año de la serie 1986–1996 habían ocurrido, después del primer año postrasplante hasta el final de seguimiento (10–20 años), estenosis biliar en el 11% y enfermedades vasculares en el 9%. Hubo mortalidad en el 4% de los niños afectados de problemas biliares o vasculares3.
La enfermedad de la vena porta afecta especialmente a los niños con vena porta hipoplásica debido a la enfermedad primaria; sucede con más frecuencia en niños con atresia biliar26,27. La evidencia de problemas tiene lugar en el seguimiento a medio y largo plazo, muchas veces son subclínicos, pero la observación de estenosis en la zona anastomótica puede determinar turbulencias al flujo y una trombosis posterior, por lo que a la mayoría de esos pacientes se les realiza angioplastia percutánea. En la experiencia de trasplante de donante vivo en Japón, en una serie de 568 niños hubo complicación (estenosis o trombosis) portal tardía en 39 casos28. El flujo portal se recuperó con radiología intervencionista en 25 casos, mediante una dilatación con balón de la estenosis anastomótica. Once casos con trombosis portal sobrevivían (20–147 meses), de los que 7 presentaban hiperesplenismo y 2 presentaban un síndrome hepatopulmonar. En un caso fue necesario el retrasplante. La trombosis portal en niños trasplantados determina várices en el asa de derivación biliodigestiva y son menos prominentes en el territorio gástrico debido a las adherencias creadas con la cirugía de trasplante. El tratamiento resolutivo es la realización de un shunt quirúrgico entre la vena mesentérica y la porta intrahepática izquierda (shunt de Rex). No obstante, según una serie de 83 niños en Canadá afectados de hipertensión portal postrasplante, al final del seguimiento solamente un 44% presentaba esplenomegalia y un 6% había tenido hemorragia digestiva29.
Las complicaciones biliares afectan a un 10% en el seguimiento a largo plazo. Los injertos split o de vivo tienen peculiaridades que justifican mayor riesgo (8–25%), principalmente el hecho de que la anastomosis se realiza en las proximidades de la zona de corte, con un conducto biliar de diámetro menor o con necesidad de anastomosar más de un conducto30. En la patogenia de la estenosis también se considera posible que la regeneración hepática cause una compresión o tracción de la anastomosis. En algunos niños un daño isquémico inicial causa lesión de la vía biliar que con el tiempo se expresa con estenosis biliar. La dilatación de estenosis anastomótica por vía transhepática permite solventar la mayoría de los casos, aunque suele precisar procedimientos sucesivos y en algunas series hasta el 40% de pacientes han requerido stent o cirugía31,32.
La reconstrucción del drenaje venoso en niños es frecuentemente la anastomosis terminoterminal entre vena suprahepática del injerto y vena suprahepática del receptor, o terminolateral de la suprahepática del injerto a la cava inferior del receptor, conservando la cava propia (piggy-back). El síndrome de Budd-Chiari se produce por una estenosis vascular en la zona anastomótica o por compresión del vaso debido a hipertrofia o rotación del injerto. En niños trasplantados ocurre esta complicación solamente en un 2% de primeros injertos, pero la incidencia es alta (31%) en retrasplantes33. Del total de casos de Budd-Chiari en nuestra serie, un 61% se detectó en el postoperatorio inmediato y un 40% se detectó en el seguimiento tardío. La dilatación con balón corrige el problema si se trata de una estenosis; casos aislados requieren stent por recurrencia tras la angioplastia.
Procesos patológicos del injerto relacionados con la enfermedad de basePocas enfermedades hepáticas pediátricas presentan complicaciones en el injerto atribuibles a la enfermedad original. Es excepcional la necesidad de trasplante por hepatitis B crónica o hepatitis C crónica en niños.
En niños trasplantados por colestasis intrahepática por defecto de FIC 1 se produce un síndrome postrasplante que combina diarrea crónica y esteatosis del injerto, junto con persistente mal crecimiento y algunas otras complicaciones que no afectan a todos los niños, como pancreatitis y sordera neurosensorial34. La esteatosis es de patogenia desconocida, asocia disfunción crónica del injerto, sin ictericia ni signos de hipertensión portal, aunque recientemente se han comunicado pacientes con evolución a cirrosis35.
En las colestasis intrahepáticas por defecto de BSEP, el trasplante cura la enfermedad, pero se han observado algunos pacientes afectados de episodios de disfunción del injerto que remedan la enfermedad original (colestasis con GGT normal, histología con células gigantes)36,37. Se ha confirmado que la patogenia es el reconocimiento inmunitario de la proteína BSEP del injerto y el bloqueo de su función por anticuerpos específicos, a pesar de su localización canalicular37. Estos episodios se controlan satisfactoriamente con aumento de la inmunosupresión.
Efectos de la inmunosupresión a largo plazoFunción renalLos inhibidores de calcineurina causan una disminución del filtrado glomerular y tubulopatía. A largo plazo hay un descenso medio del 30% en el filtrado glomerular, respecto a los valores previos al trasplante38. Sin embargo, la mayoría de los niños tienen una función renal conservada. Aunque los métodos de evaluación basados en creatinina sobreestiman, un 13% de los pacientes a los 5 años del trasplante presenta un filtrado glomerular inferior a 90ml/min/1,73m217. El 5% desarrolla insuficiencia renal terminal39.
En Lyon efectuaron un importante estudio a largo plazo en un grupo de 69 niños trasplantados entre 1991 y 2005 y evaluaron la función renal mediante aclaramiento de inulina40. Hubo insuficiencia renal (aclaramiento inferior a 60ml/min) en un 26% de los pacientes. La incidencia acumulada fue del 8,7, el 15 y el 25,4% a los 3, 5 y 10 años postrasplante, respectivamente. Sin embargo, para el conjunto de pacientes, los valores medios de filtrado descendieron en el primer año y quedaron estabilizados después hasta el 4.o año. En pacientes con seguimiento hasta el 8–10.o año hubo descenso significativo en los valores, respecto a los obtenidos en el primer año. En este estudio se identificaron varios factores asociados con el desarrollo de insuficiencia renal. Uno era el diagnóstico previo al trasplante de enfermedad en el que puede asociarse una enfermedad renal (como el síndrome de Alagille o la glucogenosis). Esos niños tuvieron una tasa del 60%, comparado con un 17,5% en diagnósticos que no acompañan enfermedades del riñón. Otro factor asociado a insuficiencia renal fue la inmunosupresión primaria con ciclosporina, mientras que los niños que recibieron tacrolimus presentaron una incidencia mínima. Por último, la detección de hipertensión arterial en el seguimiento precedió a insuficiencia renal.
Ningún paciente del estudio anterior alcanzó el grado de insuficiencia renal terminal durante la edad pediátrica. Sin embargo, en 22 casos que se transfirieron a unidades de adultos, con edades comprendidas entre 18 y 31 años y una mediana de evolución postrasplante de 15 años el 23% tuvo insuficiencia renal grave (<30ml/min/1,73m2)40.
Además de cambios funcionales, las pruebas de imagen revelan cambios morfológicos renales. En una serie de 108 niños hubo, 10 años después del trasplante, un 30% que presentaba quistes renales llenos de líquido, de 1 a 4cm de diámetro, o zonas hiperdensas redondeadas de menos de 3cm41. Estas últimas, interpretadas como quistes hemorrágicos o con calcio, eran visibles en tomografía computarizada, sin realce con inyecciones de contraste y visibles también en resonancia magnética con baja señal en T2 pero generalmente inapreciables con ecografía. En la experiencia de Bicetre, en 14 niños hubo ambos tipos de lesiones (media de 20 lesiones por niño) en ambos riñones, mientras que 11 niños tenían solamente 2-3 quistes y 8 niños tenían solamente 2–3 lesiones hiperdensas. La alteración funcional de los niños afectados era solo moderada, con un filtrado medio de 76ml/min, y, por tanto, esas lesiones quísticas parecen distintas a las que surgen en individuos con insuficiencia renal terminal.
En otra serie, los quistes renales se observaron en un 11% de 235 niños seguidos durante una media de 7 años postrasplante42. El tiempo de seguimiento en los afectados era de 13 años, significativamente más largo que en los niños que no tuvieron quistes. Entre el 5.o y el 10.o año de seguimiento la incidencia de quistes renales fue mucho más elevada en niños que recibían ciclosporina, comparado con los tratados con tacrolimus.
El reconocimiento precoz de la nefropatía es importante para aplicar regímenes de inmunosupresión alternativos. En niños, la medición de cistatina C >1,06mg/l es un buen indicador de un filtrado glomerular <80ml/min evaluado por 51Cr-EDTA, ha propuesto como el dintel en el que deberían tomarse medidas de protección43.
La reducción de ciclosporina o tacrolimus, habitualmente combinada con la asociación de azatioprina o micofenolato, es el método de protección renal más común. La mejoría se logra en el 82% de los casos, sin riesgo de rechazo44.
La retirada completa de ciclosporina o tacrolimus, pasando a dar fármacos no nefrotóxicos, como micofenolato o sirolimus, se ha empleado en pocos niños. Una serie de 48 casos se transfirieron a micofenolato de mofetilo (20–40mg/kg/día) y se obtuvo una mejoría significativa en el filtrado glomerular, de 54 a 77ml/min/1,73m2 (valores de mediana) antes del cambio y al 2.o mes, respectivamente45. Hubo un 14% de niños con disfunción del injerto. La observación de que en los niños con insuficiencia renal terminal esta conversión solamente permitió mantener la misma cifra de filtrado es un aviso de que las pautas de protección deben tomarse antes de que ocurra un deterioro grave.
TumoresEl estado de inmunosupresión farmacológica es un factor predisponente a neoplasia. Durante la edad pediátrica es raro observar cáncer, probablemente por la baja frecuencia en que sucede en niños. En una casuística francesa sobre 605 trasplantados hepáticos pediátricos, 34 (5,6%) se diagnosticaron de PTLD, 5 de linfoma de Burkitt, 2 de linfoma no hodgkiniano, uno de sarcoma de Kaposi y uno de carcinoma renal46.
La tasa de PTLD en supervivientes hasta los 5 años del trasplante fue del 6% en el registro SPLIT17. En el HULP la incidencia de PTLD entre 1 y 20 años postrasplante fue del 13,4% (17 casos)3. El tratamiento con retirada de la inmunosupresión y la administración de quimioterapia en los afectados de linfoma permitieron la supervivencia en el 70,6% de esos pacientes, en el 58% de ellos hubo necesidad de restaurar el tratamiento inmunosupresor por rechazo. Los fallecimientos se debieron a la forma más grave de PTLD (linfoma) en 4 pacientes y por rechazo crónico en uno.
Psiquismo y calidad de vida. Transición al cuidado en centros de adultosDiversos análisis de la calidad de vida en niños con trasplante hepático muestran que es diferente tanto en el aspecto físico como emocional respecto a los niños sanos47. El estudio específico muestra dificultades cognitivas (CI <−2 DE) en el 27% de niños trasplantados48,49. A los 5 años postrasplante, el 29% tiene una talla baja para la edad17. La percepción de los pacientes de su propia calidad de vida es buena, pero los padres son conscientes de la gravedad de los procesos de enfermedad que tuvieron y de los riesgos de rechazo y efectos adversos de la inmunosupresión y discrepan de la percepción de buena calidad de vida que refieren los pacientes. Con el mismo estado de salud, la percepción y las expectativas de los pacientes y la familia pueden ser diferentes. En un estudio de 55 adolescentes ingleses, la calidad de vida relacionada con la salud estuvo globalmente disminuida por morbilidad en el injerto o por los efectos de la inmunosupresión. Los que habían recibido el trasplante a menor edad tuvieron mejor percepción de su estado. No hubo diferencias en la autoestima y la salud emocional comparados con adolescentes normales50.
En una encuesta a pacientes de 17 a 33 años, trasplantados en la infancia, al 45% se lo había transferido a especialistas de adultos, en el 75% de los casos entre los 17 y 21 años. Los pacientes entrevistados consideraron adecuada la edad de transición en el 69% de los casos, demasiado pronto en el 15% y demasiado tarde en el 5%51. El 88% había adquirido autonomía en los aspectos referentes a su salud, pero el 72% de los jóvenes apreciaba la ayuda de sus padres en el cuidado médico. Un 7% reconocía no seguir seriamente el tratamiento. La mitad de los pacientes lamentaba haber perdido una relación privilegiada con el pediatra, y la idea de haber podido tener consultas compartidas con el especialista pediátrico y el de adulto era bien acogida. El 81% se sentía bien, el 43% no hablaba nunca o casi nunca del trasplante en su entorno, el 53% se mostraba preocupado por posibles problemas en el futuro. El porcentaje de fumadores (31%) y consumidores de cannabis (11%) no era diferente al de jóvenes no trasplantados, pero excepcionalmente consumían alcohol o drogas duras.
La transición del niño trasplantado a unidades de adultos se realiza según criterios administrativos cambiantes entre centros y países, pero siempre en una edad de especial riesgo. El incumplimiento del tratamiento en la fase de transición es más elevada que en pacientes pediátricos y más elevada que en pacientes trasplantados en edad adulta52. El problema se ha abordado manteniendo en seguimiento pediátrico al paciente hasta una edad adulta más avanzada o creando unidades específicas que combinan especialistas pediátricos y de adultos. El problema de pérdida de injertos en la fase de transición es serio. En una serie de 111 pacientes de 12 a 21 años, el 45% admitió no haber tomado alguna dosis o haber faltado a alguna revisión médica durante un año; de 30 casos con omisión esporádica o completa de los inmunosupresores hubo rechazo en el 33%, frente a un 9,3% de los pacientes con buen cumplimiento53. Debido a la dificultad de detectar incumplimiento hasta que aparece rechazo, la variabilidad en los niveles de la medicación inmunosupresora puede ser una herramienta útil54,55. Una DE amplia (superior a 2 o 2,5ng/ml) en el nivel de tacrolimus es un dato objetivo que permite seleccionar a los adolescentes a los que hay que vigilar especialmente. El aumento de la frecuencia de las revisiones tiene buen impacto, por aumentar la consciencia del paciente respecto a la importancia de la correcta función del injerto. Algunos centros consideran que la realización de una biopsia habitual en la adolescencia contribuye al cumplimiento.
La transición es un proceso que comienza en la edad adolescente, a los 11–14 años, en el que debe cambiar la forma de relación con el niño, para que sea progresivamente capaz de entender la enfermedad y relacionarse con el médico de una manera autónoma56. También es necesario un proceso de transición para los padres. La transición tiene que ser flexible, por la diferencia de maduración y estado de salud de los pacientes. La comunicación entre el especialista pediátrico y el de adultos es esencial, en muchos pacientes hay temor de que aspectos relevantes de su enfermedad anterior no se transmitan adecuadamente a su nuevo equipo médico. En la tabla 5 se resumen los aspectos más importantes que el médico especialista de adulto debe chequear en cada caso.
Aspectos importantes del paciente inicialmente pediátrico, transferido al cuidado por especialistas de adultos
| Tipo de injerto | Reducido (el 50% de los trasplantes desde 1995) o entero. Cirugía distinta según reducción (segmento lateral izquierdo, lóbulo izquierdo, entero con resección de parte del lóbulo D) modifica el tipo de anastomosis vasculares |
| Tipo de reconstrucción biliar | Y de Roux en el 95% de los casos |
| Sutura de Y de Roux visible en Rx de abdomen | |
| Tipo de reconstrucción vascular | Arterial: terminoterminal o injerto a aorta infrarrenal. Cava: terminoterminal o suprahepática cava con conservación de cava propia |
| Apéndice | Exéresis habitual en trasplante o cirugías previas |
| Anomalías anatómicas asociadas | En el 5% de atresia biliar: malrotación intestinal, ausencia de cava retrohepática |
| Posible imagen de hiperplasia nodular si había antecedente de trombosis recanalizada | |
| Normas para realizar biopsia del injerto | Asegurar lugar de punción con ecografía. Profilaxis antibiótica indicada (Y de Roux, bacteriemia) |
| Normas para evaluar vía biliar | No es posible CPRE si Y de Roux. Precisa acceso transhepático. ECO: aerobilia posible por Y de Roux, pero asociada a más riesgo de colangitis |
| Inmunosupresión | Antecedentes de incumplimiento. Variabilidad de niveles. En sospecha de incumplimiento: chequeo muy frecuente aumenta la concienciación del paciente |
| Algunos reciben ciclosporina por alergia alimentaria en el pasado (angioedema por múltiples alimentos), bajo tacrolimus | |
| Hepatitis C | Problema infrecuente (trasplante anterior a 1990) |
| Rara la hepatopatía avanzada, descrito frecuente rechazo crónico si recibe tratamiento, evaluar riesgo-beneficio | |
| Fertilidad | No evaluada la repercusión de enfermedad+ tratamientos previos. Riesgo de hijos afectados de enfermedad si hay enfermedad original: síndrome de Alagille (autosómico dominante, con el 50% de riesgo). Atresia biliar: no existe riesgo de hijos afectados |
| Vigilar reactivación CMV durante gestación | |
| Vigilar anticuerpos Rh en gestación |
Lóbulo D: lóbulo derecho; RH: Rhesus.
Los autores declaran no tener ningún conflicto de intereses.