Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más comunes del tracto gastrointestinal, caracterizados por presentar mutaciones somáticas activadoras de los genes KIT o PDGFR. La gran mayoría de los GIST son esporádicos, pero se han reportado formas hereditarias inusuales1.
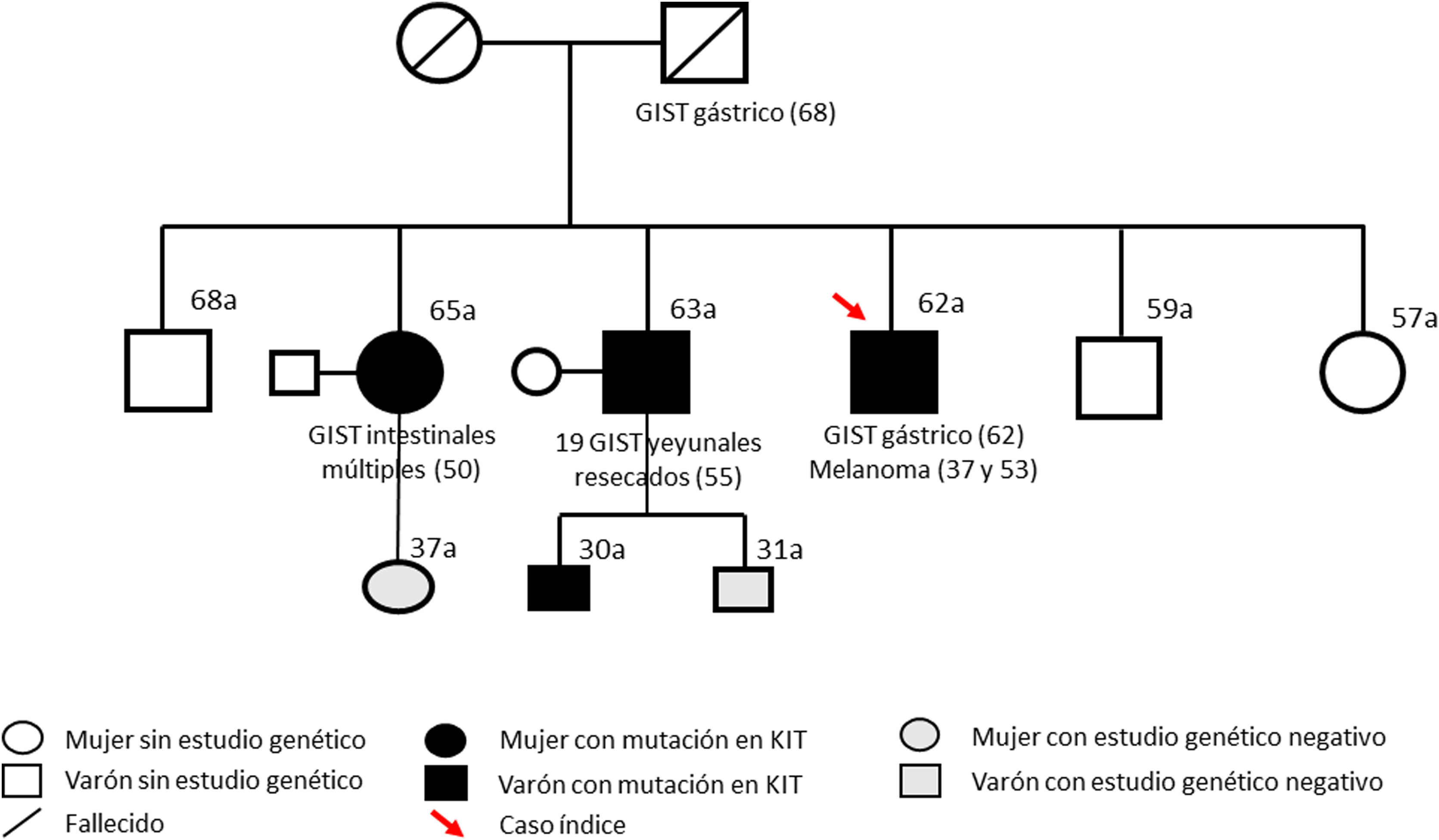
Presentamos el caso de un varón de 62 años, nacido en 1960 y sin hijos, remitido a consulta por antecedentes familiares de GIST. Su padre había fallecido de un GIST gástrico diagnosticado a los 68 años, y dos de sus cinco hermanos habían sido intervenidos en varias ocasiones de GIST multifocales intestinales (diagnosticados a los 50 y 55 años, respectivamente). El paciente tenía antecedentes de dos melanomas cutáneos resecados a los 37 y 53 años y se encontraba en remisión. Se solicitó estudio genético en los dos hermanos afectos y posteriormente en el paciente confirmando la presencia de una mutación patogénica germinal en KIT (c.2458G> T, p.Asp280Tyr, exón 17). Sus otros tres hermanos rechazaron el estudio genético y permanecen asintomáticos (fig. 1). De acuerdo con Oncología, el paciente comenzó seguimiento con tomografía axial computarizada (TAC) abdominal cada tres años y gastroscopia anual.
En una gastroscopia de screening, y estando el paciente asintomático, se detectó una lesión submucosa en antro de 4 cm con ulceración central sugestiva de GIST. Se realizó una ecoendoscopia que confirmó la presencia de una lesión subepitelial hiperecogénica dependiente de la muscular propia con criterios endosonográficos de sospecha. Las biopsias mostraron positividad para CD117 y DOG1, sin mitosis y un índice Ki67 de 10%; compatible con GIST, sin poder establecer el riesgo de progresión por el tamaño de la muestra. El TAC abdominal descartó extensión a distancia y el paciente fue remitido a cirugía. El análisis histológico de la pieza quirúrgica confirmó la presencia de un GIST de 4 cm de bajo grado (G1), con 4 mitosis/5 mm2, índice de proliferación (Ki-67) de 30%, márgenes libres y muy bajo riesgo de recurrencia (1,9%). No se identificó invasión linfovascular, perineural ni ganglionar (T2N0M0).
Los GIST son tumores infrecuentes derivados de la transformación neoplásica de las células intersticiales de Cajal. La mayoría son esporádicos y hasta un 85% presenta mutaciones somáticas que condicionan ganancia de función de los genes KIT o PDGFR. El 15% restante suele estar asociado a mutaciones en otros genes como NF1, SDH o BRAF1. Los GIST hereditarios debidos a mutaciones germinales de KIT o PDGFR son extremadamente raros, con poco más de 50 familias reportadas hasta la fecha2. La mutación tiene una herencia autosómica dominante con alta penetrancia1.
Los GIST familiares tienen un inicio precoz, con una edad media de presentación de 48 años, 10 años inferior a la de los casos esporádicos3. La mayoría son multifocales pudiendo afectar a todo el tracto gastrointestinal, lo que aumenta el riesgo de complicaciones como sangrado o perforación. Muy frecuentemente asocian alteraciones en la pigmentación cutánea (hiperpigmentación, lentigos o vitíligo), urticaria pigmentosa y alteraciones de la motilidad intestinal (disfagia, estreñimiento). Se han reportado otros cánceres en portadores en línea germinal de variantes de KIT, aunque no está claro si estos cánceres son atribuibles al genotipo subyacente3,4.
El tratamiento médico debe seguir las mismas guías que los GIST esporádicos. No obstante, la multiplicidad de los tumores suele complicar el tratamiento quirúrgico5. La eficacia de imatinib en GIST esporádicos depende del tipo de mutación activadora y del codón afectado, siendo las mutaciones en el exón 11 de KIT las más comunes y las que mejor responden a dicho fármaco2. Aunque existe poca evidencia sobre el papel del imatinib en pacientes con mutaciones germinales, se han descrito varios casos con respuestas muy favorables. De hecho, algunos autores recomiendan considerar el tratamiento indefinido con imatinib en pacientes con GIST múltiples, de rápido crecimiento y/o mayores de 3 cm5.
Con la creciente disponibilidad de las pruebas genéticas, es probable que el número de familias con GIST hereditarios aumente. Desgraciadamente faltan recomendaciones sobre el tipo y la frecuencia de screening a realizar en estos individuos o de cuándo iniciarlo. Algunos autores recomiendan la realización frecuente de gastroscopias y TAC o resonancia magnética nuclear (RMN) abdominal a intervalos variables de seis meses a tres años según los hallazgos5. Hasta disponer de directrices formales, el cribado en portadores asintomáticos debe individualizarse y guiarse por el genotipo subyacente y los antecedentes familiares.
Conflictos de interésLos autores declaran no tener conflictos de interés con relación al presente artículo.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribución de autores: Eukene Rojo, Pablo Miranda, Raquel Herranz y Felipe de la Morena han contribuido en la redacción del borrador del artículo. Todos los autores revisaron críticamente el contenido del manuscrito y aprobaron la versión definitiva que se presenta.