La ecografía tiene un excelente rendimiento diagnóstico tanto cuando se sospecha una enfermedad de Crohn como en la valoración de la actividad o en determinar su extensión y localización, muy similar a otras exploraciones como resonancia magnética o tomografía computarizada. Tiene una buena correlación con las lesiones endoscópicas y permite la detección de complicaciones como estenosis, fístulas o abscesos. Complementa a la colonoscopia en el diagnóstico y dada su tolerancia, coste e inmediatez, es una buena herramienta para la monitorización de la enfermedad. En la colitis ulcerosa su papel es menos relevante, limitándose a valorar la extensión y actividad cuando no sea posible o haya dudas con otras técnicas diagnósticas. A pesar de sus ventajas, su empleo en la enfermedad inflamatoria intestinal (EII) no está muy extendido en nuestro país. Por este motivo, el presente documento revisa las virtudes e inconvenientes de la técnica para favorecer su conocimiento e implantación en las Unidades de EII.
Ultrasound has an excellent diagnostic performance when Crohn's disease is suspected, when performing an activity assessment, or determining the extension and location of Crohn's disease, very similar to other examinations such as MRI or CT. It has a good correlation with endoscopic lesions and allows the detection of complications such as strictures, fistulas or abscesses. It complements colonoscopy in the diagnosis and, given its tolerance, cost and immediacy, it can be considered as a good tool for disease monitoring. In ulcerative colitis, its role is less relevant, being limited to assessing the extent and activity when it is not possible with other diagnostic techniques or if there are doubts with these. Despite its advantages, its use in inflammatory bowel disease (IBD) is not widespread in Spain. For this reason, this document reviews the advantages and disadvantages of the technique to promote knowledge about it and implementation of it in IBD Units.
La enfermedad inflamatoria intestinal (EII) tiene un curso crónico con exacerbaciones que puede determinar en el tiempo la aparición de complicaciones que ocasionan un grado variable de discapacidad. La colonoscopia es la técnica aconsejada tanto para el diagnóstico inicial como para el seguimiento de la EII1. Sin embargo, únicamente es capaz de evaluar la mucosa y los hallazgos endoluminales. Por otra parte, su valoración está limitada al colon e íleon terminal. Este hecho, concretamente en la enfermedad de Crohn (EC) dado su carácter transmural y afectación de otros segmentos intestinales, hace que el estudio pueda ser incompleto. Consecuentemente, los principales consensos recomiendan la realización de una prueba de imagen que complemente a la colonoscopia1 preferentemente que no conlleve radiación. Las opciones se limitan a la resonancia magnética (RM) y a la ecografía abdominal. Si bien la primera es práctica habitual en la mayoría de los países de nuestro entorno, no ocurre lo mismo con la ecografía, cuya implantación en Europa es irregular2. Dada su baja implantación en nuestro medio, desde GETECCU hemos revisado las ventajas e inconvenientes de la técnica, los principales hallazgos y su correcta interpretación, así como su posicionamiento en el manejo de la EII.
Ventajas de la ecografía intestinalLa ecografía intestinal aporta importantes ventajas en el diagnóstico y valoración de la EII (tabla 1), es muy bien tolerada por el paciente, pudiendo ser realizada sin preparación específica y siendo muy accesible, barata y no invasiva.
Diferencias entre las principales técnicas de imagen en la EC
| Entero-TC | Entero-RM | Ecografía | Cápsula endoscópica | |
|---|---|---|---|---|
| Disponibilidad | ++++ | ++ | ++++ | ++ |
| Accesibilidad | ++++ | + | ++++ | ++ |
| Resolución espacial | ++++ | +++ | ++ | - |
| Detección de complicaciones | ++++ | ++++ | +++ | - |
| Seguridad | RadiaciónContraste IV | Contraste IV(depósitos cerebrales - significado incierto) | ++++ | +Posibilidad de impactación |
| Repetible | +Dosis acumulada | ++Tolerancia-coste | ++++ | ++Coste |
| Evaluación central | +++ | +++ | + | |
| Inmediatez | ++ | - | ++++ | - |
| Coste | ++ | +++ | + | ++++ |
| Tolerancia | ++ | ++ | ++++ | +++ |
| Necesidad de preparación | ++ | ++ | +* | -/++** |
| Duración | +++ | ++ | +++ | + |
Su excelente tolerancia facilita su uso en la monitorización de la enfermedad, permitiendo ajustar los tratamientos con base en este seguimiento, circunstancia que se ha relacionado con mejor pronóstico del paciente3. En los estudios que comparan la tolerancia de las diferentes técnicas diagnósticas en la EII, la ecografía intestinal es la mejor tolerada, a la altura de una analítica de sangre y con una utilidad percibida similar a la RM4.
Otra de las grandes ventajas es su inmediatez, de forma que puede ser realizada sobre la marcha. Es el denominado POCUS (point of care ultrasonography) que permite acelerar de forma clara la toma de decisiones con un alto rendimiento, tanto en el diagnóstico inicial como en la monitorización5,6.
Los costes de la técnica son menores que los de la RM. Así, en un modelo de decisión publicado, la estrategia más coste-eficaz en el diagnóstico de la EC es la colonoscopia junto con la ecografía intestinal7. Otra gran ventaja de la técnica es su inocuidad si lo comparamos con la realización de una ileocolonoscopia (invasiva) o una tomografía computarizada (TC) (radiación)8.
Globalmente las cifras de sensibilidad y especificidad de la ecografía intestinal son similares a las de la TC y la RM en el diagnóstico de la EC y en la valoración de la gravedad de la enfermedad9,10. Tiene un menor rendimiento en la valoración de algunos segmentos (recto y duodeno retroperitoneal) y hallazgos concretos (abscesos o fístulas) situados en la pelvis profunda o retroperitoneo10-13.
El rendimiento de la ecografía es dependiente del operador e influyen también el equipo empleado y el hábito constitucional del paciente10,14. Sin embargo, en el estudio de Fraquelli et al.15 se evaluó la variabilidad interobservador de la ecografía intestinal encontrando un buen grado de acuerdo en la medida del grosor de la pared intestinal, la valoración del Doppler color, la presencia de adenopatías, líquido libre y en la detección de estenosis, parámetros importantes en el diagnóstico de la enfermedad y en la valoración de la actividad inflamatoria.
Técnica, equipo, principios físicosPara el examen es necesario el uso de transductores convencionales y de alta frecuencia, de al menos 5 MHz, para ser capaces de discriminar las capas de la pared intestinal.
La exploración incluye un estudio ecográfico en modo B, siguiendo una exploración sistemática del abdomen, empleando la técnica de compresión gradual y focalizando en aquellas localizaciones en las que el paciente manifieste dolor o sensibilidad16,17. Además, se realiza un estudio en modo Doppler que debe estar optimizado para la detección de flujos lentos de los pequeños vasos de la pared intestinal (filtro de pared bajo, ganancia alta y escala de velocidad baja)11,14,15,18.
La exploración se puede realizar sin preparación, aunque en las exploraciones programadas se recomienda un ayuno de al menos cuatro horas para evitar la interferencia del peristaltismo asociado a la ingesta con el Doppler. En determinadas circunstancias puede completarse la exploración con la ingesta oral de contraste de una solución isotónica (polietilenglicol) para distender las asas, en volumen variable (250-800 mL)11,16. Los estudios que utilizan esta técnica, llamada SICUS (small intestine contrast ultrasonography), muestran mayor capacidad para valorar el intestino delgado proximal, detectar estenosis y evaluar la recurrencia postquirúrgica, además de disminuir la variabilidad interobservador19,20. Sin embargo, la duración del procedimiento aumenta de 25 a 45-60 minutos y dificulta la valoración en modo Doppler color21,22.
El uso de contraste intravenoso (iv) aumenta la sensibilidad en la detección de la vascularización de la pared intestinal, respecto al estudio en modo Doppler color. Se emplea un agente de contraste ecográfico de microburbujas de hexafluoruro de azufre (Sonovue®), que se elimina por vía respiratoria y que cuenta con un excelente perfil de seguridad. Para la evaluación de la hiperemia con contraste intravenoso se emplea un software específico en el que se obtienen unas curvas de tiempo-intensidad, que hacen posible cuantificar el realce de la pared del intestino23,24. Existe una amplia variabilidad de las medidas obtenidas con el contraste iv en los diferentes equipos por lo que se recomienda, en la medida de lo posible, utilizar el mismo ecógrafo y transductor para la monitorización de la enfermedad.
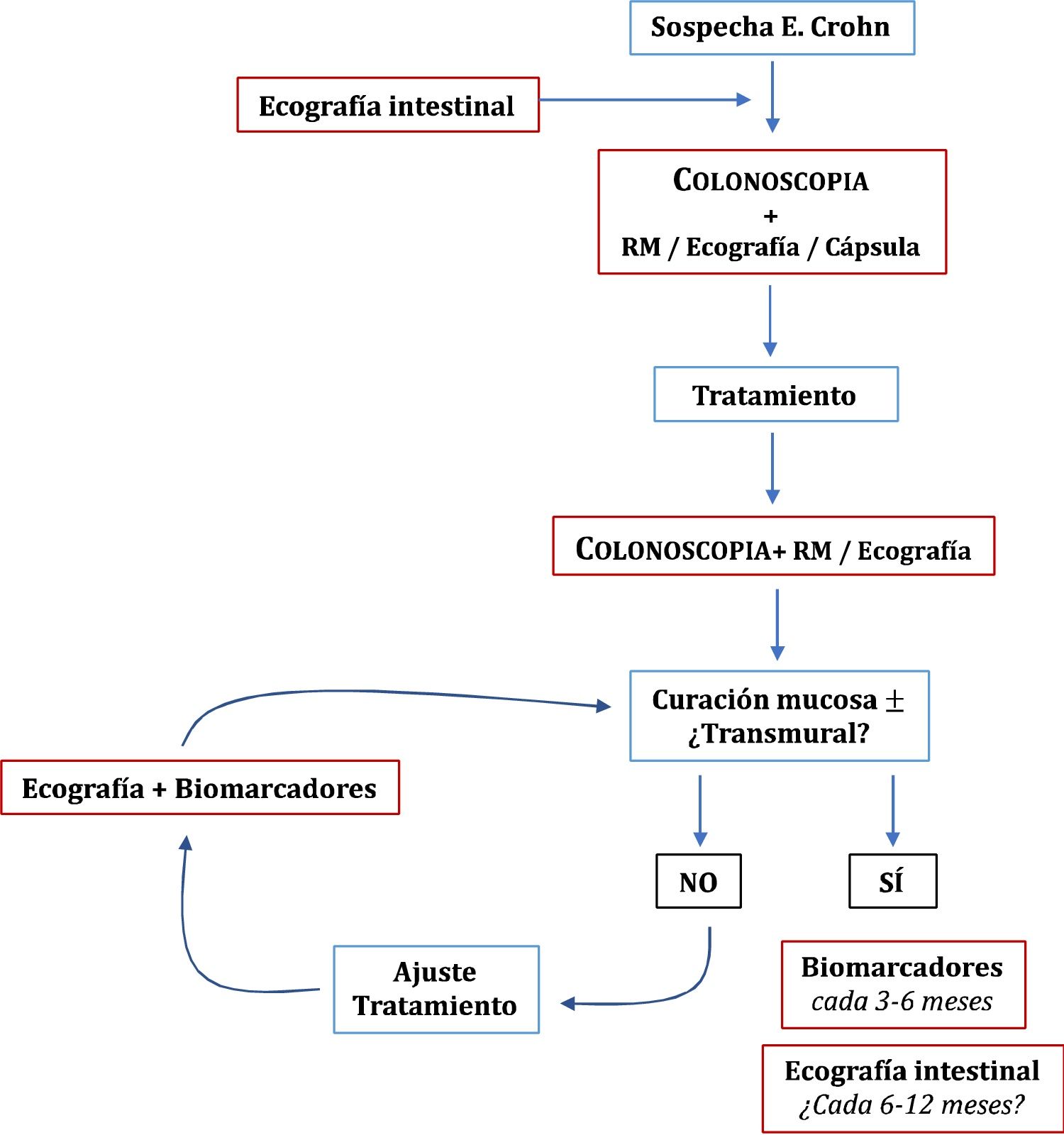
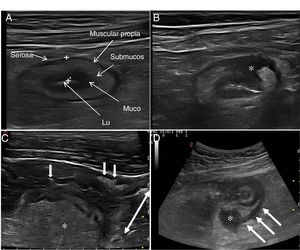
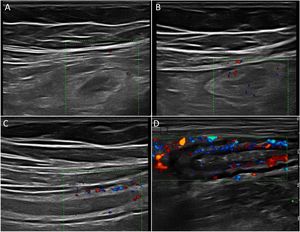
Ecografía en la enfermedad de CrohnHallazgos principales de la ECEl signo ecográfico característico de la EC es el engrosamiento de la pared intestinal, que afecta al íleon terminal hasta en un 70% de los casos y que, de forma característica, puede ser discontinuo. Otros hallazgos que podemos encontrar son: predominio de la capa submucosa, presencia de úlceras profundas, desestructuración del patrón de capas, proliferación fibrograsa, estenosis, fístulas, flemones y abscesos (Imágenes 1-3).
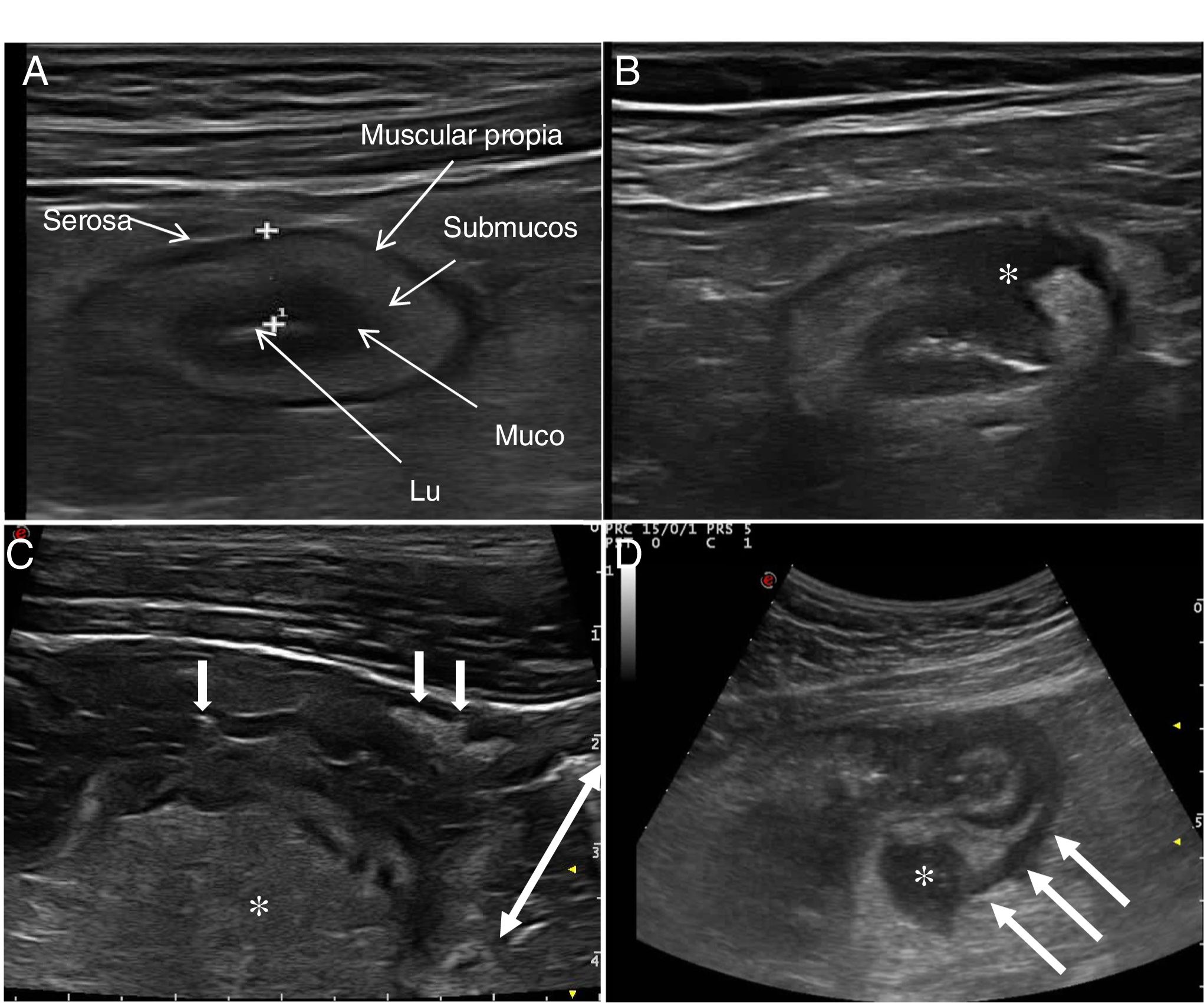
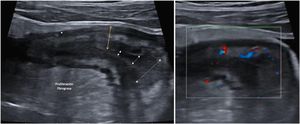
Parámetros ecográficos de actividadEngrosamiento parietalEl grosor de la pared es el parámetro ecográfico más sólido para el diagnóstico y evaluación de la actividad de la enfermedad (fig. 1) y presenta baja variabilidad interobservador15,25.
El grosor de la pared intestinal normal es menor de 2 mm26. El punto de corte con mayor sensibilidad y especificidad para considerar un asa intestinal como patológica se ha situado entre 4 mm (sensibilidad 89% y especificidad del 96%)27 y 3 mm (sensibilidad 89,7% y especificidad del 95,6%) en los dos metaanálisis publicados recientemente. En este sentido el documento de consenso de la EFSUMB recomienda utilizar un punto de corte de 3 mm para obtener una mayor sensibilidad en el diagnóstico y la valoración de la actividad28.
Hiperemia parietalOtro pilar diagnóstico para la detección de actividad es la hiperemia parietal detectada con ecografía Doppler color (fig. 2). La densidad de vasos se evalúa empleando la escala semicuantitativa modificada de Limberg, que clasifica de 0 a 3 el grado de vascularización parietal29. Esta escala ha demostrado una buena correlación con los hallazgos histológicos12,30,31, la actividad endoscópica31-34 y la actividad clínica31,35-39 de la enfermedad. Por otra parte, la persistencia de hiperemia parietal podría asociarse a un mayor riesgo de brote de la enfermedad39.
A) Ecoestructura en capas de un corte transversal de íleon terminal; B) Desestructuración focal de la pared (asterisco); C) Corte longitudinal de íleon con úlceras mucosas (flechas); D) Corte transversal de íleon engrosado con un trayecto fistuloso (flechas) y formación de absceso (asterisco).
La ecografía con contraste iv aumenta la sensibilidad diagnóstica (87-97%) en la detección de la hiperemia frente al Doppler color, aunque con menor especificidad (60,5%-87%)32,34,40,41.
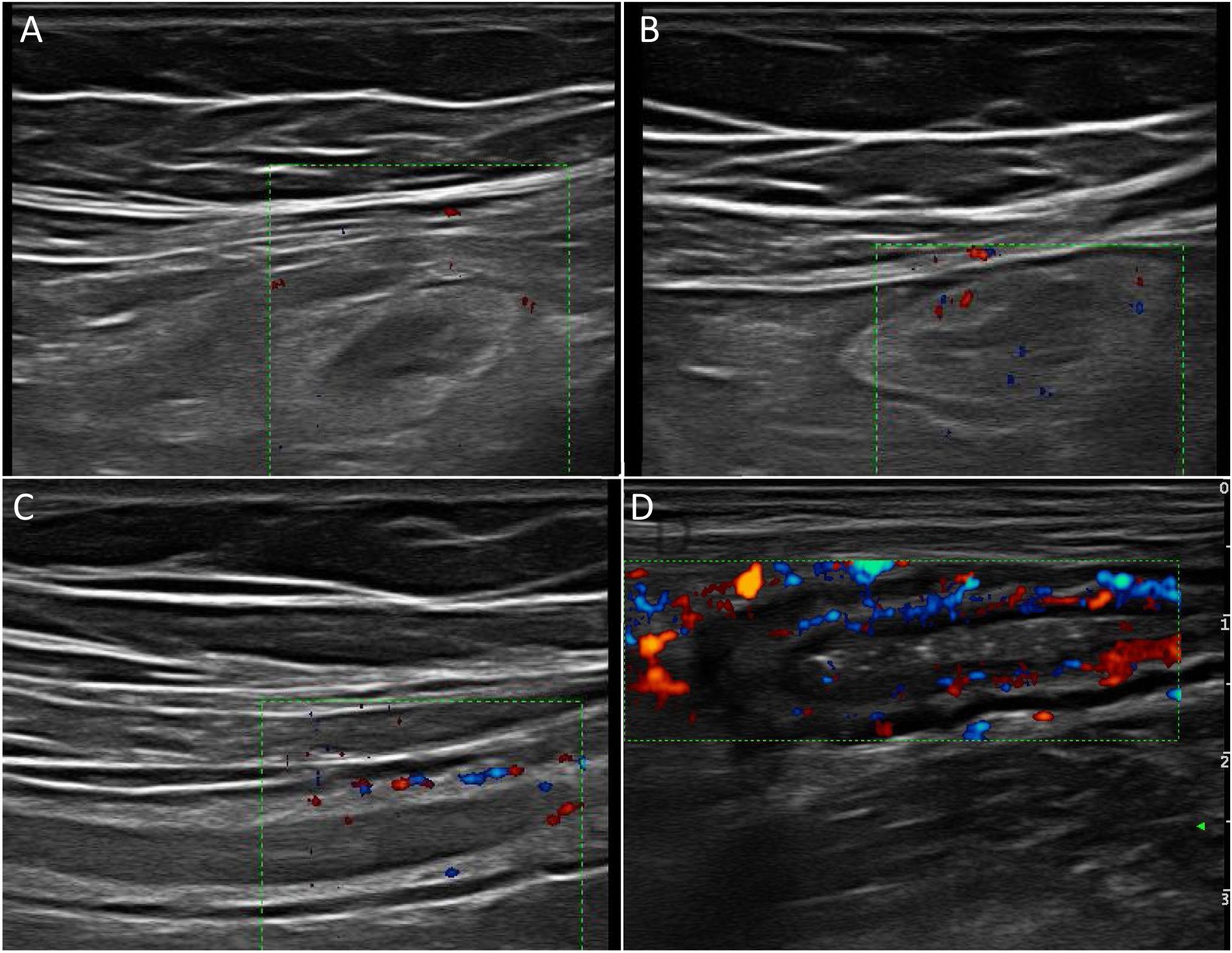
Ecoestructura de la paredLas sondas de alta frecuencia permiten demostrar la ecoestructura de la pared intestinal con mayor resolución que la RM42. El patrón de capas puede estar conservado o desestructurado de forma focal o segmentaria (fig. 1). La pérdida focal de la pared se ha asociado con la presencia de úlceras longitudinales profundas (con una sensibilidad del 91% y una especificidad del 100%43) y con un incremento del riesgo de cirugía43-45.
También la ecografía puede identificar la presencia de úlceras (fig. 3), que se reconocen como imágenes hiperecogénicas que profundizan en la pared en grado variable. En algunas series42, la capacidad diagnóstica de la ecografía es superior a la RM para la detección de úlceras con una precisión diagnóstica del 80,7% frente a un 58,5% de la RM.
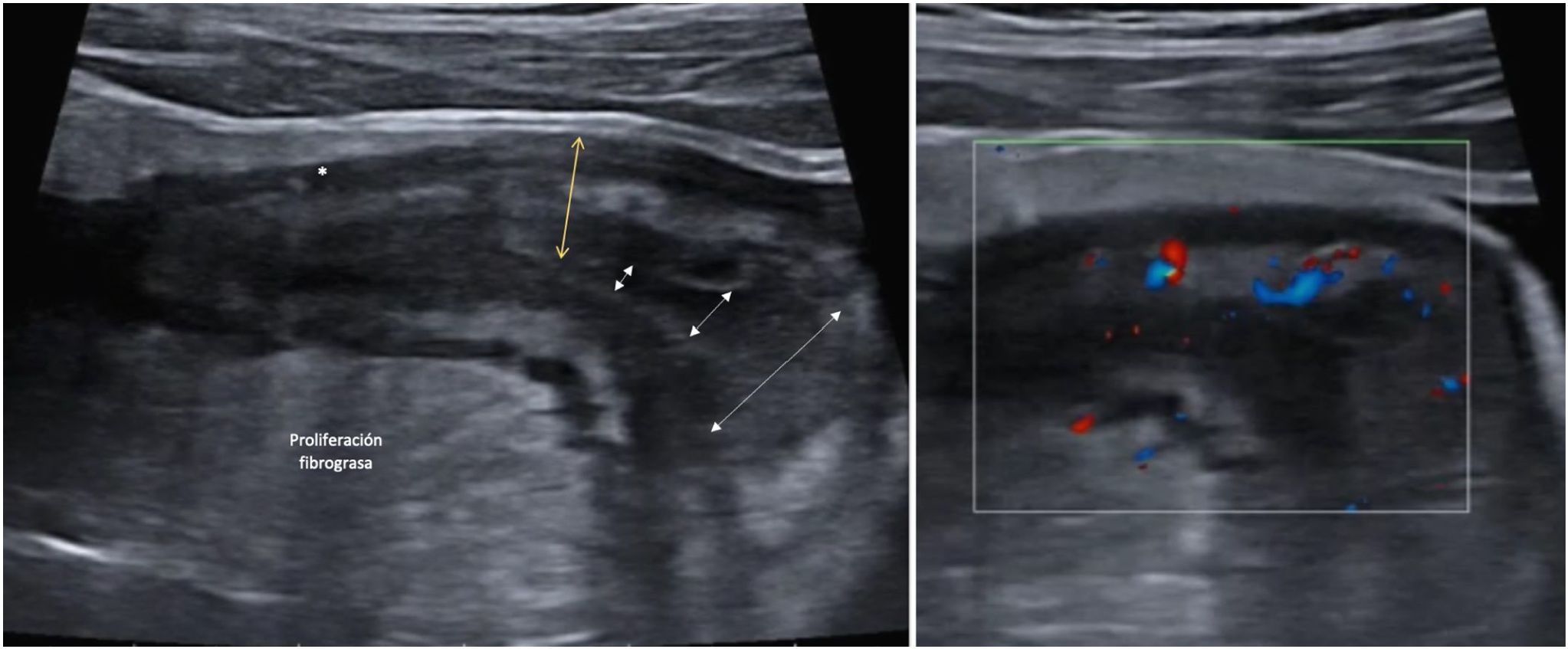
Proliferación fibrograsaOtro parámetro ecográfico que se suele asociar a EC activa es la afectación de la grasa mesentérica. Se caracteriza por la presencia de un aumento de la ecogenicidad de forma homogénea que rodea a un segmento intestinal afectado. Este hallazgo se identifica hasta en un 47% de los pacientes y se asocia de forma significativa a la presencia de fístulas (OR = 13,5) y al engrosamiento patológico de la pared (OR = 7,6)46. Sin embargo, es un hallazgo que puede persistir hasta en un 24% de los pacientes con EC quiescente sin que se asocie a un mayor riesgo de recidiva. fig. 4
A: Estenosis de la luz (las flechas discontinuas indican el estrechamiento progresivo de la luz. Se acompaña de proliferación fibrograsa muy evidente y alguna úlcera (asterisco). B: Señal Doppler marcada (Limberg 2-3) que indica la presencia de hiperemia y por tanto es una estenosis con actividad inflamatoria.
Se identifican hasta en un 25%, aproximadamente, de pacientes con EC47,48. Su presencia y número es más frecuente en la infancia, en el debut de la enfermedad, así como en pacientes con fístulas y abscesos. Por otra parte, estas adenopatías pueden desaparecer tras iniciar tratamiento47.
Extensión y localizaciónLas guías de la ECCO/ESGAR respaldan el uso de la ecografía intestinal, la RM y la cápsula endoscópica (CE) para el estudio de extensión y localización49 de la enfermedad.
La ecografía intestinal tiene un rendimiento diagnóstico comparable a la RM y la CE en la localización de la enfermedad12,50. Su sensibilidad y especificidad para la localización de segmentos afectados es del 86-94 y 94-96%, respectivamente10-12, mostrando excelente rendimiento en la localización ileocecal y con peores resultados que la CE para la localización de tramos proximales (yeyuno o íleon proximal)51-53, o que la RM en la localización profunda de la pelvis o del recto.10,13,54-56. Su precisión también va a depender de la gravedad de la enfermedad, siendo la endoscopia más sensible que las técnicas de imagen para la detección de las formas leves (en íleon terminal y colon)10,49. En la valoración de la longitud del segmento afecto la RM muestra mejor concordancia con los hallazgos quirúrgicos, subestimando la ecografía la extensión, especialmente cuando el segmento es superior a 20 cm12.
ComplicacionesEstenosisUna estenosis (fig. 3) puede definirse como la existencia de un segmento intestinal engrosado (> 4 mm), rígido, de luz disminuida, con un tramo intestinal distendido proximal a dicho segmento12. Con contraste oral se define cuando la luz del segmento afectado tiene un diámetro inferior a 1 cm, medido en el momento de la máxima distensión del asa57.
La ecografía, la TC y la RM tienen una alta sensibilidad y especificidad para el diagnóstico de estenosis de intestino delgado y colon, con una rentabilidad diagnóstica similar10,49,58. En el caso de la ecografía la sensibilidad para detectar estenosis es del 79,7% y la especificidad del 94,7%13. La sensibilidad aumenta al 92% si empleamos contraste oral13.
En la actualidad, no existe ninguna prueba diagnóstica que sea capaz de forma aislada de determinar el componente fibrótico o inflamatorio de las estenosis59. Además, histológicamente la mayor parte de las estenosis son mixtas60. Mediante ecografía, la desestructuración del patrón de capas se asocia a un mayor componente inflamatorio mientras que la hiperecogenicidad de la capa submucosa se asocia a un mayor componente fibrótico13,61, aunque estos resultados no se han contrastado en series más amplias. El grado de hiperemia con Doppler color30,62 o el realce con el contraste62-65 han demostrado tener buena correlación con el grado de fibrosis o inflamación siendo los parámetros más útiles el pico máximo, el porcentaje de realce y el tiempo hasta el pico57. Por último, uno de los avances ecográficos que podrían ser prometedores en cuanto a la caracterización de las estenosis es la elastografía. Esta técnica permite valorar la rigidez del tejido mediante softwares específicos incluidos en los equipos ecográficos. En una reciente revisión sistemática66 se encontraron valores medios más altos de la elastografía cuantitativa en las estenosis fibróticas, si bien los autores señalan una alta heterogeneidad entre los estudios y un riesgo de sesgo alto.
FístulasLas fístulas derivan de las fisuras murales y tractos sinusales, que se manifiestan inicialmente como irregularidades hipoecoicas en el margen externo de la pared67-69. Cuando la inflamación progresa se forman trayectos hipoecoicos en la grasa mesentérica que pueden acabar en un extremo ciego o terminar en una masa inflamatoria mesentérica70,71. Las fistulas conectan estructuras epitelizadas entre sí o con la piel. Así, pueden ocurrir entre asas de intestino delgado (entero-entéricas), con el colon (entero-cólicas), vejiga (entero-vesicales), o vagina (entero-vaginales)12,61,68,69,72. La presencia de gas en el interior de las fístulas se mostrará como focos ecogénicos que reverberan dentro del trayecto hipoecoico.
La sensibilidad de la ecografía para el diagnóstico de las fístulas es similar a la descrita para la TC y RM y varía entre 67-87%, con una especificidad del 90-100%10,13,73. Las últimas guías de consenso de la ECCO-ESGAR para el diagnóstico y monitorización de la EII recomiendan la ecografía intestinal como una de las técnicas de imagen para evaluar las complicaciones fistulizantes49.
La ecografía transperineal (o incluso transvaginal) es de utilidad en las fístulas y abscesos perianales. En una revisión sistemática reciente, la sensibilidad en la detección de abscesos alcanza el 86% con un VVP del 90%. El rendimiento en la detección de fístulas incluso es mayor (sensibilidad 98%, VPP 95%)74. La ecografía endoanal no la vamos a comentar porque excede al ámbito de estas recomendaciones.
Flemones y abscesosLos abscesos suelen formarse como resultado de fístulas o por complicaciones de la cirugía67. Se manifiestan ecográficamente como masas hipo o anecoicas, con refuerzo posterior y con paredes gruesas bien definidas, pudiendo contener gas. Por otro lado, los flemones se aprecian como masas inflamatorias hipoecoicas con márgenes mal delimitados y sin pared identificable12,61,67,69,71,72,75.
En ocasiones, abscesos y flemones pueden tener una apariencia similar en ecografía modo B. La diferenciación entre ambas entidades es importante para decidir el manejo. La ecografía Doppler color puede ayudar a diferenciarlos, al mostrar vascularización en el interior del flemón mientras que en el absceso únicamente se aprecian vasos en la pared. El uso del contraste ecográfico ha facilitado esta distinción con seguridad, mostrando el flemón un realce difuso de la lesión mientras que en los abscesos el realce es periférico, con una porción interna avascular, debido al contenido líquido76. De esta forma, el contraste define mejor el tamaño del absceso.
La sensibilidad de la ecografía para el diagnóstico de abscesos abdominales varía del 81-100%, con una especificidad entre 92-94%, similar a la TC y la RM. En ciertas áreas anatómicas, como la pelvis profunda o retroperitoneo, son más difíciles de evaluar por la presencia de gas que puede ocultar las lesiones o confundirse con un asa intestinal13,57,73.
La ecografía es particularmente útil como guía en el drenaje de colecciones y en la monitorización de la lesión si se realiza tratamiento con antibióticos y anti-TNF77. Por todo ello, la ecografía con contraste iv debería considerarse la técnica diagnóstica de elección para la diferenciación entre flemón y absceso, así como en el control evolutivo de su resolución13.
Posicionamiento global en el manejo de la ECDiagnóstico inicialSi bien para el diagnóstico inicial de la EC se recomienda la realización de una ileocolonoscopia, siempre se debe complementar con una exploración que investigue el intestino delgado, bien sea CE, RM o ecografía49, puesto que cambia el manejo hasta en un 50-60% de los pacientes78,79.
En las revisiones sistemáticas publicadas, la ecografía tiene una sensibilidad del 85-97% para el diagnóstico de EC y una especificidad del 83-97%10,27,40,41,50,80-82. Los estudios que comparan ecografía y RM muestran un rendimiento similar 12,54,55,83-86 (tabla 2), aunque en el estudio METRIC, que es el metodológicamente más adecuado55, la RM se muestra un 10% superior a la ecografía en determinar la extensión en el intestino delgado. No obstante, al diagnóstico, la ecografía aporta inmediatez y muy probablemente en centros con experiencia en ecografía intestinal, ambas técnicas puedan ser superponibles.
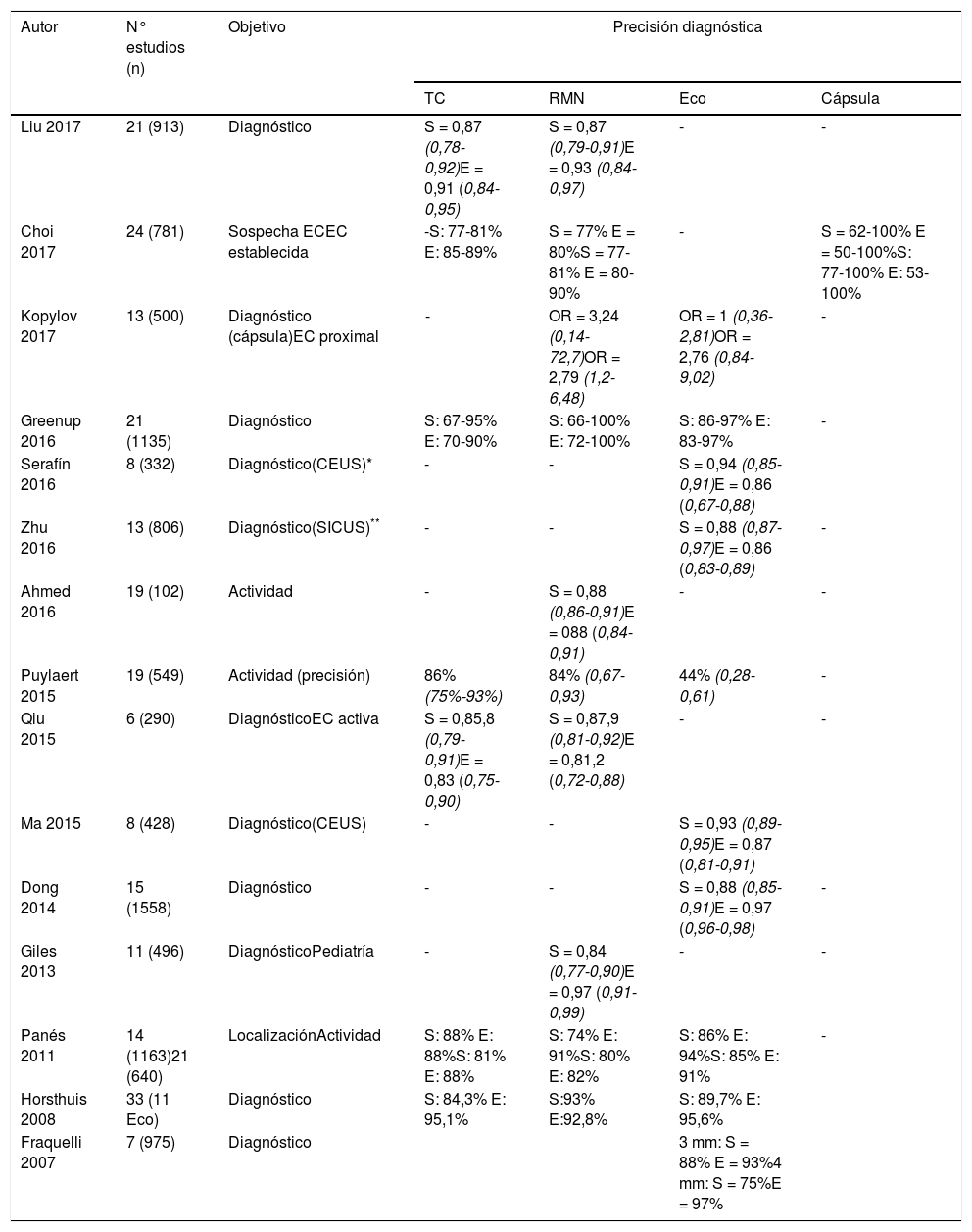
Precisión diagnóstica de la ecografía intestinal y otras técnicas de imagen en metaanálisis y revisiones sistemáticas
| Autor | N° estudios (n) | Objetivo | Precisión diagnóstica | |||
|---|---|---|---|---|---|---|
| TC | RMN | Eco | Cápsula | |||
| Liu 2017 | 21 (913) | Diagnóstico | S = 0,87 (0,78-0,92)E = 0,91 (0,84-0,95) | S = 0,87 (0,79-0,91)E = 0,93 (0,84-0,97) | - | - |
| Choi 2017 | 24 (781) | Sospecha ECEC establecida | -S: 77-81% E: 85-89% | S = 77% E = 80%S = 77-81% E = 80-90% | - | S = 62-100% E = 50-100%S: 77-100% E: 53-100% |
| Kopylov 2017 | 13 (500) | Diagnóstico (cápsula)EC proximal | - | OR = 3,24 (0,14-72,7)OR = 2,79 (1,2-6,48) | OR = 1 (0,36-2,81)OR = 2,76 (0,84-9,02) | - |
| Greenup 2016 | 21 (1135) | Diagnóstico | S: 67-95% E: 70-90% | S: 66-100% E: 72-100% | S: 86-97% E: 83-97% | - |
| Serafín 2016 | 8 (332) | Diagnóstico(CEUS)* | - | - | S = 0,94 (0,85-0,91)E = 0,86 (0,67-0,88) | |
| Zhu 2016 | 13 (806) | Diagnóstico(SICUS)** | - | - | S = 0,88 (0,87-0,97)E = 0,86 (0,83-0,89) | - |
| Ahmed 2016 | 19 (102) | Actividad | - | S = 0,88 (0,86-0,91)E = 088 (0,84-0,91) | - | - |
| Puylaert 2015 | 19 (549) | Actividad (precisión) | 86% (75%-93%) | 84% (0,67-0,93) | 44% (0,28-0,61) | - |
| Qiu 2015 | 6 (290) | DiagnósticoEC activa | S = 0,85,8 (0,79-0,91)E = 0,83 (0,75-0,90) | S = 0,87,9 (0,81-0,92)E = 0,81,2 (0,72-0,88) | - | - |
| Ma 2015 | 8 (428) | Diagnóstico(CEUS) | - | - | S = 0,93 (0,89-0,95)E = 0,87 (0,81-0,91) | |
| Dong 2014 | 15 (1558) | Diagnóstico | - | - | S = 0,88 (0,85-0,91)E = 0,97 (0,96-0,98) | - |
| Giles 2013 | 11 (496) | DiagnósticoPediatría | - | S = 0,84 (0,77-0,90)E = 0,97 (0,91-0,99) | - | - |
| Panés 2011 | 14 (1163)21 (640) | LocalizaciónActividad | S: 88% E: 88%S: 81% E: 88% | S: 74% E: 91%S: 80% E: 82% | S: 86% E: 94%S: 85% E: 91% | - |
| Horsthuis 2008 | 33 (11 Eco) | Diagnóstico | S: 84,3% E: 95,1% | S:93% E:92,8% | S: 89,7% E: 95,6% | |
| Fraquelli 2007 | 7 (975) | Diagnóstico | 3 mm: S = 88% E = 93%4 mm: S = 75%E = 97% | |||
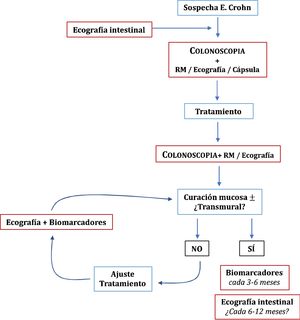
Una vez que iniciado un tratamiento en los pacientes con EC, es necesario evaluar si se han conseguido los objetivos y, de ser así, monitorizar periódicamente la posibilidad de reactivación de la enfermedad. La respuesta inicial, endoscópica o transmural, se recomienda evaluarla dentro de los primeros seis meses de iniciado el tratamiento49 La ecografía puede ser de utilidad en esta monitorización. El principal estudio en este sentido es el TRUST, multicéntrico y prospectivo, que incluyó 234 pacientes seguidos durante 12 meses. Prácticamente todos los parámetros evaluados (grosor de la pared, pérdida de la estratificación en capas, proliferación fibrograsa, señal Doppler color, adenopatías o estenosis) experimentaron mejoría ya al tercer mes de tratamiento47. Los cambios ecográficos pueden ser incluso más tempranos habiéndose descrito ya a las dos y cuatro semanas38,87,88. Por otro lado, la ecografía tiene una excelente correlación con los hallazgos endoscópicos, pudiendo establecer una buena estimación de la curación mucosa89. De los distintos parámetros el que mejor predice curación mucosa es la señal Doppler color (κ = 0,82; p < 0,001) con una sensibilidad del 97,6% y especificidad del 82,4%.
La curación transmural o desaparición completa de las lesiones conlleva una mejor evolución que la mejoría parcial a medio-largo plazo90-92, e incluso, podría tener un valor pronóstico mayor que la curación mucosa aislada93. Aproximadamente un tercio de los pacientes con curación mucosa presentan lesiones persistentes en las técnicas de imagen, y no todas estas lesiones tienen la misma significación pronóstica93,94. Con RM, el engrosamiento residual, el realce y la presencia de estenosis se asocian con un mayor riesgo de recidiva, no así la proliferación fibrograsa46,94.
Una vez conseguidos los objetivos del tratamiento, el papel de las técnicas de imagen en la monitorización de los pacientes con EC se centra en los casos de sospecha de recidiva, síntomas no explicados o antes de un cambio de tratamiento relevante49. La clínica y los biomarcadores no están exentos de falsos negativos, por lo que algunos autores recomiendan una exploración cada 6-12 meses95, aunque es algo que no está suficientemente explorado en la literatura especializada. En pacientes en remisión y con PCR normal, hasta un 27% tienen actividad ecográfica, pudiendo cambiar la decisión clínica del médico en un 58-60% de los casos54. El papel de la ecografía en el diagnóstico y monitorización de la EC se resume en la figura 1.
RecurrenciaLa ileocolonoscopia se considera la técnica de elección para la evaluación inicial y se propone la realización a los 6-12 meses tras la cirugía96, utilizándose el índice de Rutgeerts (iR) para la evaluación y gradación de los hallazgos97. Sin embargo, no está bien establecido cuando se debe realizar la siguiente ileocolonoscopia, por lo que se ha propuesto el empleo de la ecografía junto a la calprotectina fecal como métodos válidos no invasivos, alternativos a la ileocolonoscopia, durante el seguimiento de la enfermedad.
La sensibilidad y especificidad globales de la ecografía para la detección de recurrencia posquirúrgica (RPQ) es de 94% y 84%, respectivamente98-102. El grosor de la pared es el principal parámetro estudiado y en general se considera como signo de recurrencia un grosor del íleon neoterminal ≥ 3 mm. El uso de contraste oral mejora la sensibilidad (99%), aunque con disminución de la especificidad (74%)98. Otro aspecto que se ha estudiado es la detección de la gravedad de la recurrencia (iR ≥ i3). El valor de corte que mejor predice la presencia de recurrencia grave (iR3-4) es el grosor ≥ 5 mm, con una sensibilidad del 83,8% y especificidad del 97,7%98. Otros signos asociados con las formas graves de enfermedad son la extensión de la afectación del íleon neoterminal y la presencia de complicaciones (fístulas, abscesos) o estenosis99,102-104. La gradación de la hiperemia con ecografía Doppler color se ha correlacionado con los grados de gravedad de la recurrencia endoscópica105. Los estudios con contraste iv mejoran la detección de las formas graves de recurrencia con un alto valor predictivo positivo (82-90%)102,103.
Diagnóstico diferencialLos hallazgos ecográficos de la EII descritos anteriormente pueden identificarse en otras enfermedades y, en ocasiones, el diagnóstico diferencial puede ser complejo. El engrosamiento de la pared es uno de los signos más frecuentes en la afección intestinal y es común a numerosas entidades. Será el aspecto de la ecoestructura de la pared, la localización de la afectación y otros hallazgos ecográficos asociados lo que nos puede ayudar a diferenciarlas. Además, en la mayor parte de las ocasiones la presentación clínica del cuadro ayuda también a establecer el diagnóstico de la enfermedad (tabla 3).
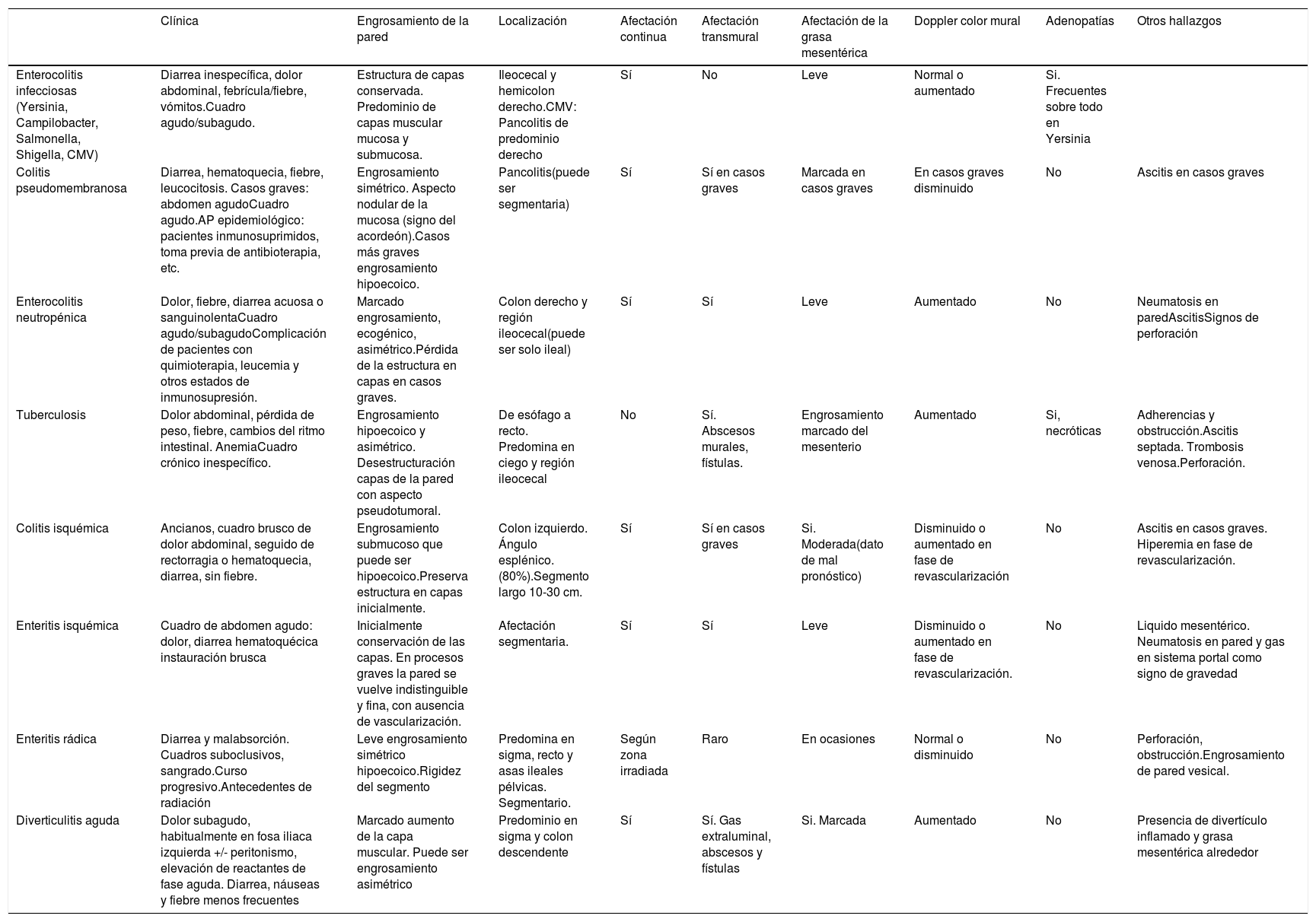
Principales diagnósticos diferenciales de la EII
| Clínica | Engrosamiento de la pared | Localización | Afectación continua | Afectación transmural | Afectación de la grasa mesentérica | Doppler color mural | Adenopatías | Otros hallazgos | |
|---|---|---|---|---|---|---|---|---|---|
| Enterocolitis infecciosas (Yersinia, Campilobacter, Salmonella, Shigella, CMV) | Diarrea inespecífica, dolor abdominal, febrícula/fiebre, vómitos.Cuadro agudo/subagudo. | Estructura de capas conservada. Predominio de capas muscular mucosa y submucosa. | Ileocecal y hemicolon derecho.CMV: Pancolitis de predominio derecho | Sí | No | Leve | Normal o aumentado | Si. Frecuentes sobre todo en Yersinia | |
| Colitis pseudomembranosa | Diarrea, hematoquecia, fiebre, leucocitosis. Casos graves: abdomen agudoCuadro agudo.AP epidemiológico: pacientes inmunosuprimidos, toma previa de antibioterapia, etc. | Engrosamiento simétrico. Aspecto nodular de la mucosa (signo del acordeón).Casos más graves engrosamiento hipoecoico. | Pancolitis(puede ser segmentaria) | Sí | Sí en casos graves | Marcada en casos graves | En casos graves disminuido | No | Ascitis en casos graves |
| Enterocolitis neutropénica | Dolor, fiebre, diarrea acuosa o sanguinolentaCuadro agudo/subagudoComplicación de pacientes con quimioterapia, leucemia y otros estados de inmunosupresión. | Marcado engrosamiento, ecogénico, asimétrico.Pérdida de la estructura en capas en casos graves. | Colon derecho y región ileocecal(puede ser solo ileal) | Sí | Sí | Leve | Aumentado | No | Neumatosis en paredAscitisSignos de perforación |
| Tuberculosis | Dolor abdominal, pérdida de peso, fiebre, cambios del ritmo intestinal. AnemiaCuadro crónico inespecífico. | Engrosamiento hipoecoico y asimétrico. Desestructuración capas de la pared con aspecto pseudotumoral. | De esófago a recto. Predomina en ciego y región ileocecal | No | Sí. Abscesos murales, fístulas. | Engrosamiento marcado del mesenterio | Aumentado | Si, necróticas | Adherencias y obstrucción.Ascitis septada. Trombosis venosa.Perforación. |
| Colitis isquémica | Ancianos, cuadro brusco de dolor abdominal, seguido de rectorragia o hematoquecia, diarrea, sin fiebre. | Engrosamiento submucoso que puede ser hipoecoico.Preserva estructura en capas inicialmente. | Colon izquierdo. Ángulo esplénico. (80%).Segmento largo 10-30 cm. | Sí | Sí en casos graves | Si. Moderada(dato de mal pronóstico) | Disminuido o aumentado en fase de revascularización | No | Ascitis en casos graves. Hiperemia en fase de revascularización. |
| Enteritis isquémica | Cuadro de abdomen agudo: dolor, diarrea hematoquécica instauración brusca | Inicialmente conservación de las capas. En procesos graves la pared se vuelve indistinguible y fina, con ausencia de vascularización. | Afectación segmentaria. | Sí | Sí | Leve | Disminuido o aumentado en fase de revascularización. | No | Liquido mesentérico. Neumatosis en pared y gas en sistema portal como signo de gravedad |
| Enteritis rádica | Diarrea y malabsorción. Cuadros suboclusivos, sangrado.Curso progresivo.Antecedentes de radiación | Leve engrosamiento simétrico hipoecoico.Rigidez del segmento | Predomina en sigma, recto y asas ileales pélvicas. Segmentario. | Según zona irradiada | Raro | En ocasiones | Normal o disminuido | No | Perforación, obstrucción.Engrosamiento de pared vesical. |
| Diverticulitis aguda | Dolor subagudo, habitualmente en fosa iliaca izquierda +/- peritonismo, elevación de reactantes de fase aguda. Diarrea, náuseas y fiebre menos frecuentes | Marcado aumento de la capa muscular. Puede ser engrosamiento asimétrico | Predominio en sigma y colon descendente | Sí | Sí. Gas extraluminal, abscesos y fístulas | Si. Marcada | Aumentado | No | Presencia de divertículo inflamado y grasa mesentérica alrededor |
En muchas ocasiones los hallazgos ecográficos no nos van a permitir diferenciar la EII de otras afecciones intestinales, como es el caso de las ileítis infecciosas. En estos casos si realizamos una ecografía transcurridos 4-6 semanas del proceso agudo podemos comprobar la resolución de los hallazgos ecográficos en la patología infecciosa, siendo infrecuente que esto ocurra en pacientes con EC.
Ecografía en la CULa utilidad de la ecografía en la colitis ulcerosa (CU) está menos establecida debido a varios motivos: una mayor correlación entre las manifestaciones clínicas y la actividad endoscópica106, una adecuada correlación de la misma con la calprotectina fecal107, una mejor accesibilidad a la evaluación endoscópica49 y, finalmente, porque en la CU no se precisa de pruebas de imagen para monitorizar la respuesta al tratamiento108. Por otra parte, las guías ECCO no recomiendan la evaluación sistemática del intestino delgado en pacientes con CU y tan sólo lo consideran cuando se plantean dudas diagnósticas con la EC, como en casos de preservación rectal, síntomas atípicos o ileítis por reflujo109.
La ecografía no permite una adecuada valoración del recto, por lo que generalmente vamos a poder identificar la afectación desde la unión rectosigma en sentido proximal con una extensión variable. Los hallazgos ecográficos más habituales son un engrosamiento de la pared intestinal, simétrico y continuo, irregularidad de la superficie mucosa, edema submucoso, pérdida de las haustraciones e hiperemia parietal56,110. El grosor empleado para el diagnóstico de CU suele ser de 3 mm en niños111 y de 4 mm en adultos56. Debido a que la enfermedad no es transmural, son hallazgos menos frecuentes la afectación de la grasa mesentérica y la pérdida de la ecoestructura de la pared intestinal112, aunque pueden estar presentes en brotes graves de la enfermedad57.
La ecografía ha demostrado una gran correlación con los hallazgos endoscópicos en la valoración de la extensión de la enfermedad en la CU, demostrándose su utilidad en pacientes que debuten con un brote grave, en los que la colonoscopia es incompleta o limitada y en los que la extensión proximal es desconocida56,111,113.
Hay una alta correlación entre la actividad endoscópica y los hallazgos ecográficos114-117, siendo el grosor de la pared y la hiperemia parietal los parámetros más útiles111,115,116,117,118.
Aprendizaje de la técnicaHabitualmente se asume que la ecografía intestinal tiene una alta variabilidad interobservador y una curva de aprendizaje elevada. Sin embargo, en las variables principales de actividad, como son el grosor de la pared o la vascularización parietal, la correlación entre exploradores es excelente (k= 0,7-1 y 0,53-0,89 respectivamente)15. La curva de aprendizaje está poco estudiada y únicamente hay un trabajo publicado en el que establece que el número de exploraciones necesarias para alcanzar un grado de competencia similar a alguien con experiencia es de alrededor de 150-200119. La experiencia previa en ecografía abdominal acelera el proceso y si bien no es imprescindible para adquirir la capacitación, es conveniente tener conocimientos para el despistaje de otras patologías que puedan estar presentes.
ConclusionesLa ecografía es una técnica con un rendimiento similar a otras técnicas de imagen como la RMN o TC, pero aporta ventajas como es su amplia disponibilidad y accesibilidad, así como su excelente tolerancia. Puede realizarse sin preparación «a pie de cama» permitiendo un diagnóstico de la EII sobre la marcha, acortando el tiempo hasta el diagnóstico. Complementa a la colonoscopia en delimitar la extensión y valorar la actividad en el diagnóstico inicial de la EC y permite, dada su tolerancia, realizar las exploraciones que sean necesarias para una monitorización estrecha o «proactiva». Tiene capacidad, además, de diagnosticar las complicaciones asociadas a la enfermedad como estenosis, fístulas o abscesos con elevada rentabilidad, así como guiar el drenaje percutáneo de estos últimos cuando sea necesario. También tiene un papel en detectar la recurrencia tras la cirugía ayudando a ahorrar exploraciones endoscópicas. En la CU, sin embargo, tiene un papel más accesorio, puesto que la endoscopia es la técnica fundamental en el manejo de estos pacientes, pero ayuda a delimitar la extensión y actividad cuando no es posible con la colonoscopia. A pesar de estas ventajas, su difusión e implantación en las Unidades de EII en España es limitada por lo que es esencial la promoción y formación en la técnica para su incorporación a la práctica clínica habitual de forma generalizada.
RecomendacionesIntroducción y ventajas e inconvenientes
- •
En la evaluación de la EC se recomienda el empleo de pruebas de imagen seccionales que permitan la valoración de segmentos proximales al íleon terminal o de lesiones transmurales para complementar los hallazgos de la colonoscopia.
- •
La ecografía intestinal permite esta valoración con alto rendimiento, tanto al diagnóstico como en la monitorización, y aporta ventajas adicionales frente la TC (ausencia de radiación) y la RM (coste-efectividad, tolerancia, disponibilidad y accesibilidad).
Técnica
- •
La exploración se puede realizar sin ninguna preparación previa, aunque en las exploraciones programadas es conveniente un ayuno de al menos cuatro horas.
- •
Se recomienda para la valoración ecográfica de las asas intestinales el empleo de transductores de alta frecuencia (al menos 5 MHz) que permitan identificar las capas de la pared intestinal. El examen debe incluir el modo B y el Doppler color para evaluar la existencia de hiperemia de la pared intestinal.
- •
La exploración se puede complementar con la administración de contraste oral, para una mejor valoración de las estenosis y de las asas proximales al íleon.
- •
El contraste intravenoso mejora la valoración de la vascularización del asa afecta y es útil sobre todo en casos de engrosamiento patológico de la pared sin hiperemia parietal con el Doppler color o en presencia de flemones o abscesos.
Hallazgos
- •
Para el diagnóstico de EC se recomienda utilizar un grosor de la pared mayor de 3 mm para maximizar la sensibilidad. Si se prefiere una mayor especificidad diagnóstica el valor sería de 4 mm.
- •
Para evaluar la actividad de la EC se recomienda valorar el patrón en capas de la pared intestinal, la presencia de úlceras o de proliferación fibrograsa, así como la vascularización de la pared intestinal mediante Doppler color. El contraste iv se puede utilizar en aquellos casos con engrosamiento de la pared intestinal en los que el modo Doppler color no haya sido capaz de detectar hiperemia.
Extensión y localización
- •
Se recomienda el empleo de ecografía o RM para determinar la extensión de la EC.
- •
En los casos de afectación extensa (>20 mm) se recomienda la realización de una RM, especialmente al diagnóstico. En la planificación prequirúrgica se valorará una RM si se prevé que los hallazgos tengan relevancia, no siendo imprescindible su realización.
Complicaciones
- •
Ante la sospecha de estenosis en la ecografía se recomienda la administración de contraste oral para aumentar la exactitud del diagnóstico. La elastografía y el contraste iv pueden ayudar a caracterizar la naturaleza predominantemente inflamatoria o fibrótica de la estenosis.
- •
Se recomienda a la ecografía como técnica inicial ante la sospecha de absceso o fístula, dado que muestra un rendimiento diagnóstico similar a otras técnicas, sin embargo, en caso de abscesos profundos o retroperitoneales podría ser necesario el uso de la TC o RM intestinal.
- •
Se recomienda el uso de contraste iv ante la presencia de una masa inflamatoria, ya que permite diferenciar flemón de absceso y definir mejor el tamaño del absceso. La ecografía con contraste iv se considera la técnica de elección si se considera necesario la realización de un drenaje percutáneo y en la monitorización de la resolución del absceso.
Monitorización
- •
Se recomienda la realización de una ecografía temprana (a los 3-6 meses) tras la introducción de un nuevo de tratamiento para la optimización del mismo.
- •
Se recomienda realización de ecografía ante la aparición de sintomatología y antes de realizar un cambio de tratamiento.
- •
Una vez alcanzado el objetivo, en pacientes asintomáticos y aunque no hay suficiente evidencia, podría ser aconsejable la monitorización con ecografía cada 6-12 meses, dependiendo de la gravedad y características de los pacientes, para complementar la información proporcionada por los biomarcadores.
Recurrencia
- •
Se recomienda la utilización de la ecografía junto con la calprotectina fecal en el seguimiento del paciente con EC intervenido, tras la colonoscopia inicial.
- •
En caso de no reconocer la anastomosis puede ser de utilidad el uso de contraste oral. El contraste iv puede ser de ayuda en casos de engrosamiento de la pared sin hiperemia parietal en modo Doppler color.
Diagnóstico diferencial
- •
Ante cualquier sintomatología digestiva la ecografía puede ser de utilidad como primera prueba diagnóstica. En el diagnóstico diferencial con las ileítis infecciosas, previo a una posible colonoscopia, recomendamos repetir la exploración a las 4-6 semanas para comprobar resolución de los hallazgos.
Colitis ulcerosa
- •
En la CU la ecografía tiene un papel complementario de la colonoscopia. Se recomienda su realización en los casos en que no sea posible conocer la extensión de la enfermedad (brotes graves, estenosis, colonoscopia incompleta) o bien en casos de rectosigmoidoscopia normal con sospecha de actividad proximal.
Aprendizaje
- •
Se recomienda la realización de un número suficiente de ecografías tuteladas para alcanzar la capacitación que se estima en unas 200. Los conocimientos previos en ecografía son recomendables y aceleran el aprendizaje.
- -
Fernando Muñoz: Asesoramiento científico, soporte para investigación y/o actividades formativas de Tillots Pharma, Kern Pharma, Abbvie, Janssen, Pfizer y Takeda.
- -
Tomás Ripollés, Joaquín Poza Cordón, Berta de las Heras Páez de la Cadena, María Jesús Martínez-Pérez han participado en actividades formativas patrocinadas por Abbvie.
- -
Enrique de Miguel: sin conflicto de intereses.
- -
Yamile Zabana: Ordadora, consultora, junta asesora o ha recibido ayudas para la investigación de: Abbvie, MSD, Ferring, Amgen, Janssen, Pfizer, Dr Falk Pharma, Tillotts Pharma, Shire, Takeda, Otsuka Pharmaceuticals y Almirall.
- -
Miriam Mañosa Ciria: Ha recibido ayudas para la investigación, actividades formativas o por asesoramiento de MSD, Abbvie, Kern, Takeda, Janssen, Pfizer, Ferring, FaesFarma, Dr. Falk Pharma, Tillots Pharma, y Adacyte.
- -
Belén Beltrán: asesoramiento científico, soporte para investigación y/o actividades formativas para AbbVie, Otsuka, Pfizer, Takeda, y MSD.
- -
Manuel Barreriro-de Acosta: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.