Sr. Director: El tratamiento de la hepatitis C con interferón pegilado y ribavirina está asociado con numerosos efectos secundarios. Entre ellos, se han descrito manifestaciones neuropsiquiátricas, como la depresión, manifestaciones seudogripales y alteraciones hematológicas. Dentro de éstas, las más frecuentes son la anemia y la leucopenia, más rara es la trombocitopenia1 y excepcional la pancitopenia. Presentamos aquí un caso de pancitopenia extrema secundaria al tratamiento con interferón pegilado y ribavirina. Se hizo una búsqueda en Medline y Embase con los descriptores pancytopenia, interferon y ribavirin, pero no se halló ningún caso descrito de pancitopenia tan profunda secundaria al tratamiento con interferón pegilado y ribavirina.
Paciente de 36 años de edad, con hepatopatía crónica por el virus de la hepatitis C (VHC), de 13 años de evolución, sin tratamiento previo. Antecedentes: fumador de 10 paquetes al año, bebedor habitual, ex adicto a drogas por vía parenteral (ADVP) desde hacía 15 años y sin alergias medicamentosas conocidas. El paciente consultó por una transaminasemia, persistentemente elevada, conocida en los últimos 12 meses. Clínicamente, estaba asintomático y con buen estado general. Presentaba los siguientes parámetros analíticos: leucocitos 6.700/ml (48,6% neutrófilos, 39,3% linfocitos, 9,5% monocitos, 2,5% eosinófilos, 0,5% basófilos), plaquetas 204.000/ml, AST 50 U/l, ALT 78 U/l, GGT 70 U/l, FA 103 U/l, LDH 431 mg/dl, ferritina 249 mg/dl, transferrina 233 mg/dl, saturación de transferrina 44,3%; anti-VHC positivo, genotipo VHC-1a, ARN-VHC 10.700.000 copias/ml, y serología para el virus de la inmunodeficiencia humana negativa. En la ecografía abdominal no hubo hallazgos patológicos. Se propuso la realización de una biopsia hepática, a la cual el paciente se negó, pero insistió en recibir tratamiento. Éste se inició con interferón pegilado alfa-2a (Pegasys®), en dosis de 180 mg semanales, y ribavirina (Copegus®), en dosis de 1.200 mg/día. El tratamiento fue bien tolerado y se practicaron controles analíticos periódicos, hasta que a las 8 semanas presentó: leucocitos 2.100/ml (neutrófilos 63%, linfocitos 29,3%, monocitos 7,2%, eosinófilos 0,5%, basófilos 0%), hemoglobina 11,8 g/dl y plaquetas 78.000/ml. Se añadió al tratamiento anterior el factor estimulador de colonias (Filgastrim, Neupo-gen®), en dosis de 300 mg/bisemanal subcutáneo. Pese a ello, a las 12 semanas presentaba: leucocitos 1.100/ml (33,3% linfocitos 63,8% monocitos 2,9% eosinófilos 0%) hemoglobina 8,9 g/dl y plaquetas 25.000/ml. Se suspendió entonces el tratamiento con interferón y ribavirina y se inició darboepoetina alfa (Aranesp®), en dosis de 80 mg/semanales subcutáneo, y hierro oral (Ferplex®) 80 mg/día. El deterioro continuó, y a las 2 semanas de haber suspendido el interferón presentaba la siguiente analítica: leucocitos 1.000/ml (neutrófilos 13,3%, linfocitos 84,7%, monocitos 0%, eosinófilos 2%, basófilos 0%), hemoglobina 7,2 g/dl y plaquetas 3.000/ml. Se realizó una punción medular, que mostró una celularidad global normal y un retraso ligero en la maduración nuclear de la serie eritroide. Se determinaron las crioaglutininas y los anticuerpos anti-ADN y ANA, que resultaron normales. Se administró tratamiento con 50 mg/24 h de prednisona (Dacortín®) en pauta descendente, recuperándose las cifras de hemoglobina, leucocitos y plaquetas. En el último control analítico, tras 3 meses de tratamiento con prednisona, el paciente presentaba: leucocitos 6.500 (neutrófilos 59%, linfocitos 31,5%, monocitos 8,2%, eosinófilos 1,1%, basófilos 0,2%), hemoglobina 14,3 g/dl y plaquetas 166.000 U/l. De acuerdo con el paciente, se decidió no retomar el tratamiento.
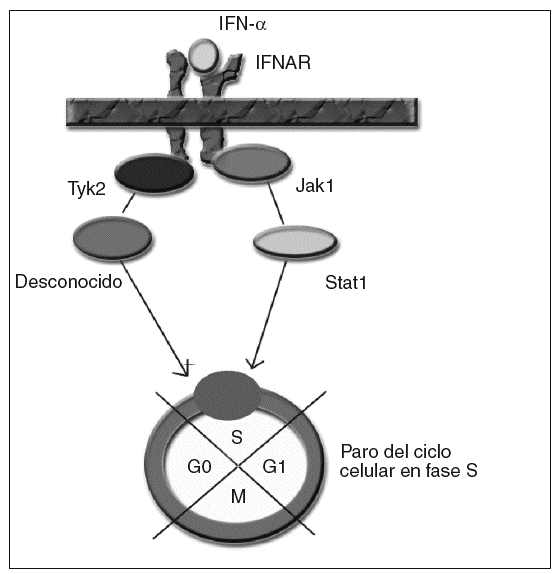
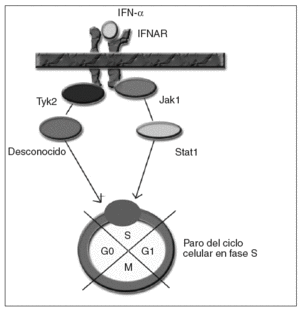
Para los estudios de causalidad sobre los efectos adversos de ciertos medicamentos se emplean diferentes algoritmos. Uno de los más utilizados es el de Naranjo et al2, que consiste en una escala de probabilidad de 0 a 9, en función de si se cumplen una serie de supuestos. Al aplicarlos, obtenemos una puntuación de 6; por tanto, el grado de causalidad para el interferón como precipitante del cuadro quedaría en probable. Para la ribavirina sería únicamente de 2, con lo que se consideraría posible, aunque evidentemente menos probable que el interferón. El mecanismo por el cual se produce la supresión de la proliferación medular por el interferón no está bien establecido. El interferón actúa a nivel celular, uniéndose al receptor de membrana del interferón (IFNAR), que posteriormente activa diferentes proteínas intracelulares en la cascada de transducción de la señal hasta el núcleo3. En el caso del efecto supresor del interferón sobre la médula ósea, se ha sugerido la activación por fosforilización de las proteínas Janus kinasa 1 (Jak1) y tirosincinasa (Tyk2), por parte de IFNAR, que a su vez activarían la proteína Stat1 y un transductor desconocido, transmitiendo la señal al núcleo y consiguiendo un paro del ciclo celular en la fase S4 (fig. 1). Éste es un caso excepcional por la gravedad del cuadro, que es necesario conocer dada la cada vez mayor frecuencia de pacientes tratados a causa de una infección por el VHC. Es necesario realizar un estrecho seguimiento de los valores hematológicos de estos pacientes.
Fig. 1. IFNAR: receptor de membrana del interferón. IFN: interferón.