El tumor de Abrikosoff (TA), o tumor de células granulares (TCG), se localiza raramente en el tracto gastrointestinal. Cuando asienta en el tubo digestivo, habitualmente aparece en el esófago. El diagnóstico suele establecerse de forma accidental al realizar una endoscopia digestiva alta por otros motivos. Endoscópicamente, es una lesión submucosa de pequeño tamaño, de coloración amarillenta y generalmente recubierta por mucosa normal. El TA es homogéneo, hipoecogénico y con bordes bien definidos en el examen ecoendoscópico. El diagnóstico definitivo es histológico. El TCG es de origen neurogénico y está formado por células eosinófilas granulares PAS-positivas, que en la inmunohistoquímica manifiestan la proteína S-100. El TA es normalmente un tumor benigno, aunque se han descrito casos de malignidad. No hay acuerdo sobre cómo debe ser el tratamiento y el seguimiento de este tumor. En la actualidad la mucosectomía endoscópica es una técnica eficaz y segura que se puede aplicar a lesiones submucosas esofágicas, lo que permite el análisis histológico posterior de toda la lesión. Presentamos 3 casos de pacientes diagnosticados de TCG esofágico que fueron tratados mediante mucosectomía endoscópica como tratamiento definitivo.
Abrikosoff's tumor (AT), or granular cell tumor (GCT), is relatively rare in the gastrointestinal tract, where the most common site is the esophagus. This tumor is usually found incidentally when an upper gastrointestinal endoscopy is carried out for another reason. Endoscopically, GCT appears as a small, yellow and submucosal lesion covered by normal mucosa. Endoscopic ultrasonography shows a homogeneous hypoechoic lesion with well defined margins.
The definitive diagnosis is histological. The origin of GCT is neurogenic and the tumor is composed of eosinophilic granular cytoplasm and PAS-positive cells, which show the S-100 protein on immunohistochemistry. Although GCT is usually clinically and histologically benign, some malignant cases have been reported. Consensus is lacking on the treatment and follow-up of this tumor. Currently, endoscopic mucosal resection is a safe and effective technique to treat submucosal esophageal lesions, allowing subsequent histologic analysis. We present three patients with esophageal CGT, who were definitively treated with endoscopic mucosal resection.
El tumor de Abrikosoff, también denominado tumor de células granulares (TCG), suele asentar en la cavidad oral y el tejido celular subcutáneo, y es infrecuente su localización en el tracto gastrointestinal (2-8%)1. Cuando el TCG aparece en el tubo digestivo, el esófago y el estómago son las localizaciones más habituales2,3.
Aunque hay otras alternativas terapéuticas más consolidadas, actualmente la mucosectomía endoscópica parece ser una buena opción para la resección de los tumores submucosos, lo que permite además su análisis histológico posterior. No obstante, su aplicación clínica en nuestro medio sanitario es todavía limitada.
Se presentan 3 casos de pacientes diagnosticados de TCG esofágico que fueron tratados mediante mucosectomía endoscópica como tratamiento definitivo.
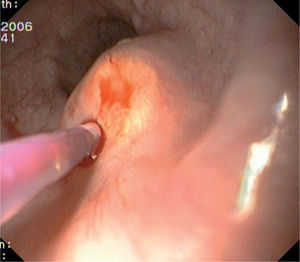
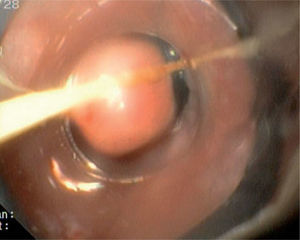
OBSERVACIÓN CLÍNICACaso 1Mujer de 31 años de edad, sin antecedentes de interés, que presentó epigastralgia durante 3 meses, sin mejoría a pesar de la administración de omeprazol en dosis doble (40 mg/día), por lo que se decidió realizar una endoscopia digestiva alta que identificó, a 30 cm de la arcada denta- ria, una formación plana de aspecto polipoideo, de 4 mm de diámetro, recubierta por mucosa de aspecto normal y de apariencia submucosa. Se tomaron biopsias de la lesión, que fueron informadas como compatibles con TCG. El estudio se completó con la realización de una ecoendoscopia que describía la lesión como una formación submucosa, hipoecogénica, de bordes lisos y de 5 × 8 mm de tamaño, sin adenopatias mediastínicas.
Caso 2Varón de 54 años de edad, sin antecedentes personales de interés, al que se le realizó una endoscopia digestiva alta por empeoramiento de la clínica de reflujo gastroesofágico a pesar de recibir tratamiento con inhibidores de la bomba de protones. En dicha prueba se observó en el esófago medio una lesión plana sobreelevada, no ulcerada, amarillenta, de 5 mm de diámetro y recubierta por una mucosa de aspecto normal. Se tomaron biopsias cuyo resultado no fue concluyente. Se realizó un examen ecoendoscópico que puso de manifiesto una tumoración discretamente hipoecogénica, de márgenes lisos y limitada a la capa submucosa, que medía 4 × 6 mm en la imagen endosonográfica.
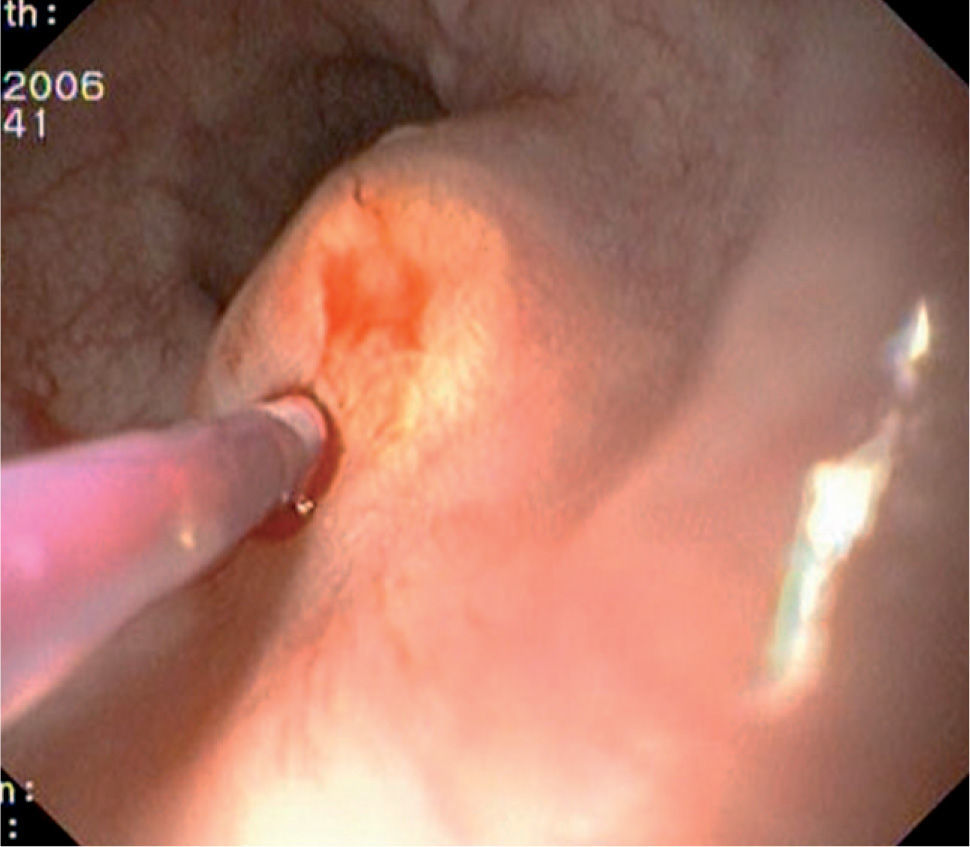
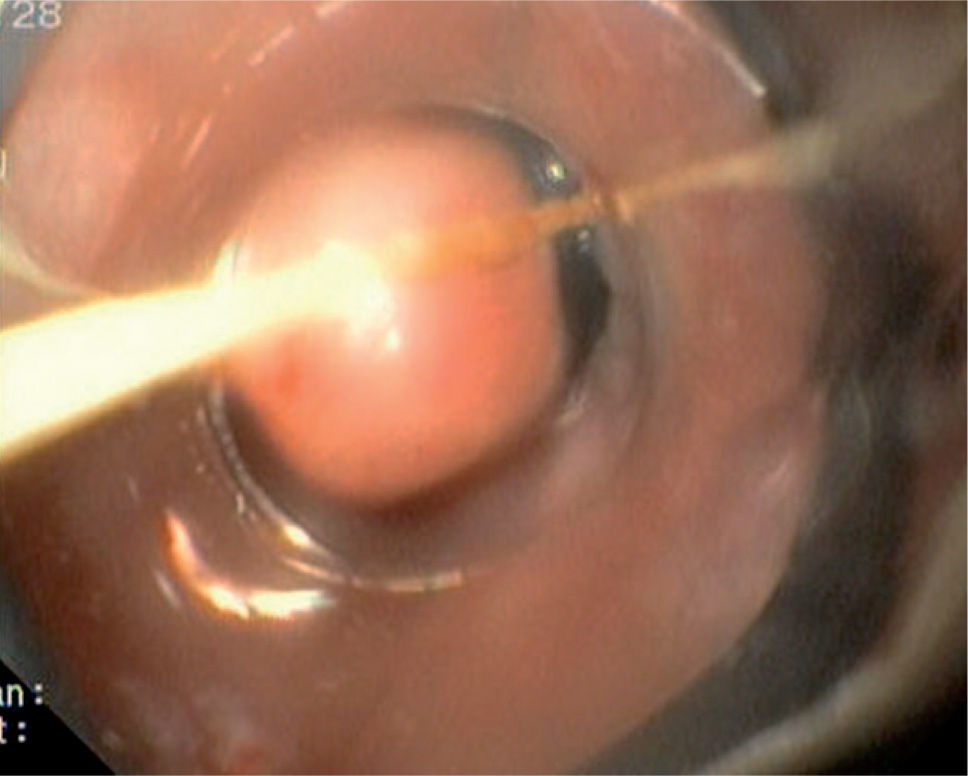
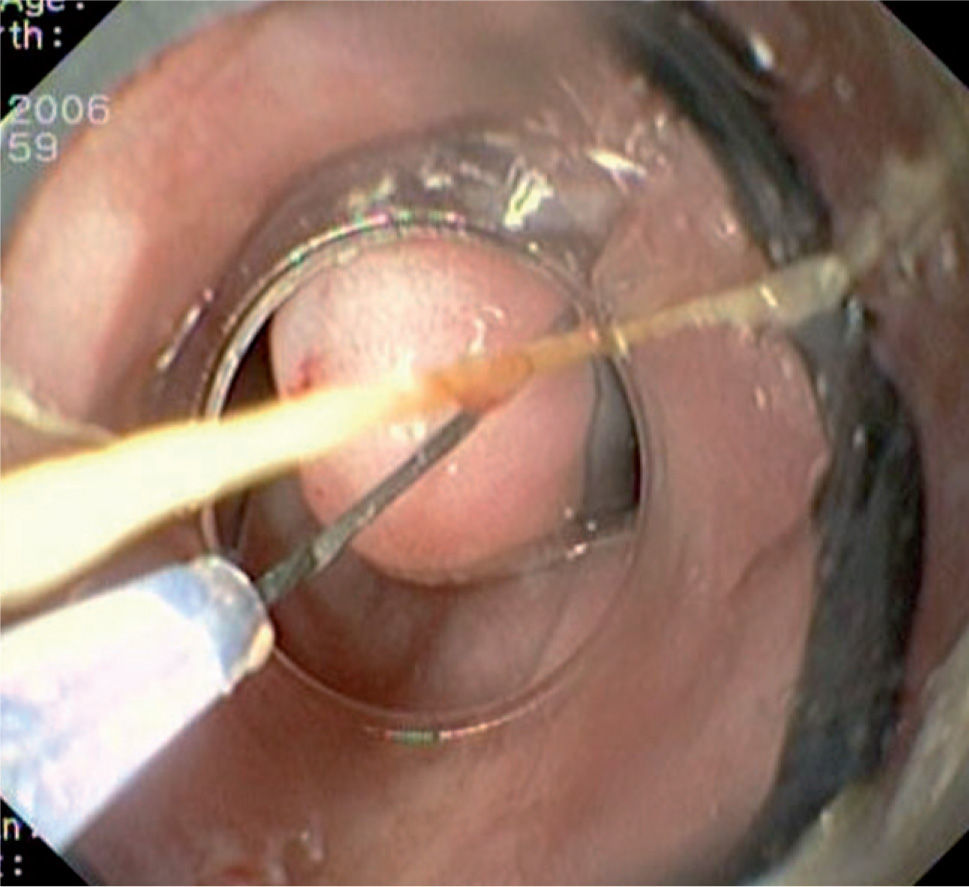
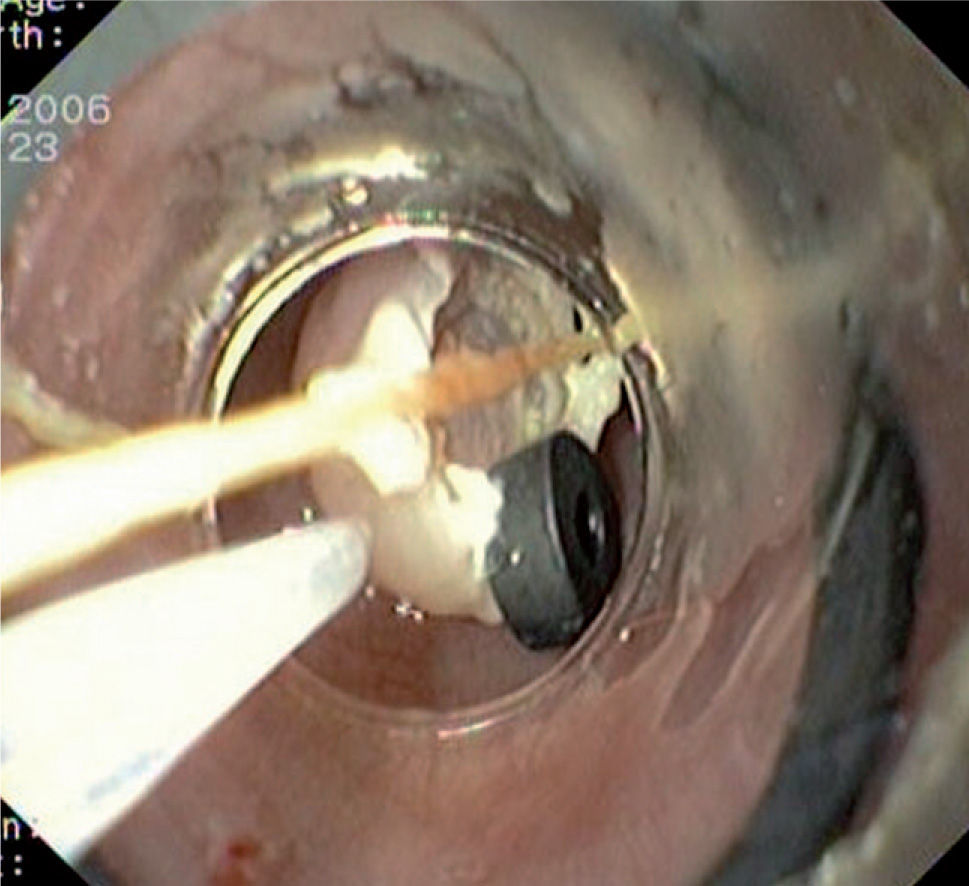
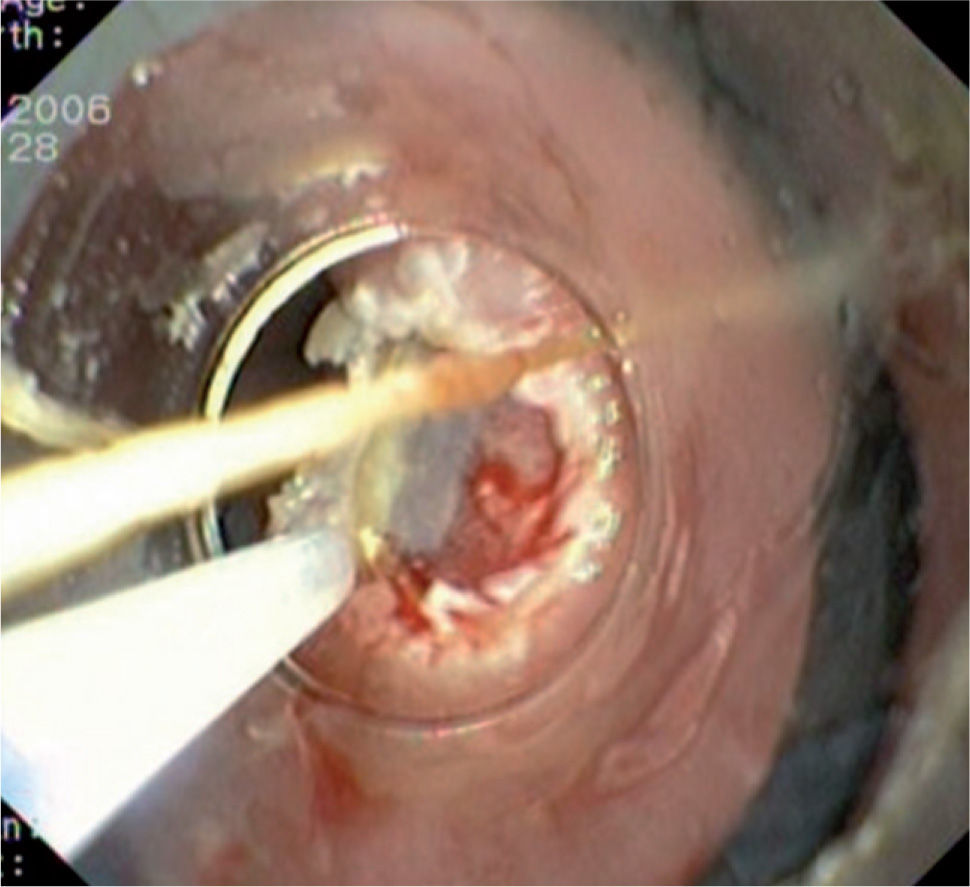
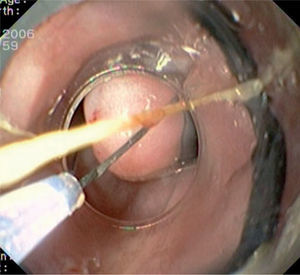
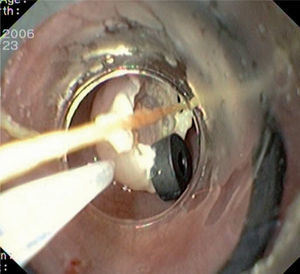
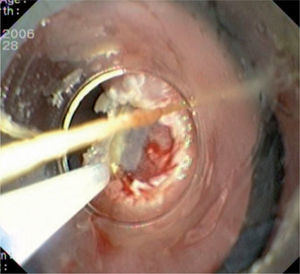
Caso 3Mujer de 28 años de edad, con anemia microcítica, que en el año 2004 presentó epigastralgia sin respuesta al tratamiento médico, por lo que se decidió realizar una endoscopia digestiva alta que puso de manifiesto un tumor de probable origen submucoso, subcentimétrico (de 8 mm) y recubierto por una mucosa de características normales, localizado en el esófago distal. Se tomaron biopsias endoscópicas con resultado compatible con TCG. Se realizó una ecoendoscopia que mostró una tumoración submucosa, hipoecogénica, de 6 × 8 mm de diámetro. Posteriormente, se realizaron controles endoscópicos periódicos sin apreciarse cambios significativos de la lesión. En función de la información aportada por la ultrasonografía endoscópica, estas lesiones descritas eran potencialmente resecables por endoscopia, por lo que se decidió realizar una exéresis de la lesión mediante mucosectomía endoscópica siguiendo la técnica habitual (figs. 1–5).
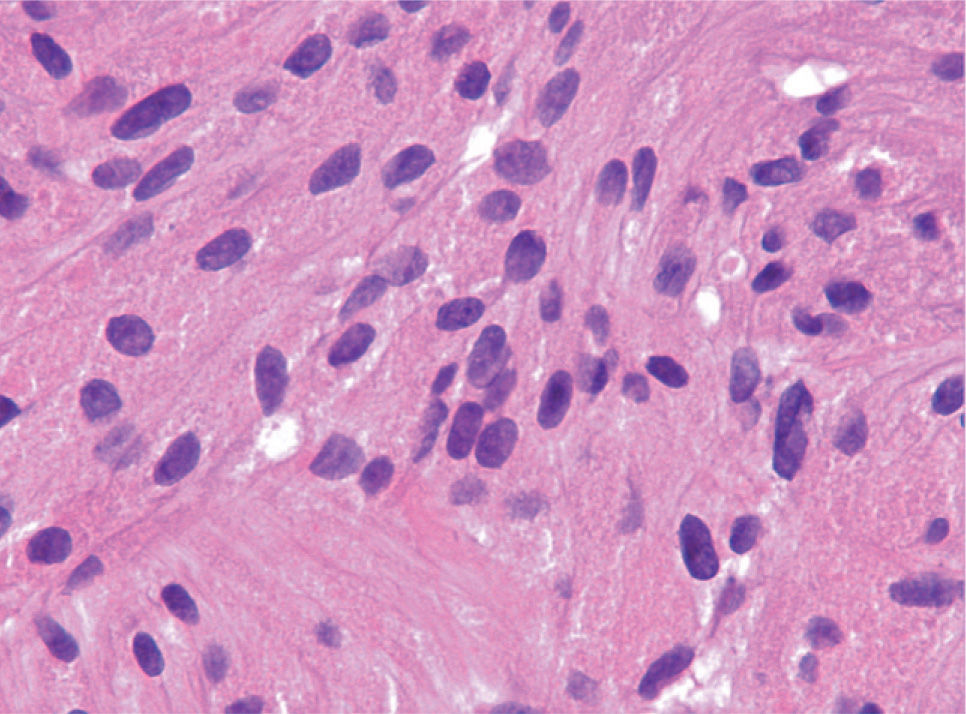
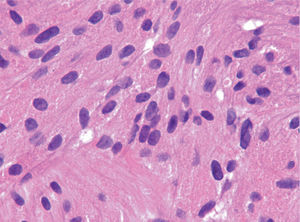
Las piezas resecadas fueron estudiadas morfológicamente en los 3 casos. Los hallazgos histológicos correspondían a una tumoración subepitelial escasamente circunscrita, no encapsulada, que infiltraba la lámina propia (un caso) y la submucosa, y respetaba los bordes quirúrgicos. Esta lesión estaba constituida por células dispuestas en nidos poco cohesivos, de citoplasma amplio eosinófilo y característicamente granular, con cuerpos ovoides, de núcleo ovalado hipercromático, sin pleomorfismo ni mitosis. El estudio inmunohistoquímico demostró positividad para la proteína S-100. El diagnóstico histológico final fue de tumor de células granulares en los 3 casos (fig. 6).
Tras completarse la resección endoscópica, los pacientes recibieron tratamiento antisecretor durante 4 semanas para la cicatrización de la úlcera creada por la mucosectomía. En los 3 casos presentados se han realizado controles endoscópicos y ecoendoscópicos posteriores sin signos de recidiva en la zona de resección (con un seguimiento superior a 12 meses en todos los casos).
DISCUSIÓNEl TCG es un tumor benigno de origen neurogénico, caracterizado por células eosinofílicas de apariencia granular. Aunque originariamente considerado por Abrikosoff en 1926 como un tumor muscular, su estrecha asociación con los nervios y sus características inmunohistoquímicas lo identifican firmemente como un tumor de origen neu- rogénico4–6. El estudio mediante microscopia electrónica e inmunohistoquímica demuestra que este tumor tiene características de células de Schwann.
El TCG suele asentarse en la cavidad oral y el tejido celular subcutáneo del tronco y de las extremidades superiores. Su localización en el tracto gastrointestinal es infrecuente (2,7-8%). Cuando el TCG aparece en el tubo digestivo se localiza en el esófago (30%) y en el estómago (10%), y es excepcional su localización en el duodeno o en el colon1–3. Los TCG pueden ser múltiples hasta en el 5-12% de los casos1,2, sobre todo en los localizados en el estómago7. Se han descrito casos de coexistencia de TCG en el tubo digestivo y en el árbol bronquial8.
Endoscópicamente, el TCG se suele presentar como una formación submucosa, de coloración blanquecina o amarillenta, recubierta por mucosa normal y de pequeño tamaño (1-2 cm de diámetro). Generalmente, se diagnostican de forma accidental y los síntomas a los que se puede asociar son disfagia, dolor retroesternal o epigastralgia9,10. El estudio ecoendoscópico del TCG suele mostrar una lesión localizada en la submucosa, homogénea, hipoecogénica y con límites bien definidos11. Esta técnica permite determinar si el tumor invade la capa muscular propia de la pared intestinal. El diagnóstico diferencial del TCG se debe realizar principalmente con el lipoma y el leiomioma, cuyas características endosonográficas son completamente distintas10. Cuando se realiza la toma de biopsias de la lesión, sólo se consigue el diagnóstico definitivo en la mitad de los casos12, y frecuentemente es necesaria su resección completa para confirmar su naturaleza.
El diagnóstico definitivo del TCG se basa en la histología, que muestra una morfología característica con tinción de hematoxilina-eosina y tinción de PAS, el cual puede confirmarse con el estudio inmunohistoquímico que demuestra positividad de estas células para la proteína S-100. El TCG, por lo general, es un tumor benigno, aunque hasta en un 1,5-2,7% de los casos puede malignizarse13,14. Las características que se asocian con malignidad del TCG incluyen: recurrencia local, crecimiento rápido, tamaño mayor de 4 cm, necrosis celular, celularidad tumoral fusiforme, atipia citológica, alta actividad mitótica, núcleo vesiculoso con nucléolo prominente y una elevada relación núcleo/citoplasma15, así como una inmunohistoquímica positiva para p53 y ki-67, ≥ 50% y ≥ 10%6,16, respectivamente.
Entre los expertos en este tema, no se ha logrado un consenso sobre cuál es la mejor actitud terapéutica ante un TCG. La mayoría de los autores recomienda realizar endoscopias anuales en los pacientes que estén asintomáticos y tengan lesiones < 1 cm. Por el contrario, si la lesión es > 1 cm, se suele aconsejar su resección endoscópica mediante fulguración (con láser o gas argón) o, más recientemente, mediante mucosectomía endoscópica17,18. La fulguración con láser es una técnica costosa y actualmente en desuso, mientras que la fulguración con gas argón impide realizar un análisis histológico completo de la lesión tumoral. La mucosectomía endoscópica es un procedimiento eficaz, seguro y que permite realizar un análisis histológico posterior de la totalidad de la lesión11, lo que hace de este tipo de tratamiento una alternativa muy atractiva, aunque con poca implantación todavía en la práctica clínica. La mucosectomía endoscópica (ME) o resección mucosa endoscópica (RME) es una técnica desarrollada en Japón en los años setenta, cuyo objetivo era extirpar las lesiones neoplásicas superficiales, que por definición tienen un mínimo riesgo de metastatizar en los ganglios linfáticos19. Posteriormente, esta técnica se ha utilizado también para la resección de lesiones benignas situadas en capas más profundas (submucosa) con una intención curativa18.
La ME ha demostrado ser una técnica segura y eficaz que se puede aplicar a lesiones situadas en el esófago, el estómago, el colon o el recto. Presenta un coste menor a la alternativa quirúrgica tradicional y parece asociarse con una tasa de morbimortalidad inferior a ésta. Es importante realizar un seguimiento endoscópico al menos 3 semanas después de la realización de la ME, para valorar la curación completa y la posible existencia de lesiones residuales20 o la recurrencia de la lesión (observada en el 5-10% de los casos)21,22.
En este artículo se describe la ME como una técnica diagnóstica y curativa de las lesiones submucosas esofágicas que, en manos expertas, parece ser fiable y segura, por lo que su uso en la práctica clínica habitual podrá aportar grandes beneficios al tratamiento de estos tumores.