El diagnóstico de sospecha de síndrome de Lynch sin mutación conocida (SSL) o Lynch-like syndrome se establece cuando existe pérdida de expresión de las proteínas reparadoras de ADN (mismatch repair o MMR) o inestabilidad de microsatélites alta, no asociadas a metilación de MLH1 ni a mutación de BRAF, pero sin evidencia de mutación de los genes que codifican estas proteínas en el análisis germinal. Se trata de un cuadro heterogéneo que puede englobar desde verdaderos síndromes hereditarios hasta casos de cáncer colorrectal (CCR) esporádico. En estos casos, los paneles multigenes desempeñan un importante papel para diferenciar ambos.
Presentamos el caso de 2pacientes con sospecha inicial de esta entidad, pero con mutación patogénica en otros genes relacionados con la reparación de ADN tras estudio de secuenciación masiva de dichos paneles.
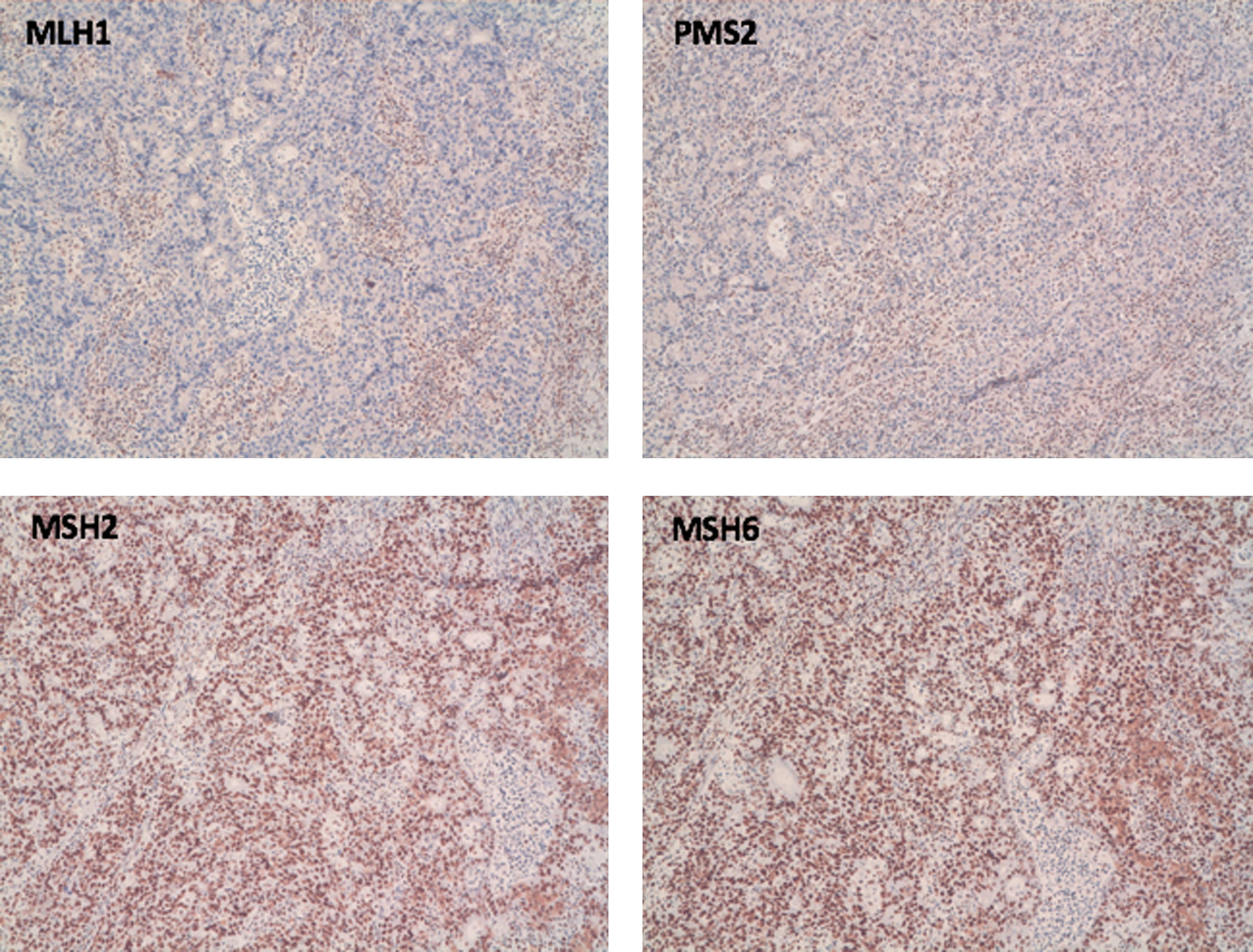
Caso 1Mujer de 70 años con antecedentes familiares de primer y segundo grado de cáncer endometrial, cáncer de mama y cáncer gástrico, diagnosticada de CCR con pérdida de expresión nuclear de MLH1 y PMS2 (fig. 1). Se solicitó estudio de mutación BRAF que mostró BRAF nativo, por lo que se realizó estudio genético. El análisis germinal a través de un panel multigén demostró ausencia de mutaciones en los genes MLH1, MSH2, MSH6, PMS2 y EPCAM, pero se detectó una variante en heterocigosis c.280-821del (p.Leu274Phefs*16) en el gen MRE11A considerada como variante posiblemente patogénica.
Caso 2Mujer de 54 años remitida por antecedente personal de CCR a los 23 años y antecedente familiar de primer grado de CCR a los 62 años. Al igual que en el otro caso, se detectó pérdida de expresión de MLH1, pero con estudio germinal de los genes relacionados con el síndrome de Lynch normal. Sin embargo, se obtuvo una variante en heterocigosis c.1343T>G (p.Leu448Ter) en el gen BARD1, descrita como variante posiblemente patogénica.
DiscusiónCon la recomendación de cribado molecular universal de síndrome de Lynch, cada vez es más frecuente encontrarnos ante la alteración molecular no acompañada de una mutación germinal. Puede deberse a diferentes causas: 1) alteraciones germinales atípicas no identificadas con los medios actuales que provocan una mutación somática de los restantes alelos; 2) alteraciones germinales en otros genes (como MUTYH, POLD1, POLE) que podrían afectar el sistema MMR; 3) alteraciones somáticas en los oncogenes, alteraciones somáticas bialélicas en los genes MMR o combinación de ambas. El comportamiento clínico de la SSL no es del todo bien conocido. Se sabe, no obstante, que la incidencia de CCR en las familias con SSL es mayor que en familias con CCR esporádico, pero menor que en familias con síndrome de Lynch. En un estudio realizado con 160 pacientes con SSL, las características demográficas, clínicas e histológicas fueron parecidas, independientemente de la historia familiar1.
Dentro de esta heterogénea entidad podríamos distinguir 2tipos de pacientes: aquellos con historia familiar que sugiere un síndrome hereditario, pero sin evidencia de una mutación familiar y aquellos pacientes sin antecedentes familiares significativos de CCR cuyo único elemento de sospecha de síndrome de Lynch son las alteraciones moleculares. En estos casos, la causa más frecuente suele ser una doble mutación somática en los genes MMR. Por eso, algunos autores proponen evaluar mutaciones somáticas para clasificarlos como esporádicos o hereditarios2. La última guía de práctica clínica de diagnóstico y prevención de CCR propone, además del análisis de mutaciones somáticas, el uso de paneles multigenes para excluir mutaciones germinales en otros genes3 que es lo que se hizo en los casos presentados.
El gen MRE11 desempeña un importante papel en la respuesta al daño del ADN y en la reparación de la rotura de la doble cadena. La deficiencia de MRE11 puede causar inestabilidad de microsatélites a través de la interacción defectuosa con MLH1 y llevar a su inactivación en los tumores MMR-deficientes4. Por su parte, la interacción entre BARD1 y BRCA1 promueve la función supresora de tumores mediante la activación de la reparación de la rotura de la doble cadena y el inicio de la apoptosis5.
Por tanto, los pacientes con SSL constituyen un grupo heterogéneo de pacientes en el que el estudio mediante secuenciación masiva puede ayudar a distinguir un verdadero síndrome hereditario del CCR esporádico.