La gastropatía de la hipertensión portal (GHP) es una complicación de la hipertensión portal (HTP) generalmente asociada a la cirrosis hepática (CH). Su etiopatogenia no está clara; se acepta, sin embargo, que la presencia de HTP es un factor imprescindible para su desarrollo. La GHP puede ser asintomática o manifestarse en forma de anemia ferropénica o hemorragia digestiva. Las lesiones endoscópicas varían desde un patrón en mosaico hasta manchas rojas difusas en los casos más graves; la localización más característica es el fundus. El tratamiento está indicado en caso de hemorragia, aguda o crónica como profilaxis secundaria. No hay datos suficientes para recomendar profilaxis primaria en pacientes que no han sangrado. Pueden utilizarse fármacos que disminuyen la presión portal, como los betabloqueantes no cardioselectivos, y/o tratamientos endoscópicos ablativos, como el argón. El papel del transarterial intrahepatic portosistemic shunt o shunt intrahepático portosistémico (TIPS) o la cirugía derivativa no ha sido suficientemente analizado. Por su parte, la ectasia vascular antral es una entidad poco frecuente en la CH cuya fisiopatología todavía se desconoce. Clínicamente, se comporta igual que la GHP y a nivel endoscópico suele presentarse como manchas rojas en antro. A menudo, es necesario realizar una biopsia para diferenciarla de la GHP. No disponemos de tratamiento médico efectivo, por lo que, en pacientes sintomáticos, se recomienda tratamiento ablativo endoscópico y, en casos graves, valorar antrectomía.
Portal hypertensive gastropathy (GHP) is a complication of portal hypertension usually associated with liver cirrhosis. The pathogenesis is unclear but the presence of portal hypertension is an essential factor for its development. GHP may be asymptomatic or present as gastrointestinal bleeding or iron deficiency anemia. Endoscopic lesions vary from a mosaic pattern to diffuse red spots; the most common location is the fundus. Treatment is indicated when there is acute or chronic bleeding, as secondary prophylaxis. There is insufficient evidence to recommend primary prophylaxis in patients who have never bled. Drugs that decrease portal pressure, such as non-cardioselective beta-blockers, and/or endoscopic ablative treatments, such as argon-beam coagulation, may be used. The role of transarterial intrahepatic portosystemic shunt) or bypass surgery has been insufficiently analyzed. Antral vascular ectasia (EVA) is a rare entity in liver cirrhosis, whose pathophysiology is still unknown. Clinical presentation is similar to that of GHP and endoscopy usually shows red spots in the antrum. Biopsy is often required to differentiate EVA from GHP. There is no effective medical therapy, so endoscopic ablative therapy and, in severe cases, antrectomy are recommended.
La GHP es una lesión de la mucosa gástrica descrita en 1985 por McCormack et al.1. Se caracteriza por la aparición en la endoscopia de pacientes con hipertensión portal (HTP) de lesiones en forma de patrón en mosaico, eritema, puntos rojos o manchas, e incluso lesiones hemorrágicas difusas. Se puede diferenciar de otros tipos de gastritis por su distinta imagen endoscópica e histológica.
La prevalencia de GHP varía entre el 7 y el 98%2–6, según las series publicadas. Estas diferencias son debidas a la diferente selección de pacientes, a que no existen criterios diagnósticos unificados y a la existencia de importantes diferencias inter e intraobservador. La incidencia es más difícil de valorar debido a una de las características propias de la GHP, que es la fluctuación en el tiempo. En pacientes con cirrosis y HTP previamente demostrada o antecedente de obliteración variceal, se sitúa entre el 24 y el 40% al año2–4.
El objetivo del presente artículo es revisar la patogenia, los criterios diagnósticos y las opciones terapéuticas de la GHP.
MétodosSe han realizado búsquedas en PubMed y ISI web of Knowledge hasta julio del 2014 de artículos relacionados con GHP o EVA. Las estrategias de búsqueda se muestran en el anexo 1. Se analizaron también la bibliografía de las revisiones principales y las bases de datos personales de los autores. Se detectaron 590 artículos potencialmente útiles, de los cuales se han utilizado 106 para la revisión.
Para valorar la calidad de la evidencia y la fuerza de recomendación se ha utilizado el sistema GRADE (https://www.fisterra.com/guias-clinicas/la-evaluacion-calidad-evidencia-graduacion-fuerza-recomendaciones-sistema-grade/).
Factores relacionados con el desarrollo de gastropatía de la hipertensión portalSe desconoce qué otros factores —además de la CH y la HTP— predisponen a la aparición de GHP. No parece que la GHP se correlacione con la edad, el sexo del paciente o la etiología de la CH7. Se han evaluado, con resultados controvertidos:
- –
Grado de disfunción hepática: algunos estudios3,4,8,9 muestran una correlación entre el grado Child-Pugh y la aparición de GHP. En cambio, otros estudios2,5,10–18 —incluido el inicial de McCormack et al.1— no observaron una correlación significativa.
- –
Presencia y tamaño de varices esofágicas: los resultados son controvertidos, y mientras algunos estudios hallan una relación directa entre el tamaño de las varices y la presencia de GHP2,4,8,9,19, otros estudios no la observan1,5,11–14,16,18.
- –
Gradiente de presión portal: hasta la actualidad, se ha postulado que la HTP es el factor desencadenante de GHP, siendo independiente de la CH. De hecho, los pacientes con HTP sin enfermedad hepática (p. ej., con trombosis portal) pueden presentar GHP2. El gradiente de presión portal se ha relacionado con la gravedad de la GHP en algunos estudios5,19, mientras que en otros no1,11–13,16. Hasta la actualidad, no se ha descrito GHP en pacientes con enfermedad hepática sin hipertensión portal14.
- –
Antecedente de esclerosis o ligadura de varices: los resultados respecto a este factor son también contradictorios con algunos autores3,10,20–23 que observan relación entre GHP y tratamiento endoscópico de las varices, mientras que otros estudios2,5 no han encontrado ninguna relación.
- –
Otros factores: hay estudios3,20,24,25 que indican que la GHP aparece más frecuentemente en la HTP de origen cirrótico que en la HTP de origen no cirrótico. Esto apoyaría la hipótesis de que la hepatopatía subyacente puede favorecer la aparición de GHP. La presencia de Helicobacter pylori (H. pylori) tampoco parece un que predisponga a la aparición de gastropatía ni al empeoramiento de las lesiones26–28.
La fisiopatología de la GHP no está bien definida. Hay diferentes hipótesis sobre la etiopatogenia; se acepta que la HTP es necesaria, pero no suficiente para el desarrollo de GHP.
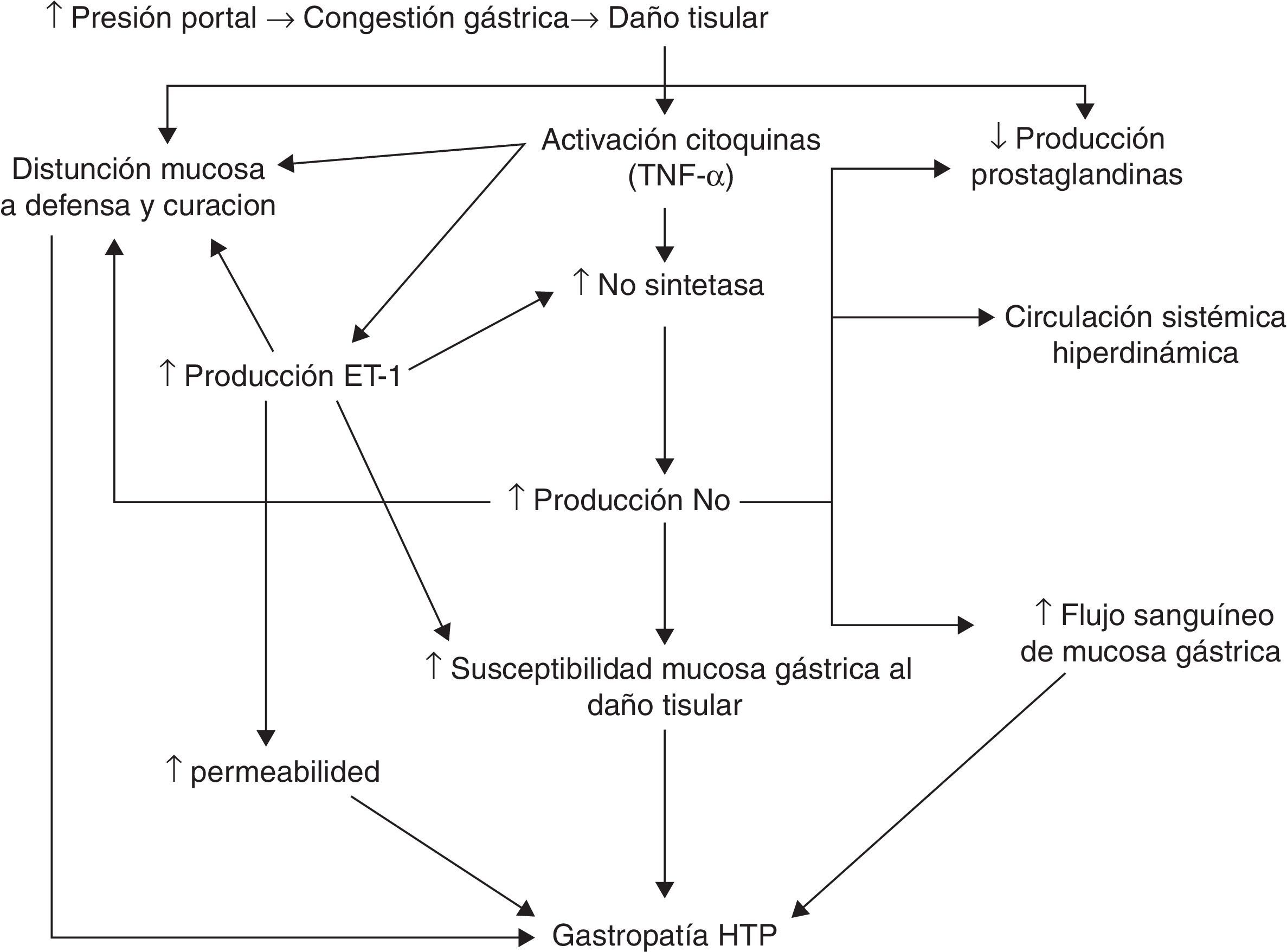
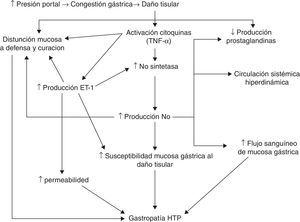
Se ha indicado que el aumento de la presión portal induce cambios en la hemodinámica esplácnica, causando congestión y daño en el tejido gástrico, provocando la activación de citocinas (como el TNF-α) y factores de crecimiento vascular. Estas sustancias activarían la óxido nítrico-sintetasa (NOS) y probablemente la endotelina-1. La sobreexpresión de la NOS produciría un exceso de óxido nítrico, lo que induciría una circulación sistémica hiperdinámica, un aumento del flujo sanguíneo gástrico y una disminución de la producción de prostaglandinas. Esta disminución de la producción de prostaglandinas, junto con el aumento de endotelina-1 y otras citocinas, causaría una disfunción de los mecanismos de defensa y reparación. Estas alteraciones favorecerían la aparición de GHP29 (fig. 1).
Posible patogenia. Modificado de Ohta et al.29.
Hay muy pocos estudios que evalúen el papel de los factores angiogénicos en la GHP. Algunos autores indican que un aumento de los niveles locales del factor de crecimiento vascular epidérmico (VEGF) alteraría la permeabilidad vascular, aumentando la fragilidad mucosa gástrica y el riesgo de lesión30,31.
Historia natural y clínicaLa GHP es causa de un 10-60% de las hemorragias digestivas altas (HDA) en pacientes con cirrosis hepática (CH). Sin embargo, menos de un 10% de los pacientes diagnosticados de GHP presentarán una HDA en algún momento de su evolución1,2,4,32. Es mucho más frecuente el sangrado crónico, que cursa con ferropenia o anemia ferropénica33. El sangrado agudo por GHP suele ser leve, raramente requiere transfusión y su mortalidad es muy baja6,34. En la mayoría de los casos (90-95%), ocurre en pacientes con GHP grave34.
La fluctuación o transitoriedad es una característica de la GHP; así, esta puede mejorar o desaparecer en un 20% de los pacientes o empeorar en un 30% de los casos2,4,6,8. La GHP es asintomática en la mayoría de casos, detectándose al realizar una endoscopia digestiva alta por cualquier otro motivo. La segunda forma de presentación más frecuente es la anemia por sangrado crónico; sin embargo, no hay datos sobre su prevalencia35. La incidencia de pacientes con cirrosis que presentan anemia por sangrado crónico sería del 3-30% al año2,4,8.
DiagnósticoEl diagnóstico de GHP se realiza mediante la endoscopia digestiva alta. La localización más frecuente es el fundus, seguido por el cuerpo y antro gástrico, aunque las lesiones pueden estar presentes en cualquier parte del tracto digestivo12,17,18,36.
En la actualidad, no hay un consenso establecido para la clasificación endoscópica de estas lesiones. Las 2 clasificaciones más utilizadas son la descrita por McCormack et al.1 en 1985, que clasifica la gastropatía en leve y grave, y la descrita por Tanoue et al.23 en 1992, que clasifica la GHP leve, moderada y grave. La descripción de las lesiones de acuerdo a estos autores es la siguiente:
- 1.
McCormack et al.1:
- 2.
Tanoue et al.23:
- –
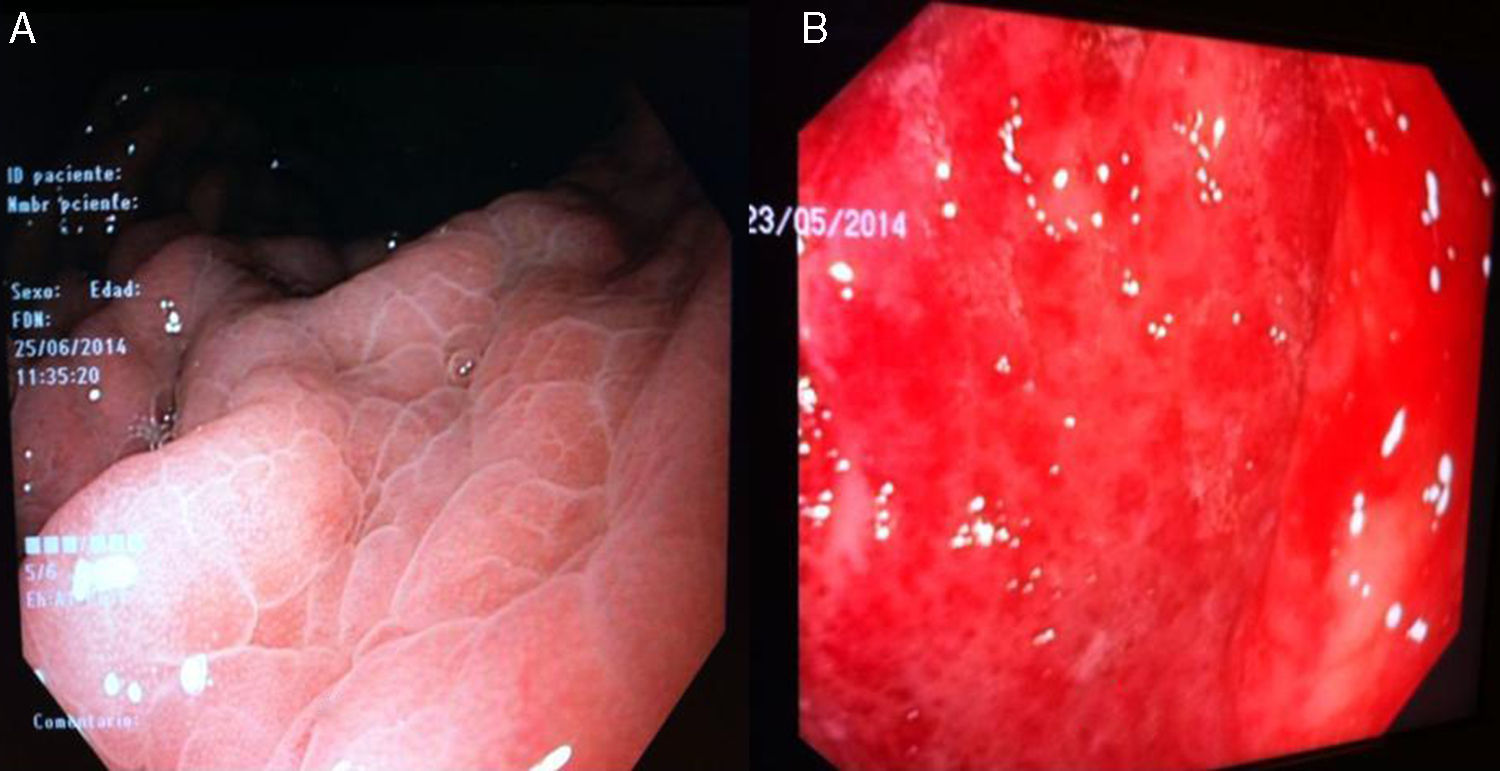
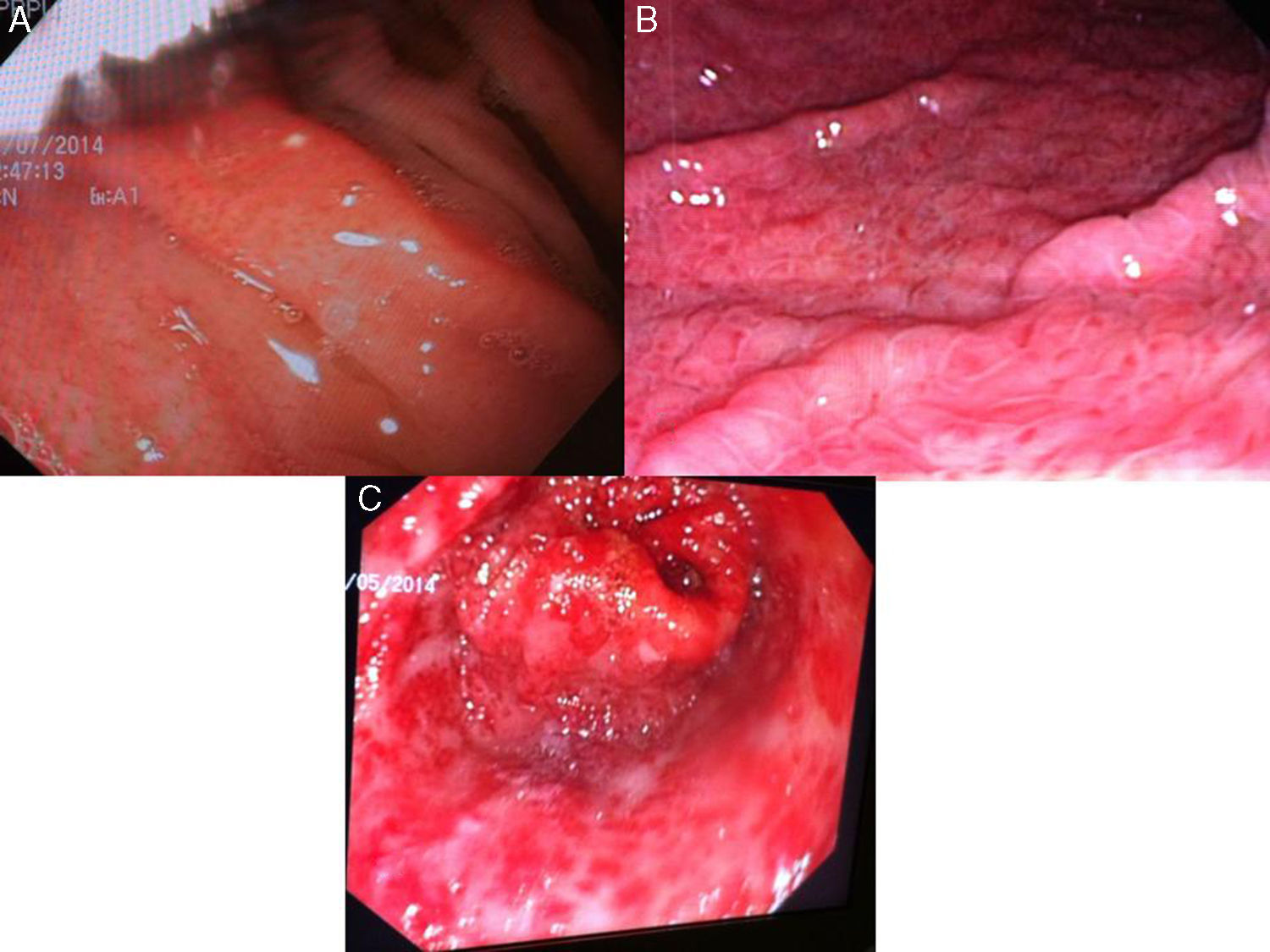
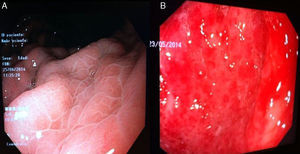
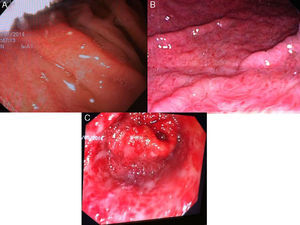
GHP leve: enrojecimiento discreto o mucosa congestiva (sin patrón en mosaico) (fig. 3A).
- –
GHP moderada: enrojecimiento severo, patrón reticular separando las áreas de mucosa edematosa y presencia de patrón en mosaico (fig. 3B).
- –
GHP grave: lesiones hemorrágicas o manchas rojas abundantes o confluentes (fig. 3C).
- –
La clasificación de McCormack tiene la ventaja de ser más simple, siendo la recomendada en la conferencia de Baveno III37,38.
La gradación es importante debido a que los pacientes con GHP grave tienen más riesgo de presentar hemorragia digestiva8.
La cápsula endoscópica también puede ser útil en el diagnóstico de la GHP, con una sensibilidad del 69-74% y una especificidad del 83-99%, según los estudios39,40.
Anatomía patológicaLa histología permite diferenciar la GHP de otras lesiones vasculares gástricas, producidas por fármacos, H. pylori o por EVA, que en ocasiones son indistinguibles por endoscopia.
La GHP se caracteriza por la dilatación y la ectasia de los capilares y las vénulas a nivel de la mucosa y submucosa gástricas, junto con edema y adelgazamiento de la pared de las arteriolas y vénulas de la submucosa, sin evidencia de inflamación (aguda o crónica), erosión subyacente o trombos de fibrina1,7,27.
Son características las vénulas de la submucosa tortuosas y de diámetro irregular1, generalmente aumentado. En casos de GHP grave, puede aparecer también atrofia glandular, hiperplasia marcada de la muscular de la mucosa y edema4.
Es posible que en ocasiones no se observen estos fenómenos bien porque las biopsias no sean suficientemente profundas —algunos autores consideran que estas alteraciones se observan en la capa más profunda de la mucosa13,26—, o bien porque los cambios histológicos sean focales26,41. Por ello se ha recomendado la realización de macrobiopsia para el diagnóstico. Hay varios estudios que han demostrado que la macrobiopsia es segura; su sensibilidad es de alrededor del 75%, sin falsos positivos26,42.
Tratamiento de la gastropatía de la hipertensión portalGastropatía de la hipertensión portal asintomáticaLa GHP asintomática es la que se detecta de manera casual, sin que el paciente presente hemorragia, anemia o ferropenia. El riesgo de hemorragia en pacientes con GHP asintomática —generalmente leve— es muy bajo, por lo que no se recomienda en la actualidad tratamiento profiláctico ni un seguimiento especial34.
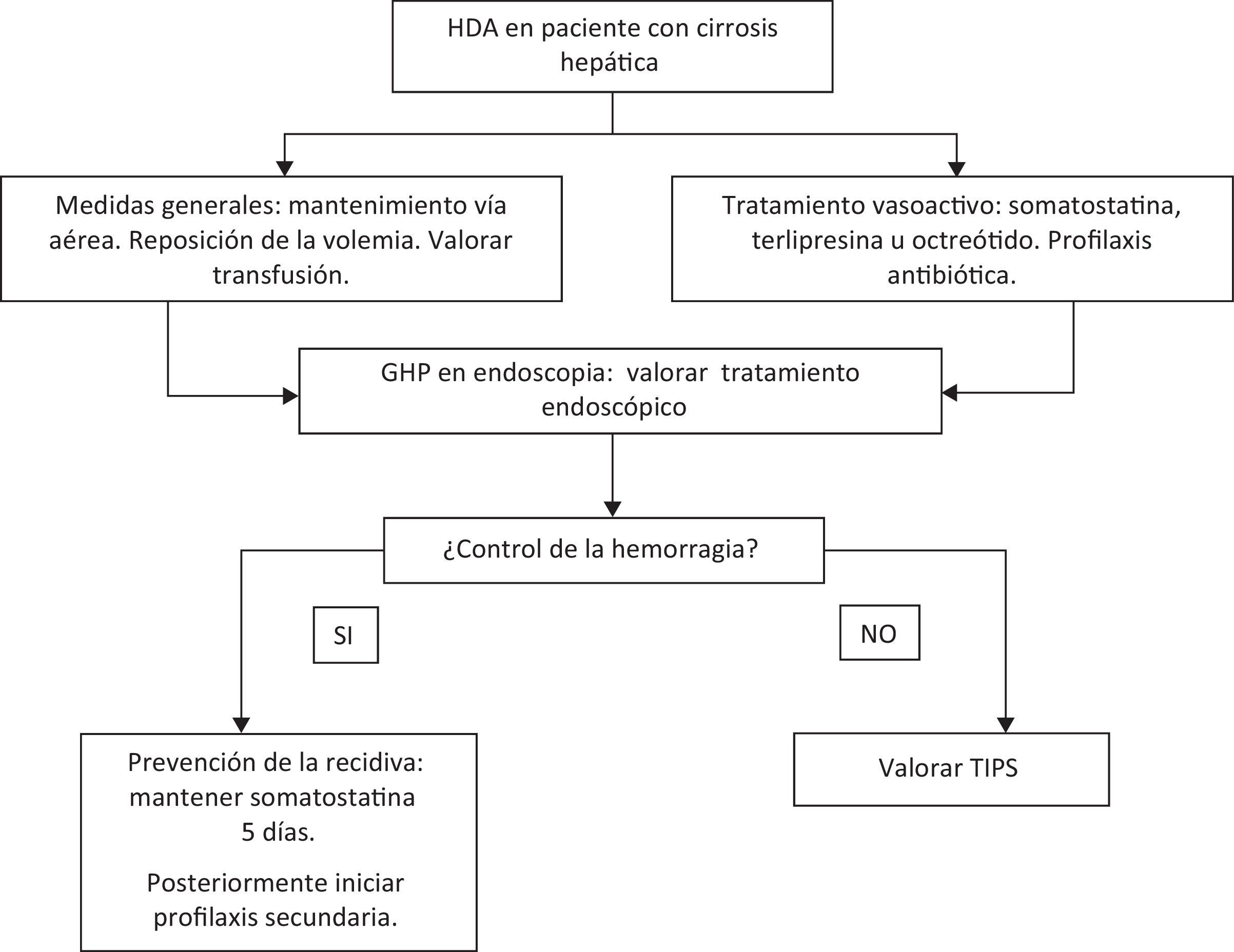
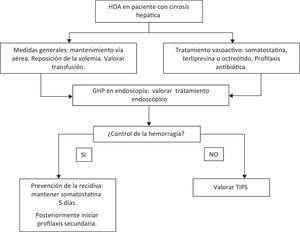
Hemorragia digestiva alta por gastropatía de la hipertensión portal (fig. 4)El manejo debe ser inicialmente el mismo que para cualquier tipo de hemorragia, es decir, hay que asegurar la vía aérea, administrar una correcta perfusión de líquidos y reponer las pérdidas sanguíneas, a la vez que se inicia el tratamiento médico específico. También es importante transfundir si el paciente lo requiere e iniciar profilaxis antibiótica para la prevención de la peritonitis bacteriana espontánea43.
Se recomienda que la reposición de sangre sea restrictiva, así Villanueva et al.44 demostraron que una estrategia transfusional restrictiva (transfusión si hemoglobina < 7g/dL) aumenta la supervivencia (95% vs. 91%, p=0,02) y disminuye la recidiva (10% vs. 16%, p=0,01) y la tasa efectos secundarios (40% vs. 48%, p=0,02) con respecto a una política de transfusión liberal (transfusión si hemoglobina < 9g/dL). Esta política general no implica que sea recomendable individualizar la política transfusional para cada paciente.
Durante el episodio de hemorragia se pueden administrar los siguientes fármacos vasoconstrictores:
- –
Somatostatina: en un estudio aleatorizado, doble ciego, en 20 pacientes con GHP sin hemorragia activa, se observó que la administración de somatostatina induce una disminución significativa del gradiente de presión portal y del flujo sanguíneo gástrico45. En otro estudio abierto en el que se incluyeron 26 casos de HDA por GHP, se administró tratamiento con somatostatina (o su análogo octreótido) y se observó control del sangrado a las 48h en el 100% de los casos, sin observar efectos adversos importantes. Durante un seguimiento de 3 meses solo hubo recidiva hemorrágica en 3 pacientes (11,5%), producidas todas ellas tras retirar la somatostatina46. Sobre la base de estos datos, la somatostatina se considera el fármaco de elección en pacientes con HDA por GHP, a pesar de que no se han publicado estudios aleatorizados en este contexto. El mecanismo de acción de la somatostatina no está del todo claro. Se cree que actúa disminuyendo la presión portal y, secundariamente, el flujo gástrico; probablemente, su efecto se potencia al disminuir los niveles séricos del glucagón, un péptido cuya elevación se asocia a un aumento de la presión portal47,48. (Calidad de la evidencia: moderada. Nivel de recomendación: fuerte).
- –
Octreótido: es un análogo de la somatostatina aparentemente eficaz en el tratamiento de la HDA por GHP. En un estudio aleatorizado en 68 pacientes con HDA por GHP se comparó octreótido con vasopresina y omeprazol, y se observó control de la hemorragia en el 100% de pacientes con octreótido, respecto un 64% de los pacientes con vasopresina y un 59% del grupo omeprazol (p=ns)49. (Calidad de la evidencia: moderada. Nivel de recomendación: fuerte).
- –
Terlipresina: es un análogo de la vasopresina que también puede ser eficaz en el tratamiento del sangrado agudo causado por GHP, dado que reduce el flujo esplácnico y la presión portal. En un estudio comparativo multicéntrico, aleatorizado y a doble ciego con 86 pacientes con HDA por varices o GHP en los que se administraron dosis distintas de terlipresina, se observó que la dosis de 2mg cada 4h durante 5 días detuvo la hemorragia en el 80%, respecto a un 75% en los pacientes con dosis más bajas (p=ns), con una escasa aparición de efectos secundarios. Por lo tanto, la terlipresina a las dosis descritas podría ser útil y parece segura en el tratamiento de estos pacientes50. (Calidad de la evidencia: alta. Nivel de recomendación: fuerte).
En general, por analogía con la HDA por varices esofágicas, se recomienda mantener el tratamiento con vasoconstrictores durante 5 días tras el control de la hemorragia50,51.
Si se objetiva hemorragia activa en la endoscopia, se puede realizar escleroterapia o cauterización con gas argón o Gold-Probe7,34. En un estudio realizado por Herrera et al.52 se realizaron múltiples sesiones de tratamiento con argón-plasma en 11 pacientes con HDA por GHP, con el objetivo de conseguir la ablación de la mayor parte de la mucosa afectada. Se consiguió el objetivo primario del estudio —que incluía tanto la ausencia de recidiva como la reducción de los requerimientos transfusionales— en un 81% de los pacientes, pero el estudio no aportó datos sobre la evolución de estos pacientes a largo plazo. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
Recientemente, se ha publicado una serie con 4 casos en los que se ha utilizado Hemospray® (un nuevo agente hemostático tópico, de gran rapidez de acción, para uso endoscópico) como tratamiento para la HDA por GHP. En todos los pacientes se utilizó juntamente con el tratamiento médico y se controló el sangrado endoscópico en los 4 casos, sin complicaciones significativas53. Por lo tanto, Hemospray® podría ser un tratamiento eficaz. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
En resumen, se dispone de muy pocos datos —procedentes además de estudios no controlados— sobre la eficacia del tratamiento endoscópico tanto en hemorragia aguda como en profilaxis secundaria. Por esto, la indicación de este debe individualizarse valorando riesgos y posibles beneficios.
Una vez el paciente se estabiliza, se recomienda iniciar profilaxis secundaria con betabloqueantes no cardioselectivos (propranolol, nadolol)54–57. El primer estudio aleatorizado en el que se evaluó el uso de betabloqueantes fue realizado por Hosking57, en 1989, en un total de 22 pacientes con GHP. Estos pacientes fueron aleatorizados a recibir propranolol 160mg/d o placebo, durante 6 semanas, y posteriormente se cruzaron los brazos de tratamiento 6 semanas más. En el periodo en que recibieron propranolol, los pacientes tuvieron menor incidencia de hemorragia, un aumento de los niveles de hemoglobina y mejoría del aspecto de las lesiones endoscópicas comparados con los pacientes que tomaban placebo (40,9% vs. 13,63%). Las diferencias no fueron estadísticamente significativas, probablemente debido al escaso número de pacientes en este estudio. La eficacia del propranolol se demostró posteriormente en un estudio multicéntrico, controlado y aleatorizado. Pérez-Ayuso et al.58 investigaron el efecto del uso prolongado de propranolol en el tratamiento profiláctico de la recidiva de la hemorragia aguda o crónica por GHP. Cincuenta y cuatro pacientes cirróticos con hemorragia (aguda o crónica) por GHP fueron aleatorizados a propranolol (26 pacientes) o placebo (28 pacientes). La tasa de recidiva hemorrágica a los 12 meses de seguimiento fue del 35% en pacientes tratados vs. el 62% en los que recibieron placebo. A los 30 meses, el 48% de los tratados con propranolol vs. el 93% de los que recibieron placebo había presentado una recidiva hemorrágica (p<0,05). Además, el número total de episodios hemorrágicos y las necesidades transfusionales fueron significativamente menores en el grupo tratado en comparación al grupo control. Se observó también una tendencia hacia una mayor supervivencia de los pacientes tratados con propranolol, pero sin significación estadística. El estudio mostró también que tras 2 años de seguimiento, hasta un 50% de los pacientes que están bajo tratamiento con betabloqueantes presentan una recidiva. Esto ha hecho imprescindible buscar tratamientos alternativos27. (Calidad de la evidencia: moderada. Nivel de recomendación: fuerte).
Se han ensayado otros tratamientos, como la combinación de betabloqueantes y 5-mononitrato de isosorbida, talidomida (un inhibidor del TNF-α), prednisona, progesterona o estrógenos, sin éxito7,34,41. El sucralfato o los inhibidores de la bomba de protones tampoco se han demostrado efectivos49,59. El losartán es un fármaco que, en modelos experimentales con ratas, disminuye la presión portal a través de la inhibición del receptor de la angiotensina-ii60, y en estudios con humanos parece tener resultados prometedores61. Las estatinas, cuya utilidad para disminuir la presión portal ha sido demostrada recientemente, no han sido evaluadas en pacientes con GHP62. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
Cuando falla el tratamiento con betabloqueantes, la derivación trans-yugular porto-sistémica (TIPS) es una posible opción terapéutica. En el estudio de Kamath et al.63 se evaluó la evolución de 40 pacientes con GHP a los que se colocó una TIPS por hemorragia. Durante un seguimiento de 6 meses, se observó que aproximadamente el 75% de pacientes con GHP grave presentaban mejoría de las lesiones endoscópicas y disminución de los requerimientos transfusionales: en el 89% de pacientes con GHP leve se observó la desaparición de las lesiones. En otros estudios con menor número de pacientes también se observó mejoría de las lesiones de GHP en la mayoría de los pacientes a los que se colocaba una TIPS64,65. En el estudio realizado por Mezawa et al. se colocó TIPS a 16 pacientes cirróticos por ascitis refractaria o HDA por varices incontrolable: se observó cómo la TIPS reducía de forma significativa la presión venosa portal y mejoraba las lesiones de GHP que presentaban 9 de los 16 pacientes65. De todos modos, la TIPS no está exenta de problemas y hay que valorar individualmente el riesgo-beneficio antes de indicarla. (Calidad de la evidencia: baja. Nivel de recomendación: débil).
También se ha demostrado que la cirugía derivativa puede ser una opción terapéutica de la GHP puesto que las lesiones de GHP revierten en todos los pacientes66. Sin embargo, la cirugía ha caído prácticamente en desuso debido a la alta morbimortalidad de la técnica y a la introducción de la TIPS. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
En pacientes con mala función hepática, o no candidatos a colocación de TIPS, puede valorarse la realización de un trasplante hepático como solución definitiva33,67. (Calidad de la evidencia: alta. Nivel de recomendación: fuerte).
Anemia ferropénica crónica por gastropatía de la hipertensión portalEl tratamiento médico incluye la reposición de hierro, sea por vía voral o intravenosa. En caso de anemia grave, debe valorarse transfusión sanguínea. Se iniciará tratamiento betabloqueante con propranolol o nadolol, a dosis terapéuticas, como profilaxis secundaria54,55.
Al igual que en la hemorragia aguda por GHP, la coagulación endoscópica con argón-plasma también se ha mostrado efectiva en algunos estudios no controlados para disminuir la recidiva hemorrágica y los requerimientos transfusionales en los casos en que el tratamiento con betabloqueantes no funcione34. También pueden combinarse ambos tratamientos. Como en el caso de la hemorragia, en los casos en que el paciente requiera transfusiones frecuentes, a pesar del tratamiento con betabloqueantes y hierro, puede valorarse la colocación de una TIPS, la realización de cirugía derivativa o incluso el trasplante hepático.
La inhibición de factores angiogénicos puede constituir una diana terapéutica prometedora para prevenir la progresión y promover la regresión de la GHP. Entre otras moléculas, se ha probado en modelos animales el sorafenib, un inhibidor del VEGF y del factor de crecimiento derivado de plaquetas (PDGF), observando que reduce la neovascularización esplácnica y disminuye un 25% la presión portal y el flujo sanguíneo esplácnico. También reduce el grado de shunt portosistémico, la fibrosis y la inflamación hepática68. Otro estudio realizado en ratas con HTP y sorafenib demostró la disminución de VEGF, PDGF, TNF-α y NOS tras la administración del mismo69.
En un estudio reciente realizado con pacientes cirróticos que tomaban sorafenib como tratamiento del carcinoma hepatocelular disminuyó el gradiente de presión portal > 20% respecto el valor basal, a la vez que se observaba una disminución de VEGF, PlGF y PDGF70. Sin embargo, este fármaco presenta importantes efectos secundarios —entre ellos, HDA por VE causada por la regresión de los vasa-vasorum de las VE— que podrían contraindicar su uso en la GHP70.
Ectasia vascular antralPrevalencia e historia naturalLa EVA es una entidad poco frecuente en la población general. Generalmente, cursa en forma de anemia crónica y es una causa infrecuente (4%) de HDA71. Sin embargo, en pacientes cirróticos se han publicado prevalencias de hasta el 30%13,72.
Los pacientes con EVA y CH presentan unas características epidemiológicas distintas de aquellos con EVA sin CH. En la población sin cirrosis, la EVA aparece en mujeres de mediana edad o edad avanzada y en relación con enfermedades autoinmunes, particularmente la esclerodermia73,74, la insuficiencia renal crónica73,74 y el trasplante de médula ósea75, entre otras76. En el caso de pacientes cirróticos, es más frecuente en hombres y con una media de edad alrededor de los 65 años77.
FisiopatologíaSe desconoce la fisiopatología de estas lesiones. Aparentemente, no existe relación con la presencia o grado de HTP; se ha comprobado, además, que estos pacientes no responden a las terapias que disminuyen la presión portal78. Tampoco se ha observado relación entre la presencia de varices y la aparición de EVA79. Se postula que la EVA podría estar relacionada con factores mecánicos a nivel de la motilidad antral. Otros autores creen que sustancias vasoactivas, como el péptido intestinal vasoactivo, la 5-hidroxitriptamina, el glucagón, las catecolaminas, etc., podrían desempeñar un papel en la etiología de la EVA. No existe ningún modelo experimental de EVA en CH.
ClínicaLa forma clínica más habitual es la anemia ferropénica. Raramente ocasiona melenas o hematemesis80. Sin embargo, los pacientes cirróticos tienen más tendencia a presentar hemorragia aguda81. La anemia suele ser más marcada en los pacientes sin CH. Esto podría ser debido a que los pacientes con CH a menudo requieren endoscopia y esto hace que la EVA se diagnostique en estadios más tempranos82. Por otra parte, los pacientes con CH y EVA suelen presentar niveles más bajos de hemoglobina que aquellos con CH y GHP72.
DiagnósticoLa endoscopia digestiva alta muestra manchas rojas características, de 1 a 5mm de diámetro, en ocasiones con signos de hemorragia aguda o reciente, sin patrón en mosaico de base, de predominio antral y con una distribución difusa o lineal. Los pacientes con CH tienden a presentar una distribución difusa, mientras que en los pacientes sin CH es habitual la distribución lineal en el antro convergiendo hacia el píloro, una imagen característica que se ha denominado «estómago en sandía»73,83. La EVA se distingue de la GHP porque generalmente tiene mayor afectación antral. Sin embargo, pueden observarse lesiones compatibles con ectasia vascular en otras áreas del estómago, duodeno y yeyuno73,82,84. Según el Consenso de Baveno III, el diagnóstico de EVA requiere la observación de agregados de manchas rojas formando un patrón lineal o difuso en el antro gástrico y confirmación por biopsia38.
A menudo, es necesaria la biopsia para distinguir la EVA de la GHP42. La EVA presenta una histología característica, con dilatación o ectasia vascular, trombos de fibrina, hiperplasia fibromuscular de la lámina propia, proliferación de células fusiformes y fibrohialinosis —depósito de una sustancia homogénea alrededor de los capilares ectásicos de la lámina propia—, sin signos inflamatorios subyacentes72,85. La presencia de proliferación de células fusiformes y fibrohialinosis en la biopsia tiene una precisión del 85% para diagnosticar EVA frente a GHP72. Sin embargo, hay una alta tasa de falsos negativos si las lesiones de EVA son focales. Por ello, una biopsia negativa no excluye la presencia de EVA86.
TratamientoEs fundamental diferenciar la EVA de la GHP, ya que el tratamiento es distinto.
En primer lugar, y como medida general, es importante corregir la anemia mediante suplementos de hierro; un 60-70% de los pacientes requerirán además transfusión73,74.
La EVA no responde a las terapias que disminuyen la presión portal, como los betabloqueantes78, la TIPS63,78 o la cirugía derivativa78,84. (Calidad de la evidencia: alta. Nivel de recomendación: débil).
El tratamiento más efectivo es el endoscópico. Se recomienda la ablación endoscópica con Heater Probe, láser YAG o coagulación con argón-plasma. Aunque no existen estudios aleatorizados que comparen estos tratamientos, la coagulación con argón es más sencilla, más barata y tiene un menor riesgo de perforación gástrica52,80,87,88. El tratamiento endoscópico disminuye la recidiva hemorrágica y puede eliminar las lesiones. En general, la media de sesiones con estos tratamientos es de 3 o 4 por paciente. No parece haber diferencias en cuanto a respuesta al tratamiento entre pacientes cirróticos y no cirróticos82. (Calidad de la evidencia: baja. Nivel de recomendación: fuerte).
En los casos donde la EVA se presenta de forma difusa, no queda claro cuál es el tratamiento endoscópico más adecuado. Hay estudios con series de pacientes donde se ha probado la crioterapia con óxido nítrico89,90 (calidad de la evidencia: muy baja; nivel de recomendación: débil) y otro donde se ha tratado con ligadura con bandas91, con resultados prometedores.
A nivel farmacológico, los estrógenos y los progestágenos pueden controlar la hemorragia y reducir los requerimientos transfusionales o de hierro, pero sin conseguir erradicar las lesiones86,92,93. Sin embargo, no se recomienda el tratamiento hormonal a largo plazo porque puede tener efectos secundarios graves94. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
El ácido tranexámico es un agente antifibrinolítico que parece útil en los casos en que hay pocas lesiones de EVA. Disminuye los requerimientos de hierro o transfusionales pero sin mejoría endoscópica de las lesiones95,96. A pesar de ello, el uso del ácido tranexámico quedaría restringido a casos refractarios, dado que aumenta el riesgo de eventos isquémicos y embolias pulmonares86,97. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
Se han publicado series de casos realizadas con 11 pacientes en total en las que en 6 de ellos la terapia con corticoides resolvió el sangrado crónico a los 3 años83,98-101, en 4 pacientes no se obtuvo respuesta74,84,102 y en un caso se suspendió el tratamiento por hiperglucemia93. Estos escasos datos no permiten recomendar en la actualidad la terapia con corticoides. (Calidad de la evidencia: muy baja. Nivel de recomendación: débil).
La antrectomía puede ser curativa, pero la alta mortalidad quirúrgica en pacientes cirróticos aconseja limitar su uso en pacientes seleccionados sin respuesta al tratamiento farmacológico ni endoscópico y sin HTP80,83,86. Antes de someter a un paciente a cirugía es necesario descartar otras causas de sangrado gastrointestinal. (Calidad de la evidencia: baja. Nivel de recomendación: débil).
Se ha sugerido que el trasplante hepático podría mejorar la EVA en pacientes cirróticos: existen 3 casos en la literatura donde se observó la completa desaparición de estas lesiones tras el trasplante. Estos hallazgos apoyarían la hipótesis de que la EVA no estaría directamente relacionada con la HTP pero sí podría estar influida por el grado de funcionalismo hepático103,104.
En la actualidad, se han propuesto nuevas moléculas como inhibidores de la angiogénesis (aminaftona)105 o inmunosupresores (ciclosporina A)106, que podrían regular la vía del EGF o las células progenitoras endoteliales, respectivamente, pero están pendientes de estudio.
ConclusionesLa GHP es una entidad frecuente en la CH, cuya fisiopatología es poco conocida, y todavía no existe un consenso respecto a la clasificación endoscópica. Para poder diferenciarla de otras entidades, es necesario recurrir a una biopsia gástrica. No hay un tratamiento establecido, excepto en los casos de hemorragia digestiva, en los que se puede iniciar tratamiento con vasoconstrictores esplácnicos (como la somatostatina), asociado o no a terapéutica endoscópica, aunque no hay estudios aleatorizados que demuestren la eficacia de esta última. En casos refractarios, puede plantearse la colocación de una TIPS o el trasplante hepático. Por otra parte, la EVA solo se puede diferenciar de la GHP mediante la anatomía patológica, dado que su imagen endoscópica es muy similar. Las lesiones aparecen predominantemente en el antro y su etiopatogenia es aún menos conocida que la de la GHP. Es importante realizar el diagnóstico diferencial entre EVA y GHP, ya que la EVA no responde a las terapias que disminuyen la presión portal y el tratamiento más efectivo es el endoscópico.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
portal AND hypertensive AND gastropathy AND (porta*[ti] OR hypertensi*[ti] OR gastropat*[ti]) «gastric antral vascular ectasia»[ti]