Diversos estudios desde 2003 han demostrado la utilidad de candesartan cilexetil, un inhibidor del receptor de angiotensinógeno II (IRAII), en la insuficiencia cardíaca crónica. Pero ni estos estudios ni los estudios poscomercialización mencionan la toxicidad hepática de este fármaco, aprobado en 1998 y con más de 4 millones de prescripciones anuales en Estados Unidos1. Sin embargo, en el año 2000 se describió el primer caso de hepatotoxicidad por candesartan2. Desde entonces, sólo se han comunicado 2 casos más3,4, por lo que no tenemos un conocimiento detallado de su perfil clínico.
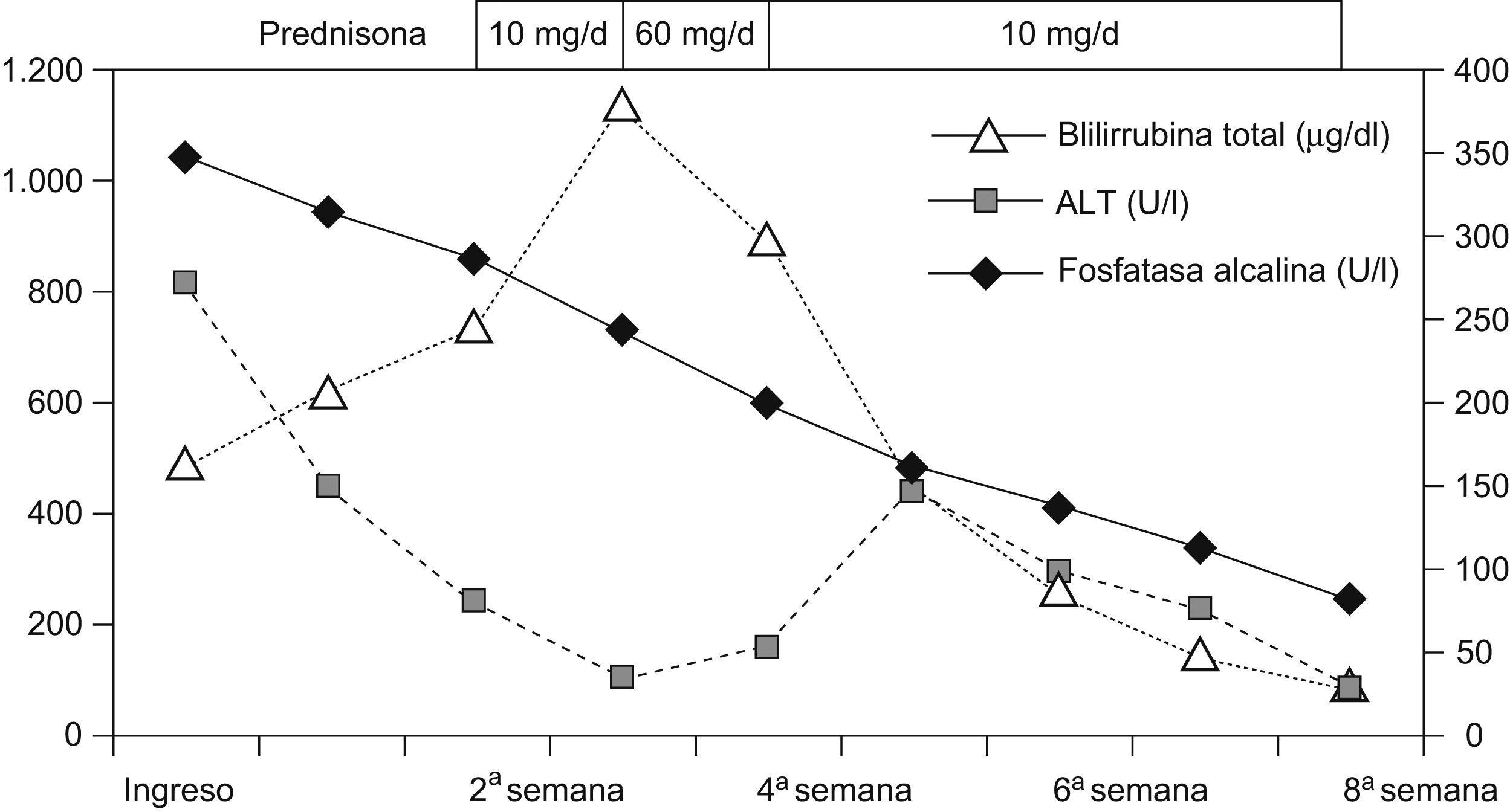
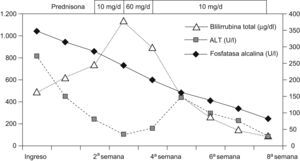
Hemos atendido a un varón de 82 años, con hipertensión arterial esencial, que ingresó por ictericia, prurito y anorexia de 2 días de evolución; desde 3 semanas antes recibía 16mg/día de candesartan cilexetil. La exploración física sólo revelaba ictericia. A su ingreso presentaba los siguientes parámetros: aspartato aminotransferasa (AST): 111U/l (0–37U/l), alanino aminotransferasa (ALT): 272U/l (0–40U/l), deshidrogenasa láctica: 485U/l (230–460U/l), gamma glutamil transferasa: 456U/l (11–49U/l), fosfatasa alcalina: 1.045U/l (90–258U/l), bilirrubina total (BT): 141μg/dl (1–17μg/dl) y bilirrubina directa (BD): 117μg/dl. Los estudios serológicos para hepatitis A, B y C, citomegalovirus, virus de Epstein Barr y los anticuerpos antinucleares, antimitocondriales y antimúsculo liso fueron negativos. El estudio del metabolismo del hierro y el cobre fueron normales, al igual que la ecografía y la TAC abdominal. A su ingreso se suspendió la medicación y se observó un descenso de la AST y la ALT durante las 2 semanas posteriores, mientras que los valores de la BT y la BD continuaron incrementándose (fig. 1). A los 15 días del ingreso se inició tratamiento con prednisona (10mg/día), pero la BT continuó aumentando (379μg/dl) y se incrementó la dosis de prednisona (60mg/día) durante una semana. Ello se acompañó de un descenso de la BT, por lo que se reinició la dosis de 10mg/día. A las 8 semanas del ingreso se suspendió la prednisona, cuando todos los parámetros de función hepática eran normales. Siete meses después el paciente permanece asintomático.
La valoración del caso establece un diagnóstico definitivo (escala de CIOMS: 10 puntos) o probable (índice de María y Victorino: 14 puntos) de hepatitis por candesartan. El mecanismo de producción de esta reacción de hepatotoxicidad no es conocido. Se ha propuesto un mecanismo inmune en algunos pacientes, pero en la mayoría de los casos se piensa que mediaría un fenómeno de idiosincrasia metabólica8. El candesartan cilexetil, convertido en candesartan a nivel intestinal y que es el metabolito activo, es eliminado, como tal, por parte del riñón y de las vías biliares. La baja afinidad y su alta tasa de unión a proteínas plasmáticas hacen que su transformación hepática en un metabolito inactivo a través del CYP2C9 sea poco importante. Sin embargo, en el proceso de excreción bilioentérico, el candesartan presenta un proceso de glucuronidación, catalizado especialmente por la UDP-glucuronosiltransferasa 1A3 (UGT1A3)5. Una variación genética de esta enzima se traduciría en una acumulación intrahepática del propio candesartan o de acil-glucurónidos de candesartan, potencialmente tóxicos, generados durante el proceso de O-glucuronidación del fármaco. Es poco probable que este último mecanismo sea operativo, dado que los 3 UGT1A3 que ejercen la máxima O-glucuronidación son fundamentalmente extrahepáticos.
El potencial hepatotóxico de los IRAII es muy variable, pues mientras se retiró el tasosartan por su hepatotoxicidad antes de su registro, del telmisartan y el olmesartan (aprobados en 1998 y 2002) no hay ningún caso publicado de hepatitis tóxica. Del resto de los IRAII, desde su aprobación por la FDA entre 1995 y 1998, se han descrito 5 casos por losartán, 2 por valsartan, 4 por ibersartan y 4 por candesartan1–4,6–10, incluyendo el caso aquí aportado. Llama la atención que 8 de las 15 pacientes son españolas y, en concreto, 3 de los 4 casos de hepatitis por candesartan son de la misma ciudad española. ¿Indica esto una mayor predisposición en nuestro ámbito a desarrollar este tipo de hepatotoxicidad o una mayor predisposición a publicar estos casos? En favor de esto último iría el que, aunque hasta 2009 hay 15 casos publicados, todos de buena evolución según los datos aportados por Reñé et al9, basados en un documento actualmente inaccesible, ya en 2001 había 13 casos de hepatitis por IRAII comunicados a la FDA, 2 de ellos mortales. Esto enfatiza la necesidad de publicar en la literatura médica, medio habitual de información, y no sólo en los boletines de las agencias sanitarias los casos de hepatotoxicidad infrecuentes para beneficiarnos todos de la experiencia acumulada. A este respecto, de los casos publicados con una descripción completa, en 7 de los 13 pacientes el tipo de daño hepático fue hepatocelular, en 4 colestático y en 2 mixto. De los 10 casos en que la evolución es conocida, el cuadro clínico y analítico se resolvió al retirar el fármaco en 3 semanas-4 meses en 6 pacientes. En los 4 casos restantes se observó una evolución prolongada. Como ocurrió en nuestro paciente, tras una primera fase de moderada hiperaminotransferasemia, se observó una progresiva elevación de la bilirrubina. Este patrón con colestasis prolongada se ha descrito en otros 3 pacientes con hepatitis por IRAII4,8,10; 2 de estos casos se resolvieron sin ninguna medida adicional. En el tercer caso, debido a candesartan4, la biopsia hepática demostró ductopenia y el tratamiento con corticoides, al igual que en nuestro paciente, se siguió de la resolución del cuadro en 8 semanas. Evidentemente, el uso de esteroides en estos casos es una estrategia empírica, aunque la presencia de cambios ductales en la biopsia o el ascenso progresivo de la bilirrubina lo pueden justificar. Pero ha de tenerse en cuenta la buena respuesta observada en estos casos, que probablemente aconseje el empleo de dosis moderadas de corticoides durante un período limitado. En el cuarto caso, una hepatitis grave por irbersartan con un patrón mixto, la evolución prolongada cursó con cambios compatibles con hepatitis autoinmunitaria en la biopsia; en ese caso, la indicación de los corticoides, que fueron necesarios durante 2 años, parece indiscutible6.