INTRODUCCION
Uno de los aspectos más fascinantes de la biología celular del hígado, que lo diferencia de otros órganos, es su capacidad de autorregenerarse cuando parte del tejido inicial desaparece, bien por hepatectomía parcial, o por necrosis de los hepatocitos, de forma que en individuos adultos sanos mantiene un perfecto balance entre ganancia y pérdida celular. El hígado, que es un órgano con un grado de proliferación relativamente bajo, inicia poco después de la resección un proceso de regeneración que culmina cuando se alcanza la masa y volumen iniciales1-3. La regeneración hepática es una respuesta fundamental del hígado ante el daño tisular. Son varios los factores que envuelven esta respuesta, un estímulo (hepatectomía), expresión de genes, síntesis de diversos factores de crecimiento y la interacción de otros factores que modulan la respuesta.
En el proceso regenerativo del hígado contribuyen todas las células maduras remanentes en el hígado. Además de hepatocitos y células no parenquimales, el hígado contiene células troncales intrahepáticas que pueden generar células precursoras denominadas ovales4. Todas las células proliferan para restablecer el tejido perdido, pero la velocidad de su respuesta es diferente. Sin embargo, la regeneración del hígado tras una hepatectomía parcial no implica a las células troncales intrahepáticas o extrahepáticas (hematopoyéticas), sino que depende de la proliferación de los hepatocitos. Los hepatocitos son los primeros en proliferar, primero alrededor del espacio periportal y luego extendiéndose hacia las venas centrales5. Los otros tipos de células hepáticas proliferan a continuación de los hepatocitos, hecho que sugiere que son éstos los que producen el estímulo para dicha proliferación. Los experimentos de trasplante celular y repoblación del hígado han demostrado que los hepatocitos son células de larga supervivencia que poseen una notable capacidad para replicarse. Así, en el hígado, tras una resección parcial del tejido, los hepatocitos, células diferenciadas y quiescentes, se replican rápida y activamente, mientras que las células precursoras intrahepáticas (células ovales) solamente lo hacen y generan el linaje en situaciones en las que la proliferación de los hepatocitos está bloqueada o retrasa da4. En resumen, el hígado posee varios tipos de células que responden a la pérdida de hepatocitos a niveles diferentes:
1. Hepatocitos maduros, que proliferan para la renovación celular normal, y tras daño hepático no grave, etc. Son numerosos, unipotentes, están precondicionados y responden rápidamente al daño hepático.
2. Células ovales, que se activan para proliferar cuando el daño hepático es extenso y crónico, o si la proliferación de los hepatocitos está inhibida. Se ubican en el canal de Hering, son menos numerosas, bipotentes y su respuesta proliferativa es más prolongada, aunque limitada.
3. Células troncales hepáticas exógenas, que pueden derivar de las células troncales hematopoyéticas de la circulación (HSC) o de células troncales de la médula ósea (MSC). Responden al daño alcohólico o a la hepatocarcinogénesis, son multipotentes, escasas, pero tienen un potencial proliferativo muy grande. Además, contribuyen de forma muy significativa a la regeneración, e incluso en la restauración de la función normal del hígado6.
La respuesta a cómo se integran estas tres poblaciones de células troncales para alcanzar un balance homeostático de la regeneración hepática continúa siendo un enigma. Si fuera posible aislar cada uno de estos tipos de células se incrementaría el conocimiento de su capacidad para diferenciarse (o para dar lugar a células que se diferencien) a hepatocito y, por tanto, de su potencial uso con fines terapéuticos en el hígado7.
El fracaso o fallo hepático agudo o fulminante se produce como consecuencia de la pérdida masiva de hepatocitos por un daño hepático grave, circunstancia que el hígado es incapaz de superar a pesar de su potencial regenerativo. La necrosis masiva de las células hepáticas se manifiesta por una claudicación brusca de todas las funciones metabólicas de síntesis hepática, independientemente de la causa que la haya producido. Las alteraciones metabólicas graves, producidas por acumulación de amonio y otros bioproductos metabolizados normalmente por el hígado, se asocian con un fallo orgánico múltiple, encefalopatía, coma hepático y muerte cerebral. El único tratamiento efectivo existente en la actualidad para el fallo hepático terminal es el trasplante alogénico de hígado. Desafortunadamente, su uso está muy condicionado a la limitada disponibilidad de órganos de donantes y, por ello, mueren pacientes en lista de espera para trasplante hepático.
Es necesario, por tanto, la búsqueda de alternativas al trasplante hepático de órgano para: a) pacientes con metabolopatías congénitas, como alternativas terapéutica antes de llegar al estadio terminal y evitar así la necesidad de un trasplante hepático; b) pacientes con fallo hepático agudo-fulminante, con la finalidad de mantener su función hepática durante el período de espera hasta recibir el trasplante, y c) pacientes con enfermedad hepática terminal susceptible de trasplante hepático y contraindicación quirúrgica para el mismo.
Se han propuesto varios métodos como alternativa al trasplante hepático alogénico o como puente para mantener a los pacientes hasta que haya disponibilidad de órgano: perfusión extracorpórea de hígado animal o humano, uso de biorreactores o hígados artificiales compuestos de células hepáticas de origen no humano o derivadas de carcinoma hepatocelular, terapia génica ex vivo o in vivo, ingeniería de tejidos y trasplante celular. Entre ellos, el que se considera más prometedor actualmente es el trasplante celular8,9. Entre los métodos de salud de mayor auge en la última década, la terapia celular ocupa un lugar destacado. La denominación «terapia celular» significa, en la versión más neutral, el empleo de células con fines terapéuticos. Así, la terapia celular tiene por finalidad sustituir o reparar la función de células o tejidos lesionados, y se basa en trasplantar células individuales a un órgano receptor en cantidades suficientes para que sobrevivan y restauren la función normal.
VENTAJAS Y LIMITACIONES DEL TRASPLANTE DE HEPATOCITOS HUMANOS
Hace más de 15 años, Bumgardner et al10, en un editorial, ya sugerían la relevancia del trasplante de hepatocitos como herramienta terapéutica alternativa para curar ciertas enfermedades metabólicas o para mejorar las funciones vitales y calidad de vida de los pacientes en lista de espera para trasplante de órgano. Se han propuesto varias vías de administración de los hepatocitos a los pacientes: por infusión directa al hígado a través de la vena porta o ectópicamente en el bazo. Para el trasplante se utiliza un número de hepatocitos limitado, con la idea de que éstos repueblen el tejido hepático gracias a la gran capacidad regenerativa que posee3. Por ello, supone un método mucho menos invasivo que el trasplante de órgano sólido y, por tanto, con mucha menor morbilidad y menor coste. A su vez, las células de un donante podrían servir para trasplantar hepatocitos en varios receptores (trasplante múltiple). Si a ello añadimos la posibilidad de crioconservar los hepatocitos durante períodos prolongados de tiempo, sería posible rentabilizar al máximo las donaciones y optimizar los implantes mediante preparación del/los receptor(es) y la programación del trasplante en el momento adecuado.
Se han realizado estudios en animales que demuestran la integración, la supervivencia y la expresión de las funciones diferenciadas de los hepatocitos en el hígado receptor11. Aunque los ensayos realizados en humanos son muy escasos, se ha descrito que la repoblación del hígado receptor con un 3-10% de hepatocitos funcionales puede ser suficiente para conseguir una mejoría clínica apreciable de la salud del paciente12. Numerosos estudios experimentales en modelos animales13-15 y ensayos puntuales recientes realizados en humanos hacen del trasplante celular una estrategia muy prometedora como método terapéutico, muy particularmente para corregir deficiencias metabólicas del hígado8,16. Las enfermedades en que el trasplante de hepatocitos ha presentado mayor éxito clínico han sido las metabolopatías congénitas8,17-22.
Otro aspecto que cabe destacar es la posibilidad de realizar tratamiento autólogo de hepatocitos modificados genéticamente ex vivo antes de ser implantados. Hay que resaltar que, en principio, se trata de un método menos inmunogénico (e incluso absolutamente compatible en el caso del trasplante autólogo). La terapia génica ex vivo tiene como objetivo corregir las deficiencias génicas de los hepatocitos del receptor, mediante trasplante autólogo, que además no precisa una inmunosupresión posterior. Ésta es también una estrategia muy prometedora, ya que se estima que la introducción de un 1-10% de hepatocitos del enfermo modificados genéticamente o hepatocitos sanos de otro individuo, sería suficiente para restaurar la función hepática12. Se han realizado varias experiencias en animales y se ha conseguido la curación de ciertas metabolopatías letales, tras la reversión de defectos genéticos metabólicos15, y aumentar la supervivencia de los hepatocitos haciéndolos resistentes a la apoptosis, principal mecanismo de pérdida celular de los implantes23.
Si bien las técnicas de cultivo y crioconservación de hepatocitos humanos están bien establecidas, el trasplante de hepatocitos humanos, a pesar de haberse mostrado posible y de gran potencial terapéutico, como se ha indicado anteriormente, sólo se ha aplicado en casos individuales o series pequeñas. Es cierto que las técnicas de aislamiento de hepatocitos humanos mediante disgregación enzimática del tejido hepático están muy desarrolladas, pero todavía es necesario adecuar las técnicas actuales para incrementar el rendimiento (número de hepatocitos/g de tejido hepático) y sobre todo la calidad (viabilidad y funcionalidad) de los hepatocitos obtenidos a partir de órganos descartados para trasplante o de fragmentos de hígado procedentes de hepatectomía24,25. Así, los líquidos de preservación utilizados durante la obtención de órganos para implante resultan en un menor éxito del aislamiento de hepatocitos humanos25. Además, la esteatosis, principal motivo de exclusión de los injertos para implante, es causa de un descenso drástico del rendimiento y la viabilidad de los hepatocitos tras la digestión enzimática del hígado. Es necesario optimizar los métodos, de modo que permitan recuperar hepatocitos humanos viables a partir de hígados grasos26. Por otra parte, se desconocen los factores del donante que proporcionan una mayor rentabilidad del procedimiento de aislamiento de hepatocitos. Su identificación permitiría acciones específicas encaminadas a mejorar el aislamiento27. Otra limitación es el desfase de tiempo entre el momento de la obtención de hepatocitos (la donación) y la utilización de los mismos (injerto en un receptor adecuado), que hace que se pierda gran cantidad de recursos. A pesar del gran avance alcanzado en la crioconservación de hepatocitos humanos, todavía existe la necesidad de optimizar los protocolos para disponer de bancos de hepatocitos donde puedan mantenerse crioconservados durante períodos prolongados de tiempo, pero que mantengan tras la descongelación una elevada viabilidad y una calidad funcional adecuada. Ello permitiría un mejor aprovechamiento de los escasos recursos existentes27-29. Por tanto, dado que la disponibilidad de hepatocitos humanos utilizables para terapia celular, a pesar de los avances conseguidos, sigue siendo muy limitada, es necesaria la búsqueda de fuentes alternativas de células para terapia celular hepática.
FUENTES ALTERNATIVAS A LOS HEPATOCITOS PARA EL TRASPLANTE CELULAR
Si el factor limitante es la obtención de hepatocitos humanos, y no parece posible aumentar el número de órganos disponibles para extraerlos, ¿qué alternativas existen? Lo ideal sería disponer de hepatocitos capaces de proliferar en cultivo, pero que conserven al mismo tiempo la expresión de funciones diferenciadas del hepatocito adulto de forma estable y prolongada. Solamente así podrían constituir una fuente inagotable de células para terapia celular. Sin embargo, hoy por hoy, todavía no se ha conseguido inducir la proliferación de los hepatocitos adultos en cultivo, de tal modo que pudieran constituir una fuente regular de células maduras y funcionales para trasplante celular. Ello ha motivado que se haya invertido en los últimos años un enorme esfuerzo en desarrollar modelos que puedan constituir una alternativa a los hepatocitos humanos, mediante diferentes aproximaciones experimentales. Se ha contemplado el uso de líneas celulares derivadas de hepatoblastomas naturales, como las células HepG2. Sin embargo, aunque su disponibilidad es ilimitada, su utilidad terapéutica es muy escasa, no sólo por su condición tumoral con el riesgo que ello conlleva de inducir cáncer hepático, sino por el hecho de la alteración de su fenotipo con la casi total pérdida de funciones hepáticas clave, lo que las incapacita para devolver al hígado su funcionalidad hepática normal30,31. La inmortalización de los hepatocitos humanos es otra opción que se ha abordado utilizando distintas estrategias32-35. El procedimiento usado con mayor frecuencia es la transfección de los hepatocitos con vectores de expresión que contienen el antígeno SV40 LT. Sin embargo, a pesar de los avances en este campo de la inmortalización celular, las células resultantes no manifiestan los rasgos fenotípicos deseables para constituir una alternativa real a los hepatocitos maduros. Finalmente, otra posibilidad, no exenta de dificultades, podría ser la utilización de hepatocitos de otras especies para xenotrasplante celular, lo que obviaría el obstáculo de la falta de hepatocitos humanos36,37.
Estudios recientes en animales sugieren nuevas alternativas al uso de hepatocitos adultos. La estrategia para el trasplante celular en un futuro no muy lejano consiste en la utilización de las llamadas células ovales del hígado y de las células hepáticas troncales, que parecen tener la capacidad de proliferar y diferenciarse en hepatocitos maduros4. No obstante, por el momento no existe una forma eficiente para purificarlas y conseguir un número suficiente de ellas para que puedan sustituir a los hepatocitos maduros en el trasplante celular. Se han utilizado también hepatocitos fetales y células troncales fetales en modelos animales con insuficiencia hepática o enfermedades metabólicas, pero no se ha demostrado todavía si estas células son capaces de restaurar la función hepática normal38. En cualquier caso, las células troncales deben cumplir dos importantes requisitos para convertirse en una alternativa real a los hepatocitos adultos: ser capaces de proliferar en el hígado receptor y diferenciarse a hepatocitos maduros. Finalmente, despiertan gran interés las investigaciones realizadas en los últimos años sobre los precursores pluripotentes (células troncales de varios orígenes) como fuente potencial para el trasplante celular a distintos órganos. Un ejemplo de ello es el uso de células mesenquimales adultas derivadas de la médula ósea para la repoblación hepática mostrada en modelos animales39,40.
CÉLULAS TRONCALES Y SU POSIBLE UTILIZACION PARA TERAPIA CELULAR
Por célula madre, como normalmente se le llama por su traducción del término original inglés stem cell, o célula troncal, se entiende cualquier célula que tiene la doble capacidad de dividirse ilimitadamente y de dar lugar a diferentes tipos de células especializadas. De acuerdo con esta segunda capacidad, las células troncales pueden ser totipotentes, pluripotentes y multipotentes, en relación con su mayor o menor versatilidad o potencialidad para diferenciarse, tal como se definen a continuación. La totipotencia es la capacidad funcional de una célula para dar lugar a un individuo completo tras un proceso de desarrollo normal. La pluripotencia es la capacidad funcional de una célula para dar lugar a varios linajes celulares o tejidos diferentes. La multipotencia es la capacidad funcional de una célula para dar lugar a alguno, pero no a todos, los linajes celulares. Las células troncales multipotentes están presentes en los tejidos u órganos adultos y tienen una capacidad limitada de reactivar su programa genético en respuesta a determinados estímulos exógenos41.
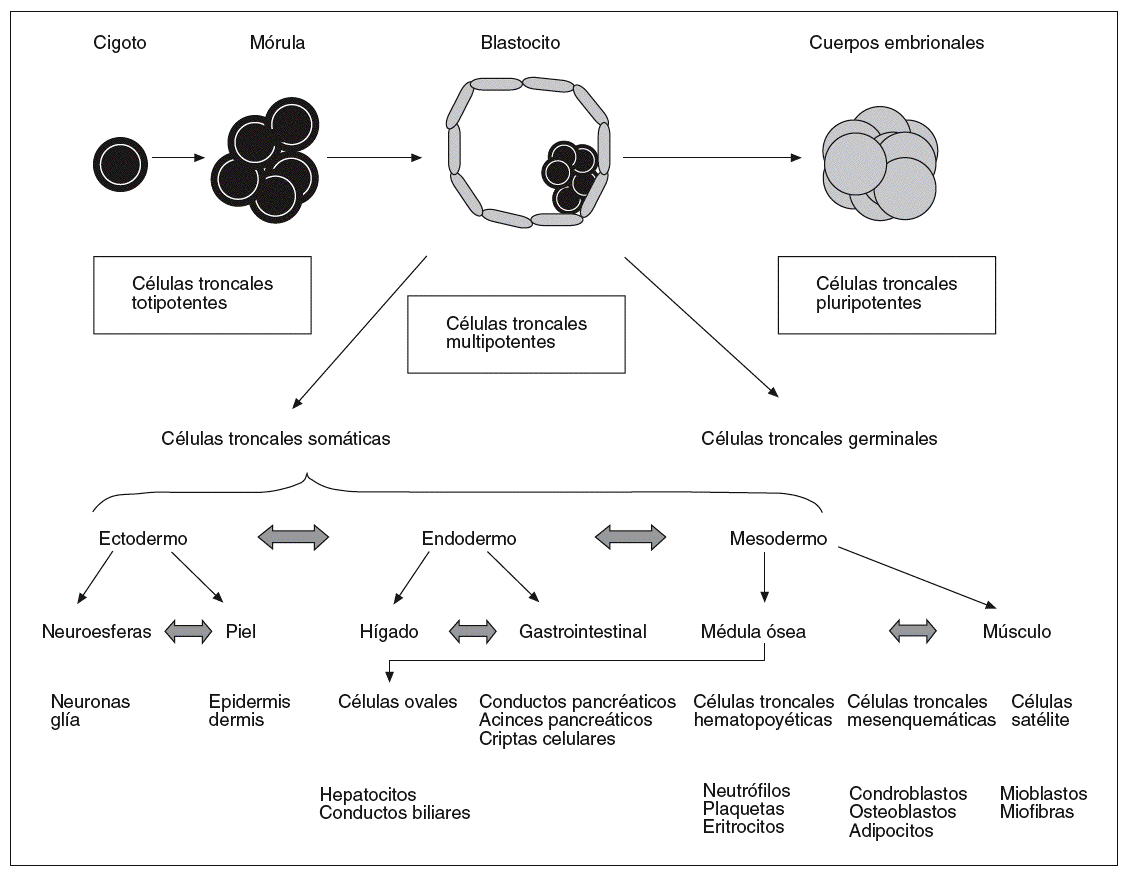
Atendiendo a su origen, hay varias clases de células troncales (embrionarias, germinales embrionarias, adultas) cuya eficacia en el establecimiento de cultivos de tejidos en el laboratorio y la valoración ética y legal para su utilización son diferentes (fig. 1).
Fig. 1. Modelo jerárquico de las células madre o troncales de acuerdo con su potencial de diferenciación.
Las células troncales embrionarias, también llamadas células ESC (acrónimo del inglés embryo stem cell), son células indiferenciadas que se encuentran en la masa celular interna del embrión en el estadio de blastocito que se desarrolla a partir del quinto o sexto día después de la fecundación.
Las células germinales embrionarias, también llamadas células EGC (acrónimo del inglés embryonic germ cells), derivan de células germinales primordiales, que constituyen la línea germinal del organismo una vez separadas de la línea celular somática y darán lugar a las células germinales.
Las células troncales adultas, también llamadas células ASC (acrónimo del inglés adult stem cells), pueden estar presentes en tejidos u órganos adultos. En el proceso de desarrollo normal del organismo adulto tiene lugar un proceso continuado de división celular para mantener constante el número de células diferenciadas de determinados tejidos que están sometidos a un desgaste natural (daño, enfermedad o muerte celular). Las células que tienen un elevado ritmo de recambio son reemplazadas a través de un proceso regulado de proliferación, diferenciación y muerte celular programada (apoptosis). Tal es el caso, por ejemplo, de las células troncales hematopoyéticas de la médula ósea y de las células epiteliales de la piel o del intestino delgado. Estos tejidos contienen subpoblaciones de células troncales encargadas de reemplazar a las células diferenciadas de corta vida42.
También se ha estudiado la utilización de las células troncales fetales, que pueden aislarse de la sangre y la médula ósea fetal, así como de otros tejidos fetales, incluidos el riñón y el hígado43. La sangre fetal es una fuente rica en HSC que proliferan más rápidamente que las del cordón umbilical o médula ósea de adulto. Además, durante el primer trimestre la sangre fetal también contiene una población de MSC, que pueden diferenciarse a múltiples linajes43. Ambos tipos de células fetales, HSC y MSC, tienen ventajas sobre sus homólogas adultas, incluida una mayor multipotencialidad y una menor inmunogenicidad. El uso de las células troncales fetales, en particular las HSC, plantea menos problemas de tipo ético que las células troncales embrionarias, y su potencial de diferenciación es mayor que el de las adultas. Por este motivo, las células troncales fetales representan una buena herramienta para explorar muchos aspectos relativos a los mecanismos moleculares responsables de la diferenciación celular y podrían ser una alternativa terapéutica muy prometedora para el trasplante celular y la terapia génica43.
No obstante, la obtención de células embrionarias humanas, o células troncales fetales, es actualmente muy controvertida. En otras especies se ha logrado generar virtualmente células de todos los tipos encontrados en órganos adultos a partir de células troncales embrionarias. Esta posibilidad ha abierto aplicaciones clínicas ilimitadas para el reemplazo y regeneración de tejidos y órganos por medio del trasplante de células derivadas de células troncales embrionarias. Sin embargo, puede existir una alternativa para obviar los aspectos éticos del uso de células embrionarias. Cada vez hay mayor seguridad de la existencia de células troncales en muchos, sino en todos, los tejidos adultos. Las células troncales adultas normalmente reabastecen al tejido de las células que ha perdido por el deterioro causado por el envejecimiento, las lesiones o la enfermedad. Estas células troncales podrían regenerar el repertorio completo de células organotípicas con la ayuda de técnicas de cultivo y protocolos de diferenciación adecuados. Utilizar estas células para trasplante celular permitiría regenerar terapéuticamente tejidos in vivo de la misma forma que lo harían las células troncales embrionarias. Por varias razones, las células troncales mejor estudiadas son las del sistema sanguíneo. Los glóbulos rojos maduros, en general, tienen una duración funcional corta, normalmente medida en días y, por consiguiente, precisan reabastecimiento de forma estable a lo largo de la vida. Dado que las células troncales están íntimamente involucradas en esta renovación, y dada la facilidad de acceder a la médula ósea, las células troncales se han estudiado en profundidad. No hay que olvidar el uso clínico de las células troncales para el tratamiento del cáncer mediante trasplante de médula ósea desde hace ya más de 30 años44. Ello indudablemente ha contribuido a fomentar la investigación básica y clínica de las aplicaciones terapéuticas de las células troncales hematopoyéticas.
En el organismo humano adulto se estima que existen unos 200 tipos de células diferentes, cuyo origen se puede retrotraer a las células troncales embrionarias pluripotentes indiferenciadas presentes en la masa celular interna del embrión en fase de blastocisto. Desde el punto de vista científico, la cuestión está en llegar a conocer cuáles son las instrucciones por las que una célula pluripotente indiferenciada se diferencia hacia un determinado tipo celular. Hasta ahora, se ha considerado que las células troncales adultas están limitadas a generar sólo células especializadas y diferenciadas del tejido donde residen, es decir, han perdido la capacidad de dar lugar a otras estirpes celulares del cuerpo: son células multipotentes. Sin embargo, numerosos estudios han puesto de manifiesto que estas células cultivadas y sometidas a ambientes humorales distintos de los habituales pueden reprogramarse y transdiferenciarse dando lugar a otros tipos celulares. Es decir, dejarían de ser células multipotentes para adquirir características de células pluripotenciales. Hay evidencias recientes sobre la posibilidad de obtener ASC, que están presentes en los propios órganos adultos, con capacidad para transdiferenciarse en células de otros tejidos u órganos in vitro. Si la utilización de las células somáticas del organismo humano se hace una realidad en la práctica clínica, se obviarían totalmente los problemas éticos derivados de la utilización de embriones.
La utilización de la terapia celular, basada en la transferencia de células o tejidos a los tejidos u órganos dañados, es uno de los grandes retos de la medicina regene rativa, que genera grandes expectativas terapéuticas para el futuro. El establecimiento de cultivos celulares de tejidos humanos en el laboratorio es a veces difícil y en determinados casos incluso imposible. Por ello, desde el punto de vista clínico sería innegable el avance que supondría la posibilidad de poner a punto técnicas que permitieran obtener cualquier tipo de cultivos de tejidos y, acaso, de órganos. En este contexto, no cabe duda de que el uso de las células troncales puede resultar fundamental.
TRANSDIFERENCIACION DE LAS CÉLULAS MADRE DE LA MÉDULA OSEA A HEPATOCITOS
Existe un tejido fuente de células troncales adultas que se considera como el más prometedor: la médula ósea. Esto está motivado por la sencillez en la recolección de las muestras y el procedimiento de aislamiento celular, al contrario de lo que ocurre con otros tejidos, sumado a la versatilidad de las células obtenidas de médula ósea para reparar tejidos dañados de muy diversas estirpes. Se han descrito diferentes tipos de células madre en la médula ósea: HSC41, MSC45, las llamadas side population cells (SPC)46 y recientemente las células progenitoras adultas multipotenciales, o MAPC39.
Células madre hematopoyéticas
Las HSC han sido identificadas tanto in vitro como in vivo por varios laboratorios y utilizadas clínicamente desde hace más de 50 años. El trasplante alogénico de progenitores hematopoyéticos ha demostrado definitivamente que existen células madre multipotenciales hematopoyéticas en la médula ósea y en la sangre periférica.
Mientras que en animales de experimentación es posible aislar e identificar las HSC, en el hombre no se ha podido identificar de igual modo la célula responsable de la regeneración del resto de líneas celulares hematopoyéticas. Además del potencial hematopoyético, diversos trabajos recientes indican que las HSC bajo ciertas circunstancias pueden ser más potentes de lo esperado, dando lugar a tejidos derivados de distintas capas embrionarias. Las células madre hematopoyéticas de médula ósea y de sangre periférica son capaces de contribuir a la angiogénesis y vasculogénesis in vivo, de tal forma que las células CD34+ no sólo contienen progenitores hematopoyéticos sino también células progenitoras endoteliales. Hoy en día se acepta que existe un progenitor común endotelial y hematopoyético (hemangioblasto), lo cual vendría apoyado por estos hallazgos de la potencialidad endotelial de las células troncales hematopoyéticas de la médula ósea47. También se han publicado recientemente trabajos que apoyarían la capacidad de las HSC de diferenciarse en células de músculo cardíaco. El grupo de Orlic et al48 ha demostrado, en un modelo de infarto de miocardio murino, que una inyección de células de médula ósea Lin y c-kit+ (fenotipo de marcesulta de la colonización de estas células en más de la mitad del área infartada. Estas posibles HSC adquirieron un fenotipo característico de células de miocardio y contribuyen a la mejora y supervivencia de los animales48. El potencial de las HSC para adquirir características de músculo esquelético, neuronas adultas, así como células de la glía, y de contribuir a otros tejidos como el epitelio pulmonar, gastrointestinal, renal o a la piel ha sido descrito recientemente principalmente in vivo49.
Basándose en que las células ovales expresan marcadores de superficie tradicionalmente asociados a HSC (c-kit, flt-3, Thy-1 y CD34), se ha sugerido que éstas podrían diferenciarse a células ovales y hepatocitos. El grupo de Lagasse et al50 ha demostrado que células madre hematopoyéticas de médula ósea con el fenotipo Lin, c-kit+, Thy-1, Sca-1 son capaces de regenerar un hígado murino en un modelo de daño hepático fulminante mientras que utilizando modelos de quimerismo en pacientes sometidos a trasplantes de médula ósea o de hígado, y aprovechando la posibilidad de utilizar el cromosoma Y como marcador del origen de la célula también se ha podido demostrar que un porcentaje de hepatocitos provienen de células madre de origen no hepático51.
Otro trabajo realizado por el grupo de Avital et al52 demuestra que en la médula ósea de rata y hombre la fracción de células beta-2-2-microglobulina-negativa, beta (2) m () y Thy-1 (+) expresan funciones y genes específicos de hígado. Comprobaron que tras la infusión intraportal en hígados de rata, estas células troncales hepáticas derivadas de la médula ósea (BDHSC) se integran con células hepáticas y se diferencian a hepatocitos maduros. A pesar de todos estos esfuerzos, ninguno de los estudios publicados hasta el momento demuestra que una única célula madre hematopoyética contribuya de forma consistente y funcional a la regeneración de un tejido distinto del hematopoyético y, por tanto, en sentido estricto no cumple los criterios necesarios para hablar de versatilidad. Cada uno de los trabajos mencionados puede ser criticado en este sentido. Sin embargo, si tomamos los es tudios de forma conjunta, sí que aportan evidencias de la existencia de HSC con estas características y potencialidades.
Células madre mesenquimales
La médula ósea también contiene células madre mesenquimales, también denominadas células madre estromales o MSC. Las MSC constituyen un modelo muy útil en aplicaciones clínicas para un número de enfermedades, tanto en terapia regenerativa como en terapia génica. En los últimos años se han descrito distintos marcadores de superficie que han permitido identificar y aislar células MSC, como SH2, SH3, CD29, CD44, CD71, CD90, CD106 y CD 120a45,53. Las MSC no expresan antígenos de superficie típicos de las HSC, como CD34, CD45 o CD1445,54. Experimentos recientes han demostrado in vitro que las MSC son capaces de diferenciarse a tejidos mesodérmicos funcionales, como osteoblastos, condroblastos, adipocitos y mioblastos esqueléticos45.
Varios grupos afirman haber conseguido diferenciar MSC a células derivadas del neuroectodermo, basándose en la adquisición de ciertos marcadores de origen neuronal por parte de dichas células cuando son sometidas a sistemas de cultivo específicos. Sin embargo, los autores no llegan a demostrar que estas células adquieran características funcionales similares a neuronas o células de la glía55. A pesar de su probada multipotencialidad mesodérmica y de su habilidad para diferenciarse a neuroectodermo, las MSC no se diferencian a tejido derivado del endodermo y, por tanto, no se pueden considerar células madre pluripotenciales.
Respecto a la diferenciación a hepatocitos de las MSC, no hay trabajos claros, aunque recientemente Shu et al40 han investigado de forma simultánea la diferenciación hepática tanto de las HSC como de las MSC derivadas de la médula ósea de rata. Estos autores concluyen que ambas MSC y HSC tienen capacidad de diferenciación hepática. Sin embargo, no de la misma manera. Las MSC pueden diferenciarse a células similares a hepatocitos maduros, nunca expresando genes específicos hepáticos tempranos, mientras que las células Thy-1.1 (+) tienen una tendencia a diferenciarse a células similares a las células troncales hepáticas, con una expresión creciente de AFP y una señal decreciente de albúmina. En otro trabajo reciente, Lee et al56 parten de células mesenquimales de médula ósea humana y de cordón umbilical. Con ayuda de un protocolo de diferenciación muy complejo consiguen la diferenciación hepática de estas células.
Las MSC constituyen un modelo muy útil en aplicaciones clínicas para un número de enfermedades, tanto en terapia regenerativa como en terapia génica57.
Células side population (SP)
Las llamadas células SPC han sido aisladas tanto a partir de médula ósea como de músculo utilizando técnicas de citometría de flujo. Se sabe que las SP son capaces de diferenciar a HSC en humanos, roedores y otras especies46,58. Además, algunos estudios describen que las SP podrían dar lugar a otros tipos de células especializadas e integrarse en distintos tejidos in vivo. Así, el grupo de Jackson et al demostró que las SP podían diferenciar a células con características de músculo cardíaco y endotelio en un modelo murino de infarto de miocardio58.
Células progenitoras multipotenciales adultas (MAPC)
Esta población celular de la medula ósea, descrita por un grupo de investigadores de la Universidad de Minnesota59, ha suscitado la atención del mundo científico, ya que se han descrito como auténticas células pluripotenciales con una capacidad diferenciadora muy similar a las células madre embrionarias. Las MAPC han sido aisladas tanto de médula humana como murina. Estas MAPC son capaces de proliferar in vitro más de 120 divisiones celulares sin un aparente envejecimiento, ya que mantienen unos valores altos de telomerasa durante todo el tiempo de cultivo. Se ha descrito que las MAPC no expresan CD34, CD44, MHC I, MHC II, CD45 y c-kit; expresan niveles bajos de Flk-1, Sca-1 y Thy-1, y altos de CD13, SSEA-1 (ratón/rata) y SSEA-4 (humano). Al igual que las células madre embrionarias, en las MAPC se detecta la activación de los factores de transcripción Oct-4 nanog y Rex-1, que son necesarios para mantener la célula en un estado proliferativo e indiferenciado. Además, se han realizado experimentos de clonación que prueban que es una única célula la que es capaz de diferenciarse a tejidos procedentes de cualquiera de las tres capas embrionarias (endodermo, mesodermo o ectodermo). In vitro, las MAPC pueden ser inducidas a diferenciar a tejidos derivados del mesodermo, como hueso, cartílago, adipocitos, músculo esquelético, estroma hematopoyética o endotelio. Pero de momento no han sido capaces de diferenciar a tejido hematopoyético maduro o cardiomiocitos. Estas células también han sido capaces de diferenciar a hepatocitos, ya que expresan HNF-3 beta, GATA4, CK19, transtiretina, AFP al séptimo día, y CK18, HNF-4 y HNF-1 alfa tras 14-28 días y funcionar como tales, pues son capaces de producir urea, albúmina, inducir el citocromo P450 con fenobarbital y almacenar glucógeno. Así, Shwartz et al60 concluyen que las MAPC pueden diferenciarse a células con características morfológicas, fenotípicas y funcionales de hepatocitos. La diferenciación de las MAPC a tejidos derivados del ectodermo, como neuronas, astrocitos y oligodendrocitos, también ha sido demostrada in vitro61.
No obstante, el proceso de aislamiento de las MAPC todavía es largo y laborioso, y aún no se han publicado experimentos que prueben que no existen fusiones celulares. Estos experimentos con MAPC son los más demostrativos de la existencia de células madre pluripotenciales, de gran potencialidad en el campo terapéutico, y como un instrumento para facilitar la comprensión de eventos que inducen las diferenciaciones de las células madre. Este tipo de resultados experimentales ponen de manifiesto que no son infundadas las esperanzas depositadas en la utilización de las células troncales adultas para la terapia celular del futuro. Sin embargo, hay autores que consideran que las células MAPC podrían considerarse como MSC, puesto que se copurifican juntas62.
CÉLULAS MADRE NO DERIVADAS DE LA MÉDULA OSEA
De forma casi continua aparecen nuevos estudios en los que se aíslan células madre a partir de tejidos adultos con capacidad multipotencial. Clarke et al63 han mostrado la existencia de células madre adultas pluripotenciales de origen neural y su capacidad de diferenciación. De la epidermis humana y murina se han aislado células madre con capacidad de diferenciarse a células especializadas procedentes de dos capas embrionarias distintas, neuroectodermo y mesodermo64. Qu-Petersen et al65 han conseguido aislar diferentes poblaciones de células madre musculares murinas. Estas células pueden mantenerse en cultivo durante más de 60 divisiones celulares sin anormalidades cromosómicas, y son capaces de diferenciarse in vitro e in vivo a endotelio, músculo y células del linaje neuronal. Uno de los trabajos que más expectativas ha despertado sugiere que es posible aislar células madre multipotenciales en el músculo cardíaco, capaces de diferenciarse in vitro e in vivo a cualquiera de los tejidos necesarios para reconstituir un corazón dañado, es decir, endotelio, músculo liso y músculo cardíaco66.
Estudios preliminares han identificado recientemente una población de células madre en la estroma adiposa. El tejido adiposo, como la médula ósea, deriva del mesénquima embrionario y contiene una estroma que se puede aislar en gran cantidad con facilidad y con la mínima molestia para el paciente. De esta forma, a partir de lipoaspirados humanos se puede aislar una población celular que, como las células de la médula ósea, es capaz de diferenciar a linajes osteogénicos, adipogénicos, miogénicos y condriogénicos67-70. Así, algunos trabajos han demostrado que las células madre derivadas del tejido adiposo tienen características similares a las de la médula ósea in vitro e in vivo, de forma que el tejido adiposo podría ser una fuente ideal de células madre autólogas71-73. Respecto a la diferenciación a hepatocitos, un trabajo muy reciente74 utiliza células derivadas de la estroma adiposa humana y muestra su diferenciación a linaje hepático in vitro. El tratamiento con ciertos factores exógenos induce la expresión de marcadores funcionales hepáticos clave en las células del tejido adiposo. Para ello, añade factores exógenos al medio de cultivo y determina mediante análisis inmunohistoquímico y de PCR la capacidad de las células del tejido adiposo de diferenciar a hepatocitos. Estos autores concluyen que el tejido adiposo puede ser una fuente alternativa para la regeneración hepática o para la terapia celular.
Las células del tejido adiposo se obtienen en grandes cantidades, con anestesia local y con la mínima molestia para el paciente. Además, parece que tienen mayor capacidad proliferativa que las células mesenquimales de la médula ósea72, por lo que en definitiva poseen ventajas objetivas para constituir una buena fuente alternativa de células adultas autólogas para la ingeniería celular.
FACTORES EPIGENÉTICOS O SEÑALES EXTERNAS QUE INDUCEN LA TRANSDIFERENCIACION DE LAS CÉLULAS MADRE
Hay una serie de hechos aún no dilucidados dentro de la terapia celular; tal es el caso de la forma en que las células madre se alojan en un tejido que ha sido dañado, donde aparentemente una serie de factores inducen a la permanencia de las mismas en un sitio y, a su vez, se inicia un proceso de especialización que las hace comportarse en forma semejante a las células sanas del tejido que las rodea. Una vez obtenido un cultivo de células diferenciadas y su posterior trasplante al paciente, se espera que éstas ayuden a recobrar la función del órgano perdida.
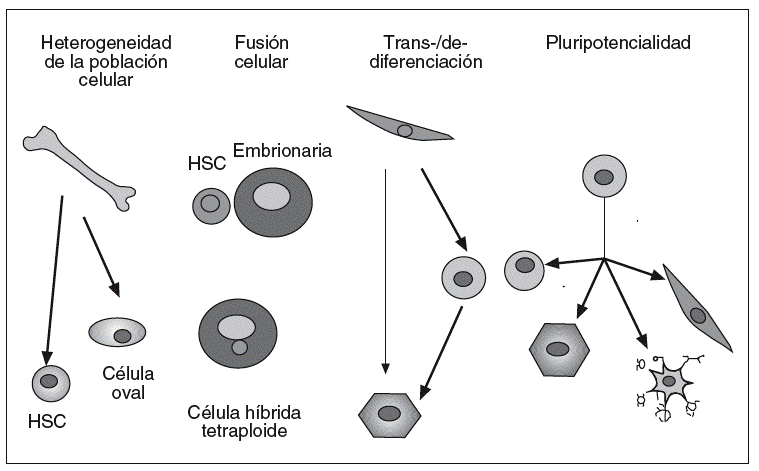
A la capacidad que adquieren estas células, bajo determinadas condiciones microambientales, de diferenciarse en células de tejidos distintos de aquel con el cual la célula madre se encuentra aparentemente comprometida se le ha denominado plasticidad42,75. En la actualidad, para es clarecer este proceso, se plantean 4 hipótesis o modelos (fig. 2) que se describen brevemente:
Fig. 2. Posibles mecanismos para explicar la plasticidad de las células madre adultas. HSC: célula madre hematopoyética. Tomado de Verfaillie et al75 y Prosper et al78.
Heterogeneidad de las células madre somáticas presentes en una población celular
La mayor parte de los estudios publicados no han sido capaces de demostrar la potencialidad de las células madre adultas en la clonación, es decir, una única célula dando origen a dos poblaciones celulares diferentes. Por ello, es posible que muchas de las observaciones realizadas correspondan realmente a la heterogeneidad de las células estudiadas, y puede haber diversas células madre en la misma población, cada una con distintas capacidades. Como ejemplo de este modelo está la heterogeneidad de células madre que se ha encontrado en la médula ósea, cada una con distintas características y potencialidades39,59,75.
Fusión de las células madre trasplantadas con las células específicas residentes en un órgano
Trabajos recientes han demostrado que al menos algunas de las observaciones de pluripotencialidad podrían justificarse por procesos de fusión entre las células madre trasplantadas y las células residentes76. El fenómeno de fusión se suele acompañar con la formación de células con características de ambas poblaciones fusionadas y generalmente con doble dotación cromosómica, lo que induce una desventaja proliferativa37,75,77.
Proceso de desdiferenciación y rediferenciación celular
Es posible que las células madre adultas, en determinadas circunstancias, se desdiferencien para posteriormente diferenciarse hacia células de distinta estirpe. Así, existe la posibilidad de que las células madre adultas puedan ser reprogramadas cuando se extraen de su microambiente natural y se sitúan en otros diferentes, en los que reciben estímulos y señales que las inducen a la activación de un nuevo programa genético que las lleva a la diferenciación en células del nuevo tejido en que se han implantado. De esta forma, una célula genéticamente afectada puede sufrir un proceso de desdiferenciación mediante un salto atrás en su etapa de maduración y adquirir por esta retrodiferenciación una nueva capacidad regenerativa, que le permite después rediferenciarse en células maduras especializadas de estirpes diferentes42,75,78.
Persistencia de células madre adultas con capacidad multipotencial o pluripotencial
Es posible que en el organismo adulto persistan células madre indiferenciadas, remanentes de tejido embrionario con capacidad pluripotencial, que en función del medio en que se sitúen pueden diferenciarse hacia células de diferentes linajes39,75.
Ninguno de estos modelos, hasta el momento, puede por sí solo explicar completamente el mecanismo de la plasticidad atribuida a las células madre. Es posible que en determinados casos, tejidos y situaciones ambientales, pueda ocurrir más de uno de estos procesos.
Respecto a la transdiferenciación de las células madre a linaje hepático in vitro, la mayoría de los trabajos publicados trata de imitar las circunstancias del desarrollo hepático para definir el proceso de diferenciación. Así, el factor de crecimiento de fibroblastos (FGF) se ha visto implicado en el proceso de diferenciación hepática de células madre embrionarias en un estado inicial. El factor de crecimiento hepático (HGF), la oncostatina M (OMS), los glucocorticoides y la insulina son factores implicados en la etapa de maduración posterior79.
PERSPECTIVAS DE FUTURO
Está fuera de toda duda la necesidad urgente por disponer de alternativas al trasplante de órgano sólido; sin embargo, de los diversos métodos propuestos hasta el momento ninguno de ellos está exento de dificultades, el trasplante celular se considera actualmente como la alternativa más prometedora como método terapéutico en las enfermedades hepáticas, para el mantenimiento de la función hepática hasta la obtención de un injerto adecuado para trasplante cuando éste sea inevitable. Hay muchos aspectos de la terapia celular que la convierten en atractiva: se trata de una aproximación nueva, prometedora, factible y versátil; posee un interés sanitario obvio por cuanto permite introducir nuevos instrumentos terapéuticos en procesos para los que no disponemos de una terapia mejor; utiliza principios comunes, independientemente del tipo de célula madre de la que se parta, e integra muy bien los conocimientos adquiridos en la investigación básica con las aplicaciones clínicas.
A pesar de todas las controversias existentes en este campo, el gran potencial terapéutico de la utilización de células madre en el futuro despierta unas enormes expectativas. Bien como materia prima para terapia regenerativa de enfermedades hasta ahora incurables o bien como vehículo de terapia génica, sólo se ha empezado a imaginar las posibilidades terapéuticas de las células madre. En este tipo de terapia, las células empleadas pueden provenir del mismo paciente o de un donante. Las células se inyectan al torrente sanguíneo o se colocan directamente en el sitio del órgano por tratar. La terapia celular autóloga (empleo de células vivas del mismo paciente) evita complicaciones y costosos tratamientos de supresión del sistema inmunológico para prevenir rechazos o las contaminaciones provenientes de un donador. Hay una serie de hechos aún no dilucidados dentro de la terapia celular; tal es el caso de la forma en que las células madre se alojan en un tejido que ha sido dañado, donde aparentemente una serie de factores inducen a la permanencia de las mismas en un sitio y, a su vez, se inicia un proceso de especialización que las hace comportarse en forma semejante a las células sanas del tejido que las rodea. Una vez obtenido un cultivo de células diferenciadas y su posterior trasplante al paciente, se espera que éstas ayuden a recobrar la función del órgano perdida. Por todo ello, es fundamental recordar que para conseguir que las células madre se transformen en una realidad terapéutica es imprescindible continuar haciendo una investigación rigurosa y estricta, que nos permita delimitar y definir sus aplicaciones terapéuticas.