La efectividad de la terapia con fármacos antifactor de necrosis tumoral α en la enfermedad inflamatoria intestinal ha sido probada en la práctica clínica.
Tras más de una década de uso de este tipo de fármacos, surge la interrogante acerca de si existe un momento apropiado para suspender estas terapias, y de qué manera esta debiera realizarse. Esta revisión tiene por objetivo evaluar la evidencia actual acerca del retiro de la terapia con antifactor de necrosis tumoral α y, eventualmente, identificar las condiciones o los subgrupos de pacientes potencialmente candidatos a la suspensión o el retiro de esta.
Anti-tumour necrosis factor α therapy in inflammatory bowel disease has been shown to be effective in clinical practice.
After more than a decade using these therapies the question arises about whether there is an appropriate time to suspend these therapies, and how this should be done. This review aims to evaluate the current evidence on these topics concerning anti-tumour necrosis factor α therapies, and eventually identify conditions and subgroups of patients that could potentially be candidates for withdrawal.
La enfermedad inflamatoria intestinal (EII), tanto por su compromiso gastrointestinal como por sus manifestaciones extraintestinales, genera una serie de alteraciones en la funcionalidad y la calidad de vida de quienes la padecen, siendo el objetivo de la terapia lograr una remisión profunda de la enfermedad (remisión clínica con curación mucosa e histología sin signos de actividad aguda), con intención de disminuir al mínimo los riesgos asociados a esta1. Lo anterior requiere de terapias a largo plazo, con seguimiento médico y de laboratorio frecuentes. Dentro de las terapias utilizadas en la EII, la introducción de la terapia biológica marcó un antes y un después respecto del manejo de los pacientes con actividad inflamatoria no controlada con las terapias tradicionales, como 5-aminosalicilatos, corticosteroides e inmunomoduladores (IM) (metotrexato y tiopurínicos).
El enfrentamiento clásico de tratamiento step-up no ha demostrado ser efectivo en todos los pacientes, y tampoco traduce un cambio en la historia natural de la enfermedad2,3. Esto ha ido cambiando mediante la indicación precoz de IM y/o biológicos, con la intención de controlar rápidamente la actividad inflamatoria con ajustes de terapia efectivos y a corto plazo4,5. Esta aproximación conlleva potenciales riesgos de desarrollo de infecciones, trastornos linfoproliferativos, algunas neoplasias como el cáncer de piel6,7, además de un costo elevado8. Por esto, en pacientes que se encuentran en remisión profunda por un período prolongado, y presentan bajo riesgo de recaída, se ha planteado la posibilidad de reducir al mínimo la dosis, aumentar el intervalo interdosis del biológico y eventualmente suspender el tratamiento. Sin embargo, esta estrategia aún no ha sido aceptada como una práctica habitual. Una reciente encuesta que incluyó a 182 gastroenterólogos de Estados Unidos y a 127 de Europa mostró que este último grupo estaba más predispuesto a suspender alguno de los fármacos de la comboterapia (fármaco biológico+IM) en pacientes con EII que se encontraban en remisión (44 vs. 18%)9. Así también, los pacientes tienen posturas diferentes al respecto. En una encuesta que incluyó solo pacientes con enfermedad de Crohn (EC), se observó que el grupo francés consideraba con mayor probabilidad suspender la comboterapia frente al grupo estadounidense (69 vs. 48%, p<0,01)10.
El objetivo de esta revisión es evaluar la evidencia, planteando una estrategia de cuándo, cómo y en qué pacientes se podría reducir y/o suspender la terapia biológica y/o el IM, abarcando los riesgos de recaída asociados a esta decisión.
Suspensión del tratamiento biológico en la enfermedad inflamatoria intestinalLos antifactor de necrosis tumoral-α (anti-TNF-α) subclase IgG1, infliximab (IFX), anticuerpo monoclonal quimérico, y adalimumab (ADA), anticuerpo monoclonal humanizado, han demostrado ser efectivos como terapia de inducción y mantenimiento tanto en la colitis ulcerosa (CU) como en la EC11–15. Las tasas de curación mucosa alcanzadas por ellos son de alrededor del 30% en la EC y del 60% en la CU, tras la fase de inducción, y entre 25-40% para la EC y 30-35% para la CU en fase de mantenimiento (semana 52-54)16,17. Estudios de la «vida real» muestran cifras más elevadas de respuesta a terapia, que llegan hasta el 90% en la fase de inducción y el 56% en seguimiento a 28 meses18, con sobrevida libre de falla a anti-TNF-α de hasta el 65,9% a 5 años19.
Terapia combinada o comboterapiaSuspensión/disminución de la terapia inmunomoduladora en comboterapia con anti-TNF-αLa formación de anticuerpos anti-IFX durante la terapia puede ocurrir entre un 43% (con IM) y un 75% (sin IM) tras la quinta infusión de IFX20, situación que conlleva secundariamente la disminución de los niveles plasmáticos (NP) de IFX y la pérdida de efectividad del fármaco (falla inmunogénica). Para evitar lo anterior, la comboterapia con IM, tiopurínicos o metotrexato estaría indicada al menos en el primer período del uso de IFX21, por ser una estrategia que disminuye la inmunogenicidad de este, por un lado, y aumenta los NP circulantes del biológico, por otro22.
En el caso de ADA, al ser un anticuerpo humanizado, se le atribuye una menor tasa de formación de anticuerpos asociada a su uso, con lo cual, el efecto de los IM sería menor en este caso. Un estudio reciente muestra que la comboterapia de tiopurínicos con ADA no se asociaría a una menor formación de anticuerpos anti-ADA vs. ADA en monoterapia (26 vs. 28%, p=1,00)23.
Enfermedad de CrohnEn general, en la EC no existe una diferencia significativa entre mantener o retirar el IM en el contexto de uso de terapia biológica de base, manteniéndose en ambos grupos una tasa de respuesta importante en el seguimiento durante el primer año de suspensión, pero con un descenso de esta en los años sucesivos, lo que confirma la necesidad de realizar un seguimiento clínico, bioquímico (calprotectina fecal [CF]) y endoscópico e imágenes según necesidad.
Un estudio de Van Assche et al. incluyó 80 pacientes con EC en remisión clínica que se encontraban en comboterapia por al menos 6 meses (IFX 5mg/kg cada 8 semanas asociado a IM, ya sea azatioprina [AZA], 6-mercaptopurina o metotrexato). Estos pacientes fueron aleatorizados a continuar (n=40) o suspender (n=40) el IM, observando que no hubo diferencia entre los grupos al comparar la necesidad de interrumpir o acortar los intervalos de administración de IFX (p=0,65). Sin embargo, en el grupo que suspendió el IM, los valores de proteína C reactiva (PCR) fueron más elevados que en el grupo que mantuvo el fármaco (2,8 vs. 1,6mg/L; p<0,005). En relación con los NP de IFX, estos fueron más bajos en el grupo que suspendió el IM (1,65 vs. 2,87ug/mL; p<0,0001). En un período de seguimiento de 104 semanas, la suspensión del IM no se tradujo en una mayor tasa de recaídas frente al grupo que continuó con el IM24.
Un estudio retrospectivo evaluó a 48 pacientes con EC en tratamiento combinado con AZA e IFX por al menos 6 meses (mediana 30,2±17,3 meses), a quienes, encontrándose en remisión clínica, se les suspendió la AZA. Trece pacientes (27%) necesitaron un cambio en la estrategia terapéutica en los siguientes 14±6,4 meses, en 9 por reactivación, requiriendo acortar los intervalos de infusión cada 6 semanas; 3 presentaron intolerancia severa a IFX, realizando cambio a ADA, y un paciente requirió cirugía por estenosis ileal. A su vez, al final del seguimiento, 35/48 (73%) se encontraban libres de recaída, sin necesidad de uso de corticoides ni IM, con una probabilidad de sobrevida libre de recaída en monoterapia con IFX de un 85% (±5%) a 12 meses y de un 41% (±18%) a 32 meses25.
No hay estudios que hayan evaluado de manera dirigida la evolución de los pacientes en tratamiento con comboterapia tras la suspensión del tratamiento con metotrexato.
Colitis ulcerosaEn la CU, esta situación ha sido evaluada solo en un estudio retrospectivo de 82 pacientes vírgenes a terapia biológica, con respuesta primaria a la inducción con IFX, en comboterapia con AZA por al menos 6 meses y que se encontraban en remisión prolongada libre de esteroides (deposiciones sin sangre y sin aumento de la frecuencia defecatoria). A estos pacientes se les siguió por una mediana de tiempo de 22,3±14 meses, el cual fue dividido en trimestres. Se mantuvo terapia con IFX y AZA, esta última siendo suspendida por decisión del médico (sumatoria de 393 trimestres con comboterapia y 282 trimestres con IFX monoterapia). En cuanto a las recaídas, estas fueron menos frecuentes en el grupo de tratamiento combinado (12/393 vs. 33/282 trimestres; p=0,049), así como también el tiempo previo a la recaída, que fue más prolongado en este grupo (16,6 vs. 7 meses; p<0,05). Una duración del tratamiento combinado mayor de 9 meses tuvo una asociación inversa con la recaída clínica (HR=0,32; IC 95% 0,15-0,70; p=0,004). Los autores plantean que en la CU el esquema comboterapia debería mantenerse por al menos 9 meses antes de la suspensión de AZA26.
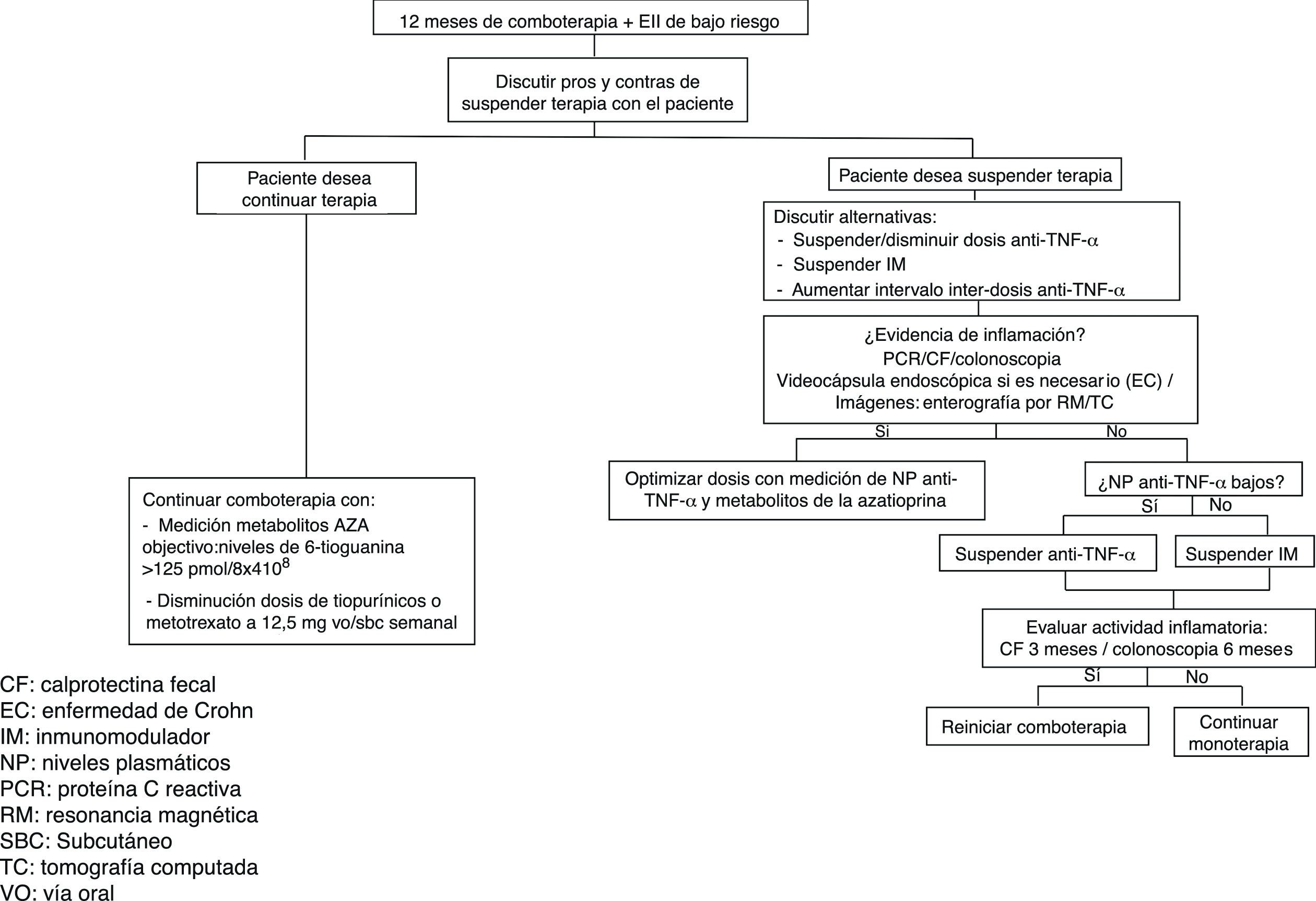
Una alternativa a suspender el IM en pacientes con EC y CU es reducir la dosis de este con el fin de disminuir la posibilidad de eventos adversos, manteniendo su efecto sobre la efectividad del anti-TNF-α. Niveles de 6-tioguanina>125pmol/8×108 serían suficientes para mantener unos NP de IFX adecuados27. En relación con metotrexato, dosis>12,5mg/semana serían más efectivas en mantener la respuesta a la terapia combinada28.
Suspensión de la terapia anti-TNF-α en comboterapia con inmunomoduladoresEl ensayo STORI es un estudio multicéntrico prospectivo en 115 pacientes con EC luminal que fueron tratados al menos durante 12 meses con IFX asociado a un IM, estando al menos 6 meses en remisión libre de esteroides antes de la suspensión de IFX. Las tasas de recaída a 12 y 24 meses fueron de 43,9±5% y de 52,2±5,2%, respectivamente, con una mediana de tiempo de recaída de 16,4 meses. Los factores de riesgo que podrían asociarse a una mayor recaída antes de la suspensión de IFX serían: sexo masculino, ausencia de resección quirúrgica, recuento blancos>6.000/L, hemoglobina<145g/L, PCR>5mg/L, CF>300ug/g. Los pacientes con≤2 factores de riesgo (29% de la población estudiada) tuvieron un riesgo de recaída a 12 meses del 15%. El 88% de los pacientes que recayeron tuvieron una respuesta clínica favorable al reiniciar el tratamiento con IFX29.
El seguimiento de este estudio evaluó a 102 pacientes y mostró que un 21,6% de ellos no requirió reiniciar terapia biológica ni tuvo complicaciones mayores a los 7 años de seguimiento. De los que reiniciaron IFX, este falló en un 30,1% a los 6 años de reiniciado. También se vio que el 70,2% de los pacientes no presentaron problemas con el retiro de la terapia (sin complicaciones mayores ni falla a retratamiento con IFX)30.
Papamichael et al. realizaron un estudio retrospectivo de 100 pacientes con EC que suspendieron IFX (mediana de tiempo de tratamiento previo a la suspensión de 7,3 meses) tras alcanzar la remisión clínica (inactividad clínica con HBI<4). Ochenta y cuatro pacientes mantuvieron IM, 16 5-ASA y 5 no tenían otra terapia asociada. Se les siguió durante una mediana de tiempo de 9,7 años (entre 8-11,5 años). Al final del seguimiento, el 52% de los pacientes mostraban remisión clínica sostenida, definida como el mantenimiento de la remisión de la enfermedad, sin necesidad de escalar en terapia o cirugías, hasta el final del periodo de seguimiento. Se asociaron a una mayor probabilidad de remisión clínica sostenida la edad al diagnóstico>25 años (p=0,012) y la duración de la enfermedad inferior a un año (p=0,017), y de los parámetros medidos en el momento de la suspensión, NP de IFX<6ug/ml (p=0,031), curación mucosa (p=0,046) y VCAM-1 (+) (p=0,024)31.
Un estudio reciente, multicéntrico, retrospectivo y observacional, evaluó 1.055 pacientes con EII (731 EC y 324 CU), quienes siendo tratados con anti-TNF-α (781 con IFX y 274 con ADA), se les suspendió el biológico (75% de forma electiva, 18% por eventos adversos y 7% por remisión tras la estrategia top-down). La mediana de seguimiento tras la suspensión fue de 19 meses (rango: 6-176). Tras la suspensión, 689 pacientes continuaron con tiopurínicos, 29 con metotrexato, 149 con 5-ASA y 188 sin terapia. Se observó que la tasa de recaída fue del 19% por paciente-año en la EC y del 17% por paciente-año en la CU (IC 95% 15-20; p = 0,1). En el análisis multivariado se observó que se asociaban a un mayor riesgo de recaída el tratamiento previo con ADA vs. IFX (HR=1,29; IC 95% 1,03-1,6; p=0,027) y la suspensión electiva del anti-TNF-α por evento adverso vs. estrategia top-down (HR=1,82; IC 95% 1,19-2,79; p=0,006 y HR=1,95; IC 95% 1,22-3,12; p=0,005, respectivamente). Por otra parte, se asoció a un menor riesgo de recaída el mantenimiento del tratamiento IM (HR=0,99; IC 95% 0,98-0,99; p=0,002) y una mayor edad en el momento de la suspensión del fármaco (HR=0,7; IC 95% 0,57-0,88; p<0,0001)32.
Una revisión sistemática y metaanálisis de 27 estudios (21 con IFX y 6 con IFX o ADA) en pacientes con EC y CU, que evaluaba el riesgo de recaída tras la suspensión de anti-TNF-α, reportó que el riesgo general de recaída en EC es del 44% y en CU del 38%. Al evaluar la recaída tras 12 meses de suspensión de la terapia, se vio que para la EC la tasa de recaída a 12 y>25 meses fue del 40 y el 49%, respectivamente, mientras que en la CU la tasa de recaída a 12 y 24 meses fue del 28 y el 36%, respectivamente. Al reiniciar terapia con anti-TNF-α, la inducción de remisión se alcanzó en un 80% de los pacientes33. Un estudio siguió prospectivamente a 78 pacientes (EC=61, CU=17) durante una mediana de 30 meses (entre 7-47 meses), a quienes les suspendieron la terapia anti-TNF-α tras alcanzar la remisión endoscópica (ausencia de ulceraciones). Se observó una tasa acumulada de recaída a 24 meses de un 49%, sin diferencias entre EC y CU (p=0,63). Un subanálisis que comparó aquellos pacientes en remisión endoscópica y bioquímica (CF<150ug/g+PCR<5mg/L) (n=27) frente a remisión clínica y endoscópica (n=23) observó tasas de recaída a 24 meses del 60 y el 52%, respectivamente (p=0,84)34.
A pesar de que metodológicamente los estudios mencionados son bastante heterogéneos (distintas definiciones de remisión clínica y tiempo en remisión previo a la suspensión), las tasas de recaída una vez suspendida la terapia anti-TNF-α, con comboterapia previa, son similares, oscilando entre un 21 y un 56% a los 12 meses, y entre un 47 y un 64% a los 24 meses. Esto evidencia que los pacientes que se encuentran en remisión clínica y endoscópica tienen la posibilidad de suspender la terapia biológica, debiendo evaluar esta opción de forma individualizada y discutida con el paciente.
Suspensión de la terapia anti-TNF-α en monoterapiaLa suspensión del anti-TNF-α en monoterapia no está aún aclarada. Los trabajos son, en su mayoría, en pacientes con comboterapia, en quienes se suspende uno de los 2 tratamientos.
Enfermedad de CrohnEl estudio ya mencionado de Casanova et al. muestra que la tasa acumulada de recaída postsuspensión del anti-TNF-α fue de un 44% por paciente-año, sin diferencias entre la EC y la CU (p=0,1). Sin embargo, al hacer el análisis considerando la suspensión desde comboterapia vs. monoterapia, se vio que aquellos pacientes que mantuvieron terapia con AZA tuvieron una incidencia de recaída del 17% por paciente-año frente a un 26% por paciente-año en aquellos sin IM32.
Otro estudio evaluó el intervalo de tiempo entre la suspensión de IFX y la recaída clínica, en 46 pacientes con EC; 23 con EC luminal con buena respuesta a 3 dosis de inducción con IFX, y 23 con EC luminal (n=11) o perianal (n=12) con respuesta sostenida a la terapia de mantenimiento con IFX cada 8 semanas, en remisión por al menos 12 meses. En aquellos pacientes con enfermedad perianal, la probabilidad acumulada de mantenerse libre de recaída tras la suspensión de IFX fue de un 45% a los 6 meses y de un 34% a los 12 meses de seguimiento, y en la enfermedad luminal fue de un 83% a los 12 meses35. Con esto, se sostiene que, a pesar de haber una tendencia a tener menores tasas de recaída al mantener la inmunosupresión tras la suspensión de la terapia biológica, no hay información suficiente a la fecha que avale o rechace dicha conducta en la EC luminal. En cuanto a la EC perianal, sí es más clara la evidencia con respecto a que no sería recomendable la suspensión de IFX, dada la alta tasa de recaída a corto plazo.
En esta misma línea, el estudio RASH, un trabajo multicéntrico, prospectivo y observacional, evaluó a 121 pacientes con EC que se encontraban en remisión clínica (CDAI<150) tras 12 meses de terapia con IFX (n=87) o ADA (n=34), en quienes les fue suspendido el biológico. La tasa de recaída a los 12 meses de suspensión fue de un 45%, con un tiempo medio a la recaída de 6 meses (entre 3,75-12 meses), identificándose como factores de riesgo asociados a la recaída el uso previo de terapia biológica (un año de diferencia) y la necesidad de uso de un esquema intensificado durante el año de terapia36.
Colitis ulcerosaEn cuanto a la tasa de recaída en la CU, una vez suspendida la terapia biológica de mantenimiento, esta es casi 3 veces superior a la del grupo que mantiene la terapia. Sin embargo, estos datos se basan en estudios retrospectivos que usan solo criterios clínicos y que no utilizan biomarcadores ni consideran los estándares actuales de remisión que incluyen variables bioquímicas, endoscópicas e histológicas.
En un estudio retrospectivo de 193 pacientes con CU en tratamiento con IFX, se evaluó la suspensión de la terapia biológica en 111 de ellos que se encontraban en remisión clínica por al menos 12 meses antes de la suspensión, sin corticoterapia ni inmunosupresión concomitante. Los 82 pacientes restantes continuaron la terapia con IFX. La tasa de recaída en quienes interrumpieron la terapia frente a los que continuaron con ella fue de 23,3 vs. 7,2 por 100 personas-año. De los 53 pacientes que recayeron tras la suspensión de IFX, el 66% reinició terapia con el mismo biológico (el 44% restante fue tratado con corticoides, ADA o golimumab). Una vez reiniciado IFX, la tasa de respuesta (disminución de al menos 3 puntos o un 30% del basal en el índice de Mayo) alcanzó un 77,1%, y la de remisión, un 51,4%37.
Medición de los NP de anti-TNF-α para la suspensión de la terapiaUna forma de evaluar la eventual suspensión de la terapia biológica es medir los NP del biológico. Un estudio retrospectivo evaluó a 48 pacientes (30 EC, 18 CU) que interrumpieron la terapia anti-TNF-α (35 IFX/13 ADA) estando en remisión con una duración media de tratamiento de 22,7±12,4 meses y con una medición de los NP de anti-TNF-α. Antes de la suspensión, 40/42 (95%) pacientes tuvieron una evaluación endoscópica sin actividad y 31/48 (65%) presentaban PCR y CF (<50ug/g) en rango normal. En el momento de la suspensión del anti-TNF-α, 20 pacientes tenían NP detectables del biológico y 28, NP indetectables. El número de pacientes que recayó fue mayor en el grupo con NP detectables (16/20 vs. 9/28) (OR 8,4, IC 95% 2,2-32; p=0,002). Asimismo, la sobrevida libre de recaída tras la suspensión del anti-TNF-α fue significativamente mayor en los pacientes con NP indetectables (p<0,001). Es importante señalar que 14 pacientes (29%) se encontraban en terapia IM concomitante en el momento de suspender el biológico, de los cuales 8 recayeron durante el seguimiento posterior a la suspensión38.
El uso de la medición de NP tendría un rol en la estrategia de retiro de la terapia biológica, pudiendo determinar si es posible suspender el IM o el anti-TNF-α. Sin embargo, es importante considerar que su utilidad en este escenario no ha sido evaluada en forma prospectiva.
Estrategias: disminución de dosis y aumento de intervalo interdosis de anti-TNF-αLa disminución de la dosis de anti-TNF-α o el distanciamiento de semanas de administración de dosis han sido evaluados en algunos estudios. Uno evaluó prospectivamente una cohorte de 12 pacientes con EC tratados con IFX (inducción y mantenimiento [5mg/kg]) en las 2 semanas posteriores a una resección intestinal por la enfermedad, manteniéndose sin actividad endoscópica a los 24 meses poscirugía, siguiéndolos luego durante 12 meses más, tras lo cual se interrumpió el fármaco sin iniciar ninguna otra terapia. En la colonoscopia de la semana 16 postsuspensión se observó que 10/12 (82%) pacientes tuvieron recurrencia endoscópica (Rutgeerts>2, sin considerar lesiones en la zona de anastomosis), con 8 de ellos con un índice de Rutgeerts de 3. Se les dio IFX 1mg/kg al inicio, sin lograr mejoría de la mucosa tras 3 infusiones, aumentándose la dosis a 2mg/kg, con un nuevo control colonoscópico a la tercera infusión, donde se observó que todos los pacientes tuvieron una disminución del índice de un punto (p=0,006), pero manteniendo un promedio de Rutgeerts de 2, por lo que se aumentó la dosis a 3mg/kg, logrando restablecer con esta dosis la integridad de la mucosa (índice de Rutgeerts de 0 o 1). Esta remisión endoscópica se logró mantener hasta la semana 52 de seguimiento con dosis de IFX de 3mg/kg cada 8 semanas39.
Un estudio de casos y controles de cohorte retrospectiva comparó 40 pacientes con EC en tratamiento con ADA cada 2 semanas (mediana de 17,9 meses) y NP de ADA>7ug/ml frente a 40 pacientes con EC que estaban en tratamiento con ADA en monoterapia (mediana de 43 meses), en quienes se decidió distanciar la dosis de ADA a cada 3 semanas, por eventos adversos (n=1), NP de ADA>7ug/ml (n=8) o la combinación de ambos (n=31). En los 2 grupos estaba disponible la medición de NP de ADA. Se observó que un 65% mantuvieron respuesta clínica a los 2 años de seguimiento. El 35% restante necesitó volver a la dosis previa por recaída clínica, NP de ADA bajos o ambos. En relación con la presencia de eventos adversos, estos disminuyeron en el grupo en que se distanció la dosis de ADA (55 vs. 100%, p<0,001). Un nivel de PCR<3,5mg/L al iniciar la reducción de la dosis se relacionó con una mayor sobrevida libre de escalar en terapia (OR=6,28, IC 95% 1,83-21,59; p=0,004)40.
En cuanto a la reducción de dosis de mantenimiento, el estudio de Sorrentino et al.39 muestra que con IFX 3mg/kg cada 8 semanas los pacientes lograrían una respuesta endoscópica adecuada. Sin embargo, esta estrategia de optimización carece de una medición de NP del fármaco, lo cual sería una herramienta útil para que este cambio de dosis fuese personalizado. Por otra parte, en cuanto al intervalo de las dosis, el estudio de Van Steenbergen et al.40 demuestra que existe un grupo de pacientes en el cual es posible distanciar el intervalo de administración del biológico, realizando la medición de NP del fármaco asociado a parámetros inflamatorios de laboratorio que nos orientarían de manera indirecta, pero con una mayor certeza respecto de la evolución del paciente.
En este sentido, el estudio TAXIT demostró que pacientes con tratamiento con IFX con NP>7ug/ml podían disminuir la dosis del fármaco sin perder respuesta a esta, resultando en un uso más eficiente y una reducción del costo del 28% respecto del costo previo a la reducción de la dosis (p<0,001)41.
DiscusiónExiste un beneficio terapéutico de los agentes biológicos establecido en el manejo de la EII. Sin embargo, su perfil de seguridad a largo plazo, los altos costos asociados y la historia natural de la EII (activación-remisión) han llevado a considerar la posibilidad de suspender la terapia en algún momento (tabla 1). En una encuesta realizada recientemente a gastroenterólogos de Europa y Estados Unidos, la principal causa de la suspensión del tratamiento IM y de la terapia biológica en pacientes en remisión fue el temor al riesgo de neoplasia y el costo económico, respectivamente9.
Razones para continuar o suspender la terapia biológica
| Detener la terapia biológica | Continuar la terapia biológica |
|---|---|
| Pérdida de respuesta con el tiempo | Posibilidad de mantener remisión libre de esteroides |
| Infecciones | Buena tolerancia |
| Cáncer | Disminuir hospitalizaciones relacionadas con la enfermedad |
| Costos | Disminuir cirugías relacionadas con la enfermedad |
| Necesidad de hospitalización para infusiones | |
| Necesidad de inyección subcutánea o intravenosa | |
| Curso oscilante de la enfermedad |
Hay quienes plantean la posibilidad de suspender la terapia por un tiempo, con opción de reiniciarla en cuanto sea necesario (CF y/o PCR elevadas)42. Sin duda, esta estrategia resultaría menos riesgosa en caso de pérdida de eficacia posreinicio de anti-TNF-α si se dispone de un mayor acceso a nuevos fármacos (antiintegrinas, anti-p40 IL-12/23, anti-Jak cinasas).
En el momento de decidir reducir la dosis o suspender un biológico, se requiere una monitorización rigurosa de los pacientes para evaluar precozmente las recaídas, pero aún no están definidos ni la forma ni el intervalo de tiempo con los cuales este seguimiento debe hacerse. En general, los estudios34,38,40,42 han considerado seguimiento clínico y bioquímico, con PCR y CF, en promedio cada 8-12 semanas, planteando que se lograría predecir la recaída clínica de manera anticipada, permitiendo realizar una aproximación endoscópica o radiológica precoz en caso de una elevación marcada de estos parámetros.
Respecto de los factores de riesgo asociados a una mayor recaída tras la suspensión de la terapia con anti-TNF-α, diversos estudios muestran que la evidencia de inflamación en el momento de la suspensión, ya sea por PCR y/o CF elevadas o por la falta de curación mucosa, se asocia a una mayor tasa de recaídas, apoyando la idea de que es necesario tener una remisión profunda antes de considerar la suspensión de un anti-TNF-α26,32,38.
Existen factores de riesgo y protectores a considerar antes de la suspensión de la terapia biológica (tabla 2) que nos obligan a tomar la decisión de suspensión/reducción del tratamiento según cada caso, manteniendo seguimientos cercanos con exámenes de laboratorio y controles preventivos en estos pacientes (fig. 1).
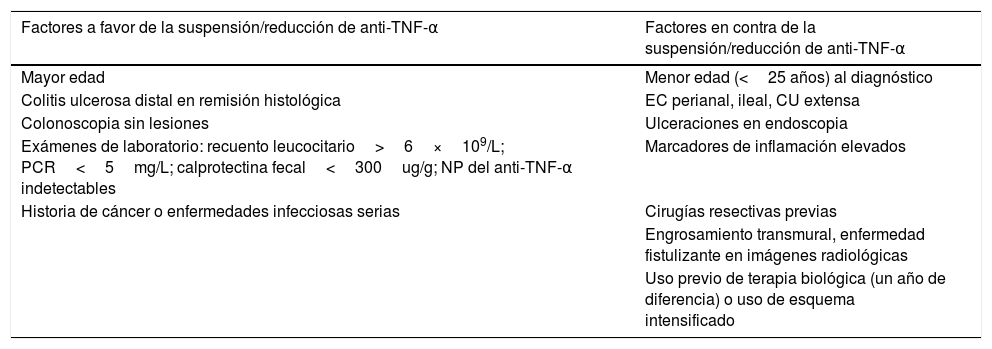
Factores a favor y en contra de la reducción/suspensión de la terapia biológica anti-TNF-α
| Factores a favor de la suspensión/reducción de anti-TNF-α | Factores en contra de la suspensión/reducción de anti-TNF-α |
|---|---|
| Mayor edad | Menor edad (<25 años) al diagnóstico |
| Colitis ulcerosa distal en remisión histológica | EC perianal, ileal, CU extensa |
| Colonoscopia sin lesiones | Ulceraciones en endoscopia |
| Exámenes de laboratorio: recuento leucocitario>6×109/L; PCR<5mg/L; calprotectina fecal<300ug/g; NP del anti-TNF-α indetectables | Marcadores de inflamación elevados |
| Historia de cáncer o enfermedades infecciosas serias | Cirugías resectivas previas |
| Engrosamiento transmural, enfermedad fistulizante en imágenes radiológicas | |
| Uso previo de terapia biológica (un año de diferencia) o uso de esquema intensificado |
En conclusión, la evidencia de la utilidad de la terapia biológica en EII es clara, pero el momento en el cual esta puede ser suspendida o retirada aún no está establecido. Estudios prospectivos que evalúen esta estrategia e incluyan las nuevas moléculas planteadas en el manejo de la EII permitirán definir cuál es el mejor escenario de cada paciente43.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.