El tratamiento habitual del adenocarcinoma colorrectal pT1 consiste en la resección endoscópica siempre que sea posible. Se requiere la evaluación de los ganglios linfáticos locorregionales cuando se detectan factores histológicos adversos en las polipectomías endoscópicas.
Materiales y métodosSe seleccionaron 29 adenocarcinomas colorrectales pT1 incluyendo las polipectomías endoscópicas y piezas quirúrgicas correspondientes. Se evaluaron por 2 patólogos todos los parámetros histológicos asociados a N+, incluyendo: grado de diferenciación tumoral, profundidad de invasión en submucosa, invasión angiolinfática (IAL), invasión perineural, inflamación crónica, gemaciones tumorales, grupos de tumor pobremente diferenciados, adenoma preexistente, borde tumoral y margen de resección endoscópico. Se realizó un análisis de regresión logística univariante y multivariante para evaluar la capacidad individual de cada variable para predecir N+.
ResultadosEn el análisis univariante, la localización rectal, la presencia de IAL y la presencia de grupos de tumor pobremente diferenciados se asociaron significativamente con metástasis ganglionares. De todas estas variables, la presencia de IAL presentó la mayor área bajo la curva ROC (0,875). El análisis multivariante no encontró ninguna variable independiente asociada a N+.
ConclusionesLa IAL y la presencia de grupos de tumor pobremente diferenciados se asocia frecuentemente con N+ en cáncer colorrectal precoz, por lo que se debe implementar rutinariamente la evaluación de estos parámetros histológicos.
Endoscopic resection is the common treatment in pT1 colorectal adenocarcinoma whenever possible. The presence of adverse histological factors requires subsequent lymph node evaluation.
Materials and methodsWe selected 29 colorectal pT1 adenocarcinoma including endoscopic polypectomies and the corresponding surgical specimens. All histologic parameters associated with N+ were evaluated by 2 pathologists, including: tumor differentiation grade, depth of invasion in the submucosa, angiolymphatic invasion (ALI), perineural invasion, chronic inflammation, tumor budding, poorly differentiated cluster, pre-existing adenoma, tumor border, and endoscopic resection margin. Univariate and multivariate logistic regression analysis were performed to assess the individual capacity of each variable to predict N+.
ResultsIn the univariate analysis, rectal tumor localization, ALI and poorly differentiated cluster was significantly associated with N+. Among the significant parameters, ALI had the highest area under the ROC curve (0.875). Multivariate analysis showed no independent variables associated with N+.
ConclusionsWe confirm that ALI and the presence of poorly differentiated cluster are frequently associated with N+ in early colorectal cancer. Consequently, these parameters should be routinely evaluated by pathologists.
A pesar de los grandes avances que se han alcanzado en el tratamiento multidisciplinario del cáncer colorrectal (CCR), la recurrencia local y/o sistémica se mantiene como uno de los principales problemas en este grupo de tumores1–12. La presencia de metástasis ganglionares locorregionales se considera uno de los principales factores pronósticos asociados con recaída local y/o a distancia, por lo tanto, es importante valorar el riesgo de afectación ganglionar, sobre todo en pacientes candidatos a una resección local, y particularmente en los tumores que infiltran la submucosa (T1)1–22.
La eficacia de los métodos actuales de detección precoz de CCR ha incrementado su diagnóstico en fases incipientes, muchos de ellos adenocarcinomas (ADC) in situ o ADC pT11,9–13. La mayoría de estos tumores T1 pueden ser tratados mediante técnicas de resección local (endoscópica o quirúrgica), siempre y cuando existan parámetros clínicos, radiológicos y/o patológicos que permitan determinar el riesgo de metástasis ganglionares, sobre todo cuando no esté programado realizar una cirugía adicional con exéresis de ganglios linfáticos locorregionales1–13.
Considerando que la incidencia de metástasis ganglionares en tumores pT1 fluctúa entre el 8-16% aproximadamente, la cirugía adicional con resección ganglionar solo beneficiaría a un pequeño porcentaje de casos2–22. Por otro lado, un gran número de pacientes se sometería a una intervención quirúrgica no exenta de riesgos, donde finalmente podría existir la posibilidad de no encontrar ganglios linfáticos afectos10–15. Verdaderamente, las complicaciones postoperatorias se han reducido con los avances actuales de la cirugía y los cuidados postoperatorios, por lo que realizar esta cirugía adicional aportaría un adecuado estadio patológico T y N que inevitablemente influiría en la toma de decisiones posteriores1–10.
Desafortunadamente, hasta donde conocemos no existen factores clínicos y moleculares predictivos de metástasis ganglionares locorregionales en tumores pT1, y a pesar de que los estudios radiológicos teóricamente ofrecen información adicional sobre el estado de los ganglios linfáticos, no existen criterios bien definidos que puedan asegurar con certeza la existencia o no de metástasis ganglionares1–5. Recientemente se ha implementado el estudio de una serie de factores histopatológicos en las piezas de polipectomía que pueden predecir el riesgo de metástasis ganglionares locorregionales, lo cual facilitaría la toma de decisiones en cuanto a tratamientos quirúrgicos adicionales1–22.
Según las guías del National Comprehensive Cancer Network y la clasificación de la Organización Mundial de la Salud (OMS), la presencia de un grado histológico pobremente diferenciado G3 y la invasión angiolinfática (IAL), respectivamente, son los únicos factores histológicos que cuando están presentes son indicativos de cirugía adicional en CCR T1 con margen de resección endoscópico negativo23. Sin embargo, existe un porcentaje de pacientes que presentan metástasis ganglionares aun sin tener pobre diferenciación tumoral o IAL en la pieza de polipectomía. Según describen las guías europeas (ESMO)24–30 y las japonesas (JSCCR)31, existen otros parámetros histológicos que cuando están presentes son indicativos de cirugía adicional. Estos factores incluyen la presencia de yemas o gemaciones tumorales (TB por tumor budding) y la profundidad de invasión en la submucosa mayor de 1mm. Recientemente se ha descrito un nuevo factor histológico, denominado «grupos de tumor pobremente diferenciados» (GTPD), que predice de manera significativa y más segura el riesgo de metástasis ganglionares en CCR T11–22. Lo cierto es que muchos de estos factores histológicos no se reflejan habitualmente en los informes histopatológicos, y según se ha demostrado en algunos estudios, no hay suficiente reproducibilidad ni estandarización, sobre todo en el TB, los GTPD y la profundidad de infiltración en la submucosa1–15.
El principal objetivo de este estudio fue la evaluación de los parámetros histológicos descritos como predictivos de metástasis ganglionares locorregionales en una serie de casos con diagnóstico de CCR estadio pT1, para conocer cuál o cuáles de ellos se asociaron más frecuentemente con la presencia o no de metástasis ganglionares.
Material y métodosSe seleccionaron 29 ADC colorrectales pT1 diagnosticados entre los años 2006-2014 en el Departamento de Patología del Instituto Valenciano de Oncología con laminillas y/o bloques de parafinas disponibles para análisis histopatológico. Las muestras seleccionadas procedían de polipectomías endoscópicas con diagnóstico de ADC infiltrante (pT1) y la correspondiente pieza quirúrgica adicional, que incluía ganglios linfáticos mesocólicos o mesorrectales. También se incluyeron aquellos casos con diagnóstico de ADC T1 que no tenían polipectomía endoscópica previa y se operaron directamente porque fueron considerados endoscópicamente irresecables. Ninguno de los pacientes recibió tratamiento neoadyuvante. Los pacientes con polipectomías endoscópicas previas fueron operados por la presencia de uno o más de los siguientes hallazgos: margen de resección endoscópico positivo o no valorable, tumores G3, presencia de IAL, TB o GTPD e infiltración en la submucosa mayor de 1mm. El estadio patológico se estableció de acuerdo con el sistema TNM715. Se incluyeron solo los casos en los que se analizaron como mínimo 12 ganglios linfáticos según la estandarización convencional para asegurar que la cirugía y la revisión anatomopatológica fueron correctas. De acuerdo con su localización, los tumores se agruparon según estuvieran originados en colon (ascendente, transverso, descendente o sigma) o recto (tercios superior, medio o inferior).
Los procedimientos seguidos en este trabajo se realizaron de acuerdo con la normativa aprobada por el comité institucional local del Instituto Valenciano de Oncología.
Después de la fijación de la pieza quirúrgica con formaldehído, se realizaron secciones histológicas del tumor (polipectomía y pieza quirúrgica) y de los ganglios linfáticos (pieza quirúrgica), las cuales fueron incluidas en parafina. Subsecuentemente, se realizaron cortes histológicos de 2-5μm y se tiñeron con hematoxilina-eosina para una evaluación histopatológica inicial. Se revisaron todas las láminas teñidas con hematoxilina-eosina analizando los siguientes parámetros histológicos: grado de diferenciación tumoral (según los criterios histológicos de la OMS 2010; G1: formación glandular en más del 95% del tumor; G2: entre el 50-95%; G3: entre el 5-50%; G4: menos del 5%), profundidad de infiltración en la submucosa desde la muscular de la mucosa (menor o mayor de 1mm), IAL y perineural (presente o ausente), inflamación crónica peritumoral (ligera, moderada, severa), TB (presente, ausente), GTPD (presente, ausente), adenoma preexistente (presente, ausente), borde tumoral (infiltrativo o expansivo) y margen de resección endoscópico en las polipectomías endoscópicas de tumores pT1 (libre o afecto). Se consideró margen afecto cuando el tumor tocaba el margen o cuando la distancia del tumor al margen fue menor de 1mm. Adicionalmente se evaluó la presencia o no de metástasis ganglionares en la pieza quirúrgica. Algunos de estos factores ya habían sido evaluados previamente por un patólogo en el informe anatomopatológico emitido de inicio; no obstante, se evaluaron nuevamente todos los parámetros histológicos independientemente por 2 patólogos (IM y JC) y una becaria graduada en Biotecnología en rotación por nuestro departamento (MVA).
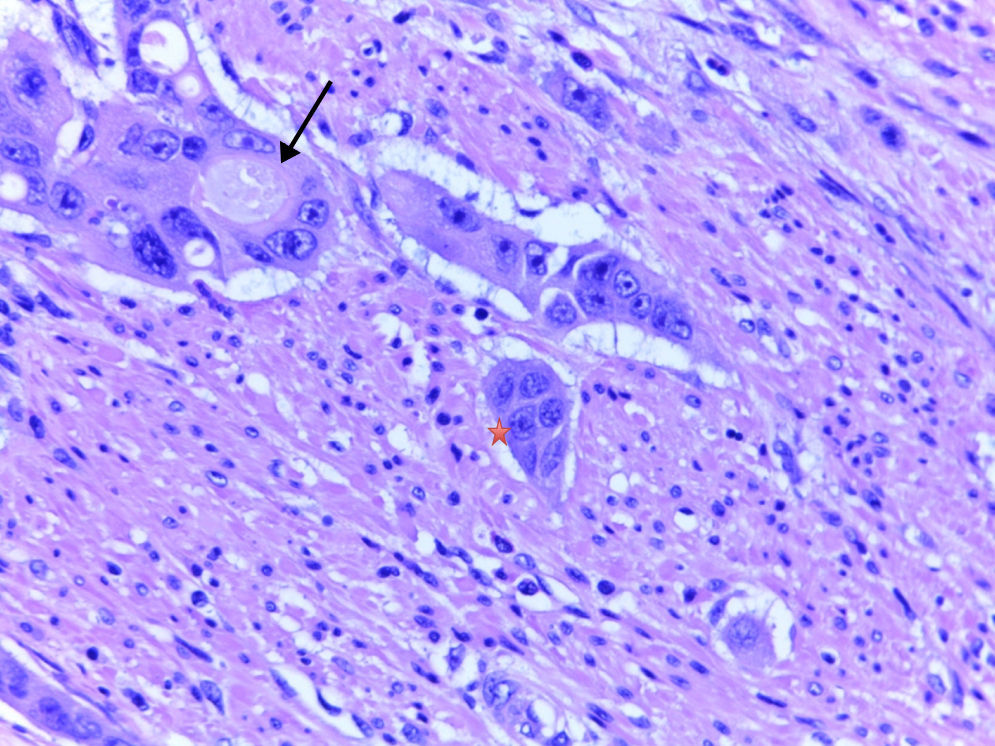
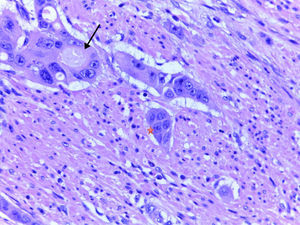
Definición de tumor budding y grupos de tumor pobremente diferenciadosTumor buddingEl TB, o gemaciones tumorales, se define como células individuales o grupos <5 aislados del tumor2–10. Las muestras histológicas analizadas con la tinción de hematoxilina-eosina se visualizaron mediante aumento de ×40 en microscopio Leica DM2000, y se clasificaron según la presencia o ausencia de TB.
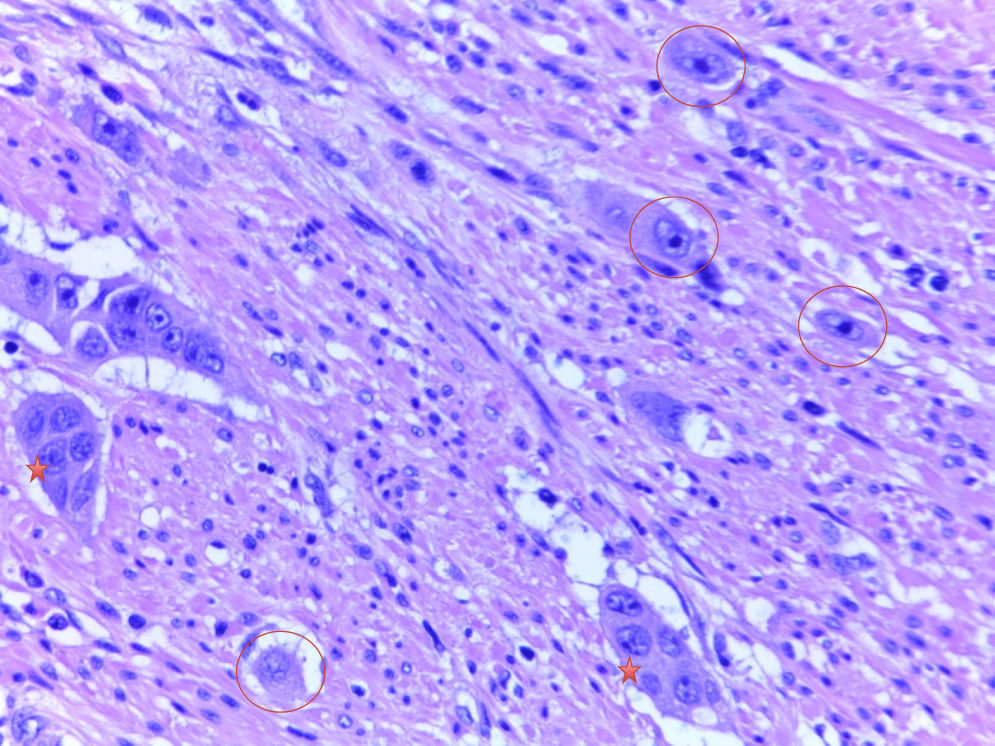
Grupos de tumor pobremente diferenciadosSegún la definición establecida por Ueno et al.2–4 y seguida por Barresi et al.5–8, los GTPD son conjuntos aislados de 5 o más células tumorales que carecen de una luz glandular identificable, aislados de zonas de necrosis o fragmentación glandular tumoral por la ulceración o inflamación. En la determinación de los GTPD se analizaron inicialmente cada uno de los casos con un aumento ×10, con el objetivo de identificar las regiones con un número significativo de GTPD. Tras esto, se recurrió a un aumento mayor (×40) para contar los grupos. Se realizó una cuantificación de los GTPD según el número de grupos presentes y conforme al sistema previamente indicado (<5, 5 a 9 y≥10 GTPD)7,8. No obstante, para facilitar el análisis estadístico y considerando el escaso número de casos, los tumores se clasificaron teniendo en cuenta solamente la presencia o ausencia de GTPD.
Análisis estadísticoInicialmente se realizó un análisis estadístico para determinar la distribución de variables clínicas (localización y estadio TNM) e histológicas. Se analizaron las características clínico-patológicas de todos los casos incluidos en el estudio, lo que permitió obtener valores de frecuencias y porcentajes. Se realizó un análisis de regresión logística univariante para evaluar la capacidad individual de cada variable para predecir la probabilidad de metástasis ganglionar (N+). Se muestran los valores de las OR con los intervalos de confianza al 95%. Los valores p asociados a estas OR se utilizaron para predecir el nivel de significación de los parámetros histológicos. La capacidad de predicción del modelo, esto es, la precisión con que los parámetros histológicos pueden predecir la presencia o ausencia de metástasis nodal, viene indicada mediante los valores del área bajo la curva ROC (ABC). A su vez, se mostraron los valores del intervalo de confianza y del valor p correspondiente. Posteriormente se realizó un análisis multivariantes que incluyó los factores que resultaron estadísticamente significativos en el análisis univariante, con objeto de identificar las variables que contribuyeron independientemente al desarrollo de metástasis nodal. Valores p<0,05 fueron considerados como estadísticamente significativos. Los análisis se llevaron a cabo para determinar el nivel de significación de las variables histológicas y clínicas, empleando el software SPSS® versión 20.
ResultadosEn total se incluyeron 29 pacientes (19 varones y 10 mujeres) con diagnóstico de ADC colorrectal pT1 (21 con polipectomías endoscópicas y las piezas quirúrgicas correspondientes por presentar algún factor histológico adverso en la polipectomía) y adicionalmente 8 piezas quirúrgicas con tumores T1 que fueron considerados irresecables de inicio. Las características clínico-patológicas de todos los casos estudiados aparecen en la tabla 1. La edad promedio fue de 63 años, y se encontraron metástasis ganglionares en 5 pacientes durante el seguimiento, que estaba disponible en las historias clínicas.
Distribución de variables clínicas y patológicas en tumores pT1
| Casos CCR (N=29) | n (%) |
|---|---|
| Localización | |
| Colon | 20 (69) |
| Recto | 9 (31) |
| Estadio TNM7 | |
| T1N0 | 24 (83) |
| T1N1 | 5 (17) |
| Grado (OMS) | |
| 1 | 25 (86) |
| 2,3 | 4 (14) |
| Profundidad submucosa (un caso no valorable) | |
| <1mm | 8 (29) |
| >1mm | 20 (71) |
| Margen (polipectomías endoscópicas con margen valorable) | |
| Libre | 13 (81) |
| Afecto | 3 (19) |
| IAL | |
| No | 18 (62) |
| Sí | 11 (38) |
| TB (un caso no valorable) | |
| No | 18 (64) |
| Sí | 10 (36) |
| GTPD (un caso no valorable) | |
| No | 21 (75) |
| Sí | 7 (25) |
| Inflamación | |
| No, ligera | 7 (24) |
| Moderada, severa | 22 (76) |
| Adenoma preexistente | |
| No | 1 (3) |
| Sí | 28 (97) |
| Borde tumoral (un caso no valorable) | |
| Expansivo | 10 (36) |
| Infiltrativo | 18 (64) |
| IPN | |
| No | 27 (93) |
| Sí | 2 (7) |
| Ganglios positivos | |
| Ausencia | 24 (83) |
| Presencia | 5 (17) |
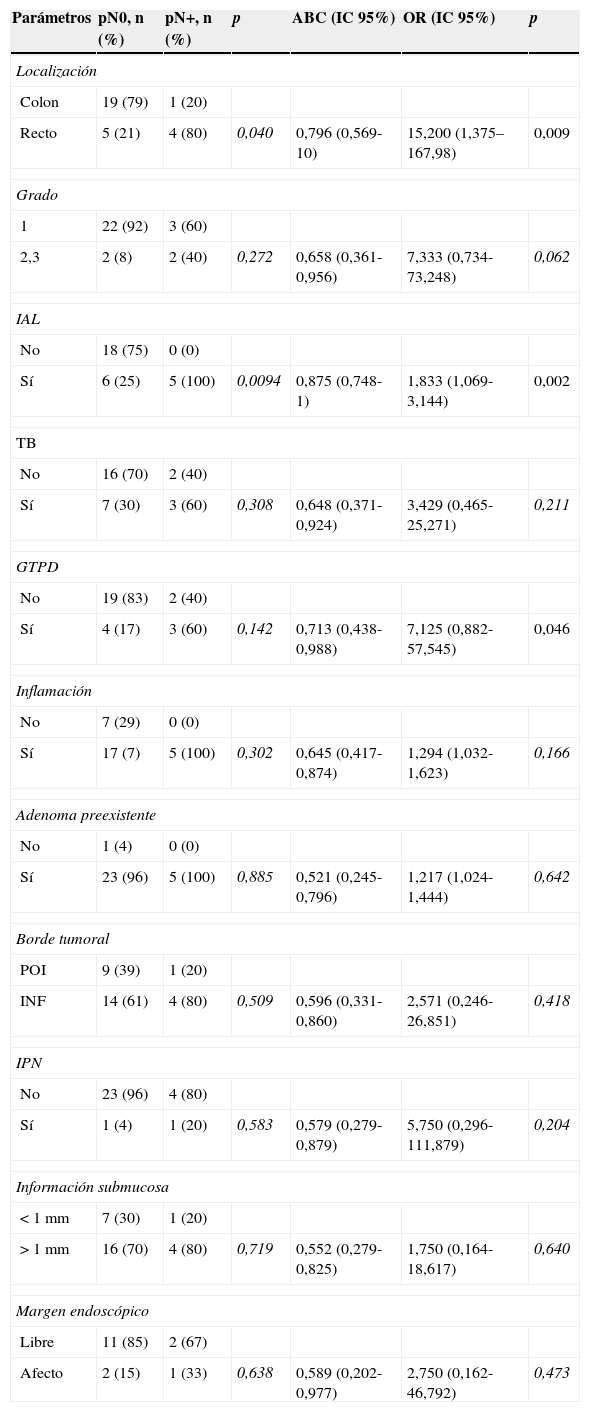
El análisis univariante y multivariante realizado para evaluar la capacidad individual de cada variable de predecir la probabilidad de metástasis ganglionar, así como la precisión con que cada parámetro clínico e histológico puede predecir la presencia o ausencia de metástasis nodal reflejada como el ABC aparece en la tabla 2. En el análisis univariante, la localización rectal (p=0,009), la IAL (p=0,002) y la presencia de GTPD (p=0,046) se asociaron significativamente con metástasis ganglionares. De todas estas variables, la presencia de IAL presentó la mayor ABC (0,875). El análisis multivariante en este grupo de tumores T1 no encontró ninguna variable independiente asociada a N+.
Correlación estadística entre la localización y parámetros histológicos en cáncer colorrectal T1 con la presencia de metástasis ganglionar
| Parámetros | pN0, n (%) | pN+, n (%) | p | ABC (IC 95%) | OR (IC 95%) | p |
|---|---|---|---|---|---|---|
| Localización | ||||||
| Colon | 19 (79) | 1 (20) | ||||
| Recto | 5 (21) | 4 (80) | 0,040 | 0,796 (0,569-10) | 15,200 (1,375–167,98) | 0,009 |
| Grado | ||||||
| 1 | 22 (92) | 3 (60) | ||||
| 2,3 | 2 (8) | 2 (40) | 0,272 | 0,658 (0,361-0,956) | 7,333 (0,734-73,248) | 0,062 |
| IAL | ||||||
| No | 18 (75) | 0 (0) | ||||
| Sí | 6 (25) | 5 (100) | 0,0094 | 0,875 (0,748-1) | 1,833 (1,069-3,144) | 0,002 |
| TB | ||||||
| No | 16 (70) | 2 (40) | ||||
| Sí | 7 (30) | 3 (60) | 0,308 | 0,648 (0,371-0,924) | 3,429 (0,465-25,271) | 0,211 |
| GTPD | ||||||
| No | 19 (83) | 2 (40) | ||||
| Sí | 4 (17) | 3 (60) | 0,142 | 0,713 (0,438-0,988) | 7,125 (0,882-57,545) | 0,046 |
| Inflamación | ||||||
| No | 7 (29) | 0 (0) | ||||
| Sí | 17 (7) | 5 (100) | 0,302 | 0,645 (0,417-0,874) | 1,294 (1,032-1,623) | 0,166 |
| Adenoma preexistente | ||||||
| No | 1 (4) | 0 (0) | ||||
| Sí | 23 (96) | 5 (100) | 0,885 | 0,521 (0,245-0,796) | 1,217 (1,024-1,444) | 0,642 |
| Borde tumoral | ||||||
| POI | 9 (39) | 1 (20) | ||||
| INF | 14 (61) | 4 (80) | 0,509 | 0,596 (0,331-0,860) | 2,571 (0,246-26,851) | 0,418 |
| IPN | ||||||
| No | 23 (96) | 4 (80) | ||||
| Sí | 1 (4) | 1 (20) | 0,583 | 0,579 (0,279-0,879) | 5,750 (0,296-111,879) | 0,204 |
| Información submucosa | ||||||
| <1mm | 7 (30) | 1 (20) | ||||
| >1mm | 16 (70) | 4 (80) | 0,719 | 0,552 (0,279-0,825) | 1,750 (0,164-18,617) | 0,640 |
| Margen endoscópico | ||||||
| Libre | 11 (85) | 2 (67) | ||||
| Afecto | 2 (15) | 1 (33) | 0,638 | 0,589 (0,202-0,977) | 2,750 (0,162-46,792) | 0,473 |
El valor predictivo de cada parámetro aparece como área bajo la curva (ABC) y odds ratio (OR).
No se llevó a cabo una correlación entre los factores histológicos, la supervivencia global o el intervalo libre de enfermedad debido a que el seguimiento clínico de estos pacientes es menor a 3 años.
DiscusiónDurante varios años se han propuesto diversos factores histopatológicos potencialmente predictivos de metástasis nodales locorregionales en CCR mínimamente invasivo1,16–22. Lamentablemente, en todos los estudios donde se han analizado estos parámetros histológicos se requiere la inclusión de casos donde la pieza quirúrgica y, por tanto, los ganglios linfáticos, estén disponibles para evaluación.Evidentemente, en aquellos casos T1 que no se operan y que habitualmente son los que no presentan factores histológicos adverso no es posible, de momento, conocer el estado ganglionar de manera definitiva. Estos casos realmente representan un sesgo que inevitablemente perdurará por largo tiempo en este tipo de estudios.
El avance en las técnicas endoscópicas de resección y los programas de detección precoz de CCR han elevado la incidencia de estos tumores detectados en estadios precoces1–8. Debido a la baja probabilidad de metástasis que tienen estas neoplasias, la resección local endoscópica o quirúrgica se ha convertido en el tratamiento de elección en CCR T1, mejorando la calidad de vida del paciente, ya que se evita una cirugía adicional que puede llegar a incluir una amputación abdominoperineal si la lesión está localizada en el tercio inferior del recto2–15. No obstante, la resección endoscópica como método de tratamiento está reservada solo para pacientes sin diseminación metastásica2–8. Por lo tanto, es imprescindible la búsqueda continua de hallazgos o factores indicativos de una diseminación ganglionar en muestras provenientes de resección endoscópica con el objetivo de identificar aquellos pacientes que pudieran beneficiarse de un tratamiento adyuvante.
En las recomendaciones europeas actuales para evaluar los CCR T1 se indica que el informe histopatológico debe incluir una serie de parámetros histológicos, como la presencia de IAL, el estado del margen de resección endoscópico, la existencia de zonas de tumor pobremente diferenciadas y de TB27–29. No obstante, aunque el patólogo informe la presencia de factores histológicos adversos, es recomendable que un equipo multidisciplinario integrado por gastroenterólogos, cirujanos, oncólogos y radiólogos determine si se debe realizar o no una resección quirúrgica adicional en cada caso en particular1–9. Esta determinación muchas veces depende de la edad, la localización de la neoplasia (rectal o colónica), las comorbilidades del paciente, entre otros2–15.
Los criterios de evaluación para estos parámetros histológicos no siempre han sido los mismos; además, no todos se han validado en series extensas, y cuando se han validado, no necesariamente se han aplicado los mismos criterios recomendados en publicaciones anteriores2–14. Particularmente, las guías japonesas recomiendan medir la profundidad de invasión en la submucosa como un parámetro predictivo muy importante asociado a la presencia o no de metástasis ganglionares31. Ueno et al.4, en su estudio que incluye 3.556 tumores con diagnóstico de CCR T1, concluyen que los casos con una profundidad de invasión en la submucosa menor de 1mm tienen muy bajo riesgo de presentar metástasis ganglionares. A pesar de las series extensas descritas en las guías japonesas (JSCCR)2–4, en Europa este criterio no está del todo implementado: la medición de distancias consume tiempo, pero fundamentalmente presenta limitaciones, ya que la muscular propia no siempre aparece incluida en las polipectomías endoscópicas de CCR T1, y muchas veces no es posible identificar adecuadamente la capa muscular de la mucosa, lo que implica cierto grado de subjetividad.
La IAL es uno de los criterios asociados a N+ desde hace muchos años, lo cual tiene mucho sentido. Sin embargo, el acuerdo interobservador en los estudios previos no siempre es alto, y en ocasiones es muy difícil distinguir la IAL del artefacto por retracción que aparece en este tipo de neoplasias1–13. A pesar de que algunos estudios describen discordancias en la evaluación de la IAL con o sin inmunohistoquímica (IHQ), en la mayoría de las investigaciones existe una adecuada concordancia11–13. Probablemente la observación por más de un patólogo, como en el presente estudio, y el acuerdo entre ellos en casos de discordancia facilita una adecuada valoración de la presencia de IAL.
La presencia de TB es otro factor histológico recientemente descrito asociado a N+, pero su detección también presenta dificultades, pues en ocasiones puede pasar inadvertido al patólogo si no se usan técnicas IHQ de citoqueratinas de amplio espectro para detectar células tumorales aisladas, que evidentemente pueden confundirse con células estromales no tumorales reactivas a la inflamación asociada a la neoplasia invasiva1,10–22.
La evaluación de los GTPD ha sido publicada en varios estudios recientes que incluyen series extensas donde se ha demostrado la asociación significativa que existe entre estos y la incidencia de N+2–8. Esta evaluación es evidentemente menos subjetiva comparada con la de los demás factores, considerando que se trata de grupos o nidos tumorales y, por lo tanto, no requiere del uso de marcadores IHQ para su detección. En el estudio recientemente publicado por Ueno et al.4 se describe cómo después de la presencia de IAL, la existencia de GTPD representó el segundo factor que con más impacto predice el riesgo de N+, independientemente del grado de invasión en la submucosa. Estos datos no son del todo discrepantes con las recomendaciones europeas que plantean que ante cualquier componente pobremente diferenciado que es sinónimo de presencia de GTPD en un ADC pT1 resecado endoscópicamente, se debe realizar una cirugía adicional para excluir metástasis ganglionares28,29. Adicionalmente, en el mismo estudio se demuestra que la evaluación de los GTPD es más reproducible que la del grado histológico según la clasificación de la OMS, y además, que el acuerdo interobservador fue superior cuando se evaluaban los GTPD comparado con el grado de diferenciación tumoral convencional y la presencia de IAL4. Sin embargo, la comunidad de patólogos internacionales no japonesa se resiste a dejar de usar el sistema de gradación histológica recomendado por la OMS, a pesar de que esta clasificación tiene una gran variabilidad interobservador y, verdaderamente, no existe un método objetivo para cuantificar el porcentaje de formación glandular2–8.
A pesar de que en el análisis univariante realizado en nuestra serie la localización rectal, la presencia de IAL y la existencia de GTPD se asociaron significativamente con metástasis nodales locorregionales, no se obtuvo ningún parámetro significativo en el análisis multivariante para este grupo de tumores pT1. El escaso número de tumores pT1 analizados en el presente estudio evidentemente constituye una de las principales limitaciones. No obstante, en el análisis estadístico 2 de los factores que previamente han sido descritos como altamente predictivos de metástasis2–8 (IAL y GTPD) también se asociaron de manera significativa con metástasis ganglionares locorregionales, al menos en el análisis univariante del estudio actual. Adicionalmente, en nuestra serie, la presencia de IAL aparece como la variable con la mayor ABC (0,875) para predecir metástasis nodales, lo que es concordante con varios estudios que demuestran que este factor histológico adverso es altamente predictivo de metástasis ganglionares2–8.
En Europa, Barresi et al. han publicado una serie de estudios en CCR T15–8, y en los 2 más recientes7,8 confirman que la simple presencia de GTPD representa un factor de alto riesgo predictivo de N+ independientemente del número de GTPD cuantificados; además, demuestran que la evaluación de los GTPD para predecir el potencial metastásico de los CCR T1 es más reproducible que la evaluación de la profundidad de infiltración en la submucosa, la IAL, el TB y el grado histológico empleado por la clasificación de la OMS. En el estudio del grupo italiano, de manera similar al de los japoneses, pero con menos casuística, se describe cómo la profundidad de invasión >1mm, así como la IAL estuvieron significativamente asociadas a N+ (p<0001)7. Todos los CCR T1 con metástasis ganglionares tenían en el tumor primario una profundidad de infiltración en submucosa >1mm. Sin embargo, la especificidad de este factor en detectar N+ fue más baja cuando se comparó con la presencia de GTPD (84,9%) o de IAL (94,6%). Por lo tanto, la presencia de invasión submucosa >1mm por sí sola como criterio de alto riesgo podría generar un incremento de falsos positivos, con un aumento del número de cirugías adicionales innecesarias7. Resulta interesante, además, que el mismo estudio muestre que la combinación de una profundidad de invasión en la submucosa >1mm y la presencia de GTPD revela una alta especificidad (88,2%) en la identificación de CCR T1 N+, lo que evidencia que la evaluación de los GTPD debe añadirse al informe histopatológico, ya que la simple presencia de estos tiene mayor valor predictivo de N+ que la gradación basada en su cuantificación7.
Considerando la importancia que tiene la detección histológica de los GTPD como factor predictivo de metástasis ganglionares locorregionales en CCR, sería interesante investigar si es posible detectar estos grupos en biopsias endoscópicas y, además, determinar si tienen el mismo valor predictivo para N+ aun cuando se detectan en las muestras procedentes de biopsias endoscópicas.
Recientemente, Barresi et al.8 han publicado otro estudio donde investigan la reproducibilidad, la seguridad y el valor predictivo de los GTPD evaluados en 152 biopsias endoscópicas con el objetivo de predecir el estado de los ganglios locorregionales y el estadio pTNM en CCR T1. Evaluaron biopsias endoscópicas (cualquier T) y posteriormente correlacionaron los resultados en la pieza quirúrgica mediante un sistema novedoso de gradación histológica basado en la cuantificación de GTPD previamente publicado por el grupo japonés4. Basado en este sistema, encontraron que los casos con un alto grado en la biopsia endoscópica según el número de GTPD encontrados se asociaban significativamente con N+, estadio pTNM avanzado y hallazgos histológicos en la pieza quirúrgica indicativos de neoplasia agresiva (TB, IPN, IAL, borde tumoral infiltrativo). Por lo tanto, concluyen que este sistema de gradación podría aportar más información de la extensión anatómica del tumor comparado con la que puede aportar la gradación según la proporción del componente glandular en biopsias endoscópicas preoperatorias según la clasificación de la OMS8. Una de las limitaciones de este estudio se basa en la localización de los GTPD. Estos nidos generalmente están en el frente de crecimiento tumoral profundo, y la mayoría de las biopsias endoscópicas normalmente aportan muestras de las zonas superficiales del tumor. Indudablemente estos resultados deben confirmarse en estudios adicionales que permitirían estratificar adecuadamente los pacientes con riesgo de metástasis nodal o estadio avanzado en el momento de la biopsia inicial, lo que obviamente tendría una gran importancia clínica para el consecuente manejo terapéutico de estos pacientes.
En nuestra casuística, a pesar de que no realizamos la correlación entre los factores histológicos y la progresión a distancia considerando el escaso número de pacientes que desarrollaron metástasis a distancia, sí observamos que no todos los tumores primarios en estos pacientes tenían factores histológicos adversos predictivos de metástasis ganglionares (IAL, TB, GTPD). Adicionalmente, solo 3 casos tenían metástasis ganglionares en la pieza quirúrgica. A pesar de los innumerables estudios que han demostrado el significado pronóstico de factores moleculares en CCR avanzado, prácticamente ninguno ha evidenciado el beneficio de estudiar estos factores en CCR T1 como decisivos en la selección del método de tratamiento de estos pacientes. De cualquier manera, algunos estudios esperanzadores han descrito en casuísticas de más de 200 casos que la expresión IHQ para CD10 está significativamente asociada a la presencia de metástasis ganglionares, como se ha descrito recientemente por Nishida et al.22. Lo cierto es que algunos de los CCR T1 que bien pueden tener o no factores histológicos adversos, progresan a distancia y se desconoce qué factores influyen realmente o están asociados con la progresión local o a distancia en estadios tempranos de CCR.
En conclusión, considerando la asociación bien demostrada de parámetros histológicos adversos con metástasis ganglionares locorregionales, sobre todo la IAL, la profundidad de invasión de la submucosa >1mm, el TB y los GTPD, es altamente recomendable implementar en todos los informes anatomopatológicos la evaluación de estos factores, especialmente en los CCR T1 resecados endoscópicamente. La evaluación de los GTPD es de gran valor, considerando que de todos ellos parece ser el parámetro más reproducible y con menos variabilidad interobservador. Sería interesante, en el marco de ensayos clínicos o estudios retrospectivos y prospectivos, estudiar en Europa series con un gran número de CCR T1 que incluyan patólogos de varias instituciones con el objetivo de validar si realmente la evaluación de estos factores histológicos debería ser decisiva en la toma de decisiones para el tratamiento del CCR en estadio precoz (figs. 1 y 2).
Isidro Machado y Miriam Valera-Alberni han contribuido igualmente en el presente estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Fundación AECC por la beca concedida a Miriam Valera-Alberni.