Las principales guías de práctica clínica recomiendan la realización de endoscopia dentro de las 24horas posteriores a la admisión en urgencias en pacientes con hemorragia digestiva alta no variceal. Sin embargo, es un margen de tiempo muy amplio y el papel de la endoscopia urgente (<6horas) es controvertido.
Material y métodosEstudio prospectivo observacional realizado en Hospital Universitario La Paz, donde son seleccionados todos los pacientes, desde el 1 de enero de 2015 hasta el 30 de abril de 2020, que acudieron a urgencias y fueron sometidos a endoscopia por sospecha de hemorragia digestiva alta. Se establecieron dos grupos de pacientes: endoscopia urgente (<6horas) y precoz (6-24horas). El objetivo primario del estudio fue la mortalidad a los 30días.
ResultadosUn total de 1.096 pacientes fueron incluidos, de los cuales 682 fueron sometidos a endoscopia urgente. La mortalidad a los 30 días fue del 6% (5% vs 7,7%, p=0,064) y del resangrado fue del 9,6%. No hubo diferencias estadísticamente significativas en la mortalidad, resangrado, necesidad de tratamiento endoscópico, cirugía y/o embolización, pero sí en la necesidad de transfusión (57,5% vs 68,4%, p<0,001) y el número de concentrados de hematíes transfundidos (2,85±4,01 vs 3,51±4,09, p=0,008).
ConclusiónLa endoscopia urgente, en pacientes con hemorragia digestiva alta aguda, también el subgrupo de alto riesgo (GBS ≥ 12), no se asoció con una mortalidad menor a los 30 días que la endoscopia precoz. Sin embargo, en los pacientes con lesiones endoscópicas de alto riesgo (Forrest I-IIB), fue un predictor significativo de menor mortalidad. Por lo tanto, se requieren más estudios para la identificación correcta de pacientes, que se beneficien de esta actitud médica (endoscopia urgente).
The main clinical practice guidelines recommend endoscopy within 24hours after admission to the Emergency Department in patients with non-variceal upper gastrointestinal bleeding. However, it is a wide time frame and the role of urgent endoscopy (<6hours) is controversial.
Material and methodsProspective observational study carried out at La Paz University Hospital, where all patients were selected, from January 1, 2015 to April 30, 2020, who attended the Emergency Room and underwent endoscopy for suspected upper gastrointestinal bleeding. Two groups of patients were established: urgent endoscopy (<6hours) and early endoscopy (6-24hours). The primary endpoint of the study was 30-day mortality.
ResultsA total of 1096 were included, of whom 682 underwent urgent endoscopy. Mortality at 30days was 6% (5% vs 7.7%, P=.064) and rebleeding was 9.6%. There were no statistically significant differences in mortality, rebleeding, need for endoscopic treatment, surgery and/or embolization, but there were differences in the necessity for transfusion(57.5% vs 68.4%, P<.001) and the number of concentrates of transfused red blood cells (2.85±4.01 vs 3.51±4.09, P=.008).
ConclusionUrgent endoscopy, in patients with acute upper gastrointestinal bleeding, as well as the high-risk subgroup (GBS ≥12), was not associated with lower 30-day mortality than early endoscopy. However, urgent endoscopy in patients with high-risk endoscopic lesions (ForrestI-IIB), was a significant predictor of lower mortality. Therefore, more studies are required for the correct identification of patients who benefit from this medical approach (urgent endoscopy).
La hemorragia digestiva alta (HDA) aguda no varicosa es una causa frecuente de atención en urgencias e ingreso hospitalario. Presenta una incidencia anual estimada de 40-150/100.000 habitantes con una significativa morbilidad, costes socioeconómicos y mortalidad asociada1. A pesar de los grandes avances en los últimos años, tanto desde el punto de vista del tratamiento médico como del endoscópico, la mortalidad permanece elevada, con resultados que oscilan entre el 2 y el 14%2-4, lo que se atribuye en parte al envejecimiento de la población y a la comorbilidad asociada.
El tratamiento inicial de estos pacientes incluye el soporte hemodinámico, el tratamiento con inhibidores de la bomba de protones y el manejo de fármacos antitrombóticos/anticoagulantes5. Posteriormente, el siguiente paso es la realización de una endoscopia digestiva, la cual es el procedimiento gold standard y resulta imprescindible para el diagnóstico y el tratamiento.
Las principales guías de práctica clínica6-9 recomiendan que los pacientes con sospecha de HDA se sometan a una endoscopia dentro de las primeras 24horas desde su admisión en urgencias, asociándose a una reducción de la estancia media, costes hospitalarios y mortalidad10-12. Sin embargo, es un margen de tiempo muy amplio, y todavía permanece controvertido cuál es el momento ideal de realizar la endoscopia en la hemorragia digestiva alta, resultando fundamental proporcionar el tratamiento adecuado y a tiempo adecuado.
Se han desarrollado diferentes escalas de estratificación de riesgos para predecir los resultados en estos pacientes con HDA e identificar aquellos de alto riesgo. Destaca la escala de Glasgow-Blatchford (GBS)13, que ha demostrado mayor capacidad predictiva14 que la puntuación de Rockall15 (RS) y el AIMS65. El valor de corte de GBS para los pacientes de alto riesgo sigue siendo ambiguo, y diferentes estudios16,17 coinciden en señalar un resultado de GBS ≥12 para identificar aquellos pacientes que tienen mayores riesgos de necesitar tratamiento endoscópico, transfusión de hemoderivados, tasas de resangrado y mortalidad.
El papel de la endoscopia urgente (EU) (≤6horas) en pacientes con HDA, sobre todo en el subgrupo de pacientes de alto riesgo, sigue siendo controvertido y un tema de intenso debate. En los últimos años se han publicado diferentes estudios que proporcionan resultados contradictorios. En la cohorte retrospectiva del estudio de Cho et al.18, con un reclutamiento total de 961 pacientes de alto riesgo, definidos por un GBS >7, la EU se asoció con una menor mortalidad (1,6% vs 3,8%, p=0,034). Sin embargo, en el ensayo clínico aleatorizado realizado por Lau et al.16 (n=516) los investigadores reportan que la EU (<6horas desde la consulta al gastroenterólogo) no se asoció con una menor mortalidad (8,9% vs 6,6%, p=0,34) a los 30días que la endoscopia precoz (EP), pero, como limitación principal, excluye aquellos pacientes que permanecen inestables hemodinámicamente.
El objetivo de nuestro estudio es evaluar el papel y los resultados clínicos de la EU (menor de 6horas desde admisión en urgencias) en la, así como identificar el subgrupo de pacientes de alto riesgo que podrían favorecerse de esta actitud médica.
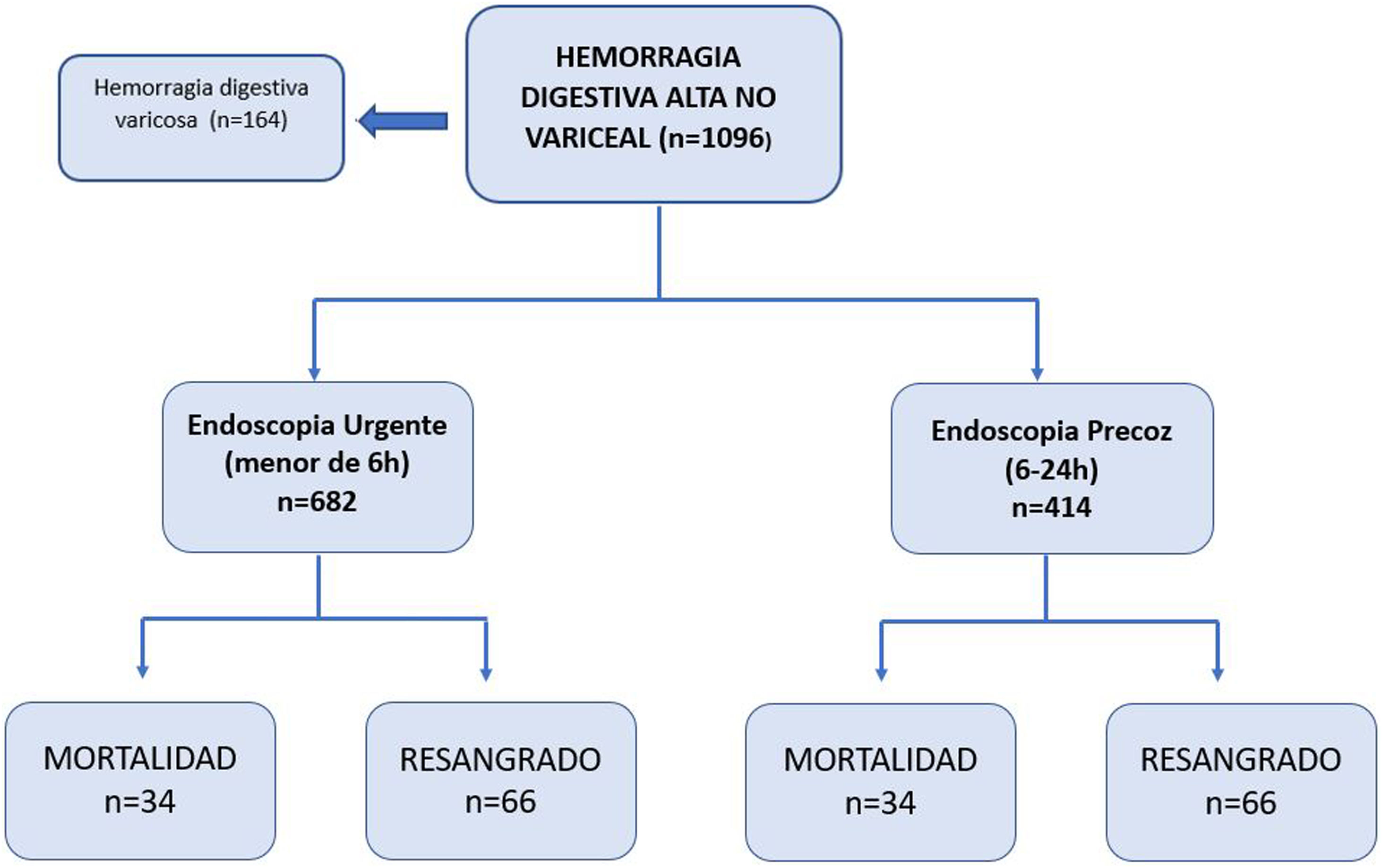
Materiales y métodosDiseño del estudio y objetivosEstudio de cohortes, prospectivo, observacional, donde se incluyen consecutivamente, desde enero de 2015 hasta mayo de 2020, todos los pacientes mayores de 18años que acuden a urgencias del Hospital Universitario La Paz (HULP), con sospecha de HDA, siendo sometidos a la realización de una endoscopia en las primeras 24horas desde su admisión en urgencias. Se excluyen del estudio aquellos pacientes en los que no existan pruebas de HDA en la endoscopia, pacientes con HDA de origen variceal, así como los pacientes con endoscopia realizada después de 24horas (fig. 1).
El tiempo de endoscopia se clasificó de acuerdo con el intervalo de tiempo entre la admisión en el servicio de urgencias y el procedimiento, de la siguiente manera: EU, menos de 6horas; EP, 6-24horas. En nuestro hospital, la endoscopia está disponible 24horas al día, 7días a la semana, dependiendo de la decisión del gastroenterólogo de guardia.
La variable principal del estudio fue la mortalidad a los 30días del ingreso hospitalario, tanto en el total de los pacientes como en los subgrupos de pacientes de alto riesgo. Como variables secundarias se estudiaron el resangrado a los 30días, la aplicación de tratamiento endoscópico, la transfusión de hemoderivados y el número de unidades transfundidas, la estancia media hospitalaria, la adecuada visualización endoscópica, la necesidad de cirugía y/o embolización.
Recogida de datos y definicionesSe extraen de los registros médicos hospitalarios los siguientes datos: edad, sexo, hora de admisión en urgencias y tiempo de endoscopia, frecuencia cardiaca (FC), presión arterial (PA), inestabilidad hemodinámica (definida por FC >100 y PAS <100), comorbilidades, cirrosis y/o malignidad (historia oncológica activa), fármacos anticoagulantes/antiagregantes; hallazgos de laboratorio como hemoglobina (Hb), INR, cifra de plaquetas. Además, se calcula la puntuación GBS y RS pre-endoscópico.
También se incluyen datos endoscópicos, estableciendo la causa del sangrado y el tipo de tratamiento aplicado, definiéndose fallo de tratamiento como la persistencia del sangrado a pesar de haber aplicado un tratamiento con finalidad hemostática.
Los pacientes de alto riesgo son aquellos con GBS ≥12 en la presentación en urgencias o quienes presentaban en la endoscopia estigmas de alto riesgo, definido por la presencia de lesiones Forrest19 I-IIB, que se benefician de la aplicación de un tratamiento hemostático endoscópico.
En nuestro estudio, la clasificación de Forrest se aplica en aquellos pacientes con patología ulcerosa (gástrica o duodenal), ya sea de causa péptica o de etiología maligna, úlceras de Cameron, úlceras en anastomosis quirúrgicas, esofagitis grave (gradoIII-IV), y síndrome de Mallory-Weiss.
El resangrado se definió como una disminución de la hemoglobina ≥2g/dl; nueva aparición de hematemesis o melena fresca, o sangrado activo visto en una nueva endoscopia. Para pacientes con un primer episodio de resangrado, la intervención endoscópica fue la primera opción de tratamiento, siendo de segunda elección la embolización o cirugía.
Análisis estadístico y consideraciones éticasLas variables cuantitativas se representarán como media ±desviación estándar, y los datos categóricos se representan como números absolutos y porcentajes. Las comparaciones, en el caso de las variables continuas, se realizarán mediante la t de Student y los datos categóricos se compararán mediante el test de chi-cuadrado (χ2). La significación estadística queda establecida en un nivel de p<0,05.
Los resultados de regresión logística univariante y multivariante se resumieron estimando la razón de posibilidades (OR) y su respectivo intervalo de confianza (IC) del 95%. De las características clínicas basales, solo aquellas con un valor de p<0,10, según el análisis univariante, serán consideradas para el modelo multivariante.
Para cálculos de supervivencia y representación gráfica se empleará el análisis estadístico Kaplan-Meier. Los cálculos fueron realizados mediante el programa SPSS Statics 24 (IBM). El estudio fue aprobado por el Comité de Ética de Investigación del HULP (Madrid, España).
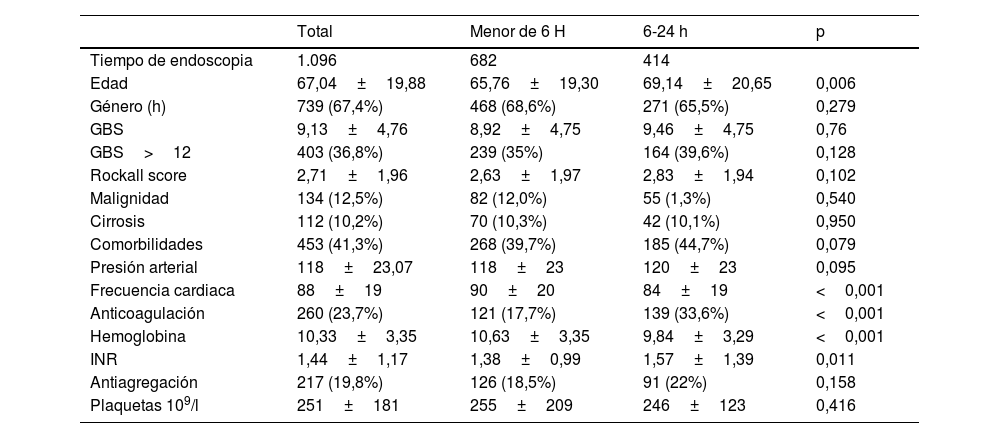
ResultadosCaracterísticas basales y datos endoscópicosSe incluyeron un total de 1.096 pacientes, de los cuales 682 (62,2%) se sometieron a EU. La edad media fue de 67±19,8 años, presentando el grupo de EU una menor edad media (p=0,006). Las melenas fue la forma de presentación más frecuente (n=561, 51,2%).
La presencia de comorbilidades, la malignidad y la cirrosis fueron observadas en el 41,3%, el 12,5% y el 10,2% de los pacientes, respectivamente; sin diferencias entre ambos grupos. Un total de 260 pacientes estaban en tratamiento con anticoagulantes (23,7%), con un mayor porcentaje en el grupo de EP (p=0,001), siendo los más utilizados los antagonistas de la vitaminaK (15,8%), sin diferencias en el empleo de fármacos antiagregantes (n=217, 19,8%).
No hubo diferencias significativas en GBS ni RS, ni PA ni en el porcentaje de pacientes de alto riesgo (35% vs 39,6%, p=0,102) entre grupos; no obstante, la FC tiende a ser a mayor en los pacientes de EU (90±20 vs 84±19; p=0,001) (tabla 1).
Características basales de los pacientes
| Total | Menor de 6 H | 6-24 h | p | |
|---|---|---|---|---|
| Tiempo de endoscopia | 1.096 | 682 | 414 | |
| Edad | 67,04±19,88 | 65,76±19,30 | 69,14±20,65 | 0,006 |
| Género (h) | 739 (67,4%) | 468 (68,6%) | 271 (65,5%) | 0,279 |
| GBS | 9,13±4,76 | 8,92±4,75 | 9,46±4,75 | 0,76 |
| GBS>12 | 403 (36,8%) | 239 (35%) | 164 (39,6%) | 0,128 |
| Rockall score | 2,71±1,96 | 2,63±1,97 | 2,83±1,94 | 0,102 |
| Malignidad | 134 (12,5%) | 82 (12,0%) | 55 (1,3%) | 0,540 |
| Cirrosis | 112 (10,2%) | 70 (10,3%) | 42 (10,1%) | 0,950 |
| Comorbilidades | 453 (41,3%) | 268 (39,7%) | 185 (44,7%) | 0,079 |
| Presión arterial | 118±23,07 | 118±23 | 120±23 | 0,095 |
| Frecuencia cardiaca | 88±19 | 90±20 | 84±19 | <0,001 |
| Anticoagulación | 260 (23,7%) | 121 (17,7%) | 139 (33,6%) | <0,001 |
| Hemoglobina | 10,33±3,35 | 10,63±3,35 | 9,84±3,29 | <0,001 |
| INR | 1,44±1,17 | 1,38±0,99 | 1,57±1,39 | 0,011 |
| Antiagregación | 217 (19,8%) | 126 (18,5%) | 91 (22%) | 0,158 |
| Plaquetas 109/l | 251±181 | 255±209 | 246±123 | 0,416 |
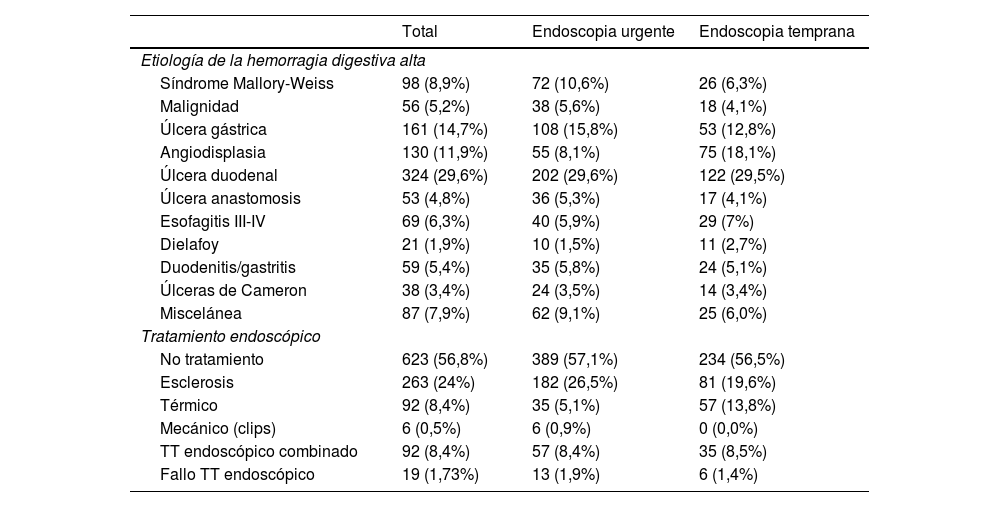
Los datos endoscópicos se muestran en la tabla 2. Entre las causas más frecuentes de sangrado se encuentran las úlceras gástricas en 161(14,7%) y duodenales en 324 (29,4%), seguidas de angiodisplasia/ectasia vascular en 130 (11,9%). El tratamiento endoscópico más empleado fue la utilización de agentes esclerosantes (24%), seguido de la combinación de dos métodos hemostáticos (8,7%). En el grupo de EU se objetivan más a menudo estigmas de alto riesgo endoscópico (Forrest I-IIB) (50,1% vs 39,5%; p=0,006). A pesar de ello, no hubo diferencias en la necesidad de aplicación de tratamiento endoscópico entre ambos grupos, lo cual es debido en gran medida a la mayor prevalencia de hemorragia digestiva secundaria a patología vascular (angiodisplasias, gastropatía, hipertensión portal) en el grupo de EP (8,1 vs 18,1%)
Causas y tratamiento de la hemorragia digestiva alta
| Total | Endoscopia urgente | Endoscopia temprana | |
|---|---|---|---|
| Etiología de la hemorragia digestiva alta | |||
| Síndrome Mallory-Weiss | 98 (8,9%) | 72 (10,6%) | 26 (6,3%) |
| Malignidad | 56 (5,2%) | 38 (5,6%) | 18 (4,1%) |
| Úlcera gástrica | 161 (14,7%) | 108 (15,8%) | 53 (12,8%) |
| Angiodisplasia | 130 (11,9%) | 55 (8,1%) | 75 (18,1%) |
| Úlcera duodenal | 324 (29,6%) | 202 (29,6%) | 122 (29,5%) |
| Úlcera anastomosis | 53 (4,8%) | 36 (5,3%) | 17 (4,1%) |
| Esofagitis III-IV | 69 (6,3%) | 40 (5,9%) | 29 (7%) |
| Dielafoy | 21 (1,9%) | 10 (1,5%) | 11 (2,7%) |
| Duodenitis/gastritis | 59 (5,4%) | 35 (5,8%) | 24 (5,1%) |
| Úlceras de Cameron | 38 (3,4%) | 24 (3,5%) | 14 (3,4%) |
| Miscelánea | 87 (7,9%) | 62 (9,1%) | 25 (6,0%) |
| Tratamiento endoscópico | |||
| No tratamiento | 623 (56,8%) | 389 (57,1%) | 234 (56,5%) |
| Esclerosis | 263 (24%) | 182 (26,5%) | 81 (19,6%) |
| Térmico | 92 (8,4%) | 35 (5,1%) | 57 (13,8%) |
| Mecánico (clips) | 6 (0,5%) | 6 (0,9%) | 0 (0,0%) |
| TT endoscópico combinado | 92 (8,4%) | 57 (8,4%) | 35 (8,5%) |
| Fallo TT endoscópico | 19 (1,73%) | 13 (1,9%) | 6 (1,4%) |
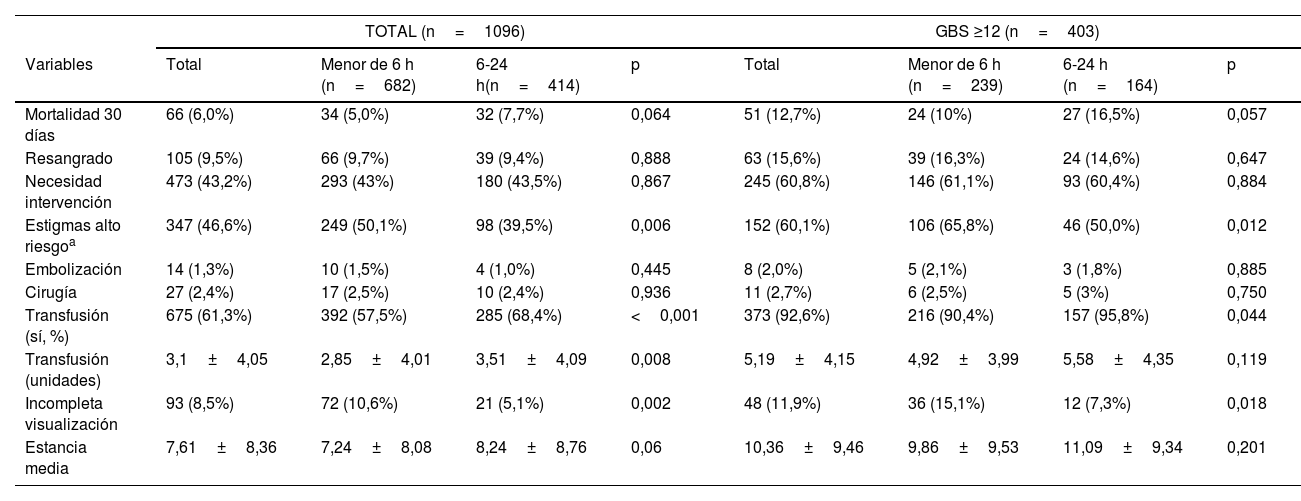
La mortalidad total a los 30 días fue del 6% (n=66), siendo menor en el grupo de EU (5% vs 7,7%), aunque sin diferencias estadísticamente significativas entre ambos grupos (p=0,064). La tasa de resangrado fue del 9,5% (n=105), sin diferencias entre los grupos de EU y EP (9,7% vs 9,4%; p=0,888). La causa más frecuente de resangrado fue la úlcera duodenal (45,7%). Se realizó cirugía en 27 pacientes (2,4%), sin diferencias entre ambos grupos (2,5% vs 2,4%; p=0,936), ni tampoco en la necesidad de tratamiento endoscópico (43% vs 43,5%, p=0,867) ni embolización (1,5% vs 1%; p=0445).
La EU se asoció significativamente a unas menores necesidades transfusionales. Un menor porcentaje de pacientes requirió transfusión de hemoderivados (57,5% vs 68,4%, p<0,001) y un menor número de unidades transfundidas (2,85±4,01 vs 3,51±4,09, p=0,008) que los pacientes con EP. La EU tuvo, más frecuentemente, una incompleta visualización endoscópica (10,5%, p=0,002). La estancia media muestra una tendencia a ser mayor en los pacientes del grupo EP (7,24±8,08 vs 8,24±8,76; p=0,06), aunque sin significación estadística (tabla 3).
Resultados clínicos totales y pacientes gbs ≥12
| TOTAL (n=1096) | GBS ≥12 (n=403) | |||||||
|---|---|---|---|---|---|---|---|---|
| Variables | Total | Menor de 6 h (n=682) | 6-24 h(n=414) | p | Total | Menor de 6 h (n=239) | 6-24 h (n=164) | p |
| Mortalidad 30 días | 66 (6,0%) | 34 (5,0%) | 32 (7,7%) | 0,064 | 51 (12,7%) | 24 (10%) | 27 (16,5%) | 0,057 |
| Resangrado | 105 (9,5%) | 66 (9,7%) | 39 (9,4%) | 0,888 | 63 (15,6%) | 39 (16,3%) | 24 (14,6%) | 0,647 |
| Necesidad intervención | 473 (43,2%) | 293 (43%) | 180 (43,5%) | 0,867 | 245 (60,8%) | 146 (61,1%) | 93 (60,4%) | 0,884 |
| Estigmas alto riesgoa | 347 (46,6%) | 249 (50,1%) | 98 (39,5%) | 0,006 | 152 (60,1%) | 106 (65,8%) | 46 (50,0%) | 0,012 |
| Embolización | 14 (1,3%) | 10 (1,5%) | 4 (1,0%) | 0,445 | 8 (2,0%) | 5 (2,1%) | 3 (1,8%) | 0,885 |
| Cirugía | 27 (2,4%) | 17 (2,5%) | 10 (2,4%) | 0,936 | 11 (2,7%) | 6 (2,5%) | 5 (3%) | 0,750 |
| Transfusión (sí, %) | 675 (61,3%) | 392 (57,5%) | 285 (68,4%) | <0,001 | 373 (92,6%) | 216 (90,4%) | 157 (95,8%) | 0,044 |
| Transfusión (unidades) | 3,1±4,05 | 2,85±4,01 | 3,51±4,09 | 0,008 | 5,19±4,15 | 4,92±3,99 | 5,58±4,35 | 0,119 |
| Incompleta visualización | 93 (8,5%) | 72 (10,6%) | 21 (5,1%) | 0,002 | 48 (11,9%) | 36 (15,1%) | 12 (7,3%) | 0,018 |
| Estancia media | 7,61±8,36 | 7,24±8,08 | 8,24±8,76 | 0,06 | 10,36±9,46 | 9,86±9,53 | 11,09±9,34 | 0,201 |
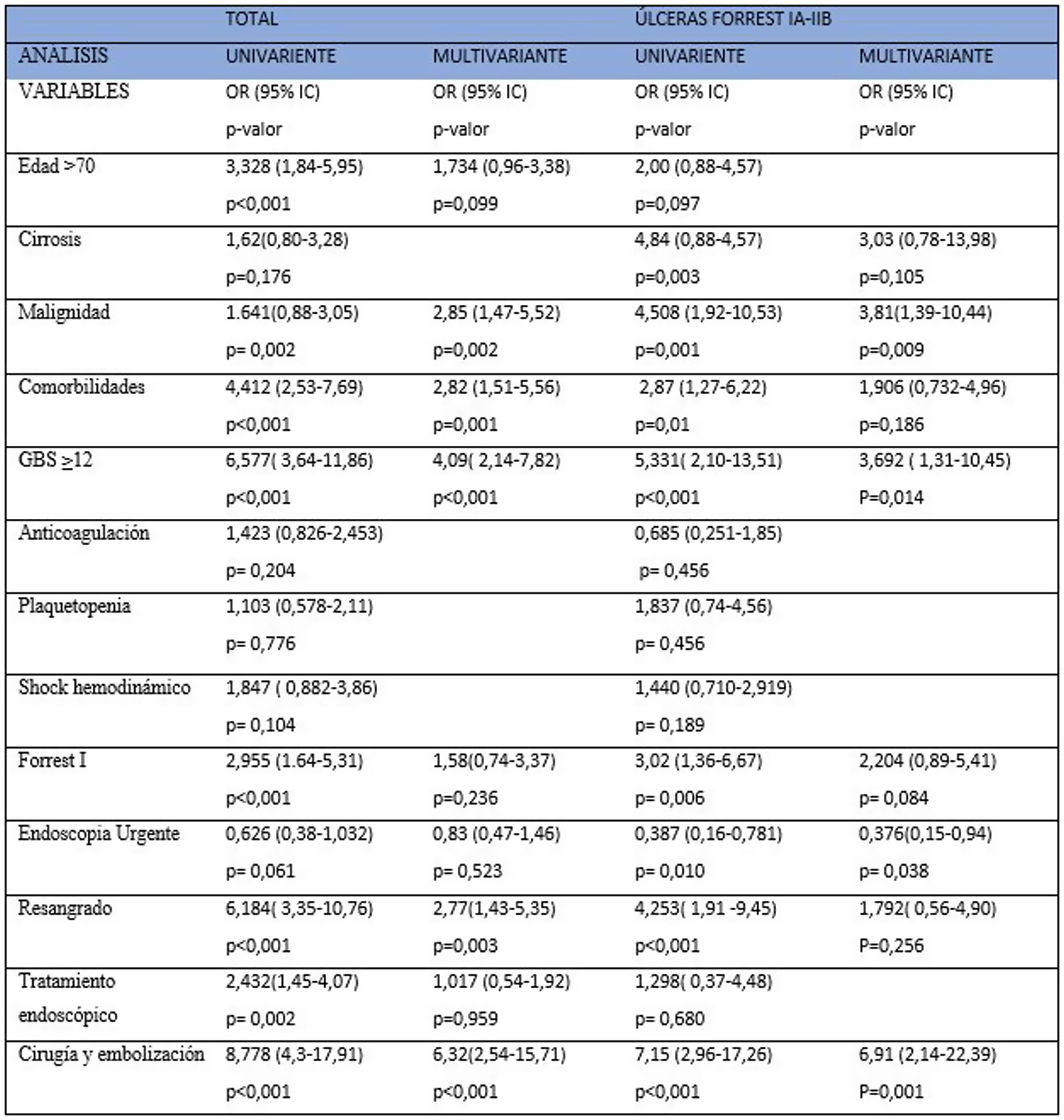
Tras ajustar entre las diferentes variables, en el análisis multivariante, la malignidad (OR=1,641; IC95%: 0,88-3,05); p=0,002), las comorbilidades (OR=4,412; IC95%: 2,53-7,69; p<0,001), la GBS ≥12 (OR=6,577; IC95%: 3,64-11,86; p<0,001), el resangrado (OR=2,77; IC95%: 1,43-5,35; p=0,003), y asimismo la necesidad de cirugía y embolización (OR=6,32; IC95%: 2,54-15,71; p<0,001), permanecen como factores independientes predictivos de mortalidad. Los resultados del análisis univariante y multivariante se presentan en la figura 2.
Subgrupos de alto riesgoGBS ≥ 12Este subgrupo está integrado por 403 pacientes (59% EU), sin diferencias en las características basales, salvo un mayor porcentaje de pacientes con comorbilidades (27,6% vs 39,9%; p=0,017) y anticoagulado en el grupo de EP (51,5% vs 62,2%; p=0,033).
Se observó una mortalidad del 12,7%, en el grupo de EU del 10% (p=0,057), y un resangrado del 15,6% (16,3% vs 14,6%; p=0,647). No hubo diferencias en la necesidad de tratamiento endoscópico, cirugía y/o embolización, ni en la estancia media hospitalaria, pero sí que un menor porcentaje de pacientes de la EU necesitó ser transfundido (90,4% vs 95,8%, p=0,044).
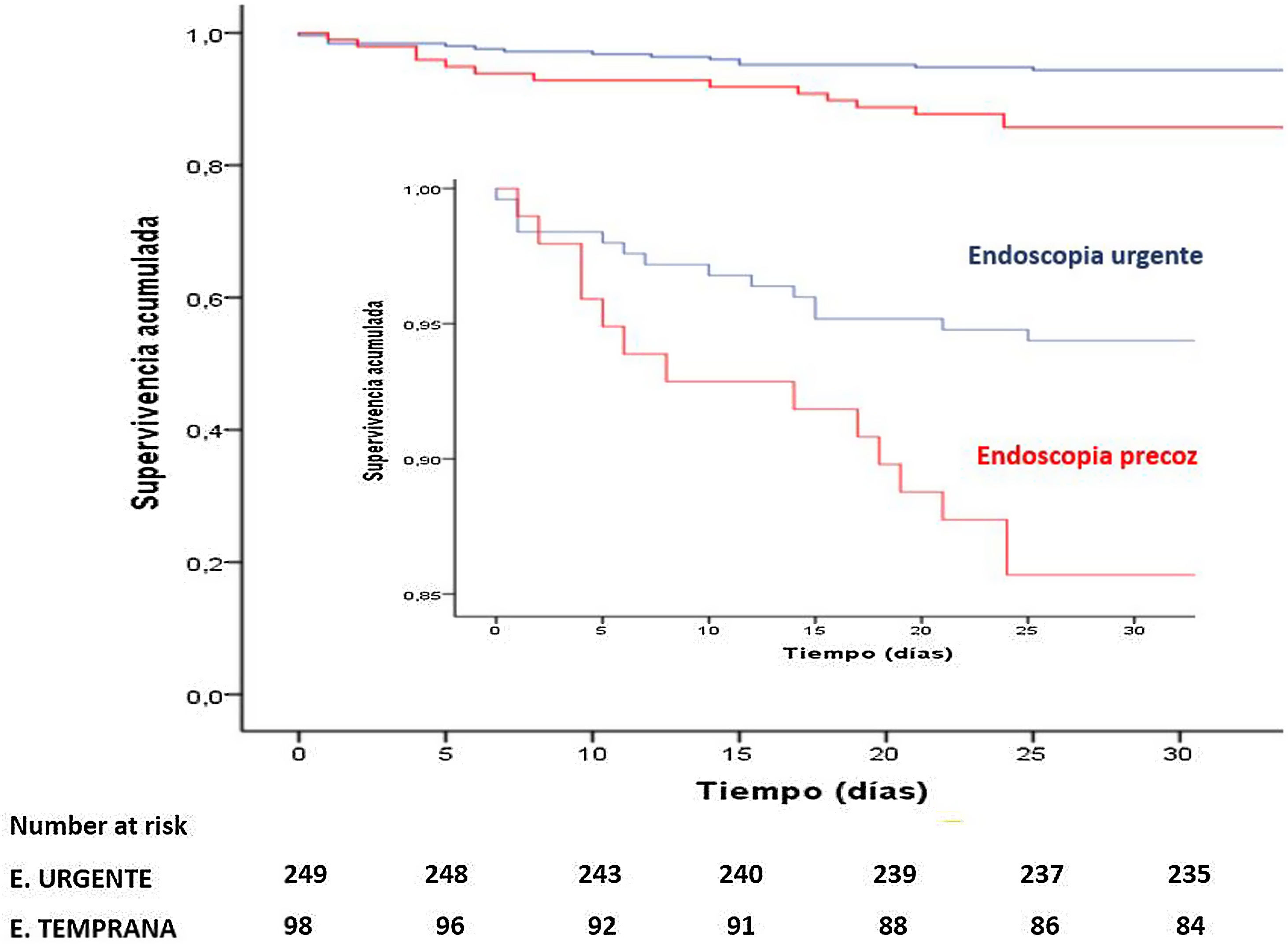
Forrest I-IIBEste subgrupo está constituido por 347 pacientes, 249 (71,7%) pertenecen al grupo de EU, sin diferencias en las principales características basales objeto de estudio, salvo un 35,7% de pacientes anticoagulados en el grupo de EP, frente al 18,9% de la EU (p=0,001). La mortalidad observada fue de 28 pacientes (8,1%), menor en el grupo de EU (5,6% vs 14,3%), con diferencias estadísticamente significativas entre grupos (p=0,008). El análisis de Kaplan-Meier mostró significativamente mayor supervivencia en aquellos que se sometieron a endoscopia dentro de las seis primeras horas (p=0,007, fig. 3). No hubo diferencias en la tasa de resangrado (19,3%, p=0,0352), en la estancia media hospitalaria (p=0,23), en la necesidad de tratamiento endoscópico (86,3% vs 92,9%; p=0,091), en la cirugía (p=0,857) y/o en la embolización (p=0,837). Sin embargo, el grupo de EU se asoció con un menor número de pacientes transfundidos (76,7% vs 88,8%, p=0,011) y un menor número de unidades transfundidas (4,0±4,6 vs 6,1±5,7; p<0,001). Además, en el análisis multivariante (fig. 2) la EU fue un predictor significativo independiente de menor mortalidad [OR=0,376; IC95%: 0,15-0,94; p=0,038).
DiscusiónEn este estudio de cohortes de 1.096 pacientes con HDA aguda no variceal, con una tasa de mortalidad total del 6,0% y resangrado del 9,4%, encontramos que la EU no condujo a una mortalidad, de resangrado, de tratamiento endoscópico, de estancia media, de necesidad de cirugía y/o de embolización menor que la EP; sin embargo, sí requirieron menores necesidades transfusionales, con las implicaciones clínicas y económicas que ello conlleva, datos que concuerdan con el estudio de Lin et al.20. Además, porcentualmente, observamos más muertes en el grupo EP, con una diferencia intergrupal en la mortalidad del 2,7%.
En el análisis de subgrupo tampoco se hallaron diferencias en los pacientes con GBS ≥12. En contraposición, los pacientes con lesiones ForrestI-IIB, el tiempo transcurrido hasta la endoscopia fue un predictor independiente significativo de mortalidad, asociándose la realización de endoscopia en las primeras seis horas con una menor mortalidad.
El papel de la EU en la HDA aguda sigue sin estar claramente definido. Para pacientes con alto riesgo, un grupo de consenso internacional no hace una recomendación a favor o en contra de la realización de endoscopia en las primeras 6-12horas21.
En los últimos años se han publicado varios estudios que han investigado la influencia del tiempo de la endoscopia sobre los resultados clínicos en pacientes con HDA, con conclusiones muy dispares. En algunos de estos estudios, la EU no mostró beneficios clínicos22-26, incluso se asocia con peores resultados27,28. De estos últimos destacamos el estudio prospectivo realizado por Laursen et al.29 en pacientes con inestabilidad hemodinámica (n=2.933), en el que la endoscopia realizada en el período de 6-24horas se asoció con una menor mortalidad hospitalaria (OR=0,73; IC95%: 0,54-0,98).
Por el contrario, cabe mencionar el estudio de Lim et al.30, en el cual la EU está asociada con menor mortalidad en el subgrupo de pacientes de alto riesgo (GBS ≥12), pero no en pacientes de bajo riesgo. La explicación es que solo un cuarto de los pacientes con GBS ≤12 tenían estigmas endoscópicos de alto riesgo, en comparación con el 70% de alto riesgo. Como solo una minoría de pacientes de bajo riesgo se beneficiaría del tratamiento endoscópico, no se esperaría que la endoscopia urgente mejorase los resultados clínicos.
Basándonos en esta premisa, seleccionamos a estos pacientes con estigmas endoscópicos de alto riesgo, empleando para ello la clasificación de Forrest (I-IIB), definidos por la presencia de lesiones que se benefician de la aplicación de terapéutica endoscópica; como así corroboran los datos de nuestro estudio, donde la gran mayoría de los pacientes necesitaron tratamiento endoscópico (88,3%). Para nuestro conocimiento, es el primer estudio que investiga los resultados de este subgrupo de pacientes, en los cuales la EU se asoció de manera estadísticamente significativa a una menor mortalidad, menor número de pacientes transfundidos y menor número de concentrados transfundidos.
De acuerdo con nuestros resultados, el hecho de que el grupo de EU necesitó menos requerimientos transfusionales, tanto en el total de los pacientes como en los subgrupos, puede explicarse, desde nuestro punto de vista, en que la aplicación de un tratamiento hemostático endoscópico precoz, con el consiguiente cese del sangrado, tendría repercusión sobre el nivel de Hb y se traduciría en menores necesidades transfusionales.
Nuestro estudio tiene varias limitaciones; principalmente se trata de un estudio observacional, sin aleatorización. Adicionalmente, no se pueden excluir factores de confusión relacionados con el paciente que no fueron estudiados. Sin embargo, para abordar posibles diferencias entre los grupos, mostramos que el GBS, la presencia de comorbilidad, la malignidad y las demás características basales no fueron significativamente diferente en los grupos. Un mayor número de pacientes del grupo de EP se encontraban anticoagulados; sin embargo, dicha anticoagulación no se relaciona de manera significativa con la mortalidad en el análisis univariante, siendo poco probablemente un factor de confusión.
Como conclusión, la EU no se asoció significativamente a una menor mortalidad, ni en el total de pacientes ni en el subgrupo GBS ≥12, pero sí a menores requerimientos transfusionales. Sin embargo, en los pacientes con lesiones ForrestI-IIB la EU fue un predictor independiente significativo de menor mortalidad. La función de la EU en la HDA no varicosa es aún discutida, siendo necesarios más estudios, aleatorizados, que identifiquen adecuadamente a los pacientes, de manera pre-endoscópica, que puedan beneficiarse de esta actitud médica.
FinanciaciónNo se ha recibido financiación para la realización de este trabajo.
Contribución de los autoresJavier Lucas Ramos: investigación, recogida de datos, redacción, edición.
Jorge Yebra Carmona: investigación, recogida de datos.
Irene Andaluz García: investigación, recogida de datos.
Marta Cuadros Martínez: recogida de datos.
Patricia Mayor Delgado: recogida de datos.
Maria Ángeles Ruiz Ramírez: recogida de datos.
Joaquín Poza Cordón: metodología, diseño, edición.
Cristina Suárez Ferrer: metodología, diseño, edición, investigación.
Ana Delgado Suárez: investigación, edición.
Nerea Gonzalo Bada: redacción-revisión.
Consuelo Froilán Torres: redacción-revisión.
Conflicto de interesesLos autores confirman que no existe ninguna relación financiera o personal con otras personas u organizaciones que pudiera dar lugar a un conflicto de intereses en relación con este estudio.