Después de casi 20 años utilizando la elastografía de transición para el diagnóstico no invasivo de la fibrosis hepática, su uso se ha extendido al cribado poblacional, la evaluación de la esteatosis y las complicaciones de la cirrosis. Por ello, la «Societat Catalana de Digestologia» encargó a un grupo de expertos actualizar el primer Documento realizado en 2011.
Material y métodosEl grupo de trabajo (8 médicos y 4 enfermeras) elaboró un panel de preguntas en base a la encuesta online «Elastografía Hepática en Cataluña 2022» siguiendo la estructura PICO y el método Delphi.
ResultadosLas respuestas se presentan con el nivel de evidencia, el grado de recomendación y el consenso final tras ser evaluadas por 2 revisores externos.
ConclusiónLa elastografía de transición utiliza el método elastográfico más sencillo y fiable para cuantificar la fibrosis hepática, evaluar la esteatosis y conocer el riesgo de complicaciones en pacientes con cirrosis. El documento ha sido avalado por la «Societat Catalana de Digestologia» y el «Col legi Oficial d’Infermeres i Infermers de Barcelona».
After almost 20 years using transient elastography (TE) for the non-invasive diagnosis of liver fibrosis, its use has been extended to population screening, evaluation of steatosis and complications of cirrhosis. For this reason, the «Catalan Society of Gastroenterology» commissioned a group of experts to update the first document carried out in 2011.
Material and methodsThe working group (8 doctors and 4 nurses) prepared a panel of questions based on the online survey «Hepatic Elastography in Catalonia 2022» following the PICO structure and the Delphi method.
ResultsThe answers are presented with the level of evidence, the degree of recommendation and the final consensus after being evaluated by two external reviewers.
ConclusionTransient elastography uses the simplest and most reliable elastographic method to quantify liver fibrosis, assess steatosis, and determine the risk of complications in patients with cirrhosis. The document has been endorsed by the “Catalan Society of Gastroenterology” and the “Col·legi Oficial d’Infermeres i Infermers de Barcelona”.
La elastografía de transición (ET) se describió por primera vez en el año 20031. Su técnica y utilidad diagnóstica se resumió en el primer Documento de Posicionamiento de la «Societat Catalana de Digestologia» (SCD)2. Desde entonces, múltiples estudios y revisiones han demostrado que es un método no invasivo sencillo y fiable para cuantificar la rigidez del hígado y el método de referencia para evaluar de forma no invasiva la fibrosis hepática3. Después de casi 20 años, su uso se ha extendido como herramienta de cribado y de evaluación de la esteatosis hepática y como una buena técnica para identificar las complicaciones de la cirrosis. Ante esta importante diversificación de la ET, la SCD ha creído conveniente actualizar de forma práctica y simplificada los conceptos más importantes del uso de la ET en nuestra práctica diaria.
Material y métodosLa SCD encargó a un grupo de expertos con ejercicio profesional en Cataluña, algunos de los cuales ya habían participado en el documento de consenso previo2, actualizar e intentar responder de forma simplificada a las preguntas más frecuentes y controvertidas que nos encontramos en la práctica clínica diaria sobre el uso de la ET.
Para conocer el grado de penetración de la técnica en nuestro territorio, se contó con la colaboración de la SCD. Tras obtener la autorización de la Junta Directiva, se elaboró una encuesta online con el título «Elastografia Hepàtica a Catalunya 2022»4 de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). La secretaria técnica de la SCD envió por correo la dirección URL a todos los miembros de la sociedad. El registro de las respuestas se realizó de forma anónima. Tan solo JAC tiene acceso al registro individual de las respuestas.
En base a la encuesta se realizó un panel de preguntas claves siguiendo la metodología adoptada por la «European Association for Study of the Liver» (EASL) según la estructura «PICO» (P: Paciente, Población o Problema; I: Intervención, Factor pronóstico, o Exposición; C: Comparación o Intervención; O: «Outcome» o Resultado)5. El panel de preguntas se agrupó en 6 apartados diferentes.
Los coordinadores del documento (JAC y XF) definieron los criterios para la selección del panel de revisores. El número de revisores debía cumplir tres criterios: 1/ dos revisores por sección, 2/ una tercera parte de enfermeras, 3/ dos revisores externos. La composición del panel se realizó en base a la experiencia en elastografía y enfermedades crónicas del hígado y la distribución geográfica. La participación en el primer documento de consenso no fue una condición indispensable2, por lo que el grupo de trabajo lo formaron ocho médicos digestólogos-hepatólogos y cuatro enfermeras expertas en la realización e interpretación de la técnica. Se asignó al menos un par de expertos a cada temática: un apartado técnico (JAC, AA), uno de recomendaciones para la correcta realización de la ET (RF, TM, LM, MCB), tres apartados clínicos orientados a su uso como herramienta de cribado (IG, RMM), diagnóstica (JMP, MV) y pronóstica (MP, XF), y un apartado para la correcta interpretación de los resultados (RF, TM, LM, MCB).
La revisión de la temática de cada pregunta se debía realizar de acuerdo con el método Delphi5 para conseguir el máximo consenso académico. Cada respuesta incluyó el nivel de evidencia (A, B o C), el grado de recomendación (fuerte o débil) y el consenso alcanzado entre los expertos (de 0/8 a 8/8). Finalmente, todo el contenido fue evaluado por 2 revisores externos, expertos hepatólogos (JG y PG) y se adecuaron las recomendaciones finales y el grado de consenso (máximo 10/10) a sus indicaciones.
Parte 1. Características técnicas de la elastografía de transición¿Qué técnica utiliza la ET para cuantificar la rigidez del hígado?La elastografía es una técnica radiológica que permite medir la propagación de las ondas en los tejidos, producidas por una fuerza mecánica o acústica. Las ondas de propagación transversales u ondas de cizalladura (o «shear-wave») se desplazan a una velocidad (m/s) que es más rápida cuanto más rígido es el tejido (kPa)6. La forma más natural de producir esta onda es mediante una fuerza mecánica y la forma más sencilla de cuantificar su velocidad de propagación por el hígado es por medio de la ET.
La ET se describió por primera vez en el año 20031. Las bases técnicas de la ET se recogieron ampliamente en el primer documento de consenso sobre ET de la SCD2. Desde entonces múltiples estudios y revisiones han demostrado que es un método no invasivo sencillo y fiable para cuantificar la rigidez del hígado y, por tanto, el método de referencia para cuantificar de forma no invasiva la fibrosis hepática3.
RESPUESTA. La ET utiliza el método elastográfico más sencillo y fiable para cuantificar la rigidez del hígado y por tanto es el método de referencia para cuantificar de forma no invasiva la fibrosis hepática. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
¿Cómo son los otros métodos de elastografía?La onda de propagación se puede producir mediante una fuerza acústica en un punto determinado («point-Shear Wave Elastography» o p-SWE) o en un área más amplia (2D-SWE)7. Existen multitud de aparatos ecográficos que incorporan el software necesario para medir la velocidad de las ondas «shear-wave» (m/s) y proporcionalmente la rigidez del hígado (kPa).
La elastografía por resonancia magnética (RME) se describió por primera vez en 20068. La RME utiliza un transductor que emite ondas mecánicas de baja frecuencia en el hígado. Las imágenes se procesan para obtener los mapas de viscosidad y elasticidad. La elasticidad se expresa en kPa y los valores son significativamente más bajos que con otras técnicas elastográficas8. La RME tiene la ventaja de que evalúa todo el parénquima hepático, pero es una exploración cara que requiere la participación del servicio de radiología, de material y software específico y tiene limitaciones en pacientes con claustrofobia o sobrecarga férrica del hígado, motivos por los que la RME ha tenido una implementación muy limitada en nuestro medio.
La SWE (p-SWE y 2D-SWE) ha demostrado una mayor aplicabilidad para evaluar a pacientes con ascitis u obesidad. Sin embargo, tiene limitaciones compartidas con la ET, como son la necesidad de ayuno, la sobreestimación de los valores obtenidos en caso de elevación de transaminasas, colestasis o hígado congestivo y la dificultad para diferenciar estadios intermedios de fibrosis9. Por otra parte, todavía no están bien definidos los criterios de calidad y no se ha demostrado su valor pronóstico en pacientes con cirrosis hepática.
RESPUESTA. Los otros métodos elastográficos son más complejos, comparten limitaciones con la ET, y han sido menos evaluados en nuestro medio, por lo que no pueden considerarse de referencia. Nivel de evidencia B. Recomendación fuerte. Consenso 8/10.
¿Qué es el CAP y para qué sirve?El CAP o «Controlled Attenuation Parameter» es el parámetro de atenuación controlada de los ultrasonidos (CAP) diseñado para detectar y cuantificar el grado de atenuación que presentan los ultrasonidos al pasar por un tejido. Su desarrollo se orientó en la cuantificación del grado de esteatosis hepática utilizando la estimación de la atenuación ultrasónica. El CAP se validó por primera vez en el año 2010, tomando el grado histológico de esteatosis como referencia, demostrando una correlación muy buena (Spearman ρ=0,81), con una fiabilidad diagnóstica medida por la curva ROC para identificar esteatosis de más de un 10% y de más de un 33% de 0,91 y de 0,95, respectivamente10.
Desde entonces, múltiples estudios y revisiones han demostrado que es un método no invasivo sencillo y fiable para estimar la esteatosis en pacientes con hepatitis virales, aunque la obesidad puede ser un importante factor de confusión en pacientes con enfermedad por hígado graso11.
RESPUESTA. El CAP o parámetro de atenuación controlada de los ultrasonidos permite evaluar de forma no invasiva la esteatosis hepática. Nivel de evidencia A. Recomendación fuerte. Consenso 9/10.
¿Para qué sirve la sonda XL y cuándo debemos utilizarla?Dado que uno de los factores más frecuentes en pacientes con esteatosis es la obesidad, en 2010 se validó el uso de una nueva sonda diseñada específicamente para pacientes obesos (con un índice de masa corporal [IMC]>30kg/m2). Esta sonda XL produce una onda mecánica con una mayor amplitud de vibración y con una distancia focal más profunda (3,5cm por debajo de la piel) que permite obtener resultados en pacientes donde la sonda M (distancia focal 2,5cm) no llega y por tanto aumenta la aplicabilidad de la ET12. Además, la sonda XL aumenta la fiabilidad diagnóstica de la ET en pacientes obesos porque sus valores se correlacionan mejor con el estadio de fibrosis que cuando son evaluados con la sonda M13. Dado que los valores que obtiene la sonda M en pacientes con obesidad son erróneamente más elevados y en algunos de ellos no se obtienen resultados, la sonda M no se debe utilizar en pacientes con IMC>35. En pacientes con IMC de 30-35 puede utilizarse la sonda M si la distancia entre la piel y la cápsula hepática medida por ecografía es inferior a 2,5cm. La selección del tipo de sonda también se puede realizar de acuerdo a las recomendaciones del software «automated probe selection tool» (auto-PS) del FibroScan® que reconoce la distancia piel-cápsula. Para ello, se debe iniciar la exploración con el auto-PS desde la sonda M y seguir su recomendación, pero cambiar a la sonda XL si surgen mediciones no válidas o poco fiables14.
RESPUESTA. La sonda XL permite obtener valores fiables de ET y CAP en pacientes con distancia piel-cápsula>2,5cm, en pacientes obesos o cuando el sistema automático de reconocimiento lo recomiende. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Se puede evaluar la rigidez del bazo con la ET?Una alternativa a la medida de la rigidez del hígado mediante ET, en pacientes con sospecha de hipertensión portal, es la elastografía en el bazo («Spleen Stiffness», SS). La SS ha demostrado una buena correlación con el gradiente de presión venoso hepático (GPVH), que es de elección para evaluar la presión portal. Los valores de SS son 3 veces más elevados que los valores de ET en el hígado y una SS<41,3kPa excluye la presencia de varices esofágicas15. Pero dado que existen pacientes que superan el límite de detección de 75kPa, en 2018 se desarrolló una sonda M para medir la SS que emite ondas a 100MHz, produciendo una reducción significativa de los valores16. A pesar de que existen metaanálisis evaluando la fiabilidad diagnóstica de la ET con sonda M (50MHz) para determinar la SS, todavía son limitados los estudios que utilizan la sonda M (100MHz). Por tanto, los valores de referencia podrían cambiar en el futuro17.
RESPUESTA. Aún son limitados los estudios que utilizan la sonda M (100MHz) para evaluar la rigidez del bazo, por lo que su utilidad y los valores de referencia están por definir. Nivel de evidencia C. Recomendación débil. Consenso 10/10.
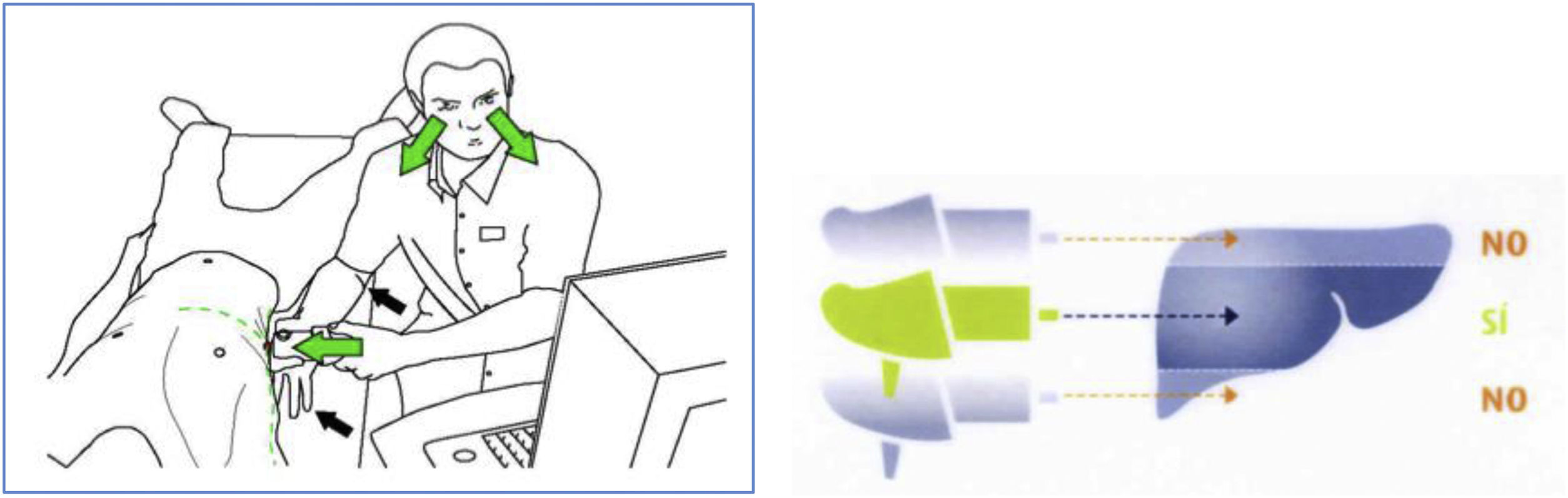
Parte 2. Recomendaciones para hacer una elastografía de calidad¿Cómo conseguir valores de ET fiables?Existen variables que podemos controlar antes y durante la prueba para conseguir una exploración de calidad (tabla 1)18. Se ha demostrado que la experiencia del operador y la calidad del examen influyen en el resultado de la rigidez hepática. La ingesta puede aumentar hasta un 26% y el ejercicio hasta un 52% los valores de ET, por lo que es recomendable el ayuno de al menos 3h y el reposo de al menos 5min antes de realizar la prueba. Las maniobras de Valsalva aumentan la rigidez hepática, mientras que la abstinencia del consumo de alcohol se asocia a una disminución de los resultados. La posición del paciente, el punto de medida y el tipo de sonda deben elegirse correctamente (fig. 1). La técnica debe ser cuidadosa y el tipo de sonda el correcto. La experiencia del explorador es importante independientemente del profesional sanitario que realice la técnica19, pero la curva de aprendizaje se logra antes que con otros métodos guiados por ecografía20. Se debe saber reconocer el patrón elastográfico típico del hígado (fig. 2.1) y descartar las imágenes con artefactos (figs. 2.2.B, 2.3.B y 2.4.B). Durante la realización de la prueba se deben comprobar las medidas individuales y debe respetarse el criterio de mínima dispersión, descartando aquellos resultados que tengan una dispersión superior al 30%. En el caso de que la exploración no alcance los estándares de calidad, se debe indicar dicha información en el documento y valorar la posibilidad de repetirla si se puede controlar el factor que influye en el resultado.
Recomendaciones para realizar una elastografía de calidad
| Recomendaciones generales |
| 1. Se debe mantener el ayuno un mínimo de 3h (líquidos 2h) antes de la prueba |
| 2. Antes de iniciar la prueba se debe explicar al paciente en qué consiste la técnica. Esto hace que disminuya la ansiedad del paciente y la exploración sea más fácil |
| 3. Dejar al paciente estirado 5min en reposo en la camilla antes de empezar |
| 4. La posición del paciente debe ser estirado en decúbito supino, el brazo derecho levantado y colocado detrás de la nuca, el brazo izquierdo a lo largo del cuerpo, y la pierna derecha cruzada sobre la izquierda para mantener una posición ligeramente encorvada que abra los espacios intercostales. En los pacientes que tengan dificultades para levantar el brazo derecho y colocarlo detrás de la nuca podemos poner una pequeña almohada bajo el brazo para elevarlo un poco, o indicar al paciente que cruce el brazo derecho hasta el hombro izquierdo |
| 5. Para localizar el área a examinar (fig. 1), debemos identificar la intersección entre el apéndice xifoideo y la línea media axilar derecha, frente al lóbulo hepático derecho, en el centro del parénquima hepático y lejos de los bordes del hígado |
| 6. La colocación de la sonda es muy importante. Se debe mantener la sonda perpendicular a la superficie de la piel; de lo contrario se sobreestimará la rigidez hepática |
| 7. Revisar la imagen elastográfica (fig. 2.1), modo TM y modo A. Estas 2 imágenes permiten asegurarnos de que la sonda está encima del parénquima hepático |
| Recomendaciones específicas |
| 1. En pacientes delgados o con parrilla costal muy larga, el espacio intercostal suele ser muy estrecho (fig. 2.2), por lo que se recomienda conseguir una posición ligeramente encorvada que abra los espacios intercostales, realizar las medidas en apnea para que el diafragma no se mueva y hacerlo en un espacio intercostal más bajo |
| 2. Cuando los pacientes están más nerviosos (fig. 2.3) e hiperventilan es aconsejable realizar las medidas en apnea o pedir que vayan respirando más lentamente |
| 3. En pacientes con obesidad (fig. 2.4), para mejorar la medición se puede apartar la piel hacia arriba para minimizar el grosor del tejido subcutáneo, exagerar la posición encorvada para abrir los espacios intercostales o pedir al paciente que se gire sobre el lado para facilitar la colocación de la sonda. Pedir al paciente que inspire profundamente y vaya expulsando lentamente el aire, momento en el que realizaremos las medidas. Lo correcto es realizar las medidas siempre en el mismo punto y no mover la sonda, pero en algunos casos es necesario levantar la sonda y colocarla en el mismo punto para continuar obteniendo medidas válidas. |
Ejemplos de imágenes elastográficas. (2.1) Imagen elastográfica modelo. (2.2) Imagen elastográfica en paciente delgado. A. Imagen correcta. En apnea. B. Imagen con artefactos. Respiración sin apnea. (2.3) Imagen elastográfica en paciente nervioso. A. Imagen correcta. Paciente relajado B. Imagen con artefactos. Paciente nervioso. (2.4) Imagen elastográfica en paciente obeso. A. Imagen correcta. Apnea y estirando el tejido adiposo. B. Imagen con artefactos. Respiración sin apnea.
RESPUESTA. Las recomendaciones de enfermería, la experiencia del explorador y la correcta selección de la sonda garantizan una evaluación elastográfica de calidad. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
Parte 3. Utilidad de la elastografía como herramienta de cribado¿Es útil la ET para realizar cribado de fibrosis hepática en la población general?La prevalencia de fibrosis avanzada en la población general es considerablemente menor que la prevalencia observada en la atención secundaria o terciaria, donde se han desarrollado y validado todos los métodos no invasivos para la evaluación de la fibrosis, incluyendo la ET. La precisión de una prueba varía según la prevalencia de la enfermedad. Este es el efecto de espectro, es decir, que en poblaciones de baja prevalencia la sensibilidad y el valor predictivo positivo (VPP) son más bajos. En un estudio controlado con biopsia con una población en la que el 6% presentaba fibrosis avanzada, similar a la de la población general, la ET demostró una sensibilidad del 86% y una especificidad del 97%21.
En los últimos años diferentes estudios realizados sobre todo en Europa y Asia han evaluado la utilidad de la ET para identificar a pacientes con enfermedad hepática no conocida y fibrosis significativa (F≥2)22–26. El mayor estudio en población general se realizó en nuestro entorno, en el área metropolitana de Barcelona, donde se evaluó la presencia de fibrosis hepática en más de 3.000 individuos mediante ET. La prevalencia de fibrosis hepática osciló entre el 5,8% con un punto de corte de ET de 8,0kPa, y el 3,6% con 9,0kPa22. Es interesante resaltar que las tasas más altas de fibrosis se observaron entre los sujetos con factores de riesgo de esteatosis hepática metabólica (EHmet) y sujetos con consumo de alcohol elevado. Los resultados del estudio de Caballería et al. son similares a los de otros estudios realizados en población general, donde la prevalencia de fibrosis significativa se encuentra entre el 2,5 y el 7,5% en función del punto de corte de ET utilizado (entre 7,9 y 9,6kPa). Todos estos trabajos indican que la ET es un buen método para detectar fibrosis hepática significativa en sujetos sin enfermedad hepática conocida y es útil para la detección de fibrosis en la comunidad. De hecho, el estudio del área metropolitana norte de Barcelona muestra que la ET tiene mayor precisión predictiva en comparación con el «NAFLD Fibrosis Score» o el FIB-4, lo que se ha confirmado en un estudio reciente con más de 5.000 pacientes comparando los marcadores no-invasivos serológicos y la ET27. Hay que tener en cuenta que la disponibilidad de la ET es limitada en los entornos de atención primaria, pero se ha demostrado que es coste-efectiva para hacer cribado de la fibrosis hepática, hecho que apoya su utilidad.28
RESPUESTA. La ET es una herramienta útil para realizar cribado de fibrosis hepática en la población general. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
¿Es útil la ET para realizar cribado de fibrosis hepática en pacientes con factores de riesgo?Dada la alta prevalencia de los factores de riesgo para enfermedades hepáticas crónicas y que estos factores de riesgo como son el consumo de alcohol, la obesidad y la diabetes van en aumento, nos interesa definir cuál es la población que más se beneficia de ser evaluada y derivada a la atención especializada. También debe tenerse en cuenta que para minimizar el efecto de espectro es esencial que las pruebas no invasivas para detectar fibrosis hepática se apliquen a poblaciones con factores de riesgo de enfermedad hepática más que a poblaciones no seleccionadas3. Como ya hemos comentado, en poblaciones no seleccionadas la sensibilidad y el VPP de la ET son más bajos, lo que puede optimizarse con una mejor evaluación y selección de los pacientes. La prevalencia de la fibrosis avanzada depende de los factores de riesgo de las cohortes incluidas. En el estudio de Caballería et al., la prevalencia de fibrosis hepática significativa (F≥2) entre sujetos sin factores de riesgo (obesidad, diabetes tipo 2, hiperlipidemia, hipertensión arterial, síndrome metabólico o consumo de riesgo de alcohol) fue muy baja, del 0,4%, en comparación al 5% en pacientes con uno o más factores de riesgo (p<0,001)22. Globalmente, aunque los estudios donde se ha evaluado la ET en poblaciones con factores de riesgo mayoritariamente incluyen cohortes pequeñas y heterogéneas, la prevalencia de fibrosis detectada por ET está en torno al 18-27% dependiendo del punto de corte utilizado29. Por ello, la comunidad científica recomienda realizar cribado de fibrosis a pacientes con factores de riesgo metabólico, con consumo de alcohol patológico o pacientes con infección por el virus de inmunodeficiencia humana3.
RESPUESTA. La ET es útil para realizar cribado de fibrosis hepática en sujetos con factores de riesgo de hepatopatía. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
¿Qué papel tiene la ET dentro del conjunto de todos los métodos no invasivos de los que disponemos para el cribado de fibrosis hepática en la población general?La ET tiene mejor precisión diagnóstica para detectar fibrosis hepática en el contexto del cribado que los marcadores serológicos, sobre todo en población general22, pero el cálculo de biomarcadores no comerciales utilizando parámetros analíticos es más sencillo y económico. Debe tenerse en cuenta que los biomarcadores serológicos utilizan dos puntos de corte. Valores por encima del punto de corte elevado diagnostican presencia de fibrosis significativa y valores por debajo del punto bajo descartan la presencia de fibrosis significativa. Globalmente los biomarcadores serológicos no comerciales tienen un valor predictivo negativo elevado (VPN>85%) que permite descartar la presencia de fibrosis avanzada o cirrosis con confianza pero tienen un VPP bajo para diagnosticar la presencia de fibrosis (VPP entre 40-70%)30. Además, hasta un 30% de los valores quedan en la llamada zona gris, entre los dos puntos de corte, haciendo que estos pacientes no puedan clasificarse con una fiabilidad suficiente.
Diferentes estudios han evaluado el uso secuencial de un biomarcador serológico seguido de un segundo método no invasivo (biomarcador directo o ET) y esta estrategia ha demostrado ser eficaz para detectar a más pacientes con fibrosis hepática en la población y evitar el exceso de pacientes derivados3,22. El estudio de cribado poblacional realizado en el área metropolitana de Barcelona demostró que seleccionando a los pacientes con factores de riesgo (obesidad, diabetes, consumo de alcohol) y aplicando el «Fatty Liver Index» (FLI), se disminuía la necesidad de realizar ET a solo un 35% de la población inicial y era capaz de detectar a los pacientes con fibrosis hepática. En este estudio, solo 2 pacientes de los 3.000 iniciales quedaban sin diagnosticar22. En otro ejemplo más reciente se evaluó el uso secuencial del FIB-4 seguido del «Enhance Liver Fibrosis score» (ELF), demostrando que era capaz de diagnosticar a un 30% de pacientes con fibrosis significativa y un 14% de pacientes con cirrosis comparado con solo un 8% y un 6% cuando se utilizaba únicamente el FIB-4. Además, con el uso de los 2 biomarcadores de forma secuencial se reducía la necesidad de derivaciones a atención especializada hasta un 70%31. Es en este contexto que la comunidad científica recomienda el uso escalonado de 2 métodos no invasivos de detección de fibrosis, recomendando primero un método ampliamente disponible y con un elevado VPN como los biomarcadores serológicos indirectos que permitan descartar de forma fiable que el paciente tenga fibrosis hepática, seguido de un segundo método más preciso que permita diagnosticar con certeza la presencia de fibrosis28–30. Con estos algoritmos se consigue una precisión diagnóstica>90% para el diagnóstico de fibrosis significativa32. Aquí es donde la ET desempeña un papel importante y puede ser utilizada en el cribado poblacional como segundo escalón del algoritmo. Para apoyar aún más su uso en el algoritmo, un análisis de coste-efectividad sobre el uso de la ET para detectar fibrosis hepática ha demostrado ser coste-efectiva tanto en población general como en subpoblaciones con factores de riesgo28.
RESPUESTA. La ET es una buena herramienta para el cribado escalonado de la fibrosis hepática después de los métodos serológicos no invasivos. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Cuál es el mejor punto de corte para la detección de fibrosis hepática en la población general mediante la ET?El objetivo que persigue el cribado poblacional de fibrosis hepática mediante la ET es identificar a los pacientes con cirrosis (F4), fibrosis avanzada (F≥3) o fibrosis significativa (F≥2), ya que es la presencia de fibrosis la que marca el pronóstico de los pacientes con enfermedad hepática crónica y por tanto son estos pacientes los que deben derivarse a la atención especializada30,33. Los pacientes con mínima o sin fibrosis (F0-1) podrían realizar seguimiento en atención primaria. Diferentes estudios han evaluado los mejores puntos de corte para detectar fibrosis o cirrosis con la ET, pero estos puntos de corte difieren en función de la etiología estudiada32. En este contexto, aun sabiendo las limitaciones de unificar un punto de corte para todas las etiologías, la guía europea (EASL) sobre el uso de los métodos no invasivos para la detección de la fibrosis recomienda el punto de corte de 8kPa como el mejor para decidir si un paciente tiene alta probabilidad de tener fibrosis hepática y se recomienda derivar a atención especializada para continuar el estudio y el seguimiento3. Destacar que este punto de corte es probable que cambie en un futuro. En el estudio de Caballería et al.22 el mejor valor de corte de la ET para fibrosis hepática significativa (F≥2) fue de 9,2kPa, con una elevada sensibilidad (93%) y especificidad (78%). Sin embargo, al derivarse de un estudio donde el número de biopsias es relativamente bajo, debería ser validado en futuros estudios prospectivos en población general antes de implementarlo en la práctica clínica con fines de cribado. Hay actualmente 4 estudios de cribado sobre fibrosis hepática en Europa y EE. UU. que nos darán más información respecto a los mejores puntos de corte, en las poblaciones diana para hacer cribado, como sobre la frecuencia del cribado26.
RESPUESTA. El punto de corte más fiable para detectar fibrosis significativa en la población general y recomendar la derivación del paciente a atención especializada es 8kPa. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Es segura la ET en una mujer embarazada?La ET puede utilizarse en mujeres embarazadas sin que ello suponga un riesgo ni para el feto ni para la madre. En las mujeres embarazadas debemos tener en cuenta que los resultados de la ET pueden ser falsamente elevados en las últimas etapas del embarazo por aumento del flujo sanguíneo en el hígado. La rigidez hepática y el CAP aumentan de forma reversible durante el embarazo y descienden después34. Así, los niveles ligeramente elevados en el tercer trimestre se pueden considerar un hallazgo normal.
RESPUESTA. La ET se puede utilizar en las embarazadas de forma segura, aunque es necesario interpretar los resultados teniendo en cuenta los cambios asociados al embarazo. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Es útil la ET para detectar fibrosis hepática en la población pediátrica?Desde la introducción de la sonda pediátrica en la ET, cada vez hay más estudios que evalúan el uso de la ET en población pediátrica y han demostrado que la ET es útil para detectar la presencia de fibrosis en esta población35. Sin embargo, hay que tener en cuenta varios aspectos a la hora de utilizar e interpretar los resultados en la población pediátrica: 1/ los estudios son en cohortes pequeñas, 2/ los puntos de corte son diferentes respecto a la población adulta, 3/ los niños tienen valores de ET más elevados que las niñas, y 4/ la etiología de la enfermedad hepática en la población pediátrica es diferente a la del adulto ya que la frecuencia de atresia biliar y fibrosis quística son más elevadas e influencian los resultados de la ET, por lo que es necesario tener en cuenta la etiología a la hora de interpretar los resultados. Sin embargo, la ET es una herramienta prometedora, y dado el aumento exponencial de obesidad y diabetes en la población infantil, es de esperar que la ET pueda ser una herramienta de cribado para la EHmet en la población pediátrica, pero faltan estudios poblacionales para evaluar su utilidad y coste-eficacia en este contexto.
RESPUESTA. La ET es una herramienta útil para realizar cribado de fibrosis hepática en la población pediátrica. Nivel de evidencia C. Recomendación débil. Consenso 10/10.
Parte 4. Utilidad de la elastografía para la evaluación de la fibrosis y la esteatosis hepática¿Qué punto de corte de la ET es el más adecuado para evaluar la fibrosis hepática en la enfermedad hepática crónica avanzada?Se han propuesto diferentes algoritmos para el cribado de la fibrosis hepática significativa en la atención primaria y otros ámbitos no hospitalarios para decidir la realización de la ET y/o la derivación a atención especializada, que varían según el área geográfica, especialmente en el uso de biomarcadores serológicos y escalas no invasivas como el FIB-4, el ELF o el «NAFLD Fibrosis score»33,36,37. En el ámbito hospitalario, La ET permite evaluar si el paciente tiene una enfermedad hepática crónica avanzada (EHCA) considerada, según la biopsia, como la presencia de fibrosis avanzada (F≥3)38. El estudio más amplio publicado hasta el momento con biopsias hepáticas recomienda un valor de ET<7-8kPa para descartar la presencia de fibrosis avanzada38.
El término de «enfermedad hepática crónica avanzada compensada» (EHCAc) refleja el continuo de fibrosis avanzada y cirrosis en pacientes con enfermedad hepática crónica en curso. Esta definición basada en la medida de la rigidez hepática tiene como objetivo estratificar el riesgo de presentar hipertensión portal clínicamente significativa y descompensación independientemente de la realización de una biopsia hepática. Aunque se han propuesto otros puntos de corte38, los más ampliamente aceptados son los propuestos en la última conferencia de Baveno VIII39. Un punto de corte de ET<10kPa (independientemente de la etiología de la enfermedad hepática crónica y en ausencia de otros signos conocidos analíticos o ecográficos de enfermedad crónica avanzada (superficie nodular, trombocitopenia, esplenomegalia, etc.) descarta la presencia de EHCAc, dado que estos pacientes tienen un riesgo de eventos hepáticos<1% a los 3 años39. Un valor comprendido entre 10-15kPa es sugestivo de EHCAc y valores de ET>15kPa son altamente sugestivos39.
Pons et al.40 analizaron los puntos de corte óptimos de EHCAc por ET en función de la etiología, determinando que el 90% de los pacientes con una ET>10kPa presentaban hipertensión portal (GPVH>5mmHg) tanto si se trataba de una hepatitis crónica por virus de la hepatitis C (VHC), hepatitis crónica por virus de la hepatitis B (VHB) o hepatopatía relacionada con el consumo de alcohol. Sin embargo, en los pacientes obesos con EHmet la prevalencia de hipertensión portal era mucho menor. En el momento de medir la elasticidad hepática se puede utilizar una regla del 5 (10-15-20-25kPa) para indicar riesgos relativos progresivamente más elevados de descompensación y muerte por enfermedad hepática independientemente de la etiología.
RESPUESTA. El punto de corte de ET más ampliamente aceptado para excluir EHCAc independientemente de la etiología es<10kPa. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
¿En qué situaciones la evidencia actual con la ET es limitada para evaluar la fibrosis hepática?En los pacientes con hepatitis crónica por el VHC que han logrado la respuesta viral sostenida (RVS) y en los pacientes con hepatitis crónica por el VHB que llevan años en tratamiento antiviral, la ET no ha demostrado ser una buena herramienta para evaluar el estadio de fibrosis después del tratamiento41,42. Recientemente, un estudio prospectivo y multicéntrico hecho en nuestra área con biopsias y ET tras el tratamiento ha demostrado una falta de correlación entre los valores de ET una vez alcanzada la RVS y la presencia de fibrosis avanzada o cirrosis41. En pacientes con hepatitis crónica por el VHB, un estudio reciente prospectivo y multicéntrico con biopsias apareadas antes del tratamiento y 72 semanas tras iniciar el tratamiento antiviral, ha demostrado que el descenso del ET no es fiable para estimar la regresión de la fibrosis hepática42.
El umbral de 8kPa se ha demostrado útil para excluir fibrosis avanzada (F≥3) en pacientes con consumo crónico de alcohol43, hepatitis autoinmune (HAI)44, colangitis biliar primaria (CBP) y colangitis esclerosante primaria (CEP)45, o de los pacientes con trasplante hepático, ya sea en el contexto del rechazo crónico o por otras causas46. Por otro lado, en pacientes con CBP y CEP un umbral de 9,5-10kPa ha demostrado ser útil para identificar fibrosis avanzada47. Sin embargo, las variables de confusión son frecuentes y el número de pacientes limitado en estos estudios. En los pacientes con consumo activo de alcohol, la rigidez hepática puede estar sobreestimada por la inflamación por lo que puede ser necesario repetir la ET cuando se considere que la inflamación ha remitido (2-4 semanas de abstinencia o reducción del consumo con mejoría bioquímica)48. En la HAI, la ET puede ser útil para monitorizar la actividad de la enfermedad junto con los niveles de transaminasas y los niveles de IgG pero es recomendable repetir la ET cuando la inflamación se haya controlado con el tratamiento inmunosupresor para interpretar los resultados3.
RESPUESTA. La ET no es una buena herramienta para evaluar la fibrosis en pacientes con enfermedad hepática viral inactiva (VHC con RVS o VHB con tratamiento antiviral). El consumo de alcohol, la inflamación y la colestasis son importantes factores de confusión en pacientes con enfermedad hepática crónica por alcohol, enfermedad autoinmune o colangitis. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Qué precisión tiene el CAP en la EHmet para diagnosticar esteatosis hepática?No existe información sobre las cifras de CAP para diagnosticar EHmet en pacientes sin síndrome metabólico. Para el diagnóstico de EHmet, existen diferentes estudios y diferentes puntos de corte evaluados pero todavía no tenemos valores consensuados de CAP. Parece que valores>275dB/m pueden utilizarse para diagnosticar la presencia de esteatosis hepática, con una sensibilidad superior al 90%. Sin embargo, se sigue considerando la ecografía como la herramienta de primera línea para el diagnóstico de esteatosis hepática a pesar de sus limitaciones (solo detecta una afectación de hepatocitos superior al 12%, tiene limitaciones en los pacientes obesos y mucha variabilidad interobservador)3. Por otro lado el FLI, que incluye el perímetro abdominal, el IMC, el valor de gammaglutamiltranspeptidasa y los triglicéridos, ha demostrado ser una excelente herramienta de cribado de la EHmet en individuos con algún factor de riesgo metabólico22. La SCD recomienda evaluar con ET a todo paciente con factores de riesgo metabólico y un valor de FLI>6036.
RESPUESTA. Valores de CAP>275dB/m han demostrado una sensibilidad>90% para detectar esteatosis en pacientes con EHmet. La ecografía se considera el método radiológico de elección para el diagnóstico de esteatosis hepática a pesar de sus limitaciones. Un valor de FLI>60 puede ser la mejor herramienta de cribado para identificar la EHmet en pacientes con algún factor de riesgo. Nivel de evidencia B. Recomendación débil. Consenso 10/10.
¿Qué precisión tiene el CAP para diagnosticar esteatosis hepática en otras enfermedades distintas a la EHmet?El CAP también ha demostrado relacionarse con la grasa hepática en pacientes con enfermedad hepática crónica por alcohol49. Un valor de CAP>290dB/m identificó esteatosis (afectación de hepatocitos>5%) con un VPP del 92% y un valor CAP<280dB/m excluyó esteatosis grave (afectación de hepatocitos>66%) con un VPN del 99%. Su fiabilidad diagnóstica fue superior al IMC, el perímetro abdominal y la ecografía, pero las diferencias con la ecografía no llegaron a ser estadísticamente significativas. Un dato a tener en cuenta es que 3 de cada 4 pacientes no obesos presentaron al parar el consumo de alcohol una disminución rápida (a los 6 días) del CAP y se mantuvo elevado en pacientes obesos49. A pesar de que en la enfermedad hepática asociada al consumo de alcohol (y también a la hemocromatosis y la enfermedad de Wilson) el sustrato histológico incluye esteatosis y esteatohepatitis, no existe evidencia suficiente para recomendar el uso del CAP en estas entidades. En pacientes trasplantados se empieza a evaluar el CAP como herramienta para detectar de forma fiable la esteatosis tras el trasplante incluso en ausencia de alteraciones bioquímicas50,51, pero no hay datos suficientes para emitir recomendaciones sistemáticas sobre su uso. La situación es similar en el caso de las enfermedades hepáticas autoinmunes52. En escenarios en los que la esteatosis puede desempeñar un papel más importante, como es la evaluación de la viabilidad de hígados de donantes para trasplante o el impacto de la esteatosis en la hipertensión presinusoidal por EHmet en pacientes con obesidad mórbida, no existe tampoco suficiente evidencia para recomendar el uso del CAP.
RESPUESTA. En la enfermedad hepática por alcohol, la hemocromatosis, la enfermedad de Wilson, la HAI, la CBP y en pacientes con obesidad mórbida o trasplante hepático la evidencia del uso del CAP para identificar esteatosis es todavía limitada. Nivel de evidencia B. Recomendación débil. Consenso 10/10.
Parte 5. Utilidad de la elastografía para identificar complicaciones de la cirrosis¿Se puede identificar la hipertensión portal clínicamente significativa con la ET?El concepto de hipertensión portal clínicamente significativa (HPCS) es un concepto hemodinámico por lo que se requiere la realización del GPVH y un valor≥10mmHg. La ET permite estimar la ausencia o presencia de HPCS y, por tanto, identificar a los pacientes con riesgo aumentado de presentar descompensaciones de la enfermedad hepática y mortalidad relacionada con esta.
Los valores de ET<10kPa descartan la HPCS, y por tanto identifican a pacientes con un riesgo de descompensación y muerte relacionada con la enfermedad hepática<1% a los 3 años. En cambio, una determinación de ET>25kPa es suficiente para identificar la presencia de HPCS (con una especificidad y un VPP>90%), detectando a los pacientes con riesgo de presentar signos endoscópicos de hipertensión portal y con mayor riesgo de descompensación39.
Si combinamos el valor de ET con el recuento de plaquetas, podemos aumentar la sensibilidad y el VPN del diagnóstico de HPCS. De esta forma valores de ET<15kPa con recuento de plaquetas>150×109/L descartan la presencia de HPCS (con una sensibilidad y un VPN>90%). Por el contrario, valores de ET de 15 a 20kPa con plaquetas<110×109/L y valores de ET de 20 a 25kPa con plaquetas<150×109/L tienen como mínimo un 60% de riesgo de presentar HPCS53.
RESPUESTA. La ET ha demostrado ser útil para descartar/identificar a pacientes con HPCS. La combinación de la ET con el recuento de plaquetas puede aumentar la sensibilidad y el VPN para descartar HPCS por encima del 90%. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
¿Cada etiología tiene puntos de corte de ET diferenciados para identificar el riesgo de descompensación?A la hora de valorar el punto de corte, es muy relevante tener en cuenta el IMC del paciente y no tanto la etiología de la enfermedad hepática. Recientemente se ha publicado un estudio de cohortes internacional identificando que un valor de ET>25kPa es el mejor punto de corte para identificar a los pacientes con enfermedad hepática crónica por alcohol, hepatitis B crónica, hepatitis C crónica y EHmet sin obesidad que presentan HPCS (con un VPP>90%). Por el contrario, el mismo punto de corte en los pacientes con EHmet y obesidad tiene un VPP mucho menor (del 62,8%). Se ha descrito un modelo combinando del valor de ET, el recuento de plaquetas y el IMC («ANTICIPATE-NASH model») para mejorar la capacidad predictiva de la HPCS en este subgrupo de pacientes. Pero este modelo está aún pendiente de validar40.
RESPUESTA. Un valor de ET>25kPa tiene un VPP superior al 90% para identificar HPCS en pacientes con enfermedad hepática crónica por alcohol, VHB, VHC y EHmet sin obesidad, pero no en obesos con EHmet. Nivel de evidencia B. Recomendación fuerte. Consenso 9/10.
¿Es útil la ET para identificar a los pacientes con enfermedad hepática crónica pero que no tienen varices esofágicas?Los pacientes con valores de ET<20kPa que tienen un recuento de plaquetas>150×109/L (criterio de Baveno VI) tienen una probabilidad muy baja (<5%) de presentar varices esofágicas de riesgo en el estudio endoscópico y por tanto no hace falta realizar la gastroscopia de cribado39,53.
RESPUESTA. La ET, cuando se combina con la cifra de plaquetas (criterio de Baveno VI), permite identificar a los pacientes que no tienen varices de riesgo con un VPN superior al 95%, por lo que no estaría indicado realizar endoscopia de cribado. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
Respecto al cribado de hipertensión portal una vez eliminada la causa etiológica, ¿hay que tener en cuenta los mismos puntos de corte de ET?El impacto de eliminar el factor etiológico primario de la EHCAc no está bien establecido. El paradigma de esta situación es la hepatitis C, puesto que tiene un tratamiento muy eficaz. Sin embargo, otros factores como la obesidad, la diabetes y el consumo de alcohol pueden contribuir a la evolución de la enfermedad hepática a pesar de haber eliminado el factor etiológico primario.
En esta situación, todavía no disponemos de una herramienta no invasiva fiable para descartar la presencia de HPCS. En ausencia de cofactores, los pacientes que alcanzan una RVS postratamiento de la hepatitis C y que durante el seguimiento presentan un descenso mantenido del valor del ET<12kPa con plaquetas>150×109/L, tienen una muy baja probabilidad de tener HPCS y por tanto, riesgo de descompensación de la hepatopatía (sensibilidad 99,2%)54. En este caso, por tanto, se puede suspender el cribado de varices. Sin embargo, hay que seguir el cribado del hepatocarcinoma, dado que hasta ahora no hay datos que indiquen que haya disminuido.
Postratamiento de la hepatitis C, alcanzando la RVS se pueden aplicar los mismos criterios de Baveno VI para descartar la presencia de varices esofágicas de riesgo (aquellas que requieren tratamiento), ET<20kPa y recuento de plaquetas>150×109/L con un VPN 100%. Respecto a las demás enfermedades hepáticas todavía no tenemos datos sólidos posteliminación del factor etiológico39,55–57.
RESPUESTA. El impacto de eliminar el factor etiológico de la enfermedad hepática no está bien establecido, pero en pacientes con infección previa por el VHC que han alcanzado la RVS se puede aplicar el criterio de Baveno VI para descartar la presencia de varices esofágicas de riesgo. Nivel de evidencia B. Recomendación fuerte. Consenso 10/10.
¿Es útil repetir la ET durante el seguimiento de los pacientes con EHCAc?La ET da información sobre el pronóstico de la enfermedad hepática crónica en el momento del diagnóstico y durante el seguimiento. Una disminución significativa del valor de ET durante el seguimiento se ha asociado a una reducción del riesgo de descompensación y disminución de la mortalidad asociada a la hepatopatía. Se define como disminución significativa del valor de ET cuando disminuye un 20% durante el seguimiento con un valor de ET<20kPa o cuando disminuye por debajo de 10kPa. En pacientes que no siguen tratamiento betabloqueante y no incluidos en programa de cribado de HPCS con gastroscopia, se recomienda realizar la ET y el recuento de plaquetas anual, y si la ET aumenta>20kPa o el recuento de plaquetas disminuye<150×109/L sería recomendable realizar una gastroscopia de cribado si el paciente no toma betabloqueantes39.
RESPUESTA. La ET da información sobre el pronóstico de la enfermedad hepática crónica durante el seguimiento por lo que se recomienda realizar la ET y el recuento de plaquetas anualmente. Si la ET aumenta>20kPa o el recuento de plaquetas disminuye<150×109/L se debería realizar una gastroscopia si el paciente no toma betabloqueantes. Nivel de evidencia C. Recomendación fuerte. Consenso 10/10.
Parte 6. Recomendaciones para interpretar los resultados¿Qué debemos tener en cuenta a la hora de interpretar los resultados de la ET para no equivocarnos?El elastograma no ofrece una imagen anatómica, es la representación gráfica de la propagación de la onda de percusión en función del tiempo y de la profundidad. El programa elimina aquellos elastogramas que no cumplen los criterios de calidad y, en este caso, no da ningún resultado numérico (medida no válida). Sin embargo, pueden existir elastogramas con anomalías que pueden ser considerados válidos por el programa y el explorador debe saber reconocer estas imágenes y no tenerlos en cuenta (figs. 2.2.B, 2.3.B y 2.4.B). Además, a la hora de interpretar los resultados del ET, deben conocerse aquellas situaciones que pueden aumentar la consistencia del hígado y por tanto elevar los valores de forma no proporcional a la fibrosis (tabla 2).
Causas que pueden sobreestimar los valores de rigidez hepática en la ET
| Situaciones que pueden aumentar los resultados de la ET |
|---|
| • El paciente no está en ayunas |
| • El esfuerzo físico inmediato |
| • El consumo de riesgo de alcohol en los días previos a la prueba |
| • Falta de experiencia del explorador |
| • El transductor está en contacto con una costilla. Espacio intercostal demasiado estrecho |
| • La sonda se encuentra en una zona muy cerca de los bordes del hígado |
| • La sonda no está perpendicular a la superficie de la piel |
| • Pacientes obesos evaluados con sonda M. El hígado está demasiado alejado de la piel |
| • Cualquier situación que aumente la dispersión de los resultados. Se produce un aumento del valor intercuartílico/valor medio |
| Enfermedades que pueden aumentar los resultados de la ET |
| • Pacientes con aumento de las transaminasas (inflamación) |
| • Pacientes con insuficiencia cardíaca (hígado de estasis) |
| • Pacientes con colestasis (patología biliar) |
| • Infiltración hepática (amiloidosis, tumoral) |
| • Los quistes hepáticos, tumores primarios o metástasis |
| • La ascitis |
RESPUESTA. Como la ET cuantifica la rigidez del hígado, todas aquellas situaciones que aumenten su consistencia deben conocerse y tenerse en cuenta dado que producirán un aumento de los resultados sin relación con la fibrosis del hígado. Nivel de evidencia A. Recomendación fuerte. Consenso 10/10.
ConclusionesComo conclusiones de este documento de posicionamiento de la elastografía hepática 2022 se recogen las respuestas del grupo de expertos, el nivel de evidencia, el grado de recomendación y el consenso conseguido para cada pregunta realizada (tabla 3).
Conclusiones del documento de posicionamiento de la elastografía hepática 2022
| Respuestas del Grupo de Trabajo | Evidencia | Recomendación | Consenso |
|---|---|---|---|
| Parte1. Características técnicas de la elastografía de transición | |||
| 1.1 La ET utiliza el método elastográfico más sencillo y fiable para cuantificar la rigidez del hígado y por tanto es el método de referencia para cuantificar de forma no invasiva la fibrosis hepática. | A | Fuerte | 10/10 |
| 1.2 Los otros métodos elastográficos son más complejos, comparten limitaciones con la ET, y han sido menos evaluados en nuestro medio, por lo que no pueden considerarse de referencia. | B | Fuerte | 8/10 |
| 1.3 El CAP o parámetro de atenuación controlada de los ultrasonidos permite evaluar de forma no invasiva y durante la misma exploración la esteatosis hepática. | A | Fuerte | 9/10 |
| 1.4 La sonda XL permite obtener valores fiables de ET y CAP en pacientes con distancia piel-cápsula>2,5cm, en pacientes obesos o cuando el sistema automático de reconocimiento lo recomiende. | B | Fuerte | 10/10 |
| 1.5 Aún son limitados los estudios que utilizan la sonda M (100MHz) para evaluar la rigidez del bazo, por lo que su utilidad y los valores de referencia están por definir. | C | Débil | 10/10 |
| Parte 2. Recomendaciones para hacer una elastografía de calidad | |||
| 2.1 Las recomendaciones de enfermería, la experiencia del explorador y la correcta selección de la sonda garantizan una evaluación elastográfica de calidad. | A | Fuerte | 10/10 |
| Parte 3. Utilidad de la elastografía como herramienta de cribado | |||
| 3.1 La ET es una herramienta útil para el cribado de fibrosis hepática en la población general. | A | Fuerte | 10/10 |
| 3.2 La ET es útil para el cribado de fibrosis hepática en sujetos con factores de riesgo por hepatopatía. | A | Fuerte | 10/10 |
| 3.3 La ET es una buena herramienta para realizar cribado escalonado de fibrosis hepática después de los métodos serológicos no invasivos. | B | Fuerte | 10/10 |
| 3.4 El punto de corte para detectar fibrosis significativa en la población general y recomendar la derivación del paciente a atención especializada es 8kPa. | B | Fuerte | 10/10 |
| 3.5 La ET se puede utilizar en las embarazadas de forma segura, aunque es necesario interpretar los resultados teniendo en cuenta los cambios asociados al embarazo. | B | Fuerte | 10/10 |
| 3.6 La ET es una herramienta útil para realizar cribado de fibrosis hepática en la población pediátrica. | C | Débil | 10/10 |
| Parte 4. Utilidad de la elastografía para la evaluación de la fibrosis y la esteatosis hepática | |||
| 4.1 El punto de corte de ET más ampliamente aceptado para excluir enfermedad hepática crónica avanzada compensada independientemente de la etiología es<10kPa. | A | Fuerte | 10/10 |
| 4.2 La ET no es una buena herramienta para evaluar la fibrosis en pacientes con enfermedad hepática viral inactiva (VHC con RVS o VHB con tratamiento antiviral). El consumo de alcohol, la inflamación y la colestasis son importantes factores de confusión en pacientes con enfermedad hepática crónica por alcohol, enfermedad autoinmune o colangitis. | B | Fuerte | 10/10 |
| 4.3 Valores de CAP>275dB/m han demostrado una sensibilidad>90% para detectar esteatosis en pacientes con EHmet. La ecografía se considerada el método radiológico de elección para el diagnóstico de esteatosis hepática a pesar de sus limitaciones. Un valor de FLI>60 puede ser la mejor herramienta de cribado para identificar la EHmet en pacientes con algún factor de riesgo. | B | Débil | 10/10 |
| 4.4 En la enfermedad hepática por alcohol, la hemocromatosis, la enfermedad de Wilson, la HAI, la CBP y en pacientes con trasplante hepático la evidencia del uso del CAP para identificar esteatosis todavía es limitada. | B | Débil | 10/10 |
| Parte 5. Utilidad de la elastografía para identificar complicaciones de la cirrosis | |||
| 5.1 La ET ha demostrado ser útil para descartar/identificar a pacientes con HPCS. La combinación del ET con el recuento de plaquetas puede aumentar la sensibilidad y el valor predictivo negativo para descartar HPCS por encima del 90%. | A | Fuerte | 10/10 |
| 5.2 Un valor de ET>25kPa tiene un valor predictivo positivo superior al 90% para identificar HPCS en pacientes con enfermedad hepática crónica por alcohol, VHB, VHC y EHmet sin obesidad pero no en obesos con EHmet. | B | Fuerte | 9/10 |
| 5.3 La ET, cuando se combina con la cifra de plaquetas (criterio de Baveno VI), permite identificar a los pacientes que no tienen varices de riesgo con un valor predictivo negativo superior al 95%, en los que no estaría indicado realizar endoscopia de cribado. | A | Fuerte | 10/10 |
| 5.4 El impacto de eliminar el factor etiológico de la enfermedad hepática no está bien establecido, pero en pacientes con infección previa por el VHC que han alcanzado la RVS se puede aplicar el criterio de Baveno VI para descartar la presencia de varices esofágicas de riesgo. | B | Fuerte | 10/10 |
| 5.5 La ET da información sobre el pronóstico de la enfermedad hepática crónica durante el seguimiento por lo que se recomienda realizar la ET y el recuento de plaquetas anualmente; Si la ET aumenta>20kPa o el recuento de plaquetas disminuye<150×109/L haría falta realizar una gastroscopia si el paciente no toma betabloqueantes. | C | Fuerte | 10/10 |
| Parte 6. Recomendaciones para interpretar correctamente los resultados | |||
| 6.1 Como la ET cuantifica la rigidez del hígado, todas aquellas situaciones que aumenten su consistencia deben conocerse y tenerse en cuenta dado que producirán un aumento de los resultados sin relación con la fibrosis del hígado. | A | Fuerte | 10/10 |
No financiado.
Conflicto de interesesXavier Forns ha actuado como asesor para Gilead y Abbvie. El resto de autores declaran no tener conflictos de interés.
Los autores querrían agradecer el apoyo y la orientación que el Dr. Xavier Calvet ha tenido, durante su presidencia en la «Societat Catalana de Digestologia», para la elaboración de este documento.