La insuficiencia renal es una complicación frecuente de la población con trasplante hepático que se asocia con una elevada morbimortalidad. Se han descrito múltiples factores de riesgo para el desarrollo de insuficiencia renal postrasplante hepático en los periodos pre y postrasplante hepático, así como en el propio momento del trasplante. Para reducir el impacto de la insuficiencia renal postrasplante hepático es necesaria una actitud activa para la identificación de los pacientes con factores de riesgo, la implementación de estrategias preventivas y la detección precoz del deterioro de la función renal. Tomando como base las evidencias publicadas y la experiencia clínica, el presente documento incluye recomendaciones para la monitorización de la función renal en los pacientes con trasplante hepático, la prevención y el manejo de la insuficiencia renal postrasplante hepático, y la derivación al nefrólogo. Asimismo, se actualizan las pautas inmunosupresoras probadas para la prevención o el control del deterioro de la función renal tras el trasplante hepático.
Renal failure is a frequent complication in liver transplant recipients and is associated with increased morbidity and mortality. A variety of risk factors for the development of renal failure in the pre- and post-transplantation periods have been described, as well as at the time of surgery. To reduce the negative impact of renal failure in this population, an active approach is required for the identification of those patients with risk factors, the implementation of preventive strategies, and the early detection of progressive deterioration of renal function. Based on published evidence and on clinical experience, this document presents a series of recommendations on monitoring RF in LT recipients, as well as on the prevention and management of acute and chronic renal failure after LT and referral of these patients to the nephrologist. In addition, this document also provides an update of the various immunosuppressive regimens tested in this population for the prevention and control of post-transplantation deterioration of renal function.
El lento y progresivo deterioro de la función renal (FR) que se produce en los pacientes trasplantados no renales es un hecho descrito desde hace ya varios años1, aunque la generalización y mayor viabilidad de este tipo de procedimientos han convertido dicho deterioro y sus consecuencias en un factor que condiciona la supervivencia de los pacientes portadores de trasplante. Actualmente, se estima que se realizan unos 100.000 trasplantes no renales (TNR) al año en todo el mundo, siendo aproximadamente la mitad de ellos trasplantes hepáticos (TH)2. En Cataluña, de los 313 TNR que se realizaron en el 2011, 187 fueron hepáticos, siendo la tasa de TH de 24,8 por millón de población (la tasa media en España ese año fue de 24,1)3. Gracias a las mejorías en las técnicas quirúrgicas y en el manejo de la inmunosupresión, la supervivencia del paciente se ha incrementado sensiblemente en los últimos años. En Cataluña la supervivencia al primer año pos-TH en las primeras intervenciones realizadas entre 1984 y 1991 fue del 66%, mientras que en los trasplantes realizados entre 2007 y 2010 fue del 88%3. La supervivencia a medio plazo es también elevada, situándose en el 77% a los 5 años.3 En consecuencia, tanto el creciente tamaño de esta población como su mayor longevidad están poniendo de manifiesto cada vez más el importante impacto que la pérdida de FR tras el TH tiene en términos de frecuencia, morbimortalidad y necesidad de recursos caros y escasos.
El desarrollo de insuficiencia renal aguda (IRA) es una complicación muy frecuente en el periodo inmediatamente previo y posterior al TH, aunque los diversos criterios utilizados en los estudios para su definición han conllevado una importante variabilidad en los datos epidemiológicos publicados. En algunos trabajos se ha definido la IRA pos-TH como la detección de unos valores de creatinina sérica incrementados en 2 veces o más con respecto a los valores basales, o como una diuresis<400cc/día. Mc Cauley et al. reportaron que el 94% de los pacientes con TH presentaban IRA postrasplante, definida como un incremento del 50% de los niveles preoperatorios de creatinina4, mientras que en una serie de pacientes trasplantados en España la tasa de IRA en el postoperatorio inmediato (definida como una creatinina sérica>2mg/dL o la necesidad de diálisis) fue del 46%5. Más recientemente, Serrano Aulló et al. han reportado una incidencia de IRA en el pos-TH del 21-73%, con un 10-18% de pacientes que requieren diálisis4,6–12. En el 2005 la Acute Kidney Injury Network propuso una clasificación para la IRA basada en la variación de los niveles de creatinina y la diuresis (tabla 1)13. Dicha propuesta ayudará a estandarizar criterios en los estudios y posiblemente a homogeneizar los datos epidemiológicos de la IRA en el TH.
Clasificación de la insuficiencia renal aguda
| Estadio | Creatinina sérica (aumento respecto nivel basal) | Diuresis |
| I | ≥0,3mg/dL o aumento del 150-200% (×1,5-2 veces) | <0,5mL/kg/h durante>6h |
| II | Aumento del 200-300% (×2-3 veces) | <0,5mL/kg/h durante>12h |
| III | Aumento≥300% (≥3 veces) o creatinina≥4mg/dL con un incremento agudo≥0,5mg/dL o necesidad de diálisis | <0,3mL/kg/h durante24h o anuria durante 12h |
Fuente: Mehta et al13.
La insuficiencia renal (IR) condiciona muy negativamente la evolución del TH, dificultando su manejo clínico y disminuyendo significativamente la supervivencia del paciente y del injerto6,14–20. En relación con la IRA, se ha establecido que la necesidad de diálisis en el postrasplante inmediato o aumentos bruscos en los niveles de creatinina sérica (×3) se asocian con una mayor mortalidad al primer mes del TH21. De hecho, algunos estudios asocian la IRA con una mortalidad del 55-90%12. Adicionalmente, la IRA en el postoperatorio inmediato se ha relacionado con una prolongación de la estancia hospitalaria y de los costes económicos, así como con un aumento del riesgo de insuficiencia renal crónica (IRC).
En la IRC se observa un lento deterioro de la FR caracterizado por un aumento progresivo de los niveles de creatinina, habitualmente asociado con la aparición o el empeoramiento de hipertensión arterial (HTA) y proteinuria22,23. Actualmente, la clasificación más aceptada para la IRC se establece en las guías Kidney Disease: Improving Global Outcomes (KDIGO), basándose en los valores de filtrado glomerular (FG) (tabla 2)24. Se considera IRC la presencia de un FG<60mL/min/1,73m2, pero lo cierto es que en la mayoría de los estudios se han venido utilizando diversos parámetros, puntos de corte y seguimientos, lo que explica que en algunos trabajos la IRC en el pos-TH se haya reportado hasta en el 80% de los pacientes7,25. En España existe un estudio multicéntrico de corte transversal realizado en 402 pacientes con TH de 6 años de evolución media (estudio ICEBERG)26 en el que se observó una prevalencia de IRC (creatinina sérica>2mg/dL y/o un FG<60mL/min/1,73m2) del 50%. Con relación a la IRC avanzada (FG<30mL/min/1,73m2), en el estudio de Ojo et al. del 2003, que incluyó a más de 69.000 pacientes con TNR, la incidencia acumulada fue del 8, 14, 18 y 28% en los años uno, 3, 5 y 10 pos-TH respectivamente, observándose un mayor riesgo en este tipo de trasplante que en otros con mayor carga inmunosupresora, como el cardiaco o el pulmonar27.
Categorías de filtrado glomerular en la insuficiencia renal crónica
| Categoría de FG | FG (mL/min/1,73m2) | Términos |
| G1 | ≥90 | Normal o elevado |
| G2 | 60-89 | Reducción levea |
| G3a | 45-59 | Reducción leve a moderada |
| G3b | 30-44 | Reducción moderada a grave |
| G4 | 15-29 | Reducción grave |
| G5 | <15 | Fracaso renal |
FG: filtrado glomerular.
En ausencia de evidencia de daño renal, las categorías G1 y G2 no cumplen los criterios de insuficiencia renal crónica.
Adaptada de Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group24.
La introducción del sistema de priorización Model of End Stage Liver Disease (MELD) ha provocado un incremento de la gravedad de los pacientes que son finalmente trasplantados y de sus comorbilidades28,29. Dado que la creatinina es uno de los valores considerados en el cálculo del MELD, no es de extrañar que con su introducción haya aumentado tanto el número de trasplantes hepatorrenales (THR) como el número de pacientes con IR en el momento del TH28,30. Este dato es de gran importancia pues ha sido demostrado que la FR preoperatoria es un factor independiente tanto de la FR postoperatoria y del requerimiento de diálisis, como de la supervivencia pos-TH30–34. En general, el TH siguiendo la priorización MELD ha incrementado la morbilidad, especialmente el número de pacientes que presentan IR pos-TH y el requerimiento de diálisis29,30,32,33. Por otra parte, el factor predictivo más relevante de IR a largo plazo es la FR en el primer año30,31, que se relaciona directamente con la FR pre-TH. Finalmente, el desarrollo de IRC influye negativamente en la supervivencia a largo plazo. Parece pues evidente que en la era de priorización MELD, con el objetivo de evitar una disminución de la supervivencia pos-TH, será fundamental la implementación de estrategias preventivas para prevenir el desarrollo de IR.
Criterios de indicación de trasplante hepático aislado o trasplante hepatorrenal en los pacientes con indicación de trasplante hepático que presentan insuficiencia renalLa IR previa al trasplante es un mal factor pronóstico en el TH35, por lo que se podría llegar a pensar que el THR estaría indicado en todos los pacientes con necesidad de TH y que, al mismo tiempo, presentaran IR. Sin embargo, la IR es de naturaleza funcional y, por tanto, potencialmente reversible tras un TH aislado, en una proporción notable de pacientes. Por otra parte, el uso indiscriminado de injertos renales en estos pacientes no es deseable ni ético si se tiene en cuenta el número elevado de pacientes en espera de trasplante renal (TR). Recientemente, la International Liver Transplantation Society ha elaborado unas recomendaciones para el THR, que se resumen en la tabla 336. No obstante, hay que señalar que estas recomendaciones tienen una serie de limitaciones importantes, como la ausencia de diferenciación entre IR orgánica y funcional, o la no utilización de datos histológicos renales. Además, hay estudios que han reportado que dichos criterios distan de ser precisos ya que existe un número sustancial de pacientes con THR con recuperación funcional de los riñones nativos o de pacientes con TH aislado con necesidad rápida de un posterior TR37,38.
Recomendaciones de la International Liver Transplantation Society para la indicación de un trasplante combinado hepatorrenal
| • Paciente con insuficiencia renal crónica en diálisis |
| • Paciente no en diálisis, pero con una tasa de filtrado glomerular <30mL/min y una proteinuria >3g/día con un cociente proteína/creatinina en orina de 24h>3 |
| • Paciente con daño renal agudo y necesidad de diálisis al menos 2 veces por semana, durante más de 6 semanas |
Fuente: Charlton et al36.
El THR ofrece una clara ventaja sobre el TH aislado en la supervivencia del paciente candidato a TH con IR y necesidad de diálisis, pero cuando se trata de un paciente con IR sin necesidad de diálisis, aunque las ventajas existen, estas no son tan evidentes, especialmente si el FG>30mL/min/1,73m2. Si tenemos en cuenta que el TR mejora claramente la supervivencia de los pacientes con IRCT en diálisis, además de las largas listas de espera que existen para recibir un TR, es imprescindible hacer un esfuerzo por parte de hepatólogos y nefrólogos para realizar una justa y equitativa repartición de los injertos renales, por las connotaciones éticas que ello comporta.
Prevención y abordaje de la insuficiencia renal aguda en el momento peritrasplante hepáticoFactores de riesgo y causas de insuficiencia renal aguda postrasplante hepáticoLa IRA en el peritrasplante es una complicación de origen multifactorial, habiéndose descrito diversas causas relacionadas con su desarrollo tanto en los periodos pre y pos-TH, como en el propio momento del trasplante. La disfunción renal pre-TH es un factor de riesgo importante de IRA en el pos-TH inmediato que puede ser funcional, y por tanto reversible tras realizar el TH, u orgánica e irreversible. Aunque los criterios diagnósticos de un tipo u otro de disfunción renal están bien establecidos, en ocasiones la frontera se difumina por la dificultad de realizar una biopsia renal pre-TH que informe sobre el grado de afectación renal desde el punto de vista histológico. Los pacientes cuya disfunción renal se acompaña de lesiones histológicas de carácter irreversible son los más vulnerables al fracaso renal y los que merecen una intervención precoz. Al no disponer de biopsia, lo habitual es que quede infradiagnosticada. Otros factores de riesgo descritos en el pre-TH son el síndrome hepatorrenal, la patología glomerular concomitante (no tributaria de TR), el sexo masculino, la edad avanzada, la diabetes mellitus (DM), la HTA con dislipidemia, antecedentes de peritonitis bacteriana, de ascitis o de encefalopatía, la hospitalización continuada, niveles de albúmina<3g/L o un Child-Pugh estadio C10,12. Por otra parte, y teniendo en cuenta que el riñón es un órgano especialmente sensible a las hipotensiones o a los fármacos vasoactivos, ciertas situaciones que pueden darse durante el procedimiento del TH aumentan el riesgo de IRA, como la existencia de hipotensión e inestabilidad hemodinámica intraoperatoria, la necesidad de múltiples transfusiones sanguíneas durante el curso de un procedimiento quirúrgico prolongado, el aumento de la presión intraabdominal o un tiempo de isquemia>8h10,12. Con relación al pos-TH es destacable el importante efecto nefrotóxico de ciertos fármacos, como los antiinflamatorios no esteroideos, los aminoglucósidos, los contrastes iodados, o, muy especialmente, los inhibidores de la calcineurina (ICN; ciclosporina A [CsA] y tacrolimus [TAC])39,40. También la inestabilidad hemodinámica, la hipotensión, el fallo del injerto hepático o las infecciones aumentan el riesgo de IRA.
El daño agudo por ICN es funcional y de causas hemodinámicas, siendo consecuencia de la alteración del equilibrio de múltiples sustancias vasoactivas, como la endotelina-1, el óxido nítrico, el tromboxano o las prostaglandinas2. Los ICN inducen además la activación del tono simpático, así como del sistema renina-angiotensina-aldosterona. El efecto a nivel renal de todo ello consiste en una vasoconstricción de las arteriolas glomerulares aferentes que provoca una reducción del filtrado, un aumento de la resistencia vascular intrarrenal y, finalmente, un aumento de la presión arterial. Estos efectos parecen ser dosis-dependientes y son reversibles tras su discontinuación, siempre que se realice precozmente. Otras causas descritas de IRA pos-TH son: sepsis, hemorragia gastrointestinal, diarrea, abuso de diuréticos, antiinflamatorios no esteroideos y uso de contrastes.
Recomendaciones generales para la prevención de la insuficiencia renal aguda postrasplante hepáticoPara prevenir el desarrollo de IRA en los pacientes con factores de riesgo, la técnica quirúrgica durante el TH tiene que ser especialmente cuidadosa con el objetivo de minimizar al máximo el sangrado. En este sentido, es fundamental la indicación de la técnica de preservación de cava, y en los casos indicados la realización de un shunt porto-cava temporal perioperatorio por su influencia en la hemorragia y FR41. Es imprescindible un exquisito control hemodinámico intra y postoperatorio a fin de evitar situaciones de hipovolemia. También es importante evitar al máximo otras complicaciones que pueden afectar la FR, como por ejemplo la sepsis42. Se debería evitar además en la medida de lo posible la administración de fármacos nefrotóxicos.
En los pacientes que desarrollen IRA y requieran hemodiálisis y técnicas de ultrafiltración, se evitará al máximo las situaciones de inestabilidad hemodinámica ya que retardan la recuperación de la FR42.
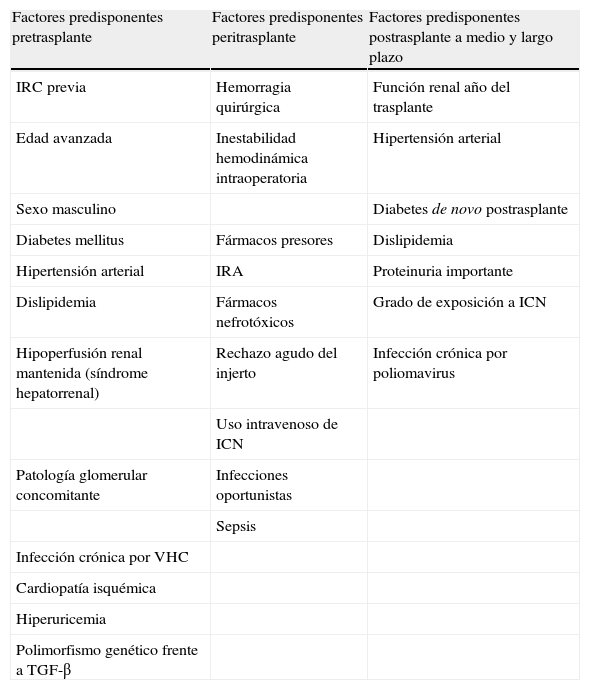
Insuficiencia renal en el paciente trasplantado hepático en mantenimiento: prevención y manejoFactores de riesgo de la insuficiencia renal crónica postrasplante hepáticoDel mismo modo que para la IRA, se han descrito varios factores de riesgo (antes, durante y después del trasplante) que se relacionan en diverso grado con el desarrollo de IRC en los pacientes con TH (tabla 4)42.
Factores de riesgo para el desarrollo de insuficiencia renal crónica en el trasplante de órgano sólido no renal
| Factores predisponentes pretrasplante | Factores predisponentes peritrasplante | Factores predisponentes postrasplante a medio y largo plazo |
| IRC previa | Hemorragia quirúrgica | Función renal año del trasplante |
| Edad avanzada | Inestabilidad hemodinámica intraoperatoria | Hipertensión arterial |
| Sexo masculino | Diabetes de novo postrasplante | |
| Diabetes mellitus | Fármacos presores | Dislipidemia |
| Hipertensión arterial | IRA | Proteinuria importante |
| Dislipidemia | Fármacos nefrotóxicos | Grado de exposición a ICN |
| Hipoperfusión renal mantenida (síndrome hepatorrenal) | Rechazo agudo del injerto | Infección crónica por poliomavirus |
| Uso intravenoso de ICN | ||
| Patología glomerular concomitante | Infecciones oportunistas | |
| Sepsis | ||
| Infección crónica por VHC | ||
| Cardiopatía isquémica | ||
| Hiperuricemia | ||
| Polimorfismo genético frente a TGF-β |
ICN: inhibidores de la calcineurina; IRA: insuficiencia renal aguda; IRC: insuficiencia renal crónica; TGF-β: factor de crecimiento transformante β; VHC: virus de la hepatitis C.
Adaptada de Guirardo et al.42.
Diversos estudios coinciden en destacar la especial importancia de factores como la edad o la FR previa al trasplante33,43, así como la presencia de patologías concomitantes lesivas a nivel renal, como la HTA o la DM. Sin embargo, la principal causa de IRC en estos pacientes es el uso de ICN44, observándose lesiones histológicas sugestivas de daño por ICN en prácticamente la mitad de los pacientes con TH con nefropatía crónica45 y en más del 70% de los pacientes con IRC avanzada30. En algunas publicaciones27,30,46 se ha observado que del 50% de pacientes con IRC a 5 años, en la mitad (25% de todos los pacientes) la disfunción renal es debida a la toxicidad de los inmunosupresores. Igualmente, del 20% de pacientes que a los 10 años presentan una disfunción renal avanzada, en el 70% (14% de todos los pacientes vivos a los 10 años) estaría relacionada con nefrotoxicidad por ICN. La nefrotoxicidad crónica por ICN se caracteriza por el desarrollo de lesiones histológicas estructurales en el riñón que, a diferencia del daño agudo, no parece relacionarse tanto con la dosis sino más bien con el tiempo de exposición a estos fármacos, siendo dichas lesiones probablemente irreversibles a pesar de su retirada. Los ICN inducen una sobreexpresión intrarrenal de factores de crecimiento fibrogénicos, tales como el TGF-β, la osteopontina o la fibronectina, que resulta en el depósito de matriz extracelular en el mesangio47. Consecuentemente, se produce una arteriolopatía hialina obstructiva que, mediante isquemia, conduce al desarrollo de atrofia tubular, fibrosis intersticial e hipertrofia glomerular compensatoria. En los últimos años se ha sugerido que la variabilidad genética (como la relacionada con la expresión del TGF-β) puede condicionar en los pacientes un cierto grado de predisposición individual a la nefrotoxicidad por ICN42. Dicha predisposición genética sería de gran interés ya que permitiría identificar a pacientes con mayor riesgo de desarrollar nefrotoxicidad pos-TH y administrarles pautas inmunosupresoras alternativas (con dosis reducidas de ICN, o sin ICN), para la prevención del daño renal.
Métodos de evaluación de la función renal (tabla 5)La detección precoz del deterioro de la FR es fundamental para la rápida instauración de acciones terapéuticas que puedan revertir/estabilizar el daño renal, siendo indispensable para ello medir de forma correcta la FR. Por motivos logístico-económicos, tanto en la práctica clínica como en la mayoría de los estudios en trasplante se suelen utilizar como indicadores de la FR la medición de los niveles plasmáticos de creatinina o la estimación del FG42, aunque ambos métodos presentan limitaciones que pueden conllevar infraestimaciones de dicha función. La creatinina es un producto metabólico casi exclusivo del tejido muscular, por lo que su producción puede verse alterada en situaciones de elevado catabolismo, así como en pacientes con una masa muscular reducida. Los niveles de creatinina dependen además de la dieta, de modo que una dieta vegetariana o pobre en carne puede reducir de forma significativa sus niveles, pudiendo también la hiperbilirrubinemia interferir en su medición. El cálculo del aclaramiento de creatinina, realizado a partir de las concentraciones plasmáticas y urinarias de creatinina (y corregido según la superficie corporal del paciente), permite una mejor predicción de la FR, aunque para la obtención de un resultado fiable se necesita una correcta recogida de orina de 24h48,49. La fórmula de Cockcroft-Gault permite estimar dicho aclaramiento calculándolo a partir de los niveles de creatinina sérica, evitando así la recogida de orina50.
Métodos de medición de la función renal
| Creatinina sérica |
| Cistatina C sérica |
| Aclaramiento de creatinina endógena |
| Estimación del aclaramiento de creatinina mediante fórmulas |
| Cockcroft-Gault: Aclaramiento de creatinina (mL/min)=[(140−edad)×(peso en kg)×(0,85 si mujer)]/(72×creatinina sérica en mg/dL)a |
| Determinación del FG |
| Inulina |
| 51CrEDTA |
| 99mTcDTPA |
| 25I-iodetalamato -Iohexol |
| Estimación del filtrado glomerular mediante fórmulas derivadas de la creatinina sérica |
| MDRD: FG=175×(creatinina×0,0113]−10,154×edad−00,203×[1 para hombres blancos; 0,742 para mujeres blancas; 1,2 para afroamericanos]b |
| CKD-EPI: FG=141×mín (creatinina sérica (mg/dL)/κ,1)α×máx(creatinina sérica (mg/dL)/κ,1)−1.209×0,993edad×1,018 [en mujeres]×1,159 [en raza negra]b |
| Nankivell; 6,7/(creatinina sérica (mmol/l)+0,25×peso (kg)−0,5×urea (mmol/l)−100/altura (m)2+35 (25 en mujeres) |
| Estimación del FG mediante fórmulas derivadas de la cistatina C95,96 |
| 100/cistatina C |
| Larsson; FG=77,24×cistatina C−10,2623 |
| Hoek; FG=−4,32+80,35×1/cistatina C |
| Grubb; FG=89,12×cistatina C−10,1675 |
| Filler; Log (FG)=1,962+[1,123×log (1/cistatina C)] |
| Le Bricon; FG=[78×(1/cistatina C)]+4 |
CKD-EPI: Chronic Kidney Disease-Epidemiology Collaboration; FG: filtrado glomerular; MDRD: Modification of Diet in Renal Disease.
La creatinina sérica no constituye un marcador fiable para la detección precoz de cambios progresivos en la FR, siendo el FG el método más recomendable42. Ello es debido a que la creatinina sérica y el FG tienen una relación inversamente proporcional y exponencial, por lo que pequeños incrementos en la creatinina por encima del límite superior normal, de aparente poca significación clínica, pueden corresponderse con importantes reducciones del FG, de hasta el 50%48,49. La inulina constituye el método de referencia para la determinación del FG, si bien sus costes y requerimientos logísticos (se necesitan varias extracciones sanguíneas) dificultan su implementación en la práctica clínica51,52. El cálculo del FG mediante radioisótopos, como el tecnecio 99 o el cromo EDTA 5152,53, es también bastante exacto y aporta información sobre la FR, la perfusión vascular y la eliminación en fase urinaria. Se han introducido agentes de contraste no radiactivos, como el iohexol y el iothalamato no radiactivo, que presentan ventajas logísticas (una sola extracción sanguínea a las 4-6h) y permiten evitar potenciales problemas de radiactividad54,55. En cualquier caso, estas técnicas son poco útiles para su aplicación repetida y prolongada en un mismo sujeto. Se han desarrollado métodos que estiman el FG a partir de diversas ecuaciones basadas en la creatinina plasmática, como la Modification of Diet in Renal Disease (MDRD; proveniente de un estudio diseñado para evaluar la evolución de la enfermedad renal crónica mediante la restricción proteica en la dieta)49,56, la CKD-EPI o la fórmula de Nankivell57 (es necesario constatar que al depender de la creatinina plasmática todas estas fórmulas están condicionadas por las mencionadas limitaciones de este marcador). La MDRD es la ecuación más extendida, existiendo diversos tipos de ella, aunque las guías K/DOQI recomiendan el uso de la MDRD-4, basada en la creatinina plasmática, la edad, el sexo y la raza del paciente46.
En los últimos años ha crecido el interés en relación con el uso de los niveles séricos de cistatina C como marcador de la FR58–60. Se trata de una proteína endógena que, a diferencia de la creatinina, cuenta con una síntesis muy estable por parte de casi todas las células del organismo que no es dependiente de la edad, el sexo, la raza, la masa muscular o la ingesta de proteínas. Además, la bilirrubina no interfiere en la determinación de su concentración61. La cistatina C se filtra completamente en el glomérulo y no se reabsorbe ni secreta en los túbulos renales. A pesar de ello, hay que tener en cuenta que en pacientes con disfunción hepática, disfunción tiroidea o en tratamiento con esteroides, los niveles de cistatina C pueden variar. Un estudio en 58 pacientes con TH demostró una correlación significativa entre cistatina C sérica y el aclaramiento de la inulina renal, con una probabilidad muy alta de que un nivel <1,2mg/L de cistatina C sérica indique que el FG se encuentra en un nivel normal62. Existen también fórmulas para la estimación del FG a partir de los niveles plasmáticos de cistatina C, si bien los estudios en TH que han comparado el uso de cistatina C frente a MDRD en la estimación del FG han obtenido resultados inconsistentes63–66.
Recomendaciones generales para la prevención, detección precoz y manejo de la insuficiencia renal crónica en pacientes con trasplante hepático estableCon el objetivo de prevenir la instauración y el desarrollo de IRC, en los pacientes portadores de un TH estable es necesario tratar adecuadamente factores de riesgo como la HTA, la DM, la dislipidemia, la obesidad, el tabaquismo y el sedentarismo, así como evitar el uso de fármacos nefrotóxicos y utilizar cuidadosamente aquellos que bloquean el sistema renina-angiotensina-aldosterona (especialmente en pacientes añosos o con riesgo de hipovolemia). Por otra parte, se deberá vigilar estrechamente al paciente siempre que sea necesario el uso de fármacos que interfieran con los niveles de inmunosupresores que se metabolizan a través de citocromo P450 (como los inhibidores de la proteasa).
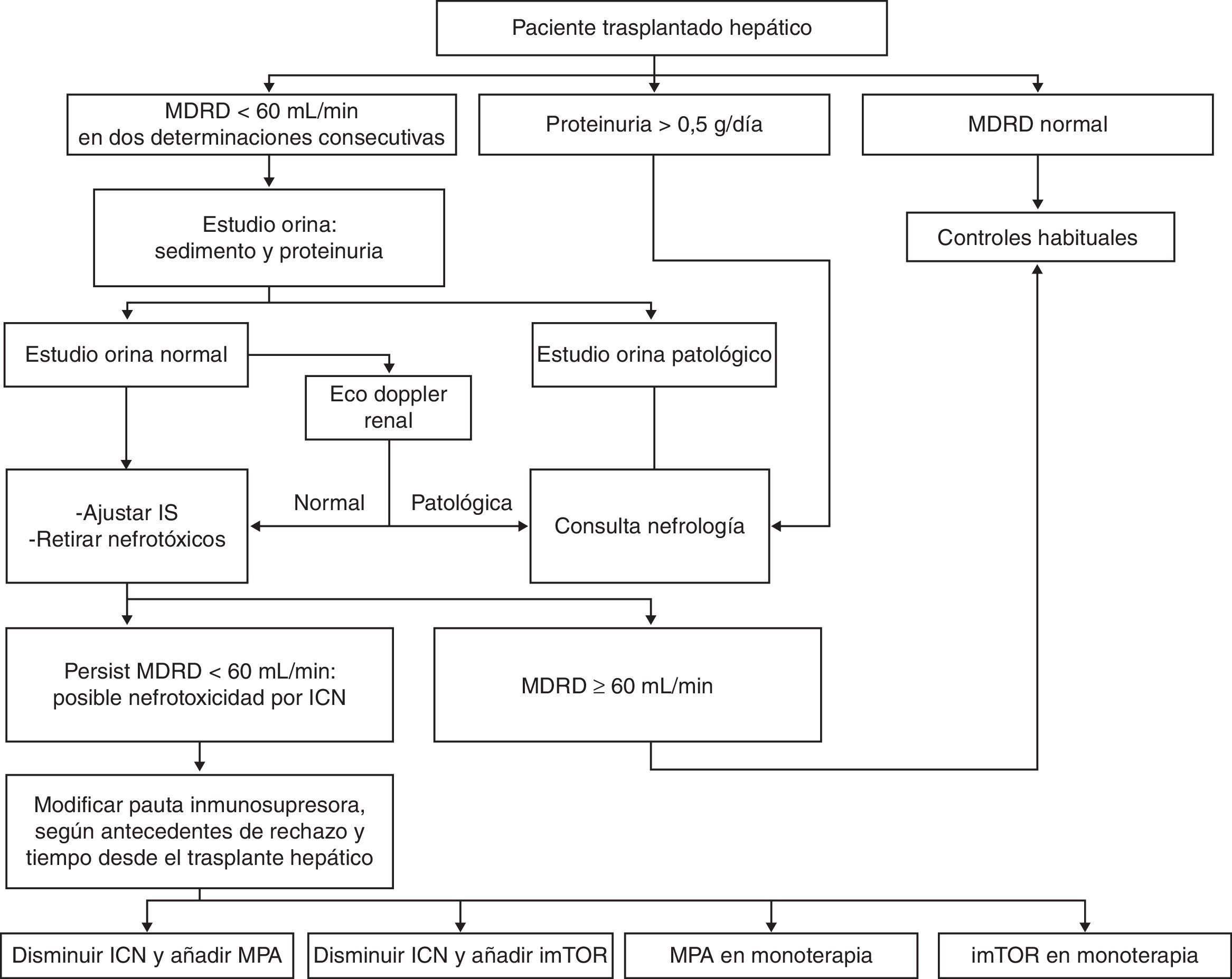
El protocolo recomendado para el seguimiento de la IRC en el TH consiste en la determinación mensual de la presión arterial, la realización de una analítica sanguínea con FG estimado por MDRD cada 3-6 meses dependiendo del tiempo transcurrido desde el TH, y una analítica de orina con sedimento y proteinuria cada 3 meses durante el primer año y cada 6 meses a partir de entonces. La figura 1 presenta un algoritmo de actuación para el diagnóstico precoz del deterioro de la FR en los pacientes con TH. La importancia de dicho diagnóstico radica en el hecho de que permite iniciar tempranamente medidas terapéuticas, relacionadas principalmente con la inmunosupresión, que pueden ayudar a preservar, o incluso a recuperar, la FR. Los pacientes con IR postrasplante que ya presentaban una IR pretrasplante merecen un seguimiento especial, ya que puede tratarse de pacientes en los que se infravaloró la indicación de un THR, o que previo al TH presentaban una IR funcional que se ha transformado en IR irreversible al sumarse acontecimientos perioperatorios graves.
Algoritmo para la detección precoz y el manejo de la insuficiencia renal crónica en el paciente trasplantado hepático. ICN: inhibidores de la calcineurina; imTOR: inhibidores de la mammalian target of rapamicyn; IS: inmunosupresión; MDRD: Modification of Diet in Renal Disease; MPA: ácido micofenólico.
Ante un paciente que presente proteinuria >500mg/día, HTA de difícil control, deterioro progresivo de la FR o microhematuria en presencia de HTA, se deberá solicitar una ecografía abdominal con estudio renal y valorar su derivación al nefrólogo. Uno de los objetivos es que el equipo del TH pueda decidir conjuntamente con el nefrólogo la indicación de una biopsia renal para el estudio de la IR, en función de las características del paciente. Más allá de la utilidad diagnóstica, la biopsia puede aportar importante información pronóstica y ayudar a la toma de decisiones terapéuticas para la IRC.
En los pacientes con TH en los que se detecta una IRC ya establecida se requiere la inmediata instauración de medidas encaminadas a reforzar el control estricto de las mencionadas comorbilidades que pueden favorecer la progresión de la IRC67. En caso necesario, el tratamiento de los pacientes con TH con IRC grave requerirá de terapia renal sustitutiva y/o de inclusión en lista de espera para TR46. La clara mejoría de los resultados del TR en la población con TNR ha generalizado la realización de este procedimiento, estimándose que prácticamente la mitad de la población con TNR de órgano sólido en diálisis entra en lista de espera y que anualmente se trasplanta de riñón a uno de cada 4 de estos pacientes27.
Prevención y tratamiento de la insuficiencia renal postrasplante hepático: rol de la inmunosupresiónActualmente existen diversas intervenciones relacionadas con cambios en la inmunosupresión que se utilizan habitualmente en la práctica clínica frente a la IR pos-TH. Estas deben apoyarse siempre en las medidas de tipo general comentadas en los apartados previos y además complementarse con el uso de la pauta inmunosupresora más adecuada para cada perfil de paciente.
La existencia de fármacos no nefrotóxicos, como los inhibidores de las síntesis de las purinas o antimitóticos (azatioprina, de uso infrecuente actualmente, y derivados del ácido micofenólico [MPA]: micofenolato mofetilo [MMF] y micofenolato sódico), o más recientemente los inhibidores de la mammalian target of rapamycin (imTOR: sirolimus [SRL] y everolimus [EVL]), han permitido el desarrollo de nuevas pautas inmunosupresoras basadas en la minimización de los ICN. En el año 2002 la Food and Drug Administration notificó un incremento del riesgo de trombosis en la arteria hepática con el uso de SRL en pacientes con TH de novo, aunque este hecho no se ha observado en series más recientes68,69. Por otro lado, EVL ha sido recientemente aprobado por la European Medicines Agency para la profilaxis del rechazo agudo en el TH, combinado con dosis reducidas de TAC y a partir de la semana 4 del trasplante.
En general, la reducción de las dosis de ICN, acompañada de la adición de MPA para garantizar una adecuada cobertura inmunológica, constituye la estrategia inmunosupresora más frecuentemente utilizada en la práctica clínica frente a la IR pos-TH. Sin embargo, son múltiples los regímenes inmunosupresores alternativos que se han utilizado con el objetivo de prevenir y tratar la IR, de los cuales a continuación se revisan las principales evidencias publicadas hasta la fecha en TH.
Insuficiencia renal perioperatoria (pacientes con insuficiencia renal pretrasplante y/o riesgo de insuficiencia renal aguda en el postrasplante inmediato)Pautas preventivas de la insuficiencia renal agudaTeniendo en cuenta que en los pacientes con FR alterada antes del TH, o con factores de riesgo para el desarrollo de IRA en el postrasplante inmediato, no se recomienda utilizar ICN de forma inicial (especialmente de forma intravenosa2) hasta que no se observe estabilización hemodinámica, en los últimos años se ha evaluado con éxito una estrategia inmunosupresora consistente en retrasar la introducción del ICN a dosis bajas hasta unos días (de 5 a 7 habitualmente) después de la realización del trasplante. El objetivo es generar una ventana de tiempo durante la cual la FR pueda recuperarse tras la operación70. En estos casos, y para prevenir rechazos, se debe utilizar inducción con anticuerpos monoclonales o policlonales71. Varios estudios han demostrado que el uso de una pauta de estas características se asocia en los primeros meses con una significativa preservación de la FR frente a pautas de novo estándar72,73. En el 2005, por ejemplo, Lin et al. compararon a 27 pacientes tratados con basiliximab e inicio retrasado de TAC a dosis reducidas, frente a 18 pacientes tratados con TAC desde el inicio74. Los pacientes del grupo basiliximab presentaban un peor Child C pre-TH y tuvieron una mayor pérdida de sangre durante la operación. A pesar de ello, los niveles séricos de creatinina fueron significativamente menores en el grupo basiliximab en los días 2 y 3 pos-TH. A los 3 meses, el aclaramiento de creatinina fue superior en este grupo y se observó una menor incidencia de IR. Las tasas de rechazo e infecciones fueron parecidas en ambos grupos. Similares resultado se han observado en el reciente estudio ReSpECT, que incluyó a más de 500 pacientes con TH de novo y buena función renal75. En este estudio los pacientes fueron aleatorizados en 3 brazos para ser tratados con: 1) terapia convencional (TAC/esteroides); 2) MMF, esteroides y TAC a dosis bajas desde el inicio; o 3) inducción con daclizumab/MMF/esteroides e inicio retrasado de TAC a dosis bajas. Al año, se observó una significativa menor reducción del aclaramiento de creatinina, así como una menor necesidad de diálisis, en el grupo 3 en comparación con el grupo 1. En este sentido, y a pesar de que el uso de pautas con exposición reducida de ICN desde el inicio del TH es la estrategia más habitual en la práctica clínica para la prevención de la aparición de IR en el postrasplante, es destacable que en el estudio ReSpECT no se hallaron diferencias significativas en términos de protección de la FR entre el grupo de terapia convencional y el grupo de TAC a dosis bajas desde el inicio del TH. La incidencia de rechazo, así como la supervivencia del injerto y del paciente, fueron comparables en los 3 brazos.
Los datos actualmente disponibles sobre pautas de novo libres de ICN en pacientes con IR que reciben un TH son aún escasos, si bien existen algunas iniciativas destacables basadas en imTOR. Actualmente está en marcha un estudio unicéntrico para la evaluación de la eficacia de un régimen inmunosupresor de novo basado en inducción con basiliximab, MMF, esteroides e inicio retrasado de SRL, en pacientes con IR (FG<50mL/min/1,73m2 y/o creatinina sérica>1,5mg/dL) receptores de un TH (estudio PATRON)76. Paralelamente, un estudio piloto, unicéntrico y prospectivo de fase ii está en marcha para evaluar en 29 pacientes con TH de novo e IR (FG<50mL/min/1,73m2) la eficacia y seguridad de un régimen basado en EVL (inicio retrasado), micofenolato sódico, esteroides e inducción con basiliximab, en términos de incidencia de rechazo agudo y FR (estudio CILT)77.
Pautas de tratamiento de la insuficiencia renal agudaA pesar de que no existen estudios prospectivos sobre el manejo de la inmunosupresión en los pacientes que desarrollan IRA en el pos-TH inmediato, la actitud habitual en la práctica clínica consiste en reducir la dosis de ICN e introducir MMF concomitantemente. En un estudio retrospectivo unicéntrico se observó que los pacientes en los que la IR perduró más de un año presentaron mejoría de FR bien tras reducir el ICN y añadir MMF, bien tras convertirlos totalmente a MMF, pero la mejoría solo pudo ser cuantificada en los 3 primeros meses, sin proseguir después78. En cambio, los pacientes en los que el cambio fue precoz, si bien la mejoría más importante fue detectada en los 3 primeros meses, la tendencia era a seguir mejorando en el tiempo.
En los pacientes con IRA severa, una alternativa consistiría en plantearse la suspensión temporal del ICN, si bien no existe consenso en relación con la duración de dicha medida, los términos en los que debería realizarse, ni las condiciones que deberían darse para la reintroducción del ICN.
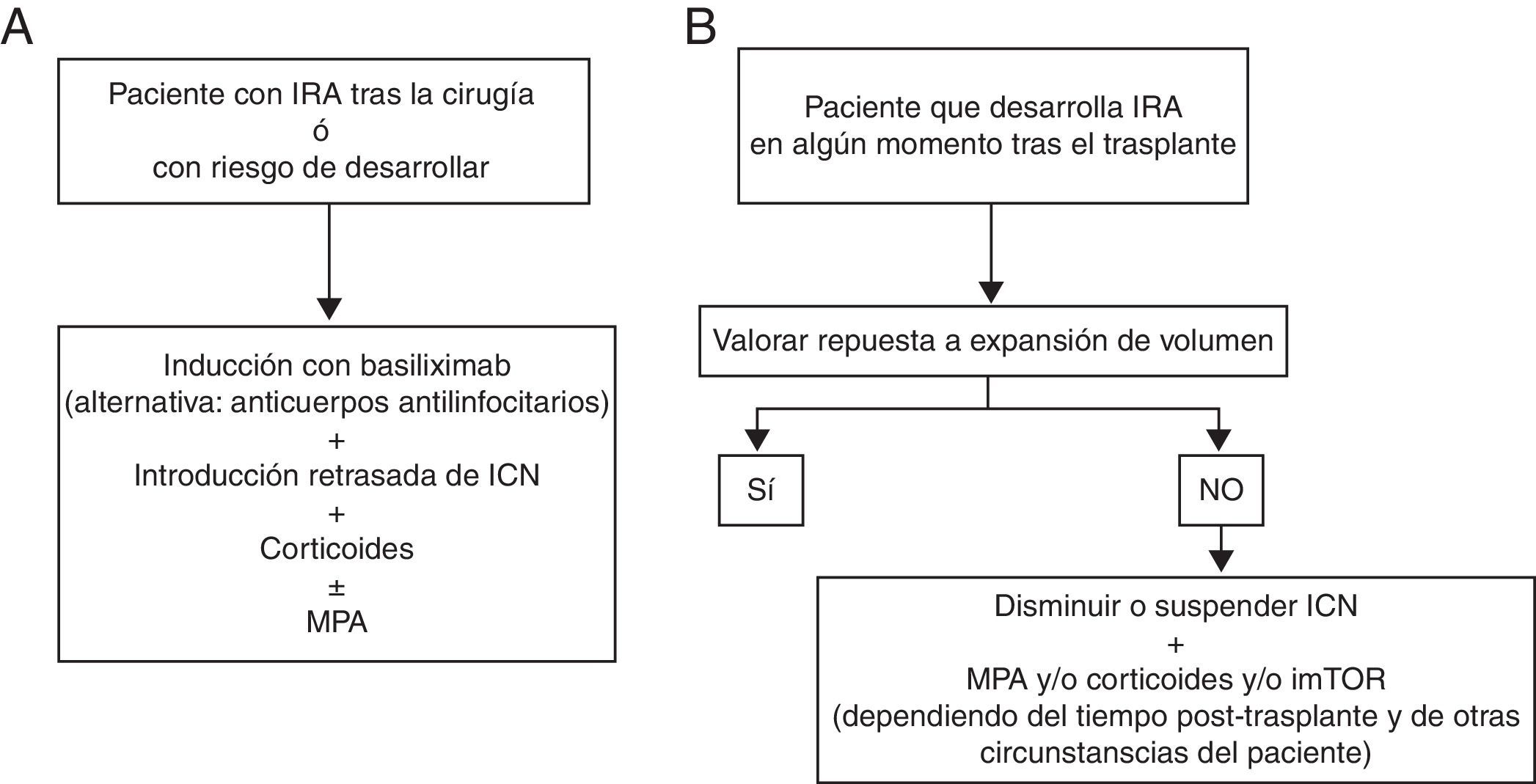
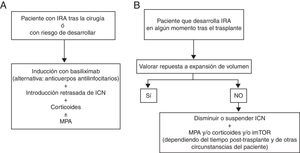
Las figura 2 A y B resumen las recomendaciones para la inmunosupresión en pacientes con TH e IRA.
Pautas recomendadas para la inmunosupresión inicial o de novo (A) y de mantenimiento (B) en el paciente trasplantado hepático con insuficiencia renal aguda. ICN: inhibidores de la calcineurina; imTOR: inhibidores de la mammalian target of rapamicyn;IRA: insuficiencia renal aguda; MPA: ácido micofenólico.
En el estudio TRY, realizado con más de 700 pacientes con TH, un régimen basado en MMF e ICN a dosis reducidas (±esteroides) desde las fases iniciales del trasplante se asoció a los 5 años con una eficaz prevención del deterioro progresivo de la FR. Dicha pauta resultó en una menor reducción del FG frente a un régimen estándar basado en ICN (±esteroides)43. Recientemente, en un estudio multicéntrico aleatorizado con 195 pacientes con TH de novo, se ha observado también que el uso de TAC a dosis reducidas+MMF se asocia al año con una menor incidencia de IR (incremento de creatinina sérica>30% vs. nivel basal) en comparación con el uso de TAC a dosis estándar+MMF79. En este trabajo se observó además una menor tasa de rechazo agudo en el grupo estudio, hecho que confirma la seguridad de una estrategia preventiva de estas características a pesar de la reducción del ICN.
La viabilidad de esta pauta de minimización de ICN en pacientes con TH de novo ha sido evaluada recientemente con imTOR en el estudio de fase iii de EVL (RAD2304). En este estudio multicéntrico y abierto, 719 receptores de un TH de novo fueron aleatorizados al mes del trasplante en 3 brazos: EVL+exposición reducida a TAC (EVL+TAC-R), EVL con retirada de TAC a los 4 meses (la inclusión de pacientes en este grupo fue detenida prematuramente debido a una mayor incidencia de rechazo) o TAC con exposición estándar (TAC-E) (todos los brazos incluyeron esteroides)80,81. A los 24 meses, la concentración media de TAC fue un 35% inferior en el grupo EVL-TAC-R en comparación con el grupo TAC-E, observándose una evolución de la FR significativamente mejor en el grupo de EVL. La tasa de fallo de eficacia (variable principal compuesta por rechazo agudo confirmado por biopsia y tratado, pérdida de injerto o muerte) fue comparable entre grupos (no inferioridad de EVL-TAC-R vs. TAC-E), observándose una incidencia de rechazo agudo confirmado por biopsia significativamente inferior en el grupo de EVL. El perfil de seguridad fue comparable con estudios anteriores de EVL, sin observarse mayor incidencia de trombosis. Globalmente, los resultados del estudio pivotal de EVL confirman que la minimización de TAC con la introducción de EVL al mes del TH es una alternativa segura y eficaz, con mejor FR, en comparación con la inmunosupresión estándar basada en TAC.
Una potencial estrategia preventiva frente a la IRC, que de momento cuenta con pocos datos aunque prometedores, es retirar los ICN en los primeros meses de evolución del TH para instaurar una monoterapia de MPA o imTOR en pacientes con FR conservada (FG en estadios i y ii y proteinuria <500mg/24h). En un estudio unicéntrico, reportado en el 2010 por Masetti et al., 78 pacientes de novo tratados con CsA y MMF fueron aleatorizados a los 30 días pos-TH para ser convertidos a EVL en monoterapia o para seguir con el tratamiento inicial82. Tras 12 meses, los pacientes del grupo EVL presentaron un FG significativamente mejor frente a la terapia con ICN y una menor incidencia de IRC de estadio ≥iii, siendo la supervivencia comparable en ambos grupos. Teniendo en cuenta que algunas experiencias iniciales en TH sugieren que la conversión tardía a imTOR no suele ser tan efectiva83,84, estos resultados reforzarían la conveniencia de introducir precozmente estos fármacos en las pautas inmunosupresoras con fines preventivos, si bien son necesarios estudios multicéntricos de mayor envergadura.
Pautas de tratamiento de la insuficiencia renal crónicaEn los pacientes en los que se detecta una IRC pos-TH, los cambios en la inmunosupresión van encaminados a estabilizar o mejorar en la medida de lo posible la FR (pautas «de rescate»). En estos casos la disminución de los ICN mediante la introducción de MMF se ha asociado con mejoras significativas de la FR en seguimientos de hasta 3 años85,86. En un estudio prospectivo aleatorizado que incluyó a 56 pacientes con TH y nefrotoxicidad crónica por ICN (creatinina sérica: 140-300micromol/L), la introducción de MMF seguida de la reducción de CsA resultó al cabo de un año en una reducción significativa de la creatinina frente a la continuación de CsA a dosis estándar87. Igual que en los estudios de novo, en este trabajo no se observó un aumento en los episodios de rechazo agudo a pesar de la minimización del ICN, lo que sugiere que esta estrategia de recuperación de la FR en pacientes con deterioro progresivo de la misma ofrece un adecuado balance riesgo-beneficio.
La retirada del ICN y la instauración de una monoterapia con MPA han sido también probadas como estrategia de rescate en pacientes con IRC establecida. En un estudio aleatorizado con 26 pacientes con TH e IRC (creatinina sérica ≥125mol/L en al menos 2 mediciones realizadas con un mes de diferencia), la conversión desde ICN a MMF se asoció a los 6 meses con una significativa mayor reducción de la creatinina88. De forma consistente, en series posteriores de pacientes convertidos a MMF por toxicidades secundarias a ICN (incluyendo nefrotoxicidad) se observó tras la retirada de estos una mejoría significativa de la FR89,90, así como de la dislipidemia y de la HTA89. Al comparar las 2 posibles estrategias de rescate de la FR con MPA (conversión desde ICN a MMF vs. minimización del ICN+MMF), se observa que con la retirada completa de los ICN se logra una mayor recuperación de la FR86,91, aunque el riesgo de rechazo es mayor, ocurriendo aproximadamente en el 20% de los pacientes convertidos a MMF88,89. Por ello, se recomienda que la decisión de instaurar una pauta de minimización o de retirada de los ICN con MPA se realice de forma individualizada en cada paciente, según grado de IRC e historia inmunológica del TH.
En cuanto a la conversión desde ICN a imTOR en pacientes con TH e IRC, en un estudio unicéntrico, aleatorizado y controlado en pacientes con un FG<65mL/min/1,73m2, la conversión a SRL mejoró significativamente la FR a los 3 meses vs. el mantenimiento del ICN92. A pesar de ello, un reciente metaanálisis de varios estudios publicados con SRL ha concluido que la conversión no se asocia con mejoras significativas de la FR, aunque la importante heterogeneidad de los trabajos posiblemente sesgue los resultados93. Castroagudín et al. convirtieron a EVL desde ICN a 21 pacientes con TH e IRC (creatinina sérica≥1,5mg/dL) y observaron que a los 12 meses se había producido una significativa mejoría del aclaramiento de creatinina, sin detectarse rechazos94. En este estudio, unos valores de FR relativamente conservados en el momento de la conversión (creatinina sérica≤1,7mg/dL, aclaramiento de creatinina>60mL/min y FG>45mL/min/1,73m2) fueron factores predictores de la normalización posconversión de la creatinina (≤1,4mg/dL). En otros 2 estudios, de Simone et al. confirmaron en pacientes con TH de más de 3 años de evolución media que la conversión a EVL por IRC es segura a largo plazo y permite retirar eficazmente los ICN en un 75-80% de los casos83,84. A pesar de ello, los resultados en FR fueron discretos, con tan solo una leve mejoría de la misma y una tasa de rechazo posconversión del 1-10%. Globalmente, estos estudios sugieren que para obtener un beneficio significativo frente a la IRC la conversión a imTOR debería hacerse más precozmente, al inicio del deterioro de la FR.
Conclusiones- •
La elevada prevalencia de la IR en la población con TH, junto con la importante morbimortalidad relacionada, hacen de esta condición una de las más limitantes de su evolución a largo plazo. Para reducir su impacto es necesario seguir una actitud activa de identificación de los pacientes con factores de riesgo con el fin de poder implementar estrategias de prevención y detección precoz del deterioro de la FR mediante la monitorización estrecha del FG.
- •
El manejo inicial de la IRC en los pacientes de riesgo o que presenten signos de daño renal importante debe incluir, en caso necesario, la remisión al nefrólogo, así como la valoración de la realización de una biopsia renal que confirme el diagnóstico y ayude a sopesar posibles actitudes terapéuticas.
- •
Las estrategias terapéuticas relacionadas con la inmunosupresión para prevenir o controlar el deterioro de la FR son diversas, asociándose la minimización o retirada de los ICN, junto a la introducción de fármacos no nefrotóxicos (como el MMF o el EVL), con buenos resultados en términos de preservación o mejoría de la FR.
Los autores declaran no tener ningún conflicto de intereses.