Presentamos una mujer de 41 años con antecedente de tumor de Wilms en la infancia y madre fallecida por cáncer colorrectal a los 28 años, remitida a consultas de digestivo por anemia ferropénica refractaria a hierro intravenoso de un año de evolución. La gastroscopia inicial objetivó más de 200 pólipos gástricos de entre 3-18 mm, agrupados en masas mamelonadas a nivel subcardial, cuerpo distal, incisura y antro. Su caracterización con luz blanca y NBI mostró lesiones eritematosas de superficie lisa, friabilidad con restos hemáticos frescos adheridos, de aspecto túbulo-velloso y patrón vascular denso pero regular. La ecoendoscopia describió un marcado engrosamiento irregular de la mucosa, sin cambios de ecogenicidad, infiltración de otras capas ni adenopatías adyacentes. Se realizó polipectomía de las lesiones de mayor tamaño con estudio anatomopatológico compatible con pólipos hiperplásicos (PH). Tras valoración por comité multidisciplinar y consensuado con la paciente, se decidió tratamiento mínimamente invasivo mediante resecciones endoscópicas. En la tercera gastroscopia, la histología de algunos fragmentos detectó cambios adenomatosos con displasia de bajo grado y un foco de adenocarcinoma. El estudio genético detectó la mutación del exón 11 del gen SMAD4, compatible con síndrome de poliposis juvenil (SPJ). Los marcadores tumorales, colonoscopia, cápsula endoscópica, angio-TAC y TAC de extensión, ecocardiografía y laparoscopia exploradora no detectaron diseminación a distancia ni otras alteraciones asociadas. La paciente fue sometida a una gastrectomía total laparoscópica con linfadenectomía, presentando buena evolución.
Las pérdidas ginecológicas constituyen el origen más frecuente de anemia ferropénica en mujeres en edad fértil. Las causas digestivas son las segundas en prevalencia, ya sean malabsortivas como por pérdidas del tracto gastrointestinal. En ausencia de clínica guía, la doble endoscopia está indicada como primera aproximación diagnóstica1.
Los PH constituyen los pólipos gástricos más frecuentes. Pueden ser únicos (75%), múltiples o como componente del síndrome de poliposis hiperplásica difusa (GAPPS; definido a partir de más de 50 PH)2. En zonas de alta prevalencia de Helicobacter pylori se notifican con mayor frecuencia.
En ocasiones aparecen en el contexto de síndromes polipósicos como SPJ, Gardner o Peutz-Jeghers3. Los PH sindrómicos son indistinguibles macroscópica e histológicamente de los esporádicos y asocian mayor riesgo de malignización4.
El SPJ, de herencia autosómica dominante, se caracteriza por la predisposición padecer pólipos hamartomatosos/juveniles (PJ) en el tracto gastrointestinal. La incidencia se estima entre 1:16.000-1:100.000. Puede ser asintomático o debutar como anemia, sangrado gastrointestinal o dolor abdominal. Para su diagnóstico deben cumplirse al menos uno de los siguientes criterios5:
- •
Más de cinco PJ en colon o recto.
- •
Múltiples PJ en el tracto gastrointestinal superior o inferior.
- •
Cualquier número de PJ junto con una historia familiar de SPJ.
Los PJ ofrecen alta complejidad diagnóstica dada su similitud anatomopatológica con el resto de pólipos gastrointestinales. Son más frecuentes a nivel colorrectal y la implicación exclusivamente gástrica suele asociarse a la mutación SMAD43. La mayoría son benignos pero pueden degenerar, siendo el colorrectal el cáncer más frecuentemente asociado. La incidencia de cáncer gástrico alcanza 21% en pacientes con pólipos gástricos (fig. 1).
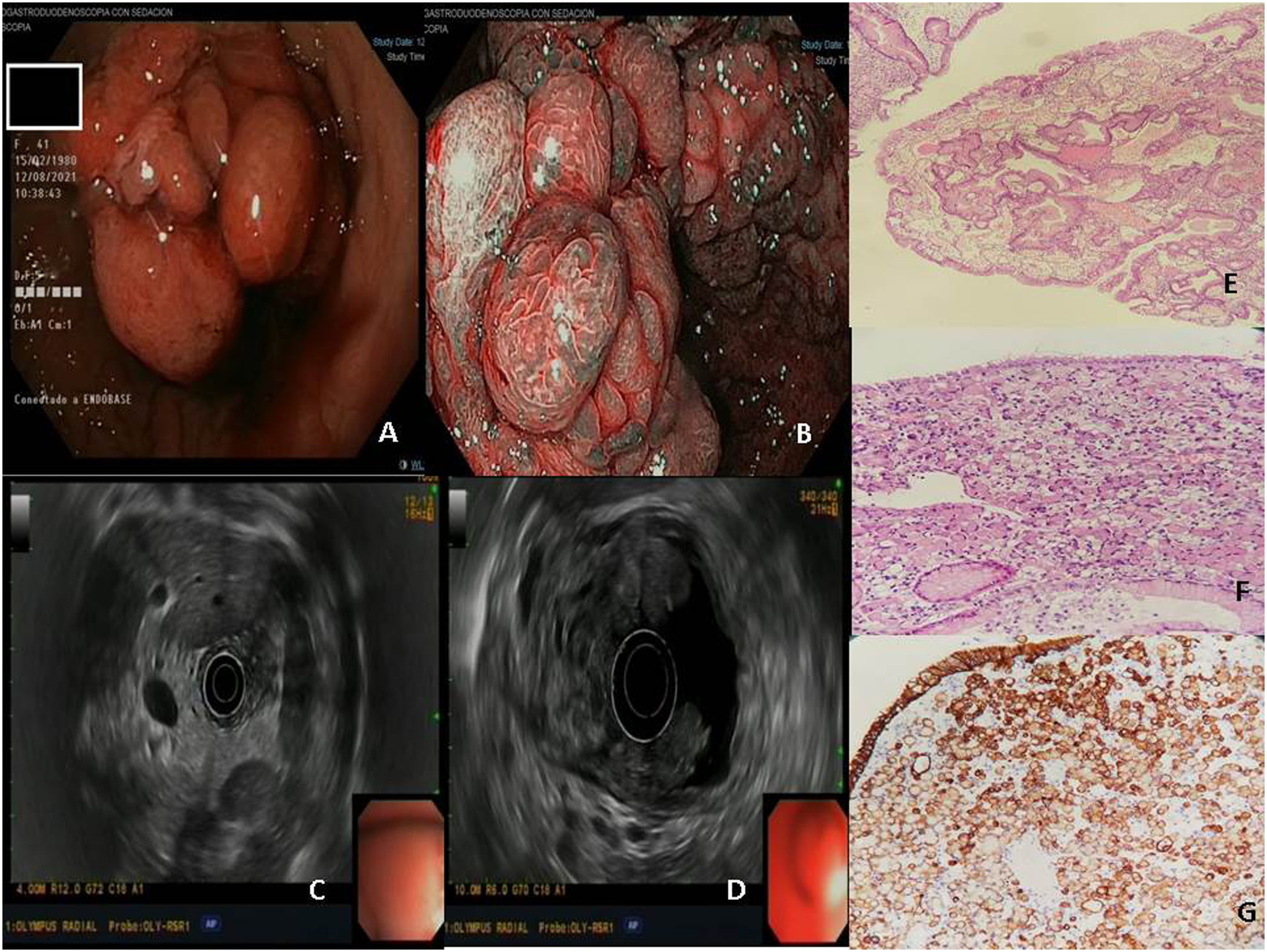
A y B. Imágenes de la gastroscopia con luz blanca y NBI, respectivamente, donde se observan pólipos gástricos hiperplásicos. C y D. Ecoendoscopia lineal donde se objetiva marcado engrosamiento irregular de la mucosa gástrica, con protrusiones luminales correspondientes a los pólipos gástricos. Las tres últimas imágenes corresponden al estudio anatomopatológico de diferentes fragmentos de polipectomías. La imagen E corresponde con una tinción H-E, en la que se observa una formación polipoide de epitelio glandular hiperplásico y congestión capilar. Las imágenes F (tinción H-E) y G (estudio inmunohistoquímico PAN-CK) representan la infiltración neoplásica por adenocarcinoma pobremente cohesivo con células en anillo de sello.
Los individuos con criterios clínicos de SPJ deben ser estudiados para las mutaciones del gen BMPR1A y SMAD4, aunque solo en 40% se detectará una mutación conocida en la línea germinal. La variante patogénica de SMAD4 asocia malformaciones arteriovenosas pulmonares, hepáticas e intracraneales; patología aórtica, epistaxis y telangiectasias.
El diagnóstico de SPJ requiere un estudio completo del tracto gastrointestinal, resecando los pólipos observados para disminuir el riesgo de sangrado, obstrucción o malignización. La gastrectomía/colectomía parcial/total será necesaria ante pólipos endoscópicamente incontrolables (> 50-100), sangrado gastrointestinal severo, displasia o historia familiar de neoplasia.
Se recomienda seguimiento mediante gastroscopia y colonoscopia cada tres años con inicio a los 15 años o antes si presentan sintomatología. Si se detectan pólipos, el seguimiento será anual. En aquellos pacientes sometidos a cirugía se mantendrán controles de los segmentos remanentes5.
Es necesario el cribado genético de los familiares de alto riesgo si se conoce la variante patogénica implicada. En caso contrario, su seguimiento será mediante colonoscopia.
Nuestra paciente desarrolló un adenocarcinoma gástrico con células en anillo de sello pT1aG3, sin invasión perineural ni linfovascular, HER2 negativo, sin alteración de proteínas reparadoras. En este estadio (IA), la administración de tratamiento adyuvante no ha mostrado beneficio, por lo que se iniciaron controles semestrales con TAC.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.