La pérdida del control intestinal preocupa mucho a las personas con lesión medular y afecta a su calidad de vida. El objetivo de esta revisión es actualizar su conocimiento.
La afectación del control neural de la continencia y la defecación tras una lesión medular provoca una disfunción intestinal con una alta prevalencia de dos síntomas principales, la incontinencia fecal y el estreñimiento. Su fisiopatología se correlaciona con las características neurológicas de la lesión y se han establecido diversos patrones fisiopatológicos que se correlacionan con las manifestaciones clínicas. La evaluación de la disfunción intestinal en estos pacientes, habitualmente es exclusivamente clínica, mientras que las exploraciones complementarias son poco utilizadas, aunque parecen prometedoras. El tratamiento se basa en establecer un programa de evacuación, pero a pesar de su aplicación correcta, los resultados no son siempre satisfactorios, por lo que es necesario desarrollar otras alternativas terapéuticas.
Loss of bowel control is distressing for persons with a medullary lesion and affects their quality of life. The present study aims to provide an updated review of the topic.
Impaired neural control of continence and defecation after a medullary lesion provokes bowel dysfunction, with a high prevalence of two main symptoms: fecal incontinence and constipation. The physiopathology of these disorders is correlated with the neurological characteristics of the lesion, and various physiopathologic patterns have been established that correlate with the clinical manifestations. Evaluation of bowel dysfunction in these patients is normally exclusively clinical and complementary examinations are rarely used, although they seem promising. Treatment is based on establishing a program of evacuation. However, despite correct application, the results can be unsatisfactory and consequently other therapeutic alternatives should be developed.
La médula espinal constituye la vía principal a través de la cual el cerebro recibe y envía información al resto del organismo. Su lesión provoca una parálisis muscular y ausencia de sensibilidad superficial y profunda por debajo del nivel de la lesión, falta de control voluntario de los esfínteres vesical y rectal, alteraciones de la sexualidad y fertilidad, y alteraciones del sistema nervioso autónomo. La sintomatología será mayor o menor según el nivel neurológico de la lesión (cervical, torácico, lumbar o sacro) y su gravedad. El nivel de la lesión y su gravedad se evalúan según los Estándares para la Clasificación Neurológica de la Lesión Medular de la American Spinal Cord Injury Association (ASIA)1. El nivel neurológico de lesión se define como el segmento más distal de la médula espinal con función motora y sensitiva normal en ambos lados del cuerpo, mientras que la gravedad se califica según la escala de deficiencia de ASIA tal y como se muestra en la tabla 1. Las lesiones de nivel cervical afectarán a las cuatro extremidades y tronco, y las de nivel dorsal y lumbar a las extremidades inferiores y parte del tronco, además de la pérdida del control esfinteriano. Las lesiones de nivel sacro no producirán parálisis de las extremidades, pero sí afectación de los esfínteres.
Escala de deficiencia de la American Spinal Injury Association
| A=completa | No hay preservación sensitiva ni motora en los segmentos sacros S4-S5 |
| B= incompleta sensitiva | Preservación sensitiva, pero no motora por debajo del nivel neurológico de la lesión y incluye los segmentos sacros S4-S5 y no hay preservación motora más allá de tres niveles por debajo del nivel motor |
| C=Incompleta motora | Función motora preservada por debajo del nivel neurológico y más de la mitad de los músculos clave presentan un grado menor de 3 |
| D=Incompleta motora | Función motora preservada por debajo del nivel neurológico y almenos la mitad de los músculos clave presentan un grado igual o mayor a 3 |
La etiología más frecuente de lesión medular es la traumática, sobre todo la ocasionada por los accidentes de tráfico, aunque también puede ser causada por diversas enfermedades (tumorales, degenerativas, vasculares, infecciosas, etc.). Se estima que la tasa de incidencia media anual de lesión medular traumática en España es de 24 casos por millón de habitantes, siendo el 74% hombres y la edad media de 32 años para los accidentes de tráfico y de 44 años en las ocasionadas por otros motivos2.
Desde la instauración del tratamiento rehabilitador de la lesión medular por Guttmann3 la esperanza de vida de estos pacientes y su calidad de vida han aumentado enormemente, de manera que pueden llevar una vida activa hasta edades avanzadas. Esto conlleva una mayor importancia de los problemas derivados de la lesión una vez superada la fase aguda, cuando el paciente ya se ha reinsertado a su domicilio. Diversos estudios ponen de manifiesto que la pérdida del control intestinal es uno de los aspectos que preocupa más a las personas con lesión medular, junto con la pérdida de movilidad y la disfunción urinaria y sexual4,5; todo ello afecta de manera importante a su calidad de vida6,7.
El objetivo de esta revisión es actualizar el conocimiento de la disfunción intestinal secundaria a lesión medular.
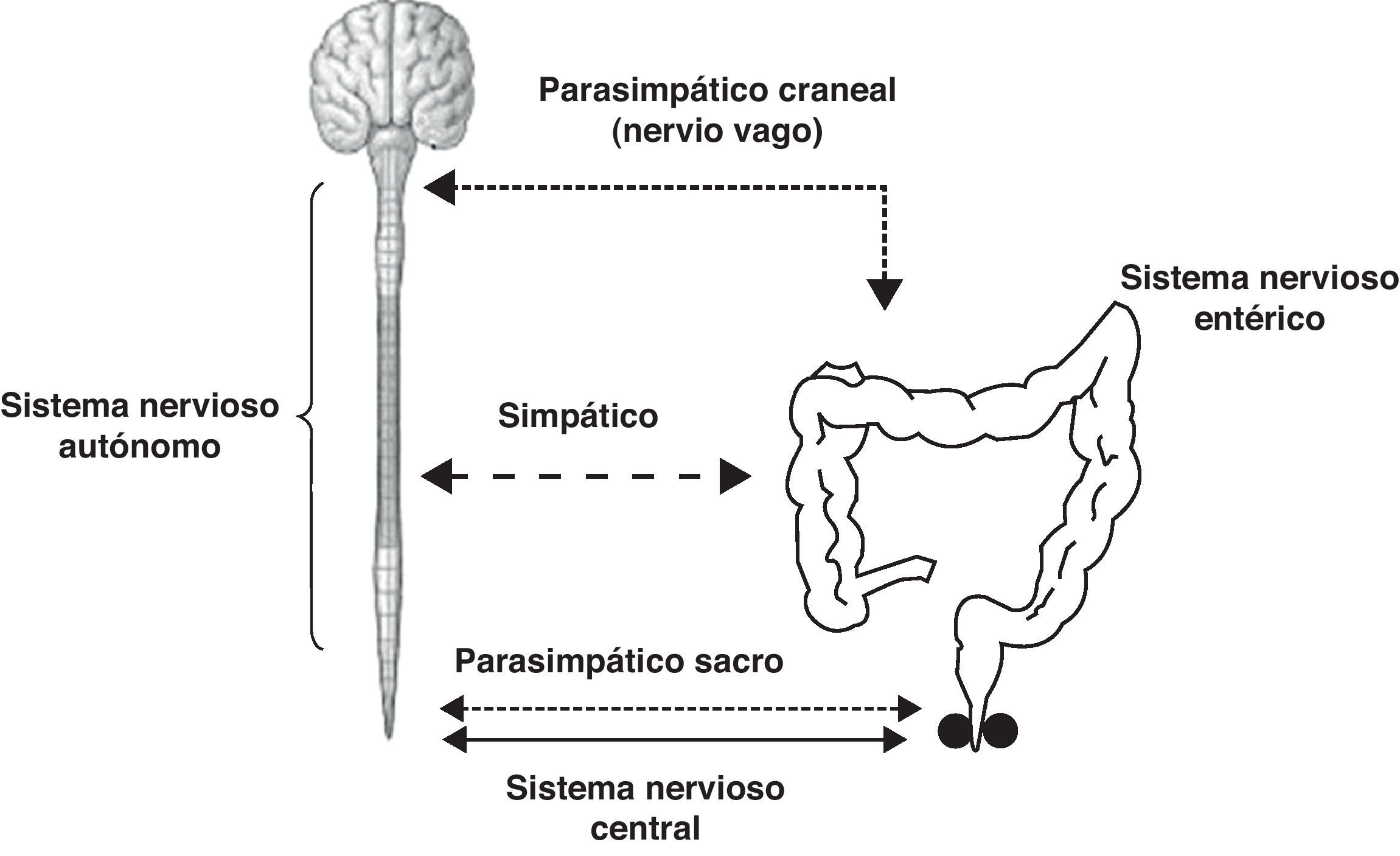
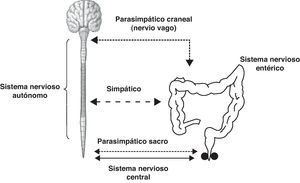
Control neural de la continencia y la defecación tras una lesión medularLa fisiología de la continencia fecal y la defecación es un proceso complejo en el que intervienen funciones autónomas y voluntarias, y en el que la presencia de un control neural indemne es imprescindible para su correcto funcionamiento. El control neural se realiza de forma integrada a tres niveles: sistema nervioso entérico, sistema nervioso autónomo (simpático y parasimpático) y sistema nervioso central (fig. 1). Cuando se produce una lesión medular el sistema nervioso entérico se mantendrá intacto y se verá afectada la inervación extrínseca (sistema nervioso autónomo y sistema nervioso central). El sistema nervioso autónomo parasimpático estará también íntegro en su porción craneal (nervio vago), pero el parasimpático sacro se verá afectado en casi todas las lesiones. El sistema autónomo simpático, dependiendo del nivel neurológico de la lesión, se mantendrá intacto (lesiones de nivel neurológico lumbar bajo o sacro) o estará totalmente afectado (lesiones de nivel neurológico cervical o dorsal alto). El control voluntario de la musculatura estriada del periné, así como la sensibilidad, se verán afectados en todas las lesiones. Dependiendo de las características de la lesión, los reflejos espinales sacros que intervienen en este proceso (reflejo de Valsalva, reflejo recto-anal excitatorio) podrán estar o no presentes. La severidad de la afectación dependerá de la gravedad de la lesión medular.
La afectación del control fisiológico neural de la continencia y la defecación provoca alteraciones de la función intestinal con dos síntomas principales, la incontinencia fecal y el estreñimiento, que se acompañan de una alta prevalencia de patología anorrectal y riesgo de disreflexia autónoma relacionada con la evacuación.
Clínica de la disfunción intestinal en el paciente con lesión medularLa prevalencia de síntomas colorrectales en los pacientes afectados de una lesión medular es muy elevada. El 27-46% presentan estreñimiento, el 31-41% incontinencia fecal, el 31% patología anorrectal y el 18% disreflexia autónoma relacionada con la evacuación8–11.
La mayoría de las personas con una lesión medular precisan tomar laxantes orales, utilizan mecanismos no fisiológicos para evacuar (estimulación química con supositorio, digitación anal), dedican mucho tiempo a la evacuación y muchos de ellos precisan evacuar en la cama y con la asistencia de otra persona8,9.
Los pacientes con una lesión medular más grave (ASIA A, B o C) y con reflejos espinales sacros preservados, son los que precisan más de la toma de laxantes vía rectal, evacuan con menos frecuencia y precisan de más tiempo, sobre todo si tienen un nivel neurológico cervical (tetraplejia); además son los que presentan una prevalencia más elevada de estreñimiento. Las lesiones menos graves (ASIA D) también presentan clínica de disfunción intestinal de forma significativa, un 15% aquejan estreñimiento, un 15% incontinencia fecal y un 31% patología anorrectal, precisando la toma de laxantes un 46% y digitación anal un 38%. Los pacientes sin reflejos espinales sacros preservados son los que presentan una incontinencia fecal más severa9.
Fisiopatología de la disfunción intestinal en pacientes con lesión medularLa fisiopatología de la incontinencia fecal y el estreñimiento en el paciente con lesión medular se correlaciona con las características neurológicas de la lesión en cuanto al nivel neurológico, la gravedad (escala de deficiencia de ASIA) y la presencia o no de reflejos espinales sacros. De acuerdo a estos parámetros se han podido establecer diversos patrones fisiopatológicos que se correlacionan con las manifestaciones clínicas12,13.
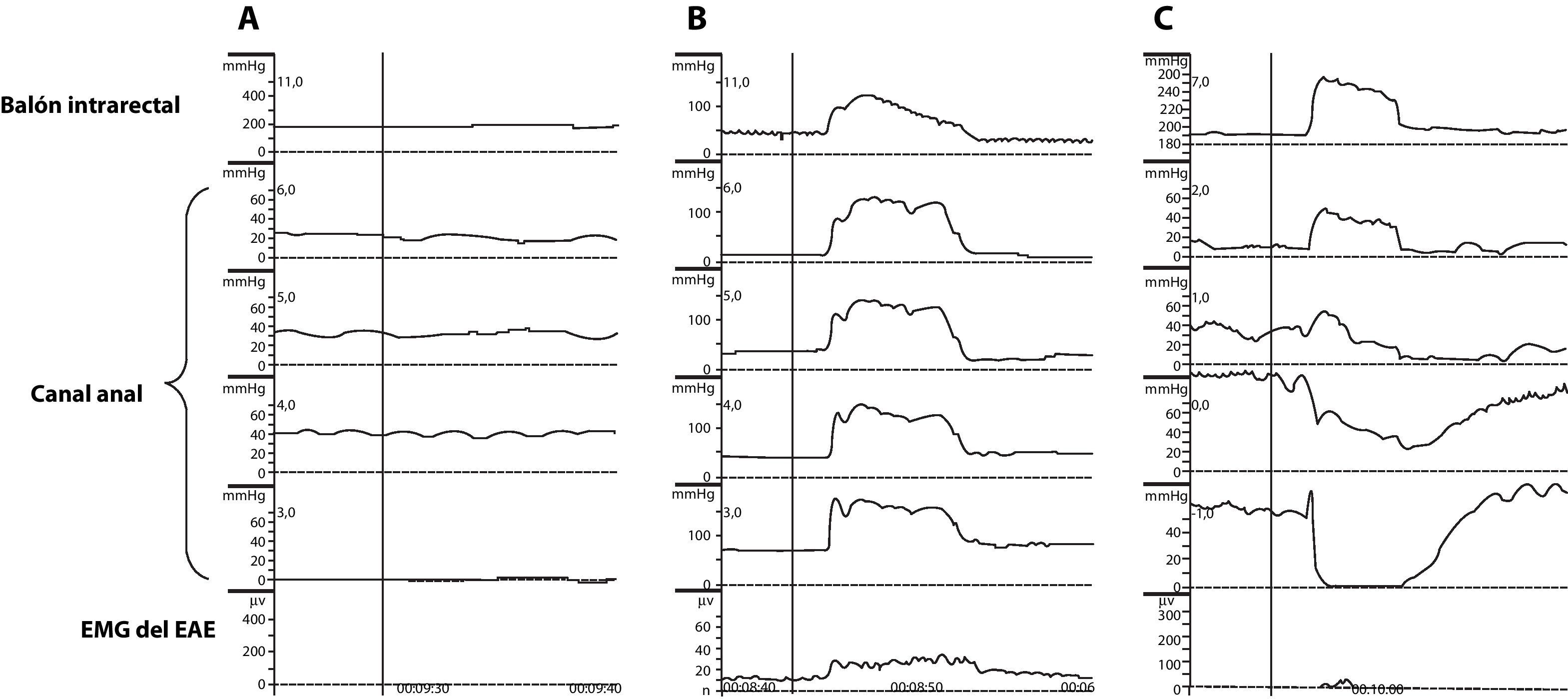
En los pacientes con una lesión medular completa motora (ASIA A y B) se han descrito tres patrones fisiopatológicos (fig. 2 y tabla 2), todos ellos tienen en común la ausencia de control voluntario sobre el esfínter anal externo, y la falta o alteración muy severa de la sensibilidad anorrectal12.
Registro mediante manometría anorrectal y EMG de superficie del EAE durante el intento de maniobra defecatoria en pacientes con lesión medular completa motora (ASIA A y B). Patrón A: no se observa prensa abdominal ni cambios en el canal anal ni en la actividad EMG del EAE. Patrón B: se observa la presencia de prensa abdominal, aumento de la presión del canal anal y actividad EMG del EAE. Patrón C: se observa prensa abdominal, reducción de la presión del canal anal sin actividad EMG del EAE.
ASIA: Escala de deficiencia de la American Spinal Cord Injury Association; EMG: electromiografía; EAE: esfínter anal externo.
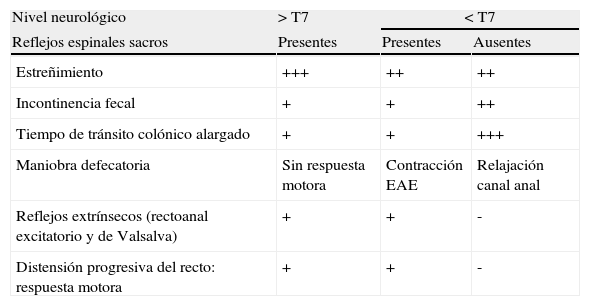
Características fisiopatológicas de la disfunción intestinal en pacientes con lesión medular motora completa (ASIA A y B)
| Nivel neurológico | > T7 | < T7 | |
| Reflejos espinales sacros | Presentes | Presentes | Ausentes |
| Estreñimiento | +++ | ++ | ++ |
| Incontinencia fecal | + | + | ++ |
| Tiempo de tránsito colónico alargado | + | + | +++ |
| Maniobra defecatoria | Sin respuesta motora | Contracción EAE | Relajación canal anal |
| Reflejos extrínsecos (rectoanal excitatorio y de Valsalva) | + | + | - |
| Distensión progresiva del recto: respuesta motora | + | + | - |
ASIA: Escala de deficiencia de la American Spinal Injury Association; EAE: esfínter anal externo.
Patrón A, presente en los pacientes con lesión medular de nivel neurológico por encima de T7 (sin control voluntario sobre la musculatura abdominal). Clínicamente son pacientes con una gran prevalencia de estreñimiento e incontinencia fecal no muy severa. Fisiopatológicamente el tiempo de tránsito colónico se encuentra moderadamente alargado y muestran incapacidad para aumentar la presión intrabdominal y ausencia de relajación del canal anal durante la maniobra defecatoria.
Patrón B, presente en los pacientes con lesión medular de nivel neurológico por debajo de T7 (mantienen control voluntario sobre la musculatura abdominal) y reflejos espinales sacros presentes. Clínicamente presentan estreñimiento con menos frecuencia que el patrón anterior y la incontinencia fecal tampoco es muy severa. Fisiopatológicamente presentan un alargamiento moderado del tiempo de tránsito colónico, capacidad para incrementar la presión intrabdominal y presencia de contracción del esfínter anal externo cuando la aumentan, realizando defecaciones obstructivas.
Patrón C, presente en lesiones de nivel neurológico por debajo de T7 sin reflejos espinales sacros. Son pacientes que clínicamente presentan estreñimiento también con menos frecuencia que el patrón A y mayor incontinencia fecal que los dos patrones anteriores. Fisiopatológicamente muestran un alargamiento más importante del tiempo de tránsito colónico, sobre todo en el colon izquierdo, capacidad para aumentar la presión intrabdominal, ausencia de resistencia anal durante la maniobra defecatoria y ausencia de contracción del esfínter anal externo cuando aumenta la presión intrabdominal o se distiende el recto.
En los pacientes con lesión medular incompleta motora (ASIAC y D) se han descrito diferentes mecanismos fisiopatológicos, similares a los patrones A y B, pero variables en cada paciente13. Un 31% no presentan contracción voluntaria del esfínter anal externo y en un 13% es normal. La abolición de la sensibilidad rectal está presente en un 18% y en un 41% la sensibilidad es normal. La mayoría de los pacientes realizan maniobras defecatorias anómalas, especialmente obstructivas con aumento de la presión del canal anal o, en ocasiones, con falta de relajación del canal anal o falta de prensa abdominal. También pueden presentar contracciones rectales reflejas al distenderse el recto y un alargamiento del tiempo de tránsito colónico13.
Evaluación de la disfunción intestinal en pacientes con lesión medularLa evaluación de la disfunción intestinal del paciente con lesión medular se realiza habitualmente desde el punto de vista exclusivamente clínico, mientras que las exploraciones para estudiar la función anorrectal (manometría anorrectal, tiempo de tránsito colónico, proctografía) son poco utilizadas. De hecho, su papel en el diagnóstico y tratamiento de este grupo de pacientes está aún por establecer, aunque parecen claramente prometedoras.
La evaluación clínica debe realizarse de forma sistemática y según el Consortium for Spinal Cord Injury debe incluir14: 1. Antecedentes patológicos relativos al sistema gastrointestinal y medicación actual que pueda influir en su función; 2. Características de la función intestinal actual (programa de evacuación: dieta, horario, dependencia, lugar, frecuencia, tiempo dedicado, método de evacuación (estimulación rectal mecánica o química, evacuación manual, maniobra defecatoria) y síntomas colorrectales (distensión abdominal, incontinencia fecal, estreñimiento, patología anorrectal, disreflexia autónoma); 3. Exploración física, que incluya la exploración abdominal y de la zona anorrectal, incluyendo la determinación de les reflejos espinales sacros bulbo-cavernoso y anal superficial. Dado que la lesión medular puede afectar al nivel funcional del paciente, esta evaluación se debe completar con una valoración de la capacidad de aprendizaje y de dirigir órdenes, posibilidad de sedestación, estado funcional de las extremidades superiores y en las transferencias y ayudas técnicas disponibles y/o necesarias.
La American Spinal Injury Association y la International Spinal Cord Society han elaborado unas recomendaciones15,16, para que la información se recoja de forma uniforme, de modo que cada variable y sus respuestas se han definido y categorizado. También se ha incluido la necesidad de aplicar escalas para evaluar la incontinencia fecal y el estreñimiento, teniendo en cuenta que, todo y la existencia de muchas, ninguna ha sido aceptada para aplicarse específicamente en pacientes con una lesión medular. Además se añade el Neurogenic Bowel Score, una escala publicada en el año 2006 que mide la gravedad del intestino neurógeno, y que es la única elaborada específicamente para pacientes con lesión medular17. El Bowel Function Extended Data Set16 incluye la realización de un examen rectal y la determinación del tiempo de tránsito colónico total y segmentario con marcadores radiopacos. Otras exploraciones complementarias, como la manometría anorrectal, las consideran de utilidad solo en investigación. En nuestra opinión, la manometría anorrectal está indicada en los pacientes con lesión medular incompleta motora (ASIAC y D), debido a la heterogeneidad de los mecanismos fisiopatológicos de incontinencia fecal y estreñimiento que pueden estar presentes13.
TratamientoA pesar de los avances en el conocimiento de la fisiopatología de la disfunción intestinal secundaria a lesión medular, el manejo de los problemas defecatorios en estos pacientes ha cambiado poco desde los tiempos de Guttmann. En 2006 la Cochrane realizó una revisión sobre el tratamiento de las alteraciones intestinales secundarias a enfermedades neurológicas, concluyendo que no se ha establecido un tratamiento basado en la evidencia científica y este se realiza en base a la experiencia y al ensayo/error, por lo que estiman necesario profundizar en este aspecto18.
Los objetivos terapéuticos en el intestino neurógeno deben ser: 1. Prevenir la incontinencia anal; 2. Conseguir una evacuación completa, regular predecible y en un tiempo razonable; y 3. Prevenir las complicaciones anorrectales14. La base del tratamiento es establecer un programa de evacuación que incluye diferentes aspectos:
Recomendaciones generales: A. Mantener una frecuencia y horario regular; B. Evacuar en sedestación siempre que sea posible; C. Valorar la ayuda de otra persona y las ayudas técnicas necesarias (silla de baño, barras laterales y alza en inodoro); D. Aporte adecuado de fibra en la dieta y líquidos suficientes (teniendo en cuenta las restricciones necesarias para el manejo de la vejiga neurógena), y E. Realización de actividad física, acorde con las preferencias y posibilidades del paciente.
Método de evacuación: Son aquellas maniobras utilizadas para provocar la evacuación de las heces tales como: A. Estimulación rectal mecánica (digitación anal) que consiste en la realización digital de masajes circulares de la pared rectal para provocar la relajación del esfínter anal interno y/o estimular la actividad motora del recto19; B. Estimulación rectal química mediante la aplicación de laxantes vía rectal; C. Evacuación manual: consiste en la extracción de las heces del recto digitalmente, y D. Maniobra defecatoria: realización de compresiones abdominales mediante maniobras de Valsalva, prensa abdominal o flexiones. Estos métodos no deben aplicarse de forma indiscriminada en todos los pacientes y su indicación dependerá de los mecanismos fisiopatológicos presentes. En los pacientes con patrones fisiopatológicos A o B, o con lesión medular incompleta motora con defecaciones obstructivas, se prescribirá la estimulación química con laxantes vía rectal y/o la digitación anal. En los pacientes con patrón B se prescribirá la maniobra defecatoria y/o la digitación anal14,20,21.
Toma de laxantes: Si con la dieta y la ingesta adecuada de fluidos no se consigue una consistencia adecuada de las heces está indicada la prescripción de laxantes por vía oral. No existen estudios que comparen la efectividad de diferentes laxantes en este grupo de pacientes, por lo que se recomienda su administración progresiva, empezando por los formadores de masa, siguiendo con los osmóticos y finalmente los estimulantes. La administración de enemas se realizará puntualmente, en caso de ausencia de evacuación durante varios días o de impactación fecal14.
A pesar de la aplicación correcta de un programa de evacuación, en muchos pacientes los resultados no son suficientemente satisfactorios, por lo que es necesario utilizar otras alternativas terapéuticas. El uso de la irrigación transanal ha demostrado ser más efectiva (menos estreñimiento, disminución de los episodios de incontinencia fecal, mejor calidad de vida y reducción del tiempo dedicado a la evacuación intestinal) que la aplicación de un programa de evacuación en pacientes con lesión medular y evacuaciones especialmente dificultosas22. A su vez, algunos estudios han demostrado que la neuromodulación de raíces sacras mejora la función intestinal en pacientes con lesión medular incompleta en los que el tratamiento conservador ha fallado. En estos pacientes se ha comprobado una mejoría de la incontinencia fecal, el estreñimiento23 y la calidad de vida23,24. Debido a las limitaciones de estos trabajos en cuanto al tamaño muestral, así como la descripción y selección de los pacientes, se precisan más estudios antes de determinar su eficacia y sus indicaciones en los pacientes con lesión medular. Otro tratamiento es el estimulador de raíces sacras anteriores (SARS). Este es un sistema diseñado, y solo indicado, para tratar la vejiga neurógena secundaria a lesión medular con músculo detrusor hiperactivo. Sin embargo, el hecho de que la inervación parasimpática y somática de la parte distal del colon y del anorrecto deriven de las mismas raíces espinales sacras que para el sistema urinario, el SARS puede actuar también sobre la función intestinal. La mayoría de los pacientes utilizan el SARS para evacuar y mejoran su función intestinal25–28. Se reduce la toma de laxantes y el número de métodos de evacuación (digitación anal, estimulación química con supositorio), se evacua con más frecuencia, y mejora el estreñimiento sin empeorar la incontinencia fecal28. La mayoría de los pacientes refieren mejorar su función intestinal y estar satisfechos tras la implantación del SARS28. Por último, la realización de una colostomía puede ser beneficiosa en pacientes con disfunción intestinal grave que no responden satisfactoriamente a otros tratamientos. Tras la colostomía se ha descrito una mejoría de la calidad de vida y una reducción del tiempo dedicado a la evacuación, aún incluyendo el relacionado con los cambios de bolsa y cuidado del estoma29,30. De todas formas, es un tratamiento poco aceptado por los pacientes en nuestro medio.
El mejor conocimiento de la fisiopatología del intestino neurógeno en el paciente con lesión medular invita a evaluar nuevas posibilidades terapéuticas. Los pacientes con lesión medular motora incompleta (ASIAC y D), presencia de contracción voluntaria del esfínter anal externo y preservación de algún grado de sensibilidad a la distensión del recto podrían beneficiarse de la aplicación de técnicas de biofeedback (rehabilitación del suelo pélvico) con el objetivo de mejorar la sensación anorrectal, potenciar la contracción del esfínter anal externo, coordinar la respuesta contráctil del esfínter anal con la sensación a la distensión rectal y reeducar la maniobra defecatoria. Se ha demostrado que el biofeedback es eficaz en el tratamiento de la incontinencia fecal de diversas etiologías31 así como en el estreñimiento obstructivo32. Es especialmente importante recordar su utilidad en pacientes con esclerosis múltiple con incontinencia fecal y/o estreñimiento33. Otro tratamiento a evaluar sería la infiltración con toxina botulínica del esfínter anal externo para tratar la evacuación obstructiva en pacientes con lesión medular motora completa (ASIA A y B) con patrón fisiopatológico B y en pacientes con lesión medular motora incompleta (ASIAC y D). Este tratamiento ha mostrado efectos beneficiosos en pacientes con anismo34 y también en pacientes con estreñimiento obstructivo debido a enfermedad de Parkinson35.
En resumen cabe destacar que la disfunción intestinal en la lesión medular es frecuente e importante, que existe una correlación entre las características neurológicas de la lesión, la clínica de la disfunción intestinal y su fisiopatología, que debe mejorarse su modo de evaluación, y–fundamentalmente - que son necesarios más estudios para evaluar la eficacia de los tratamientos actuales y futuros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.