La pandemia por el SARS-CoV-2 está conllevando una elevada mortalidad y suponiendo una crisis sanitaria a nivel mundial. La afectación fundamental es respiratoria; sin embargo, el virus también puede afectar a otros órganos, como el tracto gastrointestinal y el hígado. Los síntomas más habituales son anorexia y diarrea. Aproximadamente, en la mitad de los casos se podría detectar ARN viral en heces, lo que constituye otra línea de transmisión y diagnóstico. La covid-19 tiene peor pronóstico en pacientes con comorbilidades, aunque no existe evidencia suficiente en caso de enfermedades digestivas previas.
Las endoscopias digestivas pueden originar aerosoles, lo que que las convierte en técnicas con elevado riesgo de infección. Expertos y organizaciones científicas a nivel mundial han elaborado guías de funcionamiento para adoptar medidas de prevención.
Se revisan las evidencias disponibles sobre la afectación gastrointestinal y hepática, la repercusión en pacientes con enfermedades digestivas previas y las guías de funcionamiento para las unidades de endoscopia durante la pandemia.
The SARS-CoV-2 pandemic is leading to high mortality and a global health crisis. The primary involvement is respiratory; however, the virus can also affect other organs, such as the gastrointestinal tract and liver. The most common symptoms are anorexia and diarrhea. In about half of the cases, viral RNA could be detected in the stool, which is another line of transmission and diagnosis. covid19 has a worse prognosis in patients with comorbidities, although there is not enough evidence in case of previous digestive diseases.
Digestive endoscopies may give rise to aerosols, which make them techniques with a high risk of infection. Experts and scientific organizations worldwide have developed guidelines for preventive measures.
The available evidence on gastrointestinal and hepatic involvement, the impact on patients with previous digestive diseases and operating guidelines for Endoscopy Units during the pandemic are reviewed.
La covid-19 marcará un antes y un después en la historia de la humanidad y de la medicina, particularmente en lo referente a la enfermedad respiratoria aguda, con tantos contagios y desenlaces fatales como está habiendo; sin embargo, por los estudios que se están publicando, también habrá que tener en cuenta la afectación que el virus produce y puede seguir produciendo en el aparato digestivo.
En esta revisión clínica se van a analizar los estudios más relevantes que se han ido publicando en las últimas semanas o meses acerca del compromiso del tracto gastrointestinal y el hígado en la covid-19, haciendo especial referencia a aquellos que proporcionan directrices para mejorar y garantizar la seguridad de los pacientes y de los profesionales que efectúan endoscopias digestivas, teniendo en cuenta que estas están consideradas como exploraciones de riesgo durante esta pandemia.
Estrategia de búsquedaLa búsqueda bibliográfica se ha realizado en las bases de datos PubMed (https://www.ncbi.nlm.nih.gov/pubmed/) y Google Académico (https://scholar.google.es), empleando las siguientes palabras clave y límites:
- 1.
PubMed: (covid-19[ti] OR SARS-CoV-2[ti]) AND ((«digestive system»[MeSH Terms] OR «digestive system»[All Fields]) OR («gastrointestinal tract»[MeSH Terms] OR «gastrointestinal tract»[All Fields])).
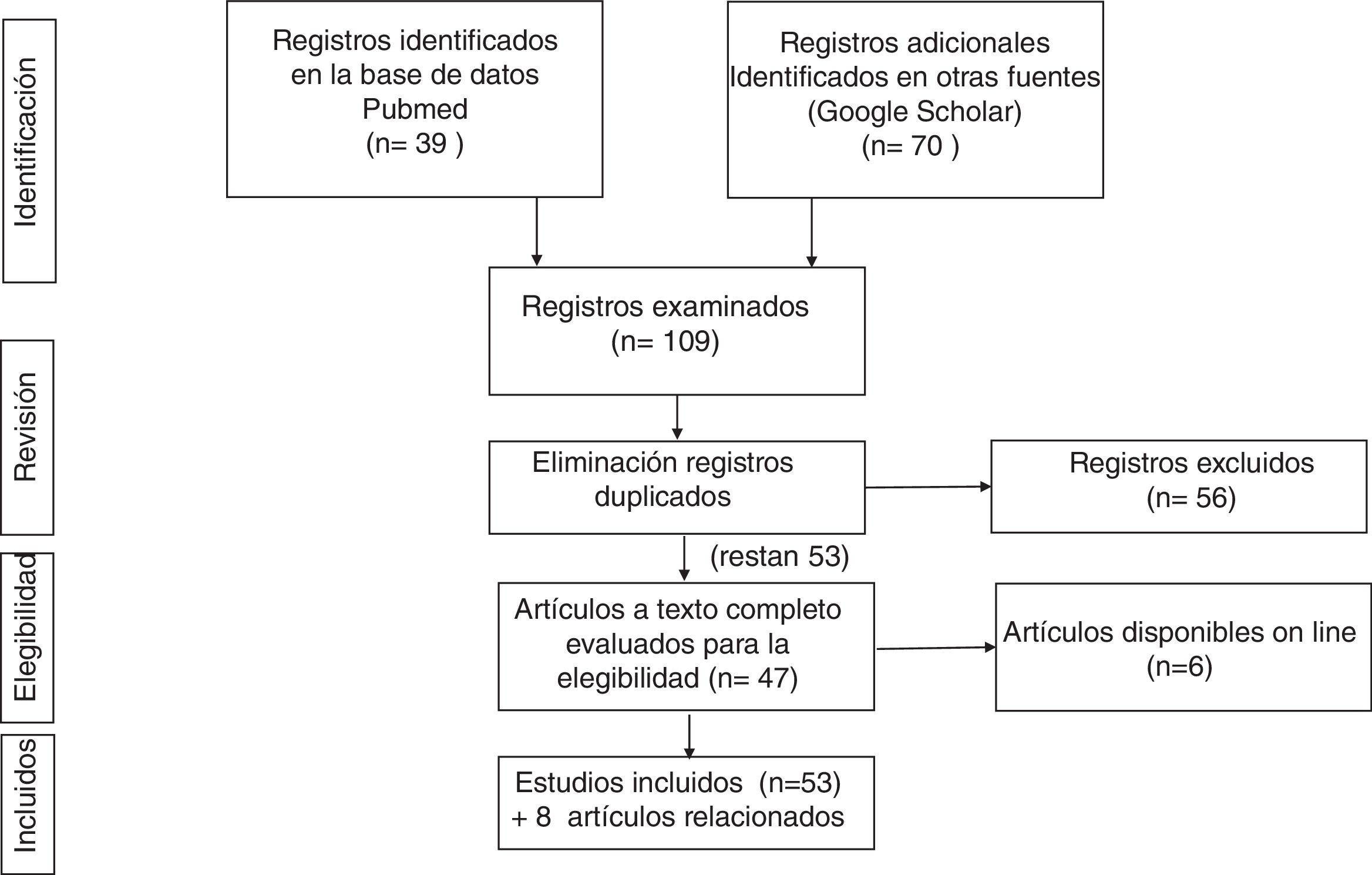
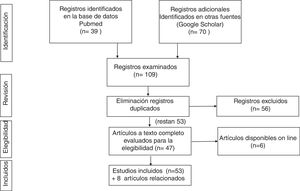
Con esta estrategia se encontraron 37 artículos, de los que se seleccionaron 19 tras eliminar aquellos que no encajaban en el planteamiento de la revisión.
- 2.
Google Académico: con la estrategia (allintitle: «covid 19» OR «SARS-CoV-2» «gastrointestinal») se recuperaron 70 estudios.
Tras cruzar los resultados de ambas búsquedas bibliográficas y eliminar los registros duplicados, se seleccionaron 51.
En la figura 1 se resume la estrategia de búsqueda bibliográfica y sus resultados.
Covid-19 y tubo digestivoEl SARS-CoV-2 infecta al hospedador gracias a su gran afinidad por el receptor de la enzima convertidora de la angiotensina 2 (ECA-2), que, además de en los neumocitos, se encuentra altamente expresado en las células epiteliales intestinales, mayoritariamente en el intestino delgado, de tal forma que el virus puede infectarlas1,2. Ello explicaría la sintomatología digestiva de los pacientes, así como la presencia de ARN de SARS-CoV-2 en heces, lo que comporta una vía de transmisión que tener en cuenta en el control de la infección3.
Los síntomas gastrointestinales pueden aparecer en la fase precoz de la enfermedad, incluso antes del desarrollo de la clínica respiratoria, por lo que su sospecha diagnóstica, fundamentalmente en todo paciente con posible contacto con la covid-19 reciente y durante el periodo de elevada incidencia del virus, será fundamental en el diagnóstico y manejo precoces4.
Estudios recientes señalan la detección del SARS-CoV-2 mediante PCR en heces de pacientes infectados, con una mayor prevalencia en aquellos con clínica digestiva, fundamentalmente diarrea5,6. El virus se ha detectado en muestras fecales después de la resolución de la sintomatología e, incluso, tras su aclaramiento en las vías respiratorias7,8, lo que podría representar una ruta de contagio adicional a la respiratoria y supondría cambios en las medidas de detección, así como del control de la propagación de la enfermedad9.
Se han descrito casos únicamente con sintomatología digestiva3,10, tal como el primer caso de covid-19 en EE. UU. Se trataba de un varón de 35 años que presentó un cuadro de náuseas y vómitos que, posteriormente, asoció diarrea y dolor abdominal. Se detectó ARN de SARS-CoV-2 en heces mediante PCR al séptimo día de enfermedad11.
Los síntomas digestivos reportados en las diferentes series de casos coinciden en que las manifestaciones clínicas más frecuentes son anorexia, diarrea, náuseas y vómitos; en menor medida, se han descrito también dolor abdominal y sangrado digestivo3,10.
Recientemente, se ha publicado un metaanálisis5 que recogía la información presente en las series descritas hasta marzo de 2020. Englobaba a un total de 4.243 pacientes con diagnóstico de covid-19 por PCR, provenientes de 60 estudios (53 de China y 7 de otros países, entre los que se encontraban uno estadounidense y otro británico). En este estudio, la prevalencia de síntomas digestivos en pacientes con infección por SARS-CoV-2 fue del 17,6%. Entre ellos, el 26,8% presentó anorexia, un 12,5%, diarrea, el 10,2%, náuseas y vómitos, y un 9,2%, dolor o malestar abdominal. En el análisis por subgrupos, se encontraron diferencias estadísticamente significativas por país de origen: en China, la prevalencia total de síntomas digestivos era del 16,1%, frente al 33,4% en el resto de los países.
El cuadro de diarrea descrito, por lo general, es de curso leve, de más de 3 deposiciones al día, cursa habitualmente sin deshidratación, suele aparecer al inicio del cuadro o durante su evolución y, además, puede verse agravado por los distintos fármacos utilizados para el tratamiento de la enfermedad12.
Se ha evaluado la presencia de síntomas digestivos y la gravedad del curso clínico de la enfermedad, con resultados variables. En el mencionado metaanálisis5, 11 de los 60 estudios los comparaban: la prevalencia de síntomas gastrointestinales fue del 17,1% en pacientes con enfermedad de curso grave (IC 95%: 6,9-36,7) frente al 11,8% (IC 95%: 4,1-29,1) en pacientes con covid-19 de curso no grave (p<0,001; I2 = 90,9% e I2 = 97,7%).
Redd et al.13 publicaron un estudio de cohortes multicéntrico que incluyó a 318 pacientes con la covid-19 con una elevada prevalencia de síntomas gastrointestinales: hasta el 61,3% presentaron, al menos, un síntoma digestivo, pero no encontraron diferencias en la gravedad del curso clínico, la necesidad de ventilación mecánica invasiva, ingreso en UCI ni mortalidad.
Respecto a la covid-19 en pacientes con enfermedad inflamatoria intestinal (EII), hoy en día no se dispone de evidencia firme sobre su repercusión en la evolución de la enfermedad, ni sobre el pronóstico en pacientes con tratamientos inmunosupresores14,15.
En una serie de 86 pacientes de la New York University Langone Health, con enfermedades inflamatorias inmunomediadas con tratamiento inmunosupresor e infección confirmada o altamente sospechosa por covid-19, no se apreció un peor pronóstico del cuadro viral16. Resultados similares se han observado en otras series recientemente publicadas17, en las que no se identifica un mayor riesgo de infección por el SARS-CoV-2 ni una mayor mortalidad en pacientes con EII.
Se ha especulado sobre un menor riesgo de complicaciones secundarias en pacientes con EII como consecuencia de la posible participación de los fármacos utilizados en el control de la cascada inflamatoria causante del distrés respiratorio agudo18.
Por otro lado, debido al uso frecuente de fármacos biológicos e inmunosupresores en pacientes con EII, se tiene cierta preocupación de que aquellos puedan ser más susceptibles a la infección por SARS-CoV-2, si bien todavía no se ha comunicado ningún infectado por este virus en una cohorte de más de 20.000 pacientes chinos con EII19.
Pese a ello, los chinos ya han implementado varias estrategias para minimizar el riesgo potencial de infección por SARS-CoV-2 en pacientes con EII; entre otras, una guía de práctica clínica propia20.
Hasta ahora, no se han notificado interacciones y efectos del SARS-CoV-2 en esófago, estómago, árbol biliar y páncreas, pero podrían aparecer en la literatura a su debido tiempo, a medida que se vayan mejorando los métodos de detección del virus21.
Covid-19 e hígadoAparte de las manifestaciones gastrointestinales, los pacientes con la covid-19 presentan frecuentemente daño hepático22.
Los datos de un estudio retrospectivo de un solo centro realizado en Wuhan (China) en pacientes con neumonía por SARS-CoV-2 detectaron elevaciones de ALT y AST en el 28% y el 35% de los pacientes, respectivamente, y un leve aumento de las cifras de bilirrubina (18% de los casos)23. En la mayoría estas alteraciones fueron leves, transitorias y sin relevancia clínica, si bien también puede producirse una afectación hepática grave en los pacientes críticos, hasta en el 28% de los casos24.
El mecanismo por el cual el virus SARS-CoV-2 causa daño hepático es desconocido. A la espera de que se realicen un mayor número de estudios y de autopsias, se postulan las siguientes hipótesis25,26.
- -
Daño hepático directo: el hecho de que se haya detectado ARN del SARS-CoV-2 en heces puede hacer pensar en una posible transmisión desde el intestino al hígado, a través de la circulación portal (viremia venosa portal)27. Los hepatocitos y colangiocitos podrían ser objetivos potenciales durante la infección por el virus (efecto citopático): la ECA-2 presenta niveles de expresión más altos en los colangiocitos, seguidos de los hepatocitos perivenulares en el hígado sano, y la disfunción de los colangiocitos podría producir daño hepático28. Apoyando esta hipótesis, Wang et al.29 realizaron el examen post mortem de 2pacientes fallecidos por la enfermedad y encontraron, por primera vez, partículas virales de SARS-CoV-2 en el citoplasma de los hepatocitos, con evidencia histológica tanto de daño citopático directo como de replicación viral intrahepatocitaria. Por otra parte, hay estudios en los que se ha observado una mayor incidencia de alteración hepática en los hombres30. Las diferencias de los niveles de expresión de la ECA-2 del hígado entre hombres y mujeres pueden ayudar a explicar las posibles diferencias clínicas en el curso de la infección por el SARS-CoV-2 en pacientes con una enfermedad hepática crónica subyacente31.
- -
Daño secundario a la respuesta inflamatoria sistémica y al estrés: en condiciones fisiológicas, el hígado es un órgano que filtra sustancias tóxicas y mantiene una inmunotolerancia, que puede verse afectada por la respuesta hiperinmune y la tormenta de citocinas que aparece en este proceso32. Hasta la fecha, en los pacientes cirróticos, en los que hay una disfunción del sistema retículo-endotelial, de los macrófagos y de la respuesta inmune adaptativa, se desconoce la implicación de dichos trastornos en el desarrollo de una forma más grave de la enfermedad hepática por el nuevo coronavirus33,34.
- -
La causa hipóxico/isquemia-reperfusión se ha descrito como la más frecuente del daño hepático grave, secundario a la claudicación pulmonar, y del shock que se producen en los pacientes críticos. En estos pacientes también hay que hacer referencia al daño hepático que, de forma colateral, puede ocasionar la congestión hepática secundaria al fallo cardíaco derecho, producido por la elevada presión positiva de la ventilación mecánica35.
- -
Daño hepático indirecto de origen tóxico-medicamentoso: en las escasas autopsias realizadas hasta la fecha en pacientes fallecidos por la covid-19, se ha evidenciado una esteatosis microvesicular con leve afectación inflamatoria lobular y portal, no específica, y similar a la encontrada en la hepatotoxicidad por fármacos36.
En la práctica clínica habitual es importante discernir el momento en el que se producen las alteraciones hepáticas. En este sentido, los modelos que estratifican el riesgo de enfermedad hepática grave en pacientes con covid-19 que se han desarrollado apuntan a que las enzimas hepáticas elevadas en el momento del ingreso, especialmente aquellas que indican daño hepatocelular (ALT y AST) y mixto (elevación de bilirrubina y GGT), previamente al uso de ciertos fármacos hepatotóxicos, estarían asociadas a formas más graves de enfermedad pulmonar y a un aumento de la estancia media hospitalaria37. Sin embargo, estos hallazgos, que están en continua reevaluación, precisan ser confirmados en estudios de cohortes prospectivos en un futuro.
Durante el ingreso, el uso de ciertos fármacos, especialmente lopinavir/ritonavir y, en la actualidad, remdesivir y tocilizumab (y, en menor medida, hidroxicloroquina y azitromicina) son el factor de riesgo de daño hepático más importante, lo que indica la necesidad de una monitorización estrecha de la bioquímica hepática en pacientes en tratamiento con estos fármacos38.
Por otra parte, la presencia de comorbilidades, como obesidad, diabetes o hipertensión arterial, entre otras, parece influir en el pronóstico de esta enfermedad causada por el nuevo coronavirus.
Varios estudios39,40 han analizado cómo la afectación hepática crónica que se produce en la covid-19, con una prevalencia del 2-11% de los pacientes, podría influir en la propia enfermedad. Hasta la fecha, el número de estudios es muy limitado y es difícil valorar ese impacto, pero estudios de cohortes y un reciente metaanálisis de 5estudios, en el que se comparaba la progresión de la enfermedad en pacientes con y sin hepatopatía crónica previa, indican que la enfermedad hepática crónica no parece influir de forma significativa en la gravedad ni en su curso evolutivo (OR: 0,67; IC 95%: 0,30-1,49; p=0,326). Sin embargo, en los estudios analizados, la causa precisa de la hepatopatía crónica desarrollada no ha sido publicada y el número de dichos estudios es insuficiente.
De otro lado, los estudios de cohortes que analizan el curso de la covid-19 en pacientes con hepatitis virales (hepatitis B)41 y los que valoran en la enfermedad por el nuevo coronavirus el impacto de la enfermedad hepática grasa no alcohólica, especialmente cuando hay obesidad, concluyen que existe un mayor riesgo de desarrollar una forma grave de neumonía y de estancias hospitalarias más prolongadas42, si bien los datos disponibles al respecto son aún insuficientes.
En cuanto a los pacientes con hepatitis autoinmune, hasta la fecha, no existe evidencia científica que avale o recomiende la disminución o cambio de la inmunosupresión, lo que, incluso, podría ocasionar una reactivación de la enfermedad y oscurecer su pronóstico. No obstante, parece adecuado estratificar los riegos de desarrollar complicaciones, monitorizar estrechamente a estos pacientes durante la infección y proponer reducir la inmunosupresión, particularmente los antimetabolitos, en los pacientes que presentan linfopenia o empeoramiento del curso de la enfermedad43.
Quedan otras cuestiones por resolver, como el efecto que podría tener la cascada inmune desencadenada en la covid-19, a corto y largo plazo, en las hepatopatías preexistentes44 como la esteatosis y la afectación que el SARS-CoV-2 podría tener en las hepatopatías colestásicas (colangitis biliar primaria y colangitis esclerosante primaria), a través del receptor ECA-2, además de las consecuencias que el daño hepático producido en la covid-19 podría tener en los pacientes con menor reserva hepática.
En este sentido, y para proporcionar respuestas en el futuro, se ha desarrollado el registro covid-Hep/Secure-Cirrhosis, de carácter universal y colaborativo, con el fin de constatar cómo la enfermedad hepática preexistente y el trasplante de hígado afectan al curso de la covid-19, y recoger, a su vez, factores del paciente como la edad, sexo, comorbilidad y la medicación empleada para analizar su influencia en el curso y los resultados de la enfermedad.
El registro se actualiza semanalmente. En la última actualización, del 12 de mayo de 2020, la cohorte controlada era de 491 pacientes; hasta esa fecha, destaca un 36% de mortalidad en los pacientes con cirrosis, muy superior a la de otros pacientes con hepatopatía crónica no cirrótica (7%) o a la de pacientes con trasplante hepático (20%), datos que seguirán siendo analizados conforme avance el registro (ver en https://www.covid-hep.net/updates.html).
Endoscopia digestiva en el contexto de la covid-19Durante la realización de la endoscopia digestiva se pueden originar aerosoles con una alta capacidad infectiva, lo que obliga a considerar a esta técnica, en todas sus modalidades, como una exploración con elevado riesgo de infección y a poner en marcha medidas de prevención para todo el personal de endoscopias.
En este sentido, algunos expertos y diversas organizaciones científicas de todo el mundo se han apresurado a elaborar diferentes guías de funcionamiento de las unidades de endoscopia digestiva durante la pandemia por el SARS-CoV-2.
Todas estas guías han ido renovando sus recomendaciones iniciales conforme avanzaba la pandemia. En general, todas ellas coinciden en sus objetivos finales45: proteger a todos los sanitarios implicados en la realización de la endoscopia digestiva, así como a los pacientes y sus cuidadores, y mantener funcionantes las unidades de endoscopia, en términos de cantidad y, sobre todo, de calidad/seguridad.
Para lograr estos objetivos, todas las guías inciden, en mayor o menor grado, en aspectos tales como:
- 1.
Reorganización de las agendas de trabajo de la unidad de endoscopia.
- 2.
Valoración/cribado del riesgo infeccioso del paciente y de la técnica endoscópica.
- 3.
Utilización de equipos de protección individual y su adecuación según el riesgo.
- 4.
Seguimiento en el domicilio del paciente y del personal.
- 5.
Desinfección del material endoscópico y de las salas de exploración.
A continuación, se revisan las guías y recomendaciones publicadas, procedentes de distintos países y continentes, tratando de extraer sus puntos comunes y aquellos en los que no coinciden totalmente.
Procedentes de EE. UU., se han revisado las guías de la American Gastroenterological Association (AGA)46, del American College of Gastroenterology (ACG) y de la American Society for Gastrointestinal Endoscopy (ASGE)47; de Europa, la guía de la European Society Gastrointestinal Endoscopy Nurses and Associates (ESGENA)48; de España, la guía de la Sociedad Española de Patología Digestiva (SEPD)-Asociación Española de Gastroenterología (AEG)45; de la Región Asia-Pacífico, la guía de la Asian Pacific Society of Digestive Endoscopy (APSDE)49; de Reino Unido, la guía de la British Society of Gastroenterology (BSG)50; de Japón, la guía de la Japan Gastroenterological Endoscopy Society (JGES) 51; de Arabia Saudí, la guía de la Saudi Gastroenterology Association (SGA)52 y de la India, la guía de la Society of Gastrointestinal Endoscopy of India, Indian Society of Gastroenterology, Indian National Association for the Study of the Liver (SGEI-ISG-INASL)53.
Asimismo, se han revisado las recomendaciones procedentes de China54, Italia55, Singapur56, Australia (Gastroenterological Society of Australia [GESA])57 y la Organización Mundial de Endoscopia (WEO)58.
En cuanto a la reorganización de la actividad endoscópica, todas las fuentes consultadas coinciden en disminuir el número de exploraciones a fin de evitar la masificación en las áreas de endoscopia y contagios entre el personal, y de permitir airear las salas y ahorrar en equipos y material de protección.
Todas las organizaciones45-58 recomiendan que se prioricen las exploraciones urgentes: hemorragia digestiva alta y baja con repercusión hemodinámica, colangiopancreatografía retrógrada endoscópica en casos de colangitis aguda obstructiva, disfagia aguda, obstrucción que requiera de una prótesis y colocación de gastrostomías, cuando no pueda demorarse la alimentación.
Coinciden en que el resto de las indicaciones deberían demorarse hasta un plazo que podría ir más allá de 12 semanas. Es el caso de las endoscopias de cribado, las de seguimiento y aquellas en pacientes sin síntomas de alarma. No obstante, algunas guías45,50 establecen un nivel intermedio, con indicaciones para discutir, algunas de las cuales deberían hacerse antes de ese plazo de 12 semanas, valorando el riesgo del retraso diagnóstico, las condiciones del paciente y el hospital, así como la disponibilidad de otros servicios de apoyo, como cirugía, radiología y oncología.
El riesgo de infección parece más dependiente del paciente que del tipo de exploración; no obstante, en lo que respecta a esta última, existen algunas diferencias entre las fuentes consultadas. Algunas recomendaciones45,55 consideran la colonoscopia como una técnica de riesgo bajo o intermedio, mientras que el resto46,56-58 no hacen diferencia entre la endoscopia alta y baja.
Respecto a la valoración del riesgo infectivo de los pacientes, todas las fuentes consultadas45-58 recomiendan hacer un cribado mediante una entrevista clínica 24h antes y el día de la prueba. Se investigará la presencia de fiebre, tos, disnea o síntomas digestivos (diarrea) en las 2semanas previas y sin causa aparente, así como el potencial contacto con pacientes con covid-19 confirmada.
La ASGE47 recomienda, además, la toma de temperatura el día de antes, por el propio paciente, y el de la exploración, ya en la unidad de endoscopias. Con base en este cribado los pacientes se consideran de riesgo infectivo bajo, intermedio o alto.
La mayoría de las organizaciones45,49-54,56-58 descartan un nivel de riesgo infectivo bajo y hablan de riesgo intermedio (sin síntomas) y riesgo alto (con síntomas, contacto o diagnóstico de covid-19 confirmado). Solo serían de riesgo bajo aquellos pacientes que hubieran pasado la infección y tuvieran PCR negativo. Todas las guías45-58 coinciden en demorar las endoscopias de pacientes con riesgo alto, salvo aquellas con indicación urgente o inaplazable.
Solo algunas de las instituciones45,48,53,55 recomiendan que el paciente acuda al hospital acompañado por un solo familiar, a ser posible menor de 65 años, que deberá permanecer siempre fuera de la unidad mientras dure el procedimiento.
De las fuentes consultadas, solo la SEPD, ESGE y la china45,48,54 recomiendan que el paciente lleve una mascarilla quirúrgica mientras permanezca en la unidad. La ASGE y la guía india47,53 solo la recomiendan si el paciente tiene síntomas. El resto de las asociaciones no se pronuncian.
Todas las guías45-58 inciden en las medidas generales (limpieza de manos antes y después de cada exploración, mantener el distanciamiento social, uso de mascarillas quirúrgicas fuera de las salas), en la formación de equipos estables de trabajo, en evitar el trasiego de los endoscopistas a zonas potencialmente infectadas, en el uso de un solo ordenador por médico y en la limpieza diaria del puesto de trabajo con una solución desinfectante específica.
En cuanto a los equipos de protección individual, varias de las guías consultadas47,48,50,53,57,58 recomiendan que el personal de la unidad reciba entrenamiento específico sobre su uso.
La AGA y la mayor parte de las organizaciones46,47,50-54,56-58, a su vez, recomiendan el uso de mascarillas tipo FFP2 y FFP3 para los procedimientos con riesgo de formación de aerosoles y no distinguen entre endoscopia alta y baja.
La SEPD, ESGE, APSDE y el grupo italiano45,48,49,55 recomiendan usar mascarillas quirúrgicas en pacientes de riesgo bajo o moderado, tanto en gastroscopias como en las colonoscopias.
En cuanto a las batas, la mayoría de las asociaciones46,56-58 recomiendan usar batas impermeables. La SEPD y el grupo italiano45,55 abogan por las batas quirúrgicas de un solo uso en procedimientos y pacientes de riesgo bajo o moderado.
Todas las organizaciones consultadas recomiendan el uso de guantes de nitrilo o látex y, alguna de ellas48, usar doble guante en pacientes de alto riesgo.
Tras realizar la endoscopia a un paciente de alto riesgo o con la covid-19 confirmada, se deben desechar la bata impermeable y la mascarilla utilizadas. En caso de desabastecimiento de estas últimas, la AGA46 recomienda cubrir las mascarillas con una quirúrgica para reutilizarlas y prolongar sus horas de uso, y así ahorrar material (evidencia escasa).
Existe unanimidad en usar gafas, o pantalla facial, y gorro desechable en todas las exploraciones, y de que se use una sala y personal específicos en pacientes de alto riesgo o con covid-19 confirmada.
De las guías revisadas, la AGA-ASGE y la ESGE47,48 recomiendan seguimiento del paciente una vez que abandone el hospital, a los 7 y 14 días, interrogándole sobre la posible aparición de nuevos síntomas que pudieran hacer pensar en la covid-19.
Cualquier miembro de la unidad con síntomas compatibles con la covid-19 debe abstenerse de acudir a trabajar y contactará con la unidad de salud laboral del hospital para adoptar las medidas oportunas.
Las guías45-58 coinciden en todo lo relativo al proceso de limpieza/desinfección, procesamiento de los endoscopios y material y de las salas de trabajo:
Se usarán los desinfectantes habituales, el ácido peracético, con eficacia demostrada frente a bacterias, micobacterias, virus y hongos. Todo el material se debe transportar a la zona de lavado en bolsas de plástico cerradas. Los endoscopios deben someterse a lavado manual antes de ser introducidos en las lavadoras. El material auxiliar debe ser de un solo uso, que se desechará en contenedores específicos. Todas las superficies y objetos que hayan estado en contacto con el paciente o sus secreciones (camilla, barandillas, pulsioxímetro, suelo, cuarto de aseo, torre de endoscopia, etc.) se deberán desinfectar tras cada exploración con una solución de hipoclorito sódico/lejía diluida al 1:100.
Tras la exploración a un paciente de riesgo intermedio, la sala debe permanecer vacía y aireada durante al menos 30 min. En caso de pacientes de alto riesgo, o con covid-19 confirmada, este tiempo debe ser de 60 min.
En cuanto al riesgo de infección para el personal sanitario y eficacia de las medidas de protección, Repici59 publica la experiencia retrospectiva de 42 unidades de endoscopia, de otros tantos hospitales de Italia, con un total de 968 sanitarios investigados. Un total de 42, resultaron positivos para SARS-CoV-2 (23 médicos, 16 enfermeras y 3 auxiliares). De ellos, 36 manifestaron síntomas respiratorios y solo 2, síntomas digestivos. Tan solo 6 sanitarios requirieron ingreso en planta y fueron dados de alta en un plazo medio de 8 días. El 70% de las unidades (con un total de 671 sanitarios) no reportaron ningún caso de infección. Tres centros acumularon el 55% de los casos positivos, la mayor parte de ellos acaecidos antes de la puesta en marcha de las medidas de protección estrictas recomendadas en Italia (8 marzo).
El análisis demuestra que la tasa de infección entre el personal de endoscopias fue muy baja, de tan solo el 4,3%, muy inferior al 10%, que era la tasa estimada en Italia para el personal sanitario durante la crisis. La mayor parte de los 968 sanitarios usaron solo mascarillas quirúrgicas, reservando las N95 o equivalentes para pacientes infectados o con alto riesgo.
¿Cómo reanudar la actividad endoscópica tras el cese del brote actual46,49,60?
Antes de retomar la actividad habrá que tener en cuenta varios factores, como la situación real de la covid-19 en nuestro hospital y área de salud; llevar a cabo una reapertura progresiva de las agendas; cuantificar el número de exploraciones pendientes; reevaluar las indicaciones; asignar un grado de prioridad (alto, medio o bajo) a las pruebas indicadas; cribar el riesgo de infección por SARS-CoV-2 mediante anamnesis y toma de temperatura en todos los pacientes; asegurar la disponibilidad de equipos de protección individual y de material de protección para todo el personal y establecer protocolos de trabajo.
El primer punto es sumamente importante y algunas guías vinculan el aumento de la actividad en las distintas indicaciones (urgentes, preferentes y electivas) al número de casos de infección presentes. Ante un número elevado de casos, se priorizarán las urgentes. Posteriormente, se irá aumentando la actividad para casos preferentes y electivos, en ese orden, según vaya reduciéndose el número de nuevos infectados, hasta recuperar el 100% de actividad en todos los subgrupos, pero ¿cuándo? No se puede saber todavía.
Las agendas deben tener en cuenta la nueva situación y ampliar los tiempos por exploración. Cuando el número de nuevos infectados sea bajo, en la desescalada, se podrá retomar la actividad de forma progresiva y de acuerdo con la priorización anteriormente establecida. En esta situación, deberá considerarse reiniciar el estudio endoscópico en pacientes con hemorragia digestiva sin signos de inestabilidad, la resección de pólipos colónicos complejos, cuando haya sospecha de inicio de EII, si hay clínica digestiva con síntomas de alarma, con síntomas sospechosos de neoplasia rectocolónica o con resultado positivo para el test de sangre oculta en heces, en reprogramar la ligadura de varices de riesgo y en retomar los estudios de diagnóstico/estadificación de pacientes con sospecha de neoplasia pancreática (ultrasonografía endoscópica).
La nueva normalidad va a obligar a todo el personal de los equipos de las unidades de endoscopia digestiva a seguir utilizando de forma rutinaria las normas generales de prevención de la infección y, mientras siga habiendo casos y alto riesgo de contagio del virus en la comunidad, todos los pacientes deberán de ser considerados como potencialmente infectados, por lo que se deberán de seguir usando los equipos de protección individual en todas las exploraciones endoscópicas, con todo lo que ello puede conllevar de incomodidades y retraso en las exploraciones.
Conflicto de interesesLos autores declaran no tener conflictos de interés.