Este artículo resume las principales novedades en el ámbito de la hemorragia gastrointestinal no varicosa comunicadas en el último Congreso Americano de Gastroenterología (DDW) en el año 2013. Se han de destacar algunos estudios que han aportado conocimientos en áreas de incertidumbre. En este sentido, y entre otros hallazgos, se ha comunicado que la administración de inhibidores de la bomba de protones (IBP) previa a la endoscopia o la realización de esta de manera precoz, antes de las 6h de la admisión del paciente con hemorragia digestiva alta (HDA), o de la colonoscopia en las primeras 24h para hemorragia digestiva baja, no mejora el pronóstico de estas. Igualmente se ha señalado que la administración oral de IBP tras la hemostasia endoscópica puede no ser inferior a los resultados obtenidos con IBP por vía intravenosa. En el campo de la terapia endoscópica destacaría el tratamiento con ablación por radiofrecuencia para la ectasia vascular antral. En el campo de la HDA y antiinflamatorios no esteroideos (AINE), nuevos datos confirman el riesgo de sufrir episodios cardiovasculares tras interrumpir el tratamiento con ácido acetilsalicílico por una HDA, el riesgo incrementado de esta al asociar fármacos gastrotóxicos y la necesidad de conocer los diferentes riesgos gastrointestinales y cardiovasculares de los diferentes AINE y coxibs al realizar la prescripción. Finalmente se ha señalado que existen evidencias para considerar que tanto factores ambientales como genéticos están involucrados en la susceptibilidad individual de sufrir hemorragia gastrointestinal.
This article summarizes the main studies in the field of non-variceal gastrointestinal bleeding reported in the last American Congress of Gastroenterology (Digestive Disease Week) in 2013. Some of these studies have provided new knowledge and expertise in areas of uncertainty. In this context and among other findings, it has been reported that the administration of a proton pump inhibitor (PPI) prior to endoscopy or the early performance of endoscopy–within 6 hours of admission in patients with upper gastrointestinal bleeding (UGIB) (or colonoscopy within 24 hours in patients with lower gastrointestinal bleeding)–does not improve the prognosis of the event. It has also been reported that oral administration of a PPI after endoscopic hemostasis may produce a similar outcome to that of intravenously administered PPI in patients with upper gastrointestinal bleeding (UGIB). In the field of endoscopic therapy, the use of radiofrequency ablation for antral vascular ectasia is of interest. Regarding UGIB and nonsteroidal antiinflammatory drugs (NSAIDs), new data confirm the risk of cardiovascular events by stopping treatment with acetylsalicylic acid (ASA) after an episode of UGIB, the increased risk of UGIB when associating gastrotoxic drugs, and the need to identify both the gastrointestinal and cardiovascular risks of each NSAID and coxib when prescribing these agents. Finally, there is evidence that both environmental and genetic factors are involved in individual susceptibility to gastrointestinal bleeding.
En el último congreso de la American Gastroenterological Association (AGA) se han presentado varios estudios de interés que tienen que ver con el manejo del paciente sangrante por lesiones del tubo gastrointestinal de origen no varicoso. A continuación se describe un resumen de los estudios más relevantes bajo mi punto de vista.
Hemorragia gastrointestinal altaManejo preendoscópicoLas guías actuales recomiendan endoscopia temprana (dentro de las 24h) ante la presencia de hemorragia digestiva alta no varicosa aguda (HDANV)1, pero se desconoce si una endoscopia realizada de manera más precoz puede dar mejores resultados en términos de mortalidad, necesidad de cirugía y utilización de recursos. En este sentido se presentó un estudio llevado a cabo en la Clínica Mayo donde se evaluó el rendimiento endoscópico y los resultados de los pacientes en dependencia de la práctica de una endoscopia urgente (≤ 8h) frente a endoscopia precoz (9–24h) en pacientes con HDANV. Para ello se revisaron 400 pacientes consecutivos que acudieron a urgencias hospitalarias con hematemesis o melenas en un período comprendido entre enero de 2009 a diciembre de 2010, de acuerdo a una base de datos mantenida prospectivamente. El momento de la endoscopia se decidió por el médico de guardia y el equipo de gastroenterología, de acuerdo a la práctica clínica estándar. Una endoscopia positiva se definió por la identificación de la causa de la hemorragia y la presencia de estigmas de alto riesgo de sangrado reciente (coágulos adherentes, vasos visibles o hemorragia activa). Las características basales del paciente, los hallazgos endoscópicos y los resultados clínicos fueron comparables entre los 2 grupos. Finalmente, 209 pacientes cumplieron los criterios de inclusión. Todos los pacientes recibieron inhibidores de la bomba de protones (IBP) por vía intravenosa (i.v.) y transfusiones de sangre según el protocolo estándar clásico de la Institución. No hubo diferencias significativas en las características basales entre los 2 grupos, excepto para una mayor proporción de estancia en la unidad de cuidados intensivos en el grupo de endoscopia urgente. Los hallazgos endoscópicos positivos para ambos grupos (endoscopia urgentes y precoz) fueron similares (14/72 [19%] y 27/137 [19%], respectivamente; p=0,96). No hubo diferencias con respecto a la mortalidad hospitalaria (el 1,3 frente al 2,9%; p=0,49), la necesidad de repetir la endoscopia dentro de las primeras 72h (el 16 frente al 17%; p=0.07), el número de transfusiones (2 frente a 1 unidad; p=0,52), la necesidad de tratamiento endoscópico hemostático (el 24 frente al 23%; p=0,87) o la duración de la estancia hospitalaria (3,7±2,9 frente a 3,2±0,3 días; p=0,34). Los autores concluyeron que el momento de la endoscopia dentro de las primeras 24 h no afecta al resultado final del episodio de HDANV. En mi opinión, los resultados son interesantes, pero se ha de reconocer que el estudio puede carecer de potencia suficiente para mostrar diferencias y que al no ser un estudio aleatorizado y ciego puede estar sesgado en el sentido de realizar una endoscopia más precoz en los pacientes más graves, por lo que el tema no queda resuelto todavía2.
Otro de los temas todavía abiertos y en discusión es la necesidad o no de administrar IBP previo a la realización de la endoscopia urgente o precoz y si esta acción terapéutica tiene efectos favorables para el paciente con HDANV. Un estudio realizado en Reino Unido analizó este extremo en 404 pacientes, 202 recibieron omeprazol i.v. durante una mediana de 1 día (rango, 0,25–2) antes de la endoscopia y 202 no, según criterio del médico de guardia. El omeprazol se administró bien en bolo de 40mg 2 veces al día (n=103; 51%), o como una perfusión de 8mg/h después de una carga de 80mg (n=99; 49%). Después de la endoscopia, el omeprazol se administró por vía i.v. o por vía oral en los pacientes que presentaban úlceras/erosiones en el esófago, estómago o duodeno. Se evaluó la necesidad de transfusión de sangre, estancia hospitalaria > 6 días y mortalidad a los 30 días. Los 2 grupos fueron comparables en cuanto a su sexo, tabaquismo, consumo de alcohol, y el uso de antiinflamatorios no esteroideos (AINE), aspirina, antitrombóticos y otros fármacos. El grupo tratado con omeprazol preendoscopia tenía mayores puntuaciones para las escalas de Blatchford y Charlson. Sin embargo, cuando los análisis de los resultados en términos de necesidad de transfusión de sangre, duración de la estancia hospitalaria o mortalidad a los 30 días, se ajustaron por estos 2 parámetros de comorbilidad, no se observaron diferencias significativas entre los pacientes que recibieron el IBP antes de la endoscopia y los que no lo hicieron. De nuevo, el estudio va en la dirección de otros estudios (no diferencias en resultados clínicos de interés), pero adolece de rigidez metodológica en términos de aleatorización (los más graves recibieron tratamiento con IBP), tamaño muestral y mezcla de lesiones leves con otras potencialmente graves3.
A pesar de que en nuestro país los hospitales que usan algún tipo de escala pronóstica del riesgo de los pacientes con hemorragia digestiva alta (HDA) es muy bajo4, el consenso internacional recomienda que estas deben usarse (especialmente las escalas de Glasgow Blatchford [GB] o Rockall [R]) para predecir qué pacientes precisan un mayor cuidado y atención con objeto de reducir la mortalidad y complicaciones1,5. En este sentido se sigue investigando, fundamentalmente, en varios aspectos relacionados con las escalas de gravedad de cara a mejorar su predictibilidad. Uno de estos estudios evaluó si una puntuación baja preendoscópica en la escala de R podía utilizarse para identificar a los pacientes que podían ser dados de alta desde urgencias sin necesidad de endoscopia inmediata, posponiéndola a una posterior consulta externa. De los 412 pacientes analizados con un diagnóstico de HDA por úlcera péptica en la endoscopia, 37 (9%) tuvieron una puntuación baja en la escala de R completa. Ningún paciente de este grupo murió, requirió cuidados intensivos o precisó intervención quirúrgica. Por el contrario, de los 54 pacientes con una baja puntuación de la escala de R preendoscópica (puntuación de 0), un 31% tenía estigmas endoscópicos de riesgo y precisó intervención endoscópica, un 13% precisó transfusión de más de 2 unidades de sangre, la tasa de resangrado fue del 6,5%, la mortalidad del 2,1% y la necesidad de intervención quirúrgica del 3,4%. Los autores concluyeron que los pacientes con HDA por úlcera péptica y baja puntuación en la escala de R completa pueden ser dados de alta después de la endoscopia, pero que, sin embargo, el uso de la escala preendoscópica de R no predice los pacientes que pueden ser manejados con seguridad en el hogar y manejados de forma ambulatoria6. Otro estudio de menor envergadura que el anterior sugirió que la escala clínica de R que no precisa de hallazgos endoscópicos tiene la misma capacidad predictiva que la escala de GB y la de R completa para identificar pacientes que requieren intervenciones, como la transfusión de sangre y la terapia endoscópica o quirúrgica, así como un alto riesgo de resangrado y muerte7. Obviamente, de ser cierto, la escala clínica de R tiene la ventaja de su facilidad de cálculo tan pronto como el paciente está en la sala de emergencias o en el ámbito ambulatorio, pero, como hemos visto, los datos son contradictorios y, en cualquier caso, dado lo limitado del estudio, esta conclusión debe tomarse con extrema cautela. Otro estudio apunta también en la dirección contraria y señala que el triaje y decisión clínica de los facultativos de guardia en la unidad de urgencias es más fiable en predecir episodios adversos que la escala preendoscópica de R8.
Se han evaluado también otras escalas pronósticas buscando capacidad predictiva y facilidad en su cálculo. De ellas destaca la AIMS65 (que incluye los parámetros: albúmina sérica < 3,0g/dl, INR [coeficiente internacional normalizado] > 1,5, estatus mental alterado, presión arterial sistólica ≤ 90mmHg y edad > 65 años), que aunque ha demostrado una buena capacidad predictiva para mortalidad intrahospitalaria, no hay estudios que analicen la mortalidad a 30 días o la necesidad para algún tipo de intervención como transfusión de sangre, endoscopia o intervención quirúrgica en pacientes con HDANV. Un estudio retrospectivo en 802 pacientes señala que la escala AIMS65 proporciona información precisa para mortalidad a corto plazo, pero no para la necesidad de intervención en HDA aguda relacionada con la hospitalización9. Un estudio italiano ha centrado también su investigación en la detección de los factores determinantes de mortalidad por HDA intrahospitalaria. Para ello analizaron de forma prospectiva 2 bases de datos nacionales multicéntricas que contienen datos sobre pacientes consecutivos ingresados en hospitales y que presentan HDANV. En ambos estudios, la mortalidad a 30 días fue la variable principal. Se incluyó un total de 2.471 pacientes consecutivos. El sangrado intrahospitalario se registró en 360 pacientes (14,6%; varones=65,8%) con una edad media de 68,8±16,3 años. La tasa de mortalidad en pacientes con hemorragia intrahospitalaria fue significativamente mayor que la observada en pacientes ambulatorios (el 8,61 frente al 3,84%; odds ratio [OR]: 2,3; intervalo de confianza [IC] del 95%, 1,52–3,5; p<0,001). Entre las 165 variables analizadas, el riesgo de muerte por hemorragias en el hospital aumentó con la presencia de comorbilidad grave, categorizadas por un puntaje ASA de 3 o 4 (OR: 2,52; IC del 95%, 1,98–3,20). Los factores de riesgo clínicos más relevantes entre las comorbilidades fueron la presencia de insuficiencia renal crónica (OR: 2,93; IC del 95%, 1,28–6,68), antecedentes de úlcera péptica (OR: 3,84; IC del 95%, 1,78–8,27) y la presencia de neoplasia (OR: 1,9; IC del 95%, 0,73–4,94). El fallo del tratamiento endoscópico resultó ser el predictor no clínico más relevante de la muerte (OR: 5,76; IC del 95%, 1,34–24,72)10. Incidiendo en este tema, otro estudio investigó si el tamaño de la úlcera sangrante como variable sola o en combinación con otros factores de riesgo era un predictor independiente de mala evolución de HDA por úlcera péptica. Se incluyeron de manera retrospectiva 1.264 pacientes. Para las úlceras ≥ 10mm, las probabilidades de resangrado a 30 días aumentaron un 6% por cada aumento del 10% en el tamaño de la úlcera (OR: 1,06; IC del 95%, 1,2–1,10; p=0,0053). Otros factores de riesgo de resangrado a 30 días fueron la presencia de estigmas endoscópicos de alto riesgo, sangrado intrahospitalario e historia de sangrado gastrointestinal previo. El tamaño de la úlcera no fue un predictor de cirugía a 30 días. Los factores de riesgo de mortalidad a los 30 días fueron la presencia de estigmas endoscópicos de alto riesgo, hemorragia intrahospitalaria, tiempo de protrombina > 35 s y cirrosis. Combinado con los estigmas de alto riesgo endoscópico, el tamaño de la úlcera fue un factor de riesgo de muerte (OR: 1,08 por cada 10% de aumento en el tamaño de la úlcera; IC del 95%, 1,02–1,14; p=0,0095)11. El resumen de todo este apartado podría ser que a día de hoy debemos mantener la realización de escalas pronósticas en estos pacientes y utilizar tanto el juicio clínico propio como los datos de la endoscopia realizada lo antes posible, ya que los datos nuevos no señalan escalas que mejoren las clásicas que incluyen datos de los hallazgos endoscópicos.
Al margen de las HDA por úlcera péptica se han comunicado también los resultados de HDA debida a o relacionada con otras causas. En este sentido, dado el creciente número de cirugías por obesidad mórbida que estamos observando en nuestro entorno, tiene interés el análisis llevado a cabo en Estados Unidos de las consecuencias de la ulceración en la anastomosis gastroyeyunal, que es una complicación tardía común después de bypass gástrico en Y de Roux, ya que se da en el 20% de los pacientes. La hemorragia es una complicación potencialmente grave de esta ulceración. Un estudio de cohorte retrospectivo utilizando la Muestra Nacional de Pacientes Internados en 2010, una base de datos representativa a nivel nacional de las hospitalizaciones en Estados Unidos, identificó 2.881 pacientes con úlcera de la anastomosis gastroyeyunal tras este tipo de cirugía bariátrica, de los que 1.024 presentaron hemorragia digestiva. La edad y la puntuación de Charlson fueron más altas en el grupo de úlcera sangrante. La tasa de mortalidad fue significativamente mayor en los pacientes con hemorragia por úlcera (p<0,01), aunque esta (2,1%) fue significativamente inferior a la tasa encontrada en hemorragia digestiva de origen no variceal12. Este mismo grupo, en un análisis de los 146.395 procedimientos bariátricos recogidos en la misma base de datos, señala que de todos los tipos de cirugía bariátrica realizada (bypass en Y de Roux, colocación de la banda gástrica ajustable laparoscópica, gastrectomía vertical en manga, gastroplastia y cirugías malabsortivas), la incidencia de hemorragia digestiva postoperatoria fue más alta después de cirugías de malabsorción, y disminuyó de forma secuencial con la gastroplastia, la gastrectomía vertical en manga, la Y de Roux y, finalmente, con la banda gástrica ajustable por vía laparoscópica. El riesgo de muerte atribuible a sangrado varió del 0% con la banda gástrica al 3,2% tras las cirugías de malabsorción. Finalmente se estimó que este tipo de complicaciones suponían una elevada carga económica para el sistema sanitario, pues el sangrado postoperatorio se asoció con un aumento en la duración de la estancia de 16.728 pacientes/día y un coste total de 138 millones de dólares (de 2 millones de dólares para la banda gástrica a 75 millones para las cirugías de malabsorción)13.
Manejo endoscópicoSe han comunicado nuevos procedimientos y sus resultados para lesiones sangrantes difíciles de tratar. Uno de ellos es el tratamiento mediante radiofrecuencia de las lesiones ectásicas vasculares del antro, que hasta ahora se están tratando preferentemente mediante argón plasma. Un estudio llevado a cabo en 8 centros europeos y 1 centro en Estados Unidos evaluó la viabilidad, eficacia y seguridad de la ablación por radiofrecuencia para el tratamiento endoscópico de la ectasia vascular antral como causa de HDA. Se incluyeron 18 pacientes con una media de edad 74±8 años y diversas condiciones subyacentes como cirrosis (7), insuficiencia renal crónica (2), diabetes (6) y síndrome de Sjogren (1). Cuatro pacientes estaban siendo tratados con aspirina, 14 habían recibido tratamiento anterior con argón (rango, 1–24 sesiones), 2 tenían tratamientos previos con electrocoagulación bipolar y 1 con crioterapia. Diez pacientes tenían signos endoscópicos de hemorragia reciente. La radiofrecuencia se realizó con el catéter de ablación HALO90 y el sistema HALOFLEX. Los pacientes recibieron una media de 2,2±0,9 sesiones (rango, 1–4). La media estimada de lesiones ectásicas gástricas tratadas fue de 93±8% (rango, 80–100%). La duración media de cada sesión fue de 37±17 min, y no se observó ninguna complicación. El número de transfusiones disminuyó significativamente, de 7,2±10,1 unidades (rango, 0–47) en los 6 meses antes del tratamiento con radiofrecuencia a 2,3±6,1 (rango, 0–27) en los 6 meses después de este (p<0,001). La tasa de hemoglobina más baja se incrementó significativamente, desde 7,0±1,2g/dl (rango, 5,0–9,6g/dl) en los 6 meses antes del tratamiento a 10,2±1,6g/dl (rango, 6,4–14,2g/dl) en los 6 meses después del tratamiento (p<0,001). Los autores concluyeron que la radiofrecuencia permite un tratamiento completo de la ectasia vascular gástrica de una manera segura y oportuna, y que podría convertirse en el procedimiento de primera línea de la ectasia vascular gástrica si se confirman los resultados en un estudio prospectivo de mayor envergadura, aspecto este con el que coincido plenamente14.
Otra lesión en ascenso y difícil de tratar son las lesiones o úlceras de Dieulafoy, que consisten en arteriolas anormalmente grandes, tortuosas y submucosas en la pared del estómago que, eventualmente, pueden erosionar la mucosa y sangrar. Aunque poco frecuentes pueden causar sangrado masivo y grave. Se han probado varias modalidades endoscópicas terapéuticas, pero no se ha demostrado la superioridad de ninguna de ellas. El videoclip Over-The-Scope —OTSC® CLIP— (Ovesco) es un nuevo dispositivo endoscópico descrito recientemente para el tratamiento de la HDA refractaria debida a grandes vasos visibles dentro de las úlceras. En teoría, el tamaño de la pinza y su gran fuerza de compresión proporcionan una ventaja en el tratamiento. Se han comunicado los resultados en 6 pacientes con HDA por lesión de Dieulafoy tratados con éxito con Ovesco. La tasa de éxito de la serie fue del 100%, con una sola complicación directamente relacionada con el uso del dispositivo (un desgarro superficial de la mucosa del esófago durante el paso de Ovesco, que fue cerrado utilizando clips sin otras complicaciones). Todos los pacientes permanecieron sin sangrado después del seguimiento durante al menos 4 semanas15.
Manejo postendoscópicoEl tratamiento endoscópico de lesiones no siempre es efectivo y la recurrencia hemorrágica es un desafío importante. Un estudio danés examinó si la embolización arterial transcatéter realizada después de una hemostasia endoscópica lograba mejorar los resultados en pacientes con úlceras de alto riesgo. El estudio fue diseñado como un no-ciego, de grupos paralelos, aleatorizado, controlado y realizado en un hospital universitario. Los pacientes ingresados con úlceras Forrest Ia-IIb controladas por la terapia endoscópica fueron aleatorizados (1:1) para recibir embolización arterial transcatéter del sangrado arterial dentro de las 24 h o el tratamiento estándar continuo. La aleatorización se estratificó según estigmas de hemorragia. Los pacientes fueron seguidos durante 30 días. Se incluyó un total de 105 pacientes. De los 49 pacientes asignados a embolización arterial transcatéter, en 31 el procedimiento se realizó con éxito. Tras ajustar por posibles variables de confusión, la embolización arterial transcatéter se asoció con una reducción de la tasa de nuevas hemorragias (p=0,079). Solo uno de los pacientes sometidos a embolización con éxito desarrolló resangrado, y este fue menor sin necesidad de intervención hemostática16.
Otro de los criterios “firmemente establecidos” que han sido recientemente desafiados es la necesidad de administrar IBP por vía i.v. tras terapia endoscópica exitosa en úlcera péptica sangrante. En este sentido, un estudio ha evaluado el efecto del tratamiento mediante IBP por vía oral. Los pacientes con Forrest Ia-IIb y que habían recibido IBP por vía i.v. 80mg en bolo y luego 8mg/h por un máximo de 24 h fueron aleatorizados en 2 brazos de hemostasia postendoscópica. En un brazo se continuaron los pacientes con esomeprazol i.v. 8mg/h durante 72 h, mientras que el otro recibió esomeprazol 80mg vía oral durante 72 h. Ambos grupos continuaron con esomeprazol 40mg 1 vez al día durante 8 semanas. Las modalidades terapéuticas incluyen inyecciones de adrenalina, hemoclips, coagulación térmica o inyecciones de histoacryl. Se analizaron las tasas de resangrado y la mortalidad hospitalaria. El estudio actual comunica los datos preliminares de 108 pacientes en un estudio todavía en marcha. En la mayoría de los pacientes (36,1%) se efectuó una gastroscopia dentro de las 6 h de acceso al hospital. No hubo muertes, ni se requirió cirugía en el momento del análisis actual. La tasa de recurrencia hemorrágica fue del 5,35% en el grupo de IBP i.v. frente al 1,92% en el grupo de IBP oral. No hubo tampoco diferencias en otros parámetros analizados. El estudio está en marcha, pero con estos datos preliminares uno se aventura a señalar que el resultado final difícilmente mostrará diferencias entre los grupos17.
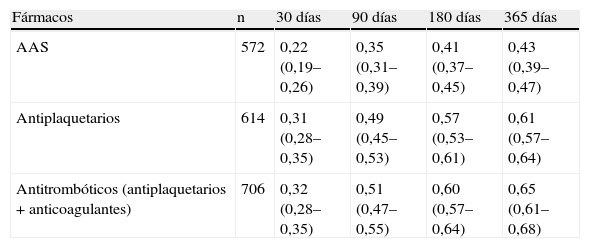
Se están comunicando más datos sobre el riesgo de interrumpir el tratamiento antiagregante en pacientes que han presentado un episodio de HDANV. En un estudio de pequeño tamaño muestral coreano que incluyó 544 pacientes consecutivos con HDA por úlcera péptica, de los que solo 72 pacientes tomaban fármacos antiplaquetarios en el momento de la hemorragia, y que fueron seguidos hasta más de 2 meses, se observó que 40 pacientes abandonaron el tratamiento antitrombótico tras la hemorragia por úlcera (grupo interrupción) mientras que 32 pacientes continuaron los antitrombóticos con/sin interrupción transitoria (grupo continuación) de este. Durante el seguimiento medio de 26,6 meses se desarrolló un episodio cardiovascular en 8 pacientes. Los episodios trombóticos se desarrollaron con más frecuencia en el grupo que suspendió el tratamiento (p=0,019). El riesgo de episodios trombóticos con la suspensión fue de 15,6 (IC del 95%, 1,8–135,2). No hubo diferencias significativas en el caso de las hemorragias recurrentes entre 2 grupos18. El estudio, aunque con tamaño muestral pequeño, apunta en la misma dirección de lo hasta ahora conocido y debiera obligar a replantearse en la práctica clínica la dinámica comúnmente vista de suspender el tratamiento antiagregante tras un episodio de HDA. Esta dinámica ha sido puesta de manifiesto de manera clara por Sáez et al19 en un estudio llevado a cabo en una base de datos de Reino Unido, donde se vio que las tasas de represcripción fueron menores para ácido acetilsalicílico (AAS) que para otros antitrombóticos (tabla 1). Las tasas acumuladas de represcripción en 365 días fueron: AAS, 0,43 (IC del 95%, 0,39–0,47); warfarina, 0,66 (IC del 95%, 0,57–0,75); clopidogrel, 0,69 (IC del 95%, 0,57–0,81); dipiridamol, 0,49 (IC del 95%, 0,31–0,71). Las tasas de represcripción fueron menores para los mayores de edad.
Tasa de represcripción de fármacos antitrombóticos (intervalo de confianza del 95%) tras un episodio de hemorragia digestiva alta.
| Fármacos | n | 30 días | 90 días | 180 días | 365 días |
| AAS | 572 | 0,22 (0,19–0,26) | 0,35 (0,31–0,39) | 0,41 (0,37–0,45) | 0,43 (0,39–0,47) |
| Antiplaquetarios | 614 | 0,31 (0,28–0,35) | 0,49 (0,45–0,53) | 0,57 (0,53–0,61) | 0,61 (0,57–0,64) |
| Antitrombóticos (antiplaquetarios + anticoagulantes) | 706 | 0,32 (0,28–0,35) | 0,51 (0,47–0,55) | 0,60 (0,57–0,64) | 0,65 (0,61–0,68) |
AAS: ácido acetilsalicílico.
Se ha de señalar que un mecanismo que puede contribuir al hallazgo de un aumento en el número de episodios cardiovasculares en pacientes con HDANV que dejan el tratamiento con antiplaquetarios, puede radicar en el hecho de que estos pacientes parecen presentar niveles prolongados de activación de las plaquetas durante al menos 12 semanas después del episodio hemorrágico20.
Hemorragia gastrointestinal bajaMientras que los ingresos hospitalarios por HDANV están bajando de manera generalizada, posiblemente debido a un descenso en la prevalencia de infección por Helicobacter pylori y a una mejor prevención de las lesiones gastroduodenales por AINE, los ingresos por complicaciones, sobre todo hemorragia, del tracto gastrointestinal bajo están subiendo discretamente21. Los problemas diagnósticos de este tipo de hemorragia son mayores, pues hay áreas como el intestino delgado que son más inaccesibles a los procedimientos diagnósticos y terapéuticos.
No hay acuerdo sobre la mejor estrategia para el diagnóstico de los pacientes que presentan grave hematoquecia. Un estudio revisó retrospectivamente historias clínicas de pacientes consecutivos que ingresaron por hematoquecia grave y sugirió que, aunque el rendimiento diagnóstico global de todos los procedimientos diagnósticos fue bajo (cápsula endoscópica, arteriografía, gammagrafía con hematíes marcados, enteroscopia, colonoscopia, resonancia, etc.), la cápsula endoscópica urgente fue el procedimiento con mayor rendimiento, pues fue capaz de localizar el punto sangrante en el 50% de los casos22.
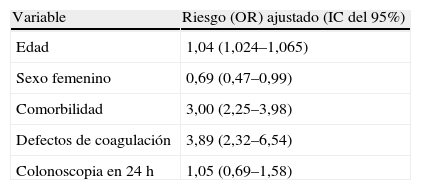
En este mismo sentido se ha de señalar la controversia actual sobre el momento idóneo de la colonoscopia en la hemorragia gastrointestinal baja (HDB). Tratando de responder a la pregunta de si la colonoscopia realizada dentro de 24 h se asocia con disminución de mortalidad intrahospitalaria, se analizaron los resultados de una gran cohorte de pacientes con HDB que englobaba a 143.489 pacientes hospitalizados con diagnósticos de ingreso primario por HDB. La mortalidad intrahospitalaria fue del 1,1%. Los predictores independientes de mortalidad (tabla 2) fueron la edad, la presencia de comorbilidad y los defectos de la coagulación, mientras que el sexo femenino se asoció con un menor riesgo de mortalidad. La realización de colonoscopia dentro de 24 h no se asoció con reducción de la mortalidad (OR: 1,05; IC del 95%, 0,69–1,58). Los autores concluyen que la realización de colonoscopia dentro de las primeras 24 h de ingreso no cambió la mortalidad de los pacientes hospitalizados con HDB23.
Predictores de mortalidad intrahospitalaria en pacientes hospitalizados por hemorragia gastrointestinal baja.
| Variable | Riesgo (OR) ajustado (IC del 95%) |
| Edad | 1,04 (1,024–1,065) |
| Sexo femenino | 0,69 (0,47–0,99) |
| Comorbilidad | 3,00 (2,25–3,98) |
| Defectos de coagulación | 3,89 (2,32–6,54) |
| Colonoscopia en 24h | 1,05 (0,69–1,58) |
IC: intervalo de confianza; OR: odds ratio.
En el terreno terapéutico merece la pena señalar que, recientemente, la ligadura endoscópica con bandas se ha utilizado para tratar la hemorragia diverticular del colon. Sin embargo, los resultados a largo plazo de este procedimiento no se conocen. Un estudio evaluó este extremo en 61 pacientes que presentaban hemorragia diverticular del colon. Durante un período medio de seguimiento de 13 meses (rango, 1–42 meses), las tasas de resangrado precoz (< 30 días) y tardío (> 30 días) fueron idénticas, con un 14%. Adicionalmente, 41 y 20 pacientes fueron objeto de seguimiento durante más de 1 y 2 años tras la ligadura, respectivamente. Las tasas de nuevas hemorragias 1 y 2 años después tras la ligadura fueron del 14,9 (6/41) y el 15% (3/20), respectivamente. Los resangrados se pudieron manejar de forma conservadora en todos los casos, salvo en un paciente que requirió hemicolectomía derecha. Los seguimientos endoscópicos identificaron la formación de cicatrices en los divertículos previamente ligados con bandas en un 62%; sin embargo, el resangrado ocurrió en algunos pacientes en otros puntos al margen de las cicatrices de la ligadura. Todo ello sugiere que el tratamiento endoscópico con bandas es seguro y eficaz para la hemorragia diverticular de colon, pero que esto puede no ser suficiente en la prevención del resangrado tardío, ya que la fuente de resangrado difiere con frecuencia de los divertículos previamente ligados24.
La enteroscopia de doble balón y la cápsula endoscópica de vídeo se han venido utilizando en los últimos años en la evaluación de la hemorragia digestiva de origen oscuro. A menudo, los estudios son complementarios y se realizan de forma secuencial (primero cápsula, segundo enteroscopia). El grado de correlación de los hallazgos entre estos 2 tests ha sido objeto de un reciente estudio con 177 pacientes, que señaló que la cápsula tuvo un rendimiento diagnóstico mayor y que los hallazgos de esta son predictivos de los resultados de la enteroscopia, pero con una correlación más baja de lo esperado. Por otra parte se evidenció que la existencia de resultados negativos con cápsula no evita que haya resultados positivos con la enteroscopia25. Se ha señalado que los mayores factores predictivos de hallazgos positivos y acción terapéutica con la enteroscopia de doble balón son la presencia de comorbilidad grave, la necesidad de transfusión de sangre y la existencia de hallazgos anteriores positivos en la endoscopia alta o baja. Por el contrario, la fatiga del endoscopista puede jugar un papel negativo en los rendimientos diagnóstico y terapéutico de la enteroscopia en el caso de hemorragia digestiva de origen oscuro26.
Antiinflamatorios no esteroideos y hemorragiaLa asociación del uso de AINE o AAS con hemorragia gastrointestinal está bien probada. Los datos que analizan aspectos concretos de esta asociación continúan produciéndose y algunos de ellos tienen relevancia clínica.
Así, nuevos datos apuntan al aumento del riesgo del uso concomitante de AINE o AAS con otros fármacos potencialmente gastrolesivos. Un análisis de casos y controles con 7 bases de datos de salud ubicadas en 3 países (Dinamarca, Italia y Países Bajos), que incluyó a 114.835 pacientes con HDANV, señaló que el uso concomitante de inhibidores de la recaptación de serotonina (IRS) con AINE no selectivos, coxibs o AAS aumenta significativamente el riesgo de HDA hasta 7 veces. El uso concomitante de corticoides, anticoagulantes o antiplaquetarios con AINE o AAS, pero no con coxibs, mostró un aumento del riesgo de HDA de hasta 13 veces. Este aumento de los riesgos fue mayor que la suma de los riesgos de los fármacos individuales27. La asociación de los IRS con HDA y AINE se ha vuelto a poner de manifiesto en otro metaanálisis basado en publicaciones disponibles en la Cochrane, revisiones sistemáticas, PubMed y resúmenes recientes de las principales actas de congresos. Al final se incluyeron 8 estudios con 32.022 casos y 228.579 controles. El uso de los IRS aumentó las probabilidades de HDA NV (OR: 1,6; IC del 95%, 1,34–4,55; p=0,0001), efecto que aumentó al asociarse con AINE (OR: 4,6; IC del 95%, 2,95–7,17; p=0,0001)28.
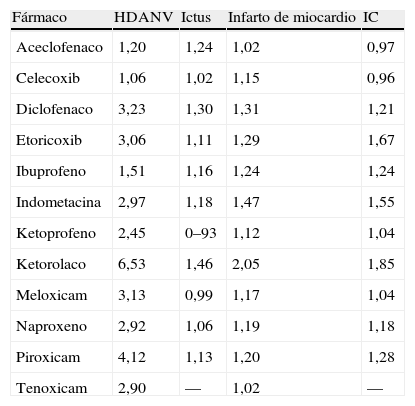
El riesgo de complicaciones con el uso de AINE no se extiende solo al campo gastrointestinal, sino también al cardiovascular, como es bien conocido. En un intento de integrar ambos riesgos para el uso de cada AINE de manera individual se ha presentado un análisis de casos y controles utilizando los datos de las 6 bases de datos referidas anteriormente. Se identificó un total de 23.411 casos con HDA, 35.691 episodios de ictus, 68.757 de infarto de miocardio y 79.876 de insuficiencia cardíaca en una cohorte de 8,9 millones de nuevos usuarios de AINE. El uso de celecoxib se asoció al menor riesgo de HDANV, mientras que el uso de ketorolaco se asoció al riesgo más alto (tabla 3). Para la insuficiencia cardíaca, los resultados fueron consistentes, pero con un menor riesgo para celecoxib y ketorolaco. El ketoprofeno fue la opción más segura con respecto al ictus mientras que el diclofenaco y el ketorolaco fueron más perjudiciales. El uso de tenoxicam o aceclofenaco se asoció a menor riesgo de infarto de miocardio. En general, los fármacos preferidos en función de su perfil gastrointestinal o cardiovascular fueron aceclofenaco y celecoxib, seguidos de la nimesulida y el ibuprofeno. Dos AINE (piroxicam y ketorolaco) ocupaban el último lugar. Estos mismos datos se han utilizado para la elección del tratamiento apropiado con AINE con respecto a las complicaciones del tracto gastrointestinal superior y complicaciones cardiovasculares basado en un modelo de decisión electrónico todavía no publicado29.
Riesgo relativo de diferentes complicaciones asociados a los AINE de manera individual (hemorragia digestiva alta no varicosa aguda [HDANV], ictus, infarto de miocardio, insuficiencia cardíaca [IC]).
| Fármaco | HDANV | Ictus | Infarto de miocardio | IC |
| Aceclofenaco | 1,20 | 1,24 | 1,02 | 0,97 |
| Celecoxib | 1,06 | 1,02 | 1,15 | 0,96 |
| Diclofenaco | 3,23 | 1,30 | 1,31 | 1,21 |
| Etoricoxib | 3,06 | 1,11 | 1,29 | 1,67 |
| Ibuprofeno | 1,51 | 1,16 | 1,24 | 1,24 |
| Indometacina | 2,97 | 1,18 | 1,47 | 1,55 |
| Ketoprofeno | 2,45 | 0–93 | 1,12 | 1,04 |
| Ketorolaco | 6,53 | 1,46 | 2,05 | 1,85 |
| Meloxicam | 3,13 | 0,99 | 1,17 | 1,04 |
| Naproxeno | 2,92 | 1,06 | 1,19 | 1,18 |
| Piroxicam | 4,12 | 1,13 | 1,20 | 1,28 |
| Tenoxicam | 2,90 | — | 1,02 | — |
El uso de anticoagulantes está aumentando de manera clara en los últimos años. La HDA por úlcera péptica asociada a la toma de estos fármacos se da en 3,7/100 personas-año y las guías actuales recomiendan reiniciar la anticoagulación tras 1 mes del episodio. Un estudio evaluó el impacto del inicio precoz de anticoagulantes antes del mes en estos pacientes. De los 11.584 pacientes consecutivos anticoagulados por fibrilación auricular, 1.329 (11,5%) desarrollaron una HDA. La anticoagulación se reinició en 653 pacientes tras una media de 48 días (rango, 4–105). De los 242 pacientes con HDA y úlcera péptica, 112 iniciaron el tratamiento en 21 días. El reinicio precoz de la anticoagulación se asoció con una mayor supervivencia en pacientes sin sangrado activo (Forest III) (hazard ratio [HR]: 0,54; IC del 95%, 0,31–0,93; p=0,02) y con un aumento del riesgo de recurrencia hemorrágica a los 3 meses en pacientes con lesiones tipo I de Forrest (HR: 4,51; IC del 95%, 1,16–17,4; p=0,03). Los autores concluyeron que la anticoagulación en estos pacientes con HDA por úlcera péptica puede iniciarse en los primeros 21 días en pacientes con signos de hemorragia reciente y sin hemorragia gastrointestinal activa en la endoscopia30.
El riesgo de HDA asociado al uso de los nuevos anticoagulantes no está todavía bien definido. Dabigatrán es un inhibidor directo de la trombina oral, aprobado para la fibrilación auricular no valvular para la prevención de ictus y la embolia sistémica. El objetivo de un nuevo estudio retrospectivo fue evaluar el riesgo de hemorragia gastrointestinal con dabigatrán en comparación con warfarina. De un total de 418 pacientes, 209 recibieron dabigatrán (edad media, 72,7 años) y 209 warfarina (edad media, 71,8 años). La incidencia de hemorragia gastrointestinal en el grupo de dabigatrán fue más baja (2,4%) que en el grupo de warfarina (5%) (OR: 2,3; p=0,0375). Los pacientes que se encontraban en tratamiento con dabigatrán durante menos de 180 días tuvieron una mayor incidencia de hemorragia gastrointestinal (5%) que los que tenían una duración mayor de 180 días (2,4%) (p<0,0001). La presencia o ausencia de uso de otro agentes antiplaquetarios, como aspirina, clopidogrel y ticlopidina no pareció afectar este efecto. La incidencia de sangrado gastrointestinal en pacientes mayores de 65 años (6,5%) fue superior a la de menores de 65 años (1%) (OR: 3; p=0,0453). El estudio es, desde luego, de limitada información dado el tamaño muestral y el carácter retrospectivo, pero no cabe duda que este es un ámbito de estudio futuro31.
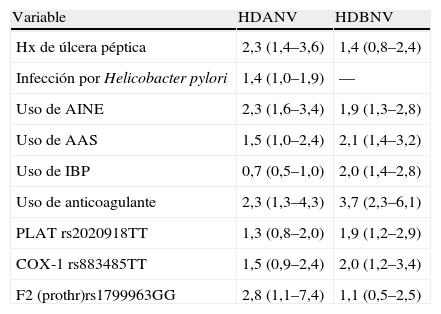
Dado que el riesgo de desarrollar hemorragia digestiva es diferente en los pacientes que toman estos fármacos se ha sugerido la existencia de susceptibilidad individual a desarrollar estos episodios. Por ello, la identificación de las personas en situación de riesgo se está convirtiendo en una estrategia clave para prevenir y reducir este problema. El objetivo de uno de los estudios presentados en el último congreso de la AGA fue evaluar el impacto de los factores ya conocidos de riesgo clínicos y ambientales, junto con polimorfismos de genes potencialmente candidatos de susceptibilidad a hemorragia digestiva. Para ello se realizó un estudio de casos y controles que comprendió 644 pacientes (edad media, 66±15,5 años; 58,9% varones) hospitalizados en una red de 8 hospitales españoles debido a hemorragia digestiva no varicosa. El estudio genético consistió en un panel de 89 polimorfismos en genes relacionados con la inflamación de la mucosa gastrointestinal, las vías de la coagulación, el metabolismo del ácido araquidónico y las enzimas metabolizantes de fármacos mediante la plataforma Illumina. Los riesgos relativos (RR) de los factores independientes asociados con hemorragia digestiva alta o baja se muestran en la tabla 4. En el subgrupo de pacientes tratados con AINE, los portadores del polimorfismo rs2020918TT del gen PLAT (activador tisular de plasminógeno) tenían un mayor riesgo de hemorragia digestiva (RR: 2,06; IC del 95%, 1,06–4,95), mientras que los portadores del polimorfismo rs1143634C de IL-1B (interleucina 1 beta) y el rs708494TT del gen PTGER2 (receptor de la prostaglandina E2) mostraron una disminución significativa (RR: 0,34; IC del 95%, 0,12–0,91, y RR: 0,67; IC del 95%, 0,43–1,06, respectivamente) de ese riesgo En opinión de los autores, estos resultados apoyan la implicación de la susceptibilidad genética en el riesgo de hemorragia digestiva asociada a diferentes factores ambientales, entre los que se incluye el consumo de fármacos gastrolesivos32.
Factores de riesgo asociados a hemorragia digestiva alta (HDANV) o hemorragia digestiva baja (HDBNV) de origen no varicoso (riesgo relativo e intervalo de confianza del 95%).
| Variable | HDANV | HDBNV |
| Hx de úlcera péptica | 2,3 (1,4–3,6) | 1,4 (0,8–2,4) |
| Infección por Helicobacter pylori | 1,4 (1,0–1,9) | — |
| Uso de AINE | 2,3 (1,6–3,4) | 1,9 (1,3–2,8) |
| Uso de AAS | 1,5 (1,0–2,4) | 2,1 (1,4–3,2) |
| Uso de IBP | 0,7 (0,5–1,0) | 2,0 (1,4–2,8) |
| Uso de anticoagulante | 2,3 (1,3–4,3) | 3,7 (2,3–6,1) |
| PLAT rs2020918TT | 1,3 (0,8–2,0) | 1,9 (1,2–2,9) |
| COX-1 rs883485TT | 1,5 (0,9–2,4) | 2,0 (1,2–3,4) |
| F2 (prothr)rs1799963GG | 2,8 (1,1–7,4) | 1,1 (0,5–2,5) |
El autor declara haber recibido ayuda de investigación iniciada por el propio investigador de Bayer y AstraZeneca.