INTRODUCCIÓN
En 19861 se informó el primer embarazo a partir de un ovocito criopreservado mediante congelación lenta y con dimetilsulfóxido (DMSO) como crioprotector. Sin embargo, con el tiempo, la técnica de congelación lenta convencional ofreció bajas tasas de supervivencia ovocitaria y embarazo,2-5 lo cual dio origen a la realización de múltiples ensayos y a la modificación del tipo de crioprotector utilizado, el volumen o sus concentraciones;6-10 el objetivo era alcanzar resultados verdaderamente alentadores.
La idea de vitrificar, o alcanzar un estado similar al vidrio, se describió por primera vez en 1860 y la retomó Luyet en 1937. Cincuenta años más tarde (1985), Rall y Fahy11 describieron como una alternativa potencial la congelación lenta, que consiste en solidificar una solución por enfriamiento rápido, hasta formar un estado vidrioso por elevación extrema de su viscosidad. Trounson12 fue el primero en sumergir un ovocito directamente en nitrógeno líquido y notificó una supervivencia aceptable y fecundación, pero bajas tasas de clivaje para la vitrificación.
Los procedimientos actuales de vitrificación implican la exposición de la célula a un volumen reducido de crioprotectores a elevadas concentraciones, seguido de congelación rápida en nitrógeno líquido. La alta osmolaridad de la solución de vitrificación rápidamente deshidrata a la célula. Al sumergirla de forma súbita en nitrógeno líquido se solidifica, de tal manera que el agua intracelular no tiene tiempo para formar cristales y lesionar a los organelos intracelulares;13 esto incrementa su supervivencia.
Varios autores han referido otros daños atribuibles a la célula, consecutivos a las bajas temperaturas; uno de los más importantes es la alteración de la segregación de los cromosomas durante la meiosis II.14-16 A ese respecto, la evidencia es aún insuficiente y un tanto controversial, ya que de igual manera otros sugieren que el huso meiótico puede sobrevivir a procesos de congelación-descongelación sin consecuencias, o al menos sin incremento del número de aneuploidías en los embriones resultantes.17-20
Un programa efectivo de criopreservación de ovocitos resulta de gran utilidad para mujeres que, por razones médicas o personales, necesiten diferir la posibilidad de embarazarse, ya sea por amenaza de pérdida de la función ovárica, afección oncológica que exige quimioterapia o radioterapia o restricciones éticas y religiosas que limiten la criopreservación de embriones. Entre sus beneficios pueden mencionarse la posibilidad de preservar los ovocitos excedentes de ciclos de hiperestimulación en técnicas de reproducción asistida y facilitar a los centros de reproducción la posibilidad de crear un banco de óvulos eficiente.
A pesar de los beneficios reconocidos de la técnica de vitrificación, los datos informados aún son insuficientes.21 Este estudio tiene por objetivo dar a conocer la evolución de más de 1000 ovocitos humanos vitrificados en cryotop en un centro de reproducción asistida.
MATERIAL Y MÉTODOS
Éste es un estudio descriptivo y observacional realizado en el Instituto Mexicano de Infertilidad de Guadalajara entre julio de 2004 y diciembre de 2008. Se vitrificaron los ovocitos propios excedentes de 79 pacientes en 88 ciclos de hiperestimulación ovárica para fecundación in vitro y 169 ciclos de donantes.
Hiperestimulación ovárica. La estimulación del ovario se realizó con hormonas recombinantes (FSHr) o menotropinas, de forma inicial en los días segundo o tercero del ciclo menstrual, de acuerdo con cada caso. Se aplicó el antagonista del GnRh (GnRH)a cuando al menos dos folículos alcanzaron 14 mm de diámetro. Se administraron hCG (10,000 UI) cuando dos o más folículos alcanzaron los 18 mm de diámetro. Los ovocitos se aspiraron 36 h después y se colocaron en medio de cultivo Upgraded B2 INRA (CCD) previamente gasificado (durante 18 h en promedio a 37°C y 5% de CO2). En éste permanecieron un promedio de dos horas y luego se separaron del cúmulo. Se identificaron los ovocitos en metafase II por la extrusión del primer cuerpo polar y se vitrificaron.
Técnica de vitrificación. Una vez separados del cúmulo, los ovocitos en metafase II se depositaron en la primera gota de un plato de cultivo con tres gotas de solución de 30 µl cada una. La primera era de solución de lavado y las otras de solución de equilibrio (etilenglicol al 7.5% y dimetilsulfóxido al 7.5%), hasta crear puentes entre ellas con la pipeta Pasteur, en dos ocasiones cada tres minutos hasta completar un promedio de 10 minutos. A continuación se depositaron en la solución de vitrificación (etilenglicol al 15%, dimetilsulfóxido al 15% y sucrosa, 0.5 M). En ésta se aspiraron, se devolvieron tres o cuatro veces y depositaron sobre la superficie del cryotop (Kitazato Supply Co, Fujinomiya, Japan).
El cryotop consiste en una lámina muy delgada de polipropileno de 0.4 mm de ancho por 20 mm de largo x 0.1 mm de espesor y una cubierta protectora, también plástica de 3 cm de longitud (Imagen 1). El cryotop se sumergió de manera súbita y directa en un recipiente con nitrógeno líquido para la colocación de su cubierta protectora (Imagen 2). Los dos últimos pasos deben realizarse en el lapso de un minuto. Descongelación. Para esta fase se observaron los siguientes pasos:
Imagen 1. Cryotop.
Imagen 2. Cryotop sumergido directamente en nitrógeno líquido.
1. Los ovocitos se depositaron en solución descongelante por un minuto.
2. Luego se aplicó una solución diluyente por tres minutos.
3. De ésta se trasladaron a la primera solución de lavado (5 min) y luego a la segunda (5 min).
4. Los ovocitos sobrevivientes se dejaron en medio de cultivo por dos a cuatro horas y posteriormente se microinyectaron mediante la técnica convencional de ICSI.
Las soluciones utilizadas son de Kitazato Supply Co., Japón.
Transferencia embrionaria, En todas las pacientes los embriones se transfirieron el segundo día del desarrollo, bajo guía ecográfica con equipo de ultrasonido marca Aloka SSD500. Para la preparación endometrial se usó agonista del GnRH en las mujeres con función ovárica y estradiol en dosis progresivas, al principio con 2 mg los primeros ocho días del ciclo de preparación, 2 mg cada 12 h los días noveno, décimo y undécimo y 2 mg cada ocho horas a partir del día duodécimo. Para el soporte lúteo se inició progesterona en perlas de 200 mg el día de la descongelación de los ovocitos en horas de la tarde y se mantuvo cada 12 h hasta el día de la transferencia de los embriones. En este último día se incrementó la dosis a 200 mg oral cada ocho horas, y se agregó progesterona en ampolletas de 50 mg, una dosis diaria por vía intramuscular. En promedio, estrógeno y progesterona se mantuvieron hasta la semana octava de gestación.
Análisis de los datos. Se emplearon la estadística descriptiva, cuadros de frecuencia y porcentaje, medidas de tendencia central y dispersión.
RESULTADOS
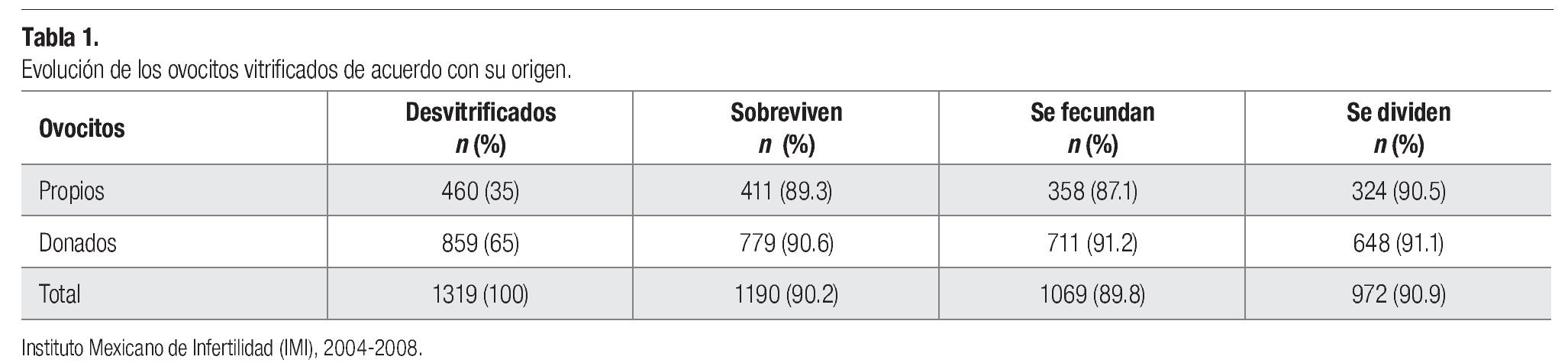
Se desvitrificaron 1319 ovocitos entre julio del 2004 y diciembre del 2008 con una supervivencia del 90.2% (1190). Hasta 65% de los óvulos descongelados pertenecía a ovodonadoras. Se consiguió la fecundación después de la microinyección por ICSI en el 90%. De esa proporción, el 91% se dividió a cuatro células en el segundo día de desarrollo (Tabla 1).
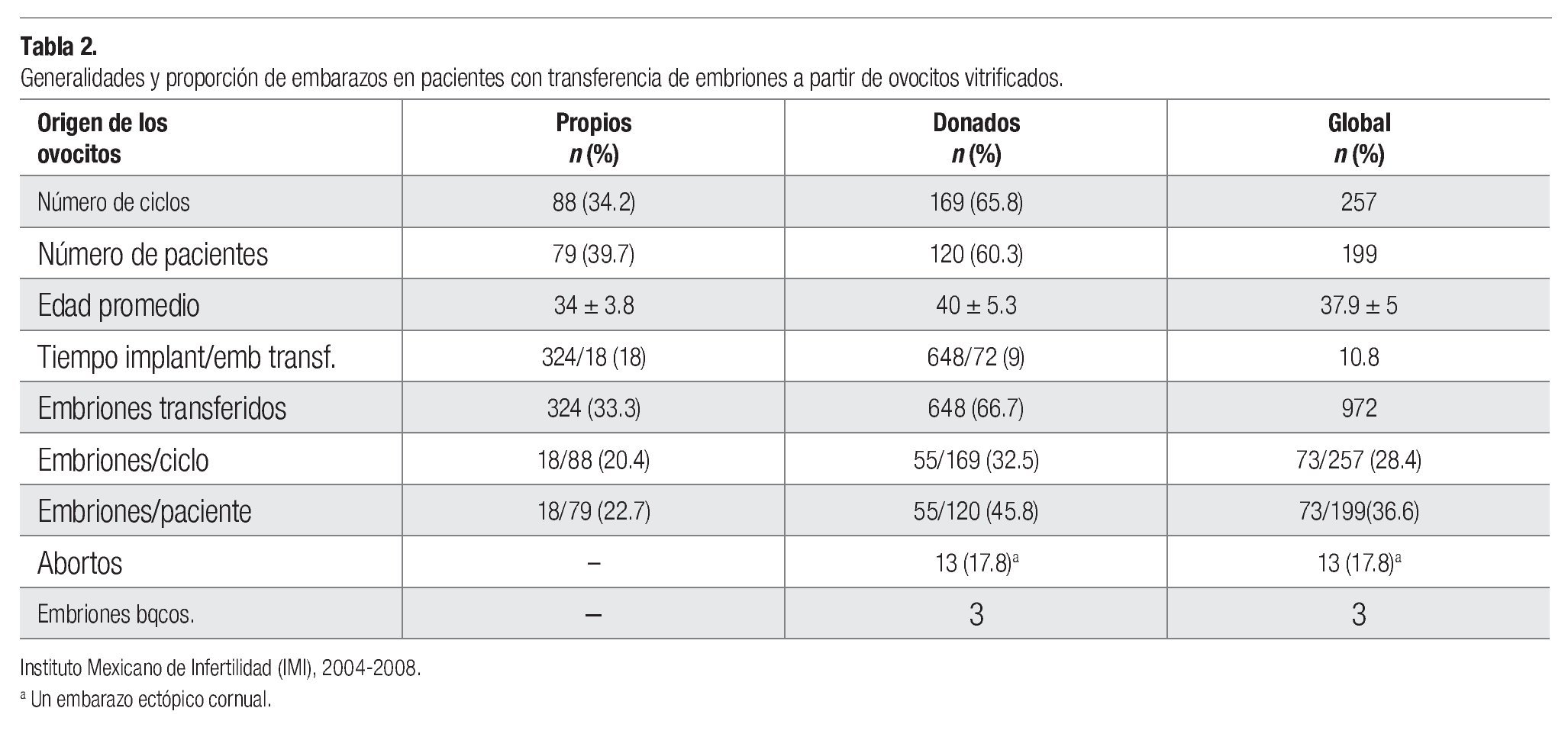
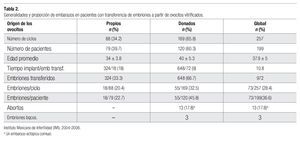
La edad promedio de las pacientes transferidas fue de 34 ± 3.8 años (ovocitos propios) y 40 ± 5.3 años (ovocitos donados). Se han logrado 73 embarazos en 199 pacientes (36.6%), 18 de ellas en el grupo de ovocitos propios y 55/120 en el grupo de ovocitos donados. Trece embarazos (17.8%) no llegaron al término, uno de ellos un embarazo ectópico cornual (Tabla 2).
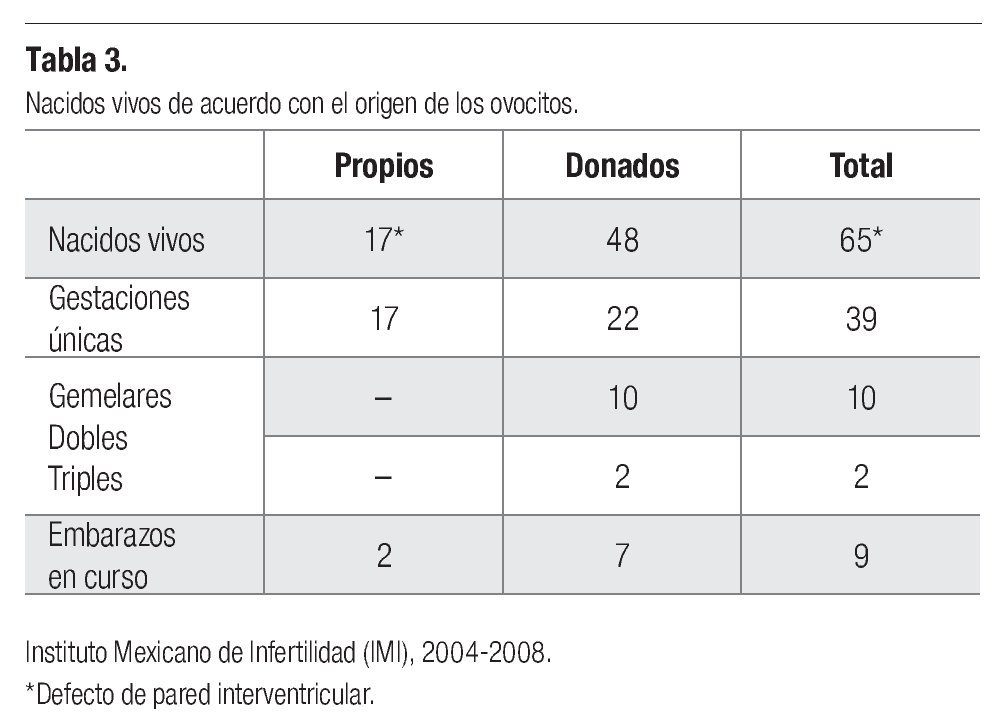
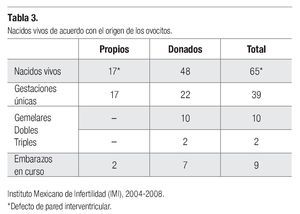
Han nacido 65 neonatos, producto de 36 gestaciones únicas, 10 gemelares dobles y dos triples. Entre los nacidos, conviene destacar el caso de una paciente nacida de la combinación de técnicas de maduración in vitro de ovocitos humanos (MIV) y vitrificación. Los ovocitos madurados in vitro y descongelados se transfirieron también en el segundo día de desarrollo embrionario en un ciclo posterior de preparación endometrial. Los nacidos vivos han sido sanos con excepción de una niña, hija de madre diabética en la que se diagnosticó una comunicación interventricular (Tabla 3).
DISCUSIÓN
La vitrificación conjuga altas concentraciones de crioprotectores en un volumen mínimo y elevadas velocidades de congelación (15,000-30,000 °C/min),22 lo que genera como consecuencia la ausencia de cristales de hielo durante los procesos de congelación-descongelación,23 una mejor conservación de la ultraestructura y menor lesión de la fisiología ovocitaria.24 Borini y colaboradores han señalado que protocolos subóptimos para criopreservación de ovocitos pueden causar daño subletal relacionado con habilidad limitada para la fecundación;25 en este estudio se observó que en forma proporcional la mejor supervivencia se corresponde con mejores tasas de fecundación y clivaje.
En este protocolo se informaron tasas de supervivencia, fecundación y clivaje comparables con las notificadas por otros autores para la vitrificación de ovocitos humanos, cualquiera que fuera el dispositivo utilizado para el depósito final de los ovocitos (cryotop, cryotip, cryoloop, cryoleaf, etc.).26-30
La proporción de embarazo es similar a la comunicada para ciclos en fresco, de forma indistinta respecto de cuando se transfirieron embriones obtenidos a partir de ovocitos propios o donados vitrificados. Hasta el momento, los nacidos informados para la vitrificación de ovocitos parece tener una incidencia de anomalías congénitas (2.5%) no mayor a la comunicada para los nacidos de embarazos espontáneos en mujeres fecundas o infundas en ciclos frescos de fecundación in vitro.31 En esta serie de nacidos vivos (n=65) se registró una comunicación inter-ventricular en una niña hija de madre diabética, dato que corresponde al 1.53% de los casos y que muy probablemente no tenga relación con la técnica. En particular, no se realizó ninguna prueba de salud cromosómica en los embriones, pero se consideró que la proporción de nacidos vivos sanos notificada sustenta de alguna manera la seguridad de la técnica.
CONCLUSIÓN
La vitrificación de ovocitos humanos en cryotop proporciona elevada supervivencia ovocitaria, fecundación, clivaje y embarazo. Es una técnica sencilla y altamente reproducible que puede beneficiar a parejas con necesidad de postergar la posibilidad de embarazo, incluidos las pacientes oncológicas. Con ella, los centros de reproducción asistida pueden ofrecer una opción distinta y desestimular la demanda de congelación de embriones.
Correspondencia:
Dra. Martha Isolina García Amador.
Boulevard Puerta de Hierro 5150. Torre C, 503-506.
Col. Plaza Corporativa Zapopan. C.P. 45116. Guadalajara, Jalisco. México.
Teléfono: (01) 333648-2550.
Correo electrónico:mgarciaamador@yahoo.com