Introducción: Diversos estudios han demostrado que la proteína fosfatasa de tirosina (PTP1B), juega un papel clave en la regulación de diversas vías de señalización celular. Estudios recientes han demostrado que PTP1B participa en la vía de HER2, en la iniciación de la tumorogénesis en cáncer de mama. Reportes previos han demostrado una regulación positiva de la PTP1B sobre la expresión de HER2. No obstante, se desconocen los efectos que esto implica sobre el desarrollo tumoral.
Objetivo: Evaluar el papel de la expresión de PTP1B en procesos biológicos, como la proliferación de células de cáncer de mama.
Material y métodos: Se realizaron ensayos de proliferación en cultivos celulares, en los cuales se sobreexpresó PTP1B mediante transfección de plásmidos.
Resultados: La sobreexpresión de PTP1B confiere una mayor capacidad proliferativa a las células tumorales, con un incremento del 80% en la tasa de proliferación.
Conclusión: La sobreexpresión de PTP1B se asocia a un incremento en la proliferación celular. Esto abre la posibilidad a la investigación de nuevos marcadores pronósticos en cáncer de mama y al desarrollo de nuevos blancos moleculares, ya que se puede considerar el uso de inhibidores de PTP1B como terapia dirigida a disminuir la proliferación y el potencial metastásico de las células tumorales.
Introduction: Several studies have shown that the protein tyrosine phosphatase (PTP1B) plays a key role in several signaling pathways. Recent studies have shown that PTP1B participates in the initiation of tumorigenesis mediated by Her2 in breast cancer. Previous reports demonstrated the upregulation of the expression of PTP1B on Her2, yet unknown effects that this implies on tumor development.
Objective: To assess the role of PTP1B expression in biological processes such as proliferation in cell cultures of breast cancer.
Material and methods: Cell proliferation assays were performed in cell cultures, which are overexpressed in PTP1B by transfection of plasmids.
Results: Overexpression of PTP1B confers greater proliferative capacity in tumor cells with a 80% increase in the proliferation rate.
Conclusion: Overexpression of PTP1B is associated with increased cell proliferation. This opens the possibility to investigate new prognostic markers in breast cancer and development of new molecular targets, such as the use of PTP1B inhibitors as therapy aimed at reducing the proliferation and metastatic potential of tumor cells.
Pagina nueva 1
¿ INTRODUCCIÓN
La fosforilación de proteínas en residuos de tirosina es una de las modificaciones postraduccionales más importantes, que las células utilizan para regular respuestas celulares. La regulación de este proceso es crucial para varios efectos biológicos que incluyen la proliferación, diferenciación, migración y muerte celular. Además, representa un punto de control para la integración de señales extracelulares y su conversión es respuestas celulares. Los niveles de fosforilación de proteínas en residuos de tirosina se encuentran estrechamente controlados, por una acción coordinada de dos tipos de enzimas llamadas proteínas tirosinas cinasas (PTK, del inglés protein tyrosine kinase) y las proteínas fosfatasas de tirosina (PTP, del inglés protein tyrosine phosphatase).1 Las PTK´s de encargan de añadir un grupo fosfato sobre residuos de tirosina de proteínas sustrato, causando un cambio estructural y promoviendo las interacciones entre proteínas en las cascadas de señalización celular. La acción de las PTK´s es regulada por la acción de las PTP´s, las cuales se encargan de remover un grupo fosfato de un residuo de tirosina de una proteína sustrato. La alteración del balance normal entre la actividad de las PTK´s y PTP´s, resulta en una fosforilación aberrante de residuos de tirosina, la cual ha sido ligada a la etiología de varias enfermedades, incluyendo el cáncer.2-5
Las PTP´s constituyen una gran familia estructuralmente diversa, altamente regulada y que puede tener efectos estimulatorios o inhibitorios.6 En el genoma humano se han identificado un total de 107 PTP´s, las cuales están divididas en receptores y no receptores.7 El dominio catalítico de las PTP´s contiene aproximadamente 280 aminoácidos y presentan un residuo de cisteína conservado, que es requerido para la actividad catalítica. La defosforilación de los sustratos ocurre a través de un mecanismo de dos pasos, que consiste en la formación de un intermediario que se forma a través de un enlace covalente de fosfato-PTP, que subsecuentemente se hidroliza.6
La función principal de las PTP´s es revertir la acción de fosforilación de las PTK´s. Además, las PTP´s pueden potenciar acciones de las PTK´s, este modo de sinergia aumenta las señales mitogénicas conduciendo a transformación y proliferación celular.1-6
La PTP1B (PTPN1) y TC-PTP (PTPN2) fueron las primeras PTP´s del tipo no receptor identificadas.8 La PTP1B fue purificada de la placenta humana, tiene un peso de 50kD, contiene un dominio catalítico de 37kD hacia su extremo N-terminal (residuos 1-300), seguido de una región reguladora de cerca de 80 a 100 residuos, y un dominio de localización en la membrana (residuos 400-435), que ancla la enzima a la cara citoplasmática del retículo endoplásmico.9,10 Su actividad catalítica es estrechamente controlada por su localización en la superficie del retículo endoplásmico, que puede restringir su acceso a los substratos. Además, existen otros cuatro mecanismos que operan en tándem para regular la actividad de PTP1B, que son la oxidación, la fosforilación, sumoilación y proteólisis.11
Diversos estudios han demostrado que PTP1B juega un papel clave en la señalización de vías metabólicas, y es un blanco terapéutico prometedor para la diabetes mellitus y la obesidad, ya que esta proteína participa en la regulación negativa en la señalización de los receptores de la insulina y la leptina. La deleción del gen de PTPN1 en ratones causa hipersensibilidad a la insulina, y está asociada con un incremento marcado de la fosforilación de tirosina del receptor de insulina y sus blancos.12-14 La PTP1B también puede inhibir la señalización de otros RTK´s, tales como los receptores de PDGF y HGF,15-18 mientras que la sobreexpresión de PTP1B en fibroblastos inhibe la transformación por oncogenes, que incrementan la fosforilación de tirosinas incluyendo HER2, Src, Bcr-Acl, Crk y Ras.19-21 También es requerida para la activación de las GTPasas de Rac y Ras. Además, también puede activar a Src mediante defosforilación de la tirosina 527 (Y527), localizado hacia el extremo carboxilo terminal de la cinasa.22-24
La PTP1B se encuentra localizada dentro de un mapa genético en el cromosoma 20 en la región q13.1-q13.2.25,26 Se ha demostrado que la ganancia o amplificación de la región del cromosoma 20q13, está asociada a pobre pronóstico en cáncer de mama.27 No obstante, no hay datos que evalúen la sobreexpresión de PTP1B en neoplasias malignas, como factor condicionante de pobre pronóstico. Esto es contrario a lo que inicialmente se pensó, que tenían propiedades antioncogénicas a través de la regulación negativa de la actividad oncogénica de las PTK´s. Sin embargo, datos recientes han demostrado que estas fosfatasas se encuentran involucradas en la regulación positiva de vías de señalización en cáncer. La PTP1B es un regulador positivo de la señalización Ras, lo cual fue demostrado en fibroblastos deficientes de PTP1B.28 Estudios recientes han demostrado que PTP1B participa en la vía de HER2, en la iniciación de la tumorogénesis en cáncer de mama. La inhibición de la expresión de PTP1B fue asociada con la disminución de la fosforilación de Erk, sugiriendo que participa en esta vía de señalización en la tumorogénesis de tumores mamarios.28,29
Recientemente, se ha asociado a PTP1B en la progresión y metástasis de líneas celulares de cáncer de mama y modelos murinos.29,30 En estudios realizados en nuestro laboratorio se ha demostrado que PTP1B, modula de forma positiva la expresión de HER2 en células tumorales de glándula mamaria,31 aunque el mecanismo que ejerce PTP1B sobre HER2 aún no está bien establecido.
El objetivo de este estudio es determinar el efecto de la expresión de PTP1B, sobre procesos biológicos como la proliferación celular en cultivos de cáncer de mama. Consideramos que la expresión de PTP1B probablemente puede conferir a las células tumorales, una mayor agresividad en base a la modulación de la proliferación. De ser así, PTP1B tendría una importante utilidad pronóstica y terapéutica para el desarrollo de blancos moleculares.
¿ MATERIAL Y MÉTODOS
CULTIVO DE CELULAS DE CÁNCER DE GLÁNDULA MAMARIA
Los cultivos celulares MBCDF y MBCD25 fueron generados previamente en el laboratorio a partir de explantes derivados de una biopsia, obtenida a partir de una mastectomía radical (Protocolo aprobado por el Comité de Ética del Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", referencia 159).
PURIFICACIÓN DE PLÁSMIDOS
Los plásmidos utilizados fueron pcDNA4A (vector vacío, sin PTP1B), pcDNA4 myc-PTP1B WT (vector con PTP1B). La purificación por Maxiprep con el kit QIAGEN® se realizó de acuerdo al protocolo indicado por el fabricante. Se realizó la determinación o cuantificación de la cantidad de DNA por medio del nanodrop.
TRANSFECCIONES
Se transfectaron las células MBCDF, MBCD25 mediante el protocolo de lipofectamina plus reagent. Se colocó 1μg de plásmido (pcDNA4A y pcDNA4-myc PTP1B WT).
ENSAYO DE WESTERN BLOT
Las células se lisaron en buffer de lisis que contiene 50mM HEPES (pH 7.4), 1 mM EDTA, 250mM NaCl, 1% de Nonidato P-40, 10mM NaF, 1mM vanadato de sodio y 1X mezcla de inhibidores de proteasa (Complete, EDTA free, Roche). Treinta microgramos de proteína fueron sometidos a una electroforesis en un gel de policramida desnaturalizante, y se transfirió a una membrana inmobilon-P PVDF® (Millipore Corp Bedford, MA). La membrana se bloqueó una hora con leche 5% en PBS Tween. Posteriormente, se incubó con los anticuerpos primarios anti-myc toda la noche a 4oC. Se incubó con el anticuerpo secundario de ratón por 45 minutos. La señal fue visualizada por quimioluminiscencia, y se expuso a una película radiográfica (Kodak®).
PROLIFERACIÓN CELULAR
Se realizaron ensayos de proliferación celular, para lo cual se sembraron 5 000 células/cm2 en placas de 24 en medio RPMI - 1640 suplementado con 10% de SFB. Tras la siembra celular, éstas se cultivaron durante cinco días en estufa a 37°C con una atmósfera de CO2 al 5%. Las células se fijaron con glutaraldehído al 1.1% en PBS, durante 20 minutos los días 0, 1, 3 y 5. Al completarse los cinco días, se procedió a la tinción de las placas con cristal violeta durante 20 minutos, posterior a lo cual se realizaron lavados con agua de las placas para retirar el exceso de colorante. Una vez completado, se dejaron solubilizar las células en 400 μl de ácido acético al 10% durante 20 minutos. Por último, la absorbancia de la solución se midió mediante espectrofotómetro a 595 nm en un lector de microplaca (Biorad 680 Microplate Reader®). Los resultados se expresaron como el incremento del número de células a partir del día cero.
¿ RESULTADOS
SOBREEXPRESIÓN DE PTP1B EN LÍNEAS CELULARES Y CULTIVOS PRIMARIOS DE CÁNCER DE MAMA
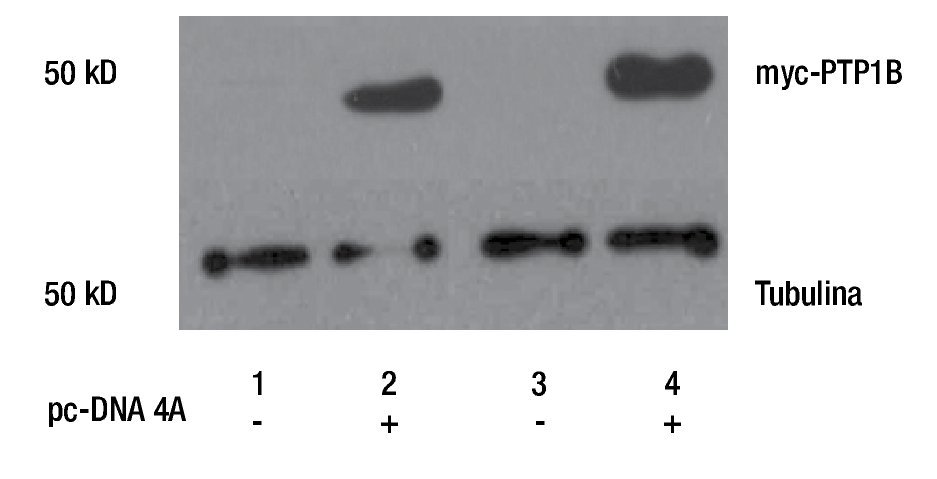
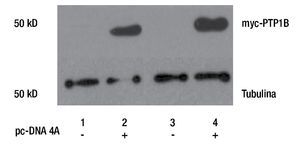
Para evaluar la participación de PTP1B en procesos biológicos como la proliferación celular, se realizó la transfección de plásmido pc-DNA4 vacío (EV) y el que contiene el cDNA de myc-PTP1B en su forma silvestre (WT), en cultivos primarios de cáncer de mama (MBCDF y MBCD25). La sobreexpresión de PTP1B fue evaluada mediante Western Blot usando un anticuerpo anti-myc, lo que demuestra que PTP1B está sobreexpresado en estas células (Figura 1). Los resultados muestran que los carriles transfectados con el vector vacío (carriles 1 y 3) no hay expresión de myc-PTP1B, mientras que en los carriles donde se expresó PTP1B (carriles 2 y 4), se encontró la expresión de myc-PTP1B.
Figura 1. Western Blot de la transfección transitoria y expresión de PTP1B WT, en cultivos primarios de cáncer de mama (MBCD25 y MBCDF). Los carriles 2 y 4 demuestran la actividad de myc-PTP1B, posterior a la transfección del plásmido pc-DNA4A. Los carriles 1 y 3 corresponden a los controles transfectados con el vector vacío.
EFECTO DE LA EXPRESIÓN DE PTP1B SOBRE LA PROLIFERACIÓN CELULAR
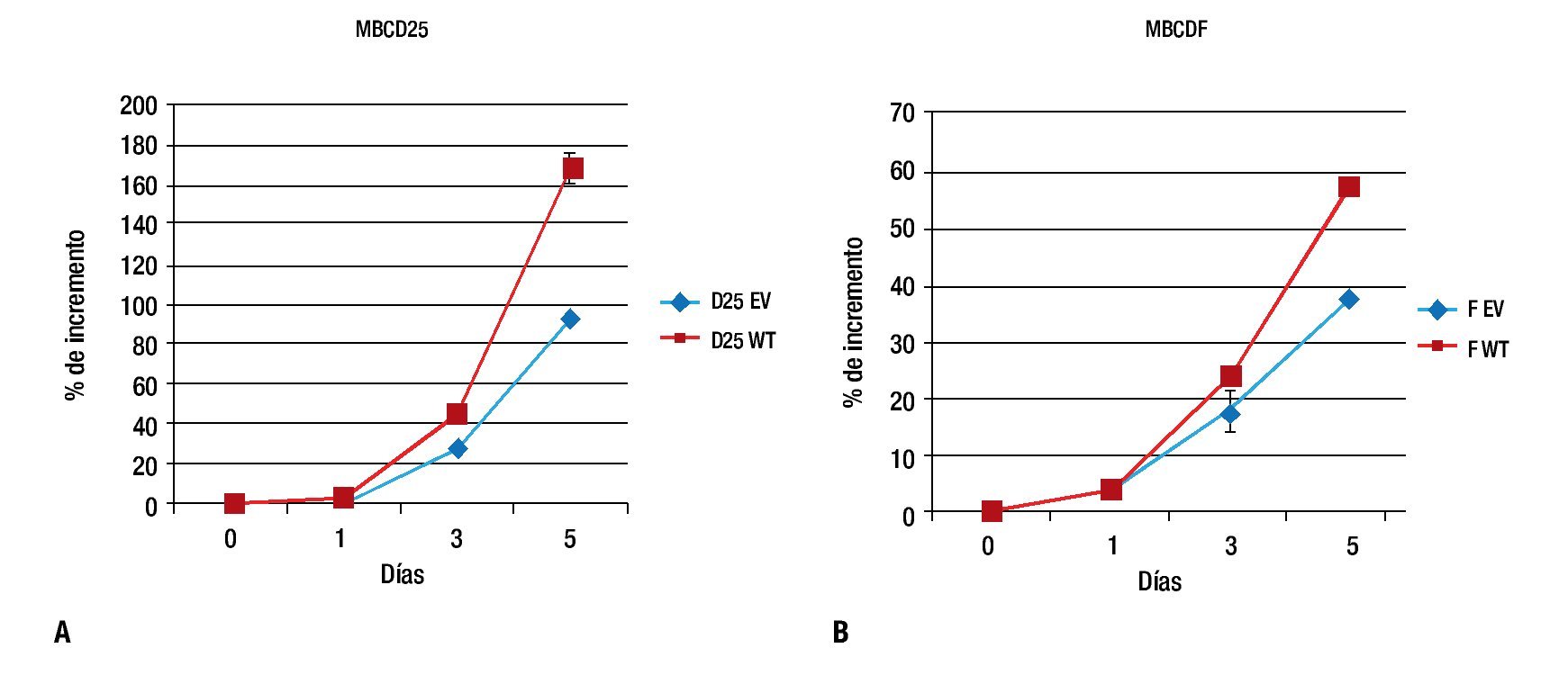
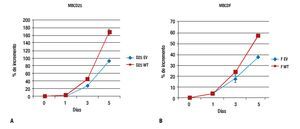
Para evaluar el efecto de la sobreexpresión de PTP1B sobre la proliferación, las células MBCD25 EV, MBCD25 WT, MBCDF EV y MBCDF WT transfectadas de manera estable, fueron usadas en ensayos de proliferación a cinco días. Observamos un incremento significativo en la proliferación en las líneas celulares que expresan PTP1B WT, el cual fue evidente al día tres y cinco de incubación. Estos resultados indican que la expresión de PTP1B posee un efecto proliferativo sobre las células tumorales de cáncer de mama, lo cual demuestra que esta fosfatasa ejerce acciones estimulatorias a nivel de la proliferación celular (Figura 2), lo que representa un hallazgo descrito por primera vez en este trabajo. De manera notable, los efectos proliferativos más sobresalientes se observaron en la línea celular MBCD25 que sobreexpresa PTP1B (WT), con una diferencia del 80% de incremento comparada con la línea transfectada con el vector vacío (EV).
Figura 2. Curvas de proliferación celular. A) MBCD25 WT con un porcentaje de incremento al día cinco del 170%, comparado con el 90% de la línea con el vector vacío (EV). B) MBCDF WT con una diferencia en el porcentaje de incremento más discreta en comparación con el vector vacío, 58% vs. 38%, respectivamente.
¿DISCUSIÓN
La expresión de PTP1B ha sido asociada en la oncogénesis en diversas neoplasias (por ejemplo, cáncer esofágico, mama, ovario y colon). Sin embargo, el mecanismo biológico por el cual PTP1B facilita la progresión del cáncer de mama, no se ha esclarecido por completo. Estudios previos en modelos murinos han demostrado que la ausencia de expresión de PTP1B en los tumores mamarios (NDL2/PTP1B -/-), confiere un retraso en el desarrollo tumoral y una frecuencia menor de metástasis pulmonares.29,30 En humanos, no existen estudios que evalúen el papel de PTP1B como factor pronóstico, los datos existentes se dirigen a la amplificación de la región del cromosoma 20q13, donde está situado el gen de PTP1B, y se ha encontrado que la amplificación de esta región se asocia a un pobre pronóstico en cáncer de mama.27 Otros estudios han demostrado que PTP1B activa a c-Src y la vía de Ras, defosforilando la tirosina inhibidora (Y527), lo que sugiere un papel oncogénico.22-24
En este estudio se demostró que la sobreexpresión de PTP1B en cultivos primarios de cáncer de mama, se asocia a un incremento significativo de la proliferación celular. Se puede plantear que el aumento en la capacidad proliferativa de las células con sobreexpresión de PTP1B ubicando a esta fosfatasa como un componente de la maquinaria de señalización que favorece la expresión, y por ende, un aumento en la actividad del receptor HER2, favoreciendo así una señalización prolongada río abajo de HER2, lo que favorecería un aumento en la capacidad proliferativa de las células. Otros estudios sugieren que el fenotipo proliferativo de HER2/neu está mediado por c-jun, y la ruptura de la adherencia celular mediada por STAT3.32,33 Estos datos nos indican que PTP1B confiere al menos, en modelos in vitro, un factor de mal pronóstico en cáncer, ya que su expresión se asocia a una mayor tasa de proliferación probablemente mediada por la sobreexpresión de HER2. Esto último, además, nos sugiere que la expresión de PTP1B puede favorecer el desarrollo de metástasis al conferir a las células tumorales una mayor capacidad de migración. Estos datos coinciden con los resultados encontrados en modelos murinos, donde la ausencia de PTP1B se asocia a un periodo libre de desarrollo tumoral mayor, y a una menor incidencia de metástasis pulmonares. Estos hallazgos justifican el estudio de PTP1B como factor pronóstico, en cáncer de mama en humanos.
¿ CONCLUSIONES
Recientemente, en nuestro laboratorio demostramos que PTP1B regula positivamente la expresión de HER2 en cultivos celulares de cáncer de mama, con un efecto dosis- respuesta, lo que sugiere que PTP1B es un modulador de la expresión del receptor HER2.31 Sin embargo, se desconocen los factores que favorecen la sobreexpresión de este receptor. Tratando de definir cuál es el papel biológico de PTP1B en cáncer de mama, en este trabajo sobreexpresamos PTP1B en cultivos primarios de glándula mamaria. Confirmamos uno de los efectos ya descritos anteriormente en el laboratorio, donde la sobreexpresión de PTP1B confiere un aumento en la expresión de HER2. Para evaluar el impacto en el desarrollo tumoral, valoramos el efecto de PTP1B sobre la proliferación celular. Los resultados muestran que la sobreexpresión de PTP1B confiere una mayor capacidad proliferativa a las células tumorales, con una diferencia de hasta el 80% en la tasa de incremento.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIAMIENTO
Protocolo apoyado por el Conacyt 102825.
Correspondencia:
Dr. Osvaldo Hernández Flores.
Norte 5 N° 16, Colonia Adolfo Ruíz Cortines,
C.P. 55050, Ecatepec, Méx., México.
Teléfono fijo: (55) 9152 2766. Celular: (044 55) 29452646.
Correo electrónico: md_hdezflores@hotmail.com