Pagina nueva 1
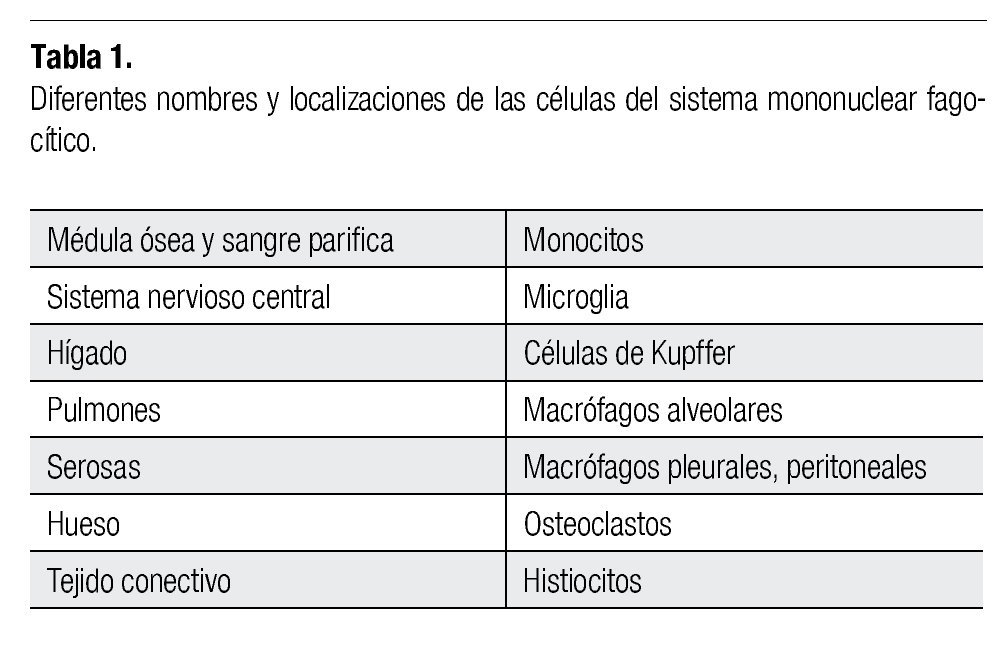
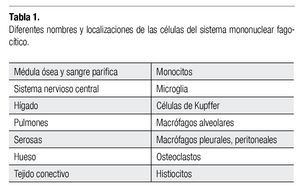
Los macrófagos son células del sistema mononuclear fagocítico (SMF), que se originan en la médula ósea, como monoblastos, y luego se diferencian en promonocitos y monocitos. Pertenecen a la serie mielocítica. De la médula ósea emigran y se localizan al interior y fuera de los órganos linfáticos, su periodo de vida y fenotipo dependen de su origen y microambiente (Tabla 1), algunos de ellos se pueden diferenciar en células dendríticas.
Estas sorprendentes células constituyen la segunda población celular del sistema inmune, y son parte crucial de la inmunidad innata. Son capaces de secretar más de 100 productos biológicamente activos y poseen más de 100 receptores de superficie celular, sus funciones van desde actividades arcaicas evolutivamente, como la fagocitosis, hasta actividades muy evolucionadas como la presentación de antígenos.1 Así pues, en la actualidad se considera que intervienen en tres funciones preponderantes del hospedero: inflamación-regeneración de tejidos, procesos inmunológicos y homeostasis.
Para ello, llevan a cabo siete funciones:1
1) Fagocitosis de microorganismos y algunas células.
2) Eliminación de células viejas, detritus y cuerpos extraños.
3) Regulación de hematopoyesis.
4) Interacción bidireccional con linfocitos.
5) Presentación de antígenos para montar respuesta inmune específica.
6) Secreción de más de 100 productos biológicamente activos.
7) Actividad antitumoral.
Clásicamente se considera que, para que los macrófagos logren su plena actividad deben pasar de un estado de reposo a un estado de activación por señales, primero de INF-γ, y luego una segunda señal dada por el lipopolisacárido (LPS). Desde el punto de vista funcional, se dividen las células del SMF en dos grandes grupos: macrófagos tipo 1 (M1) y macrófagos tipo 2 (M2). Tratamiento con INF-γ o LPS induce macrófagos M1, que se consideran proinflamatorios y secretan TNF-α, IL-1β, IL-12, que promueven la generación de linfocitos Th1, especies reactivas de oxígeno y derivadas de óxido nítrico y pueden destruir células tumorales. Mientras que el tratamiento con IL-4 o IL-13 induce M2, los cuales secretan interleucinas antiinflamatorias como la IL-10, y factor de crecimiento semejante a insulina, promueven regeneración de tejidos y angiogénesis. Es importante considerar que estas células pueden cambiar de fenotipo, por ejemplo, la fagocitosis de células en apoptosis por macrófagos de tipo M1, los desactiva y puede transformar en macrófagos tipo M2.2,3
La teoría de la vigilancia inmunológica y la teoría de la inmunoedición señalan el importante papel que juegan los macrófagos en contra y a favor de las células tumorales, de hecho desde los años 70´s se sabe que los macrófagos asociados a tumor conocidos (TAM, por sus siglas en inglés) son los leucocitos predominantes, y su presencia puede ser asociada a buen o mal pronóstico.
Las células del SMF dentro del contexto de las teorías mencionadas, se sabe que pueden combatir a las células malignas mediante dos mecanismos, la citotoxicidad que es un fenómeno irreversible, o por citostatismo no muere la célula pero pierde su capacidad de dividirse.4
La utilización de macrófagos contra las células tumorales tiene muchas ventajas, sobre las células NK o los linfocitos antitumorales específicos T o B:5
1. El espectro antitumoral es mucho mayor que el de las células NK, ni siquiera es especie específico.
2. Los macrófagos activados inespecíficamente pueden actuar contra tumores inmunogénicos, débilmente inmunogénicos o no inmunogénicos.
3. Aparentemente los macrófagos son las últimas células afectadas por la inmunosupresión que genera el cáncer.
4. Macrófagos no activos, pueden ser activados in vitro para destruir células tumorales.
5. Los macrófagos son capaces de diferenciar entre células extrañas, tumorales y células normales.
6. No se han reportado casos de resistencia a la citotoxicidad de macrófagos a líneas celulares tumorales, contrariamente a lo que pasa con las células NK.
7. La obtención de monocitos de sangre periférica es muy fácil de hacer, estos pueden activarse in vitro y reinyectarse al mismo paciente.
Sin embargo, como la mayor parte de las cosas que suceden en ciencia, lo que fluye en un sentido, también puede fluir en sentido contrario. Así pues, también es ampliamente conocido que los macrófagos pueden favorecer el desarrollo de las neoplasias por diferentes mecanismos. De hecho, esta dualidad se pone de manifiesto en que los TAMs pueden ser proinflamatorios al producir INF-g, IL-1, IL-6 y poseer actividad antitumoral, así como correlacionarse con buen pronóstico, pero en una gran variedad de tumores como en cáncer de mama, próstata, ovario, cérvix, pulmón y melanoma cutáneo, los TAMs son considerados antiinflamatorios y se relacionan con pronóstico pobre.
Los TAMs facilitan el crecimiento tumoral a través de:3
1. Quimiocinas: Los TAMs que son reclutados mediante el estímulo de la quimiocina CCL2 (proteína quimiotactante de monocitos) son relacionados con mal pronóstico. Los macrófagos tipo M2, pueden promover linfocitos Th2 y células T reguladoras.
2. Angiogénesis: Los tumores no pueden crecer más de 2 a 3 mm3, y dar metástasis si no están vascularizados. Los TAMs localizados dentro de tumores sólidos, favorecen la angiogénesis. Los TAMs inducen angiogénesis a través de VEGF, PDGF, TGF-β y un miembro de la familia FGF, que promueve angiogénesis en gliomas, carcinomas de células escamosas de esófago, próstata, vejiga y mama. También liberan los macrófagos metaloproteinasas de matriz, que favorecen la angiogénesis, como la 1, 2 3, 9 y 12.
3. Linfoangiogénesis: Los TAMs en tumores de cérvix humanos, promueven la linfoangiogénesis mediante VGEF-C y VEFG-D, con la subsecuente formación de metástasis linfáticas. Se ha sugerido que macrófagos inducen linfoangiogénesis mediante su incorporación directa en la lámina endotelial, o por estimulación de la división de células endoteliales linfáticas.
4. Crecimiento tumoral: La infiltración de TAMs se correlaciona positivamente con la proliferación de las células tumorales, como es el caso del cáncer de mama, cáncer endometrial y renal. Experimentalmente mediante la eliminación de TAMs, se demostró que son esenciales para el crecimiento de tumores. Asimismo, la metaloproteinasa MMP9 puede participar en el crecimiento tumoral. Los macrófagos tipo M2 secretan IL-10 que inhibe la acción citotóxica de células T, inhibiendo las linfocitos Th1 y la citotoxicidad NK activada por interleucinas.
5. Metástasis: Se conoce sinergia entre células de cáncer de mama y los TAMs para generar migración celular. Metaloproteinasas, IL-1-β, captesina B, entre otras, han sido reportadas para inducir metástasis.
6. Inmunosupresión: El TGF-β juega un papel crucial, tanto de la inmunidad innata como adaptativa, y promueve la polarización de los macrófagos hacia el tipo M2, inhibe a las células NK, decrece el número de células dentríticas y la presentación de antígenos. La secreción de IL-10 por TAMs, inhibe la maduración de células dentríticas y la liberación de INF-γ. El macrófago es el principal productor de prostaglandina E2, potente inmunosupresor. Además, los TAMs se relacionan de manera importante con las células madre tumorales.
Así pues, después de toda esta evidencia, es de esperarse que células del SMF capaces de secretar más productos biológicamente activos, que ni los mismos hepatocitos, y que son un verdadero puente entre la inmunidad innata y la adaptativa, tengan una compleja relación con las células tumorales. El fenotipo que adoptan entre el tipo M1 y el tipo M2, muy lábil, ha dificultado su estudio, a pesar de su enorme potencial antitumoral. Para uso terapéutico de base o adyuvante son fáciles de obtener y modularlos in vivo o in vitro, y dirigirlas hacia los sitios donde se requieren, casi con toda seguridad, con menos efectos colaterales que inmunoterapia con factores solubles o la quimio y radioterapia. Así pues, la verdadera pregunta a contestar en relación a las células del SMF es, ¿de qué depende su fenotipo M1 y M2 y cómo poder modularlo?
Correspondencia:
Dr. Francisco Javier Ochoa-Carrillo.
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan,
C.P. 14080, México D.F.,
México. Teléfono: (52-55) 5568 5013.
Correo electrónico: ochoacarrillo@prodigy.net.mx