Introducción: El receptor HER2 miembro de la familia de receptores del factor de crecimiento epidérmico (EGFR), se encuentra sobreexpresado en el 25% de los tumores de mama, confiriéndoles una biología más agresiva; de forma similar se ha observado que c-Src se encuentra sobreexpresado en tumores sólidos como el cáncer de mama, en correlación a la sobreexpresión de ErbB2, sugiriendo que participa en la vía de señalización río abajo del receptor de HER2, pudiendo tener un rol en la progresión neoplásica a través de incrementar la migración celular. Trabajos previos han sugerido la participación de c-Abl en la señalización de ErbB2, y en la modulación de la migración en células tumorales. Nuestra hipótesis fue que c-Src participa en la señalización río abajo de HER2, previo a la activación de c-Abl y que ejerce su acción promoviendo la migración celular.
Material y métodos: Se realizaron ensayos de estimulación con factor de crecimiento epidémico (EGF) e inhibidores de cinasas, inmunoblot y mortalidad celular.
Resultados: nuestros resultados sugieren que c-Src participa en la señalización río abajo de HER2, previo a la activación de c-Abl modulando migración celular, a través de una vía distinta a AKT y MAPKS. Además, inhibidores de c-Src median su fosforilación y activación río abajo de c-Abl, inhibiendo la migración celular.
Discusión: nuestro trabajo ofrece una vía de señalización para HER2 no descrita, donde participan c-Src y c-Abl, teniendo como desenlace un incremento en migración celular, confiriendo al tumor una biología más agresiva. El inhibir la migración celular y por lo tanto, la progresión y diseminación del tumor, ofrece un campo terapéutico exitoso en el tratamiento del cáncer de mama.
Introduction: The HER2 receptor member of the epidermal growth factor (EGF) receptor family are overexpressed in 25% of human breast cancers conferring a more aggressive biology. Similarly c-Src is overexpressed in solid tumors like breast cancer, in correlation with ErbB2, suggesting it plays a role in downstream receptor signaling and cellular migration. Previous studies have suggested that c-Abl is activated downstream HER2 receptor in breast cancer cells cell migration. We hypothesize that c-Src and c-Abl are activated downstream HER2 signaling and increasing migration activity in human breast cancer cells.
Material and methods: The effects of EGF stimuli and kinases inhibitors were evaluated using assay to measure migration. Western blotting was used to monitor its effects on cell signaling. Results: Our results suggests that c-Src is activated downstream signaling of HER2 before activation of c-Abl, increasing cellular migration, through a different signaling pathway than AKT and MAPKS and its downstream targets.
Discussion: Our study describes a new signaling pathway downstream HER2 receptor where c-Src and c-Abl are implicated and have a key role on migration for breast cancer cells. These data suggest that inhibitors targeted against c-Src or c-Abl kinases could potentially be useful in preventing breast cancer progression.
Pagina nueva 1
Introducción
El cáncer de mama es la neoplasia más frecuente en las mujeres a nivel mundial, y la primera causa de muerte por cáncer en el sexo femenino. Cerca de 40,000 mujeres mueren cada año por esta enfermedad1. En México, la tasa de defunciones por cáncer de mama es de 13.4% según estadísticas del INEGI reportadas en el 2011, afectando principalmente a mujeres en la 6° década de la vida, con una tasa de defunciones de 42.7% (INEGI 2010). A partir del 2006, la mortalidad por esta enfermedad en México, supera la del cáncer cervicouterino como principal causa de muerte por tumores malignos2.
En países desarrollados el cáncer de mama se diagnostica en su mayoría en etapas tempranas o localizadas, sólo el 5% sigue diagnosticándose en etapas avanzadas. En países en desarrollo los programas de detección oportuna no son de suficiente cobertura, y el mayor porcentaje de esta enfermedad se diagnostica en estadios avanzados. Según datos de instituto Mexicano del Seguro Social (IMSS), el 48% de las detecciones ocurre en etapas III y IV3. Según datos del Surveillance Epidemiology and End Results (SEER) sólo el 23% de las mujeres en estadio avanzado, estarán vivas a 5 años.
La mayoría de las muertes por cáncer son resultado de metástasis de células tumorales a órganos distantes, más que por el tumor primario. La habilidad de tumores derivados de epitelio a progresar y metastatizar, correlaciona con su habilidad a migrar y capacidad para degradar la matriz extracelular. Por este motivo, se ha estudiado la activación de cinasas y factores de crecimiento involucrados en estos eventos4.
El receptor ErbB (también conocido como HER) se expresa en varios tejidos de origen epitelial, mesenquimal y neuronal, en los cuales están involucrados en el control de diversos procesos biológicos como proliferación diferenciación, migración y apoptosis. La sobreexpresión ha sido documentada con muchos tipos de cáncer y asociada a un pobre pronóstico. Debido a la importancia de ErbB tanto en el desarrollo y transformación celular, se realizan esfuerzos para aclarar las señales intracelulares a partir de esta familia de receptor de tirocina cinasa. La activación del receptor del factor de crecimiento epidérmico (EGFR) por su ligando, induce dos tipos de fosforilación: la que aumenta la actividad cinasa y la que permite el anclaje a otras proteínas. Estos residuos se encuentran en el extremo c-terminal de los receptores y unen proteínas homologas de Src-2 (SH2), dentro de las que destacan Grb2 o Shc, que permiten ensablar complejos de señalización al receptor. Esto lleva a una activación de cinanas de serina-treonina, y otras proteínas cinanas y/o factores de transcripción (Olayioye et al. 2000). Esta cascada de señalización permite la amplificación de la señal que resulta en cambios de la función de las proteínas y en activación transcripcional. Las dos vías de señalización mejor descritas para esta familia de receptores de ErbB son dos, la vía de ras/MAPK y la vía de PI3K /AKT.
El c-Src se ha encontrado sobreexpresado en muchos tipos de células tumorales humanas, principalmente en cáncer de próstata. En tejidos de mama, los niveles de las 3 proteínas conocidas de c-Src en células epiteliales son variables y difícil de detectar por medio de ensayos de inmunohistoquímica, aunque por medio de inmunoblot se ha documentado su sobreexpresión5-8.
Se ha establecido cada vez más aparente que el número de receptores, específicamente de la familia EGFR, así como de tirocina cinasa como c-Src, juegan un rol crítico en el desarrollo y progresión de muchos tumores sólidos, incluyendo al cáncer de mama9,10. La sobreexpresión de EGFR se asocia a etapas más tardías de carcinogénesis11,12, y es implicada en el desarrollo de resistencia a medicamentos y peor pronóstico. Interesantemente, una coexpresión de c-Src se ha observado en la mayoría de los tumores sólidos, sugiriendo una posible relación entre c-Src en la señalización del receptor. Trabajos previos (Plattner et al.) han mostrado la participación de c-Abl en la señalización celular río abajo de HER2, donde su activación se relacionó con mayor migración celular en cáncer de mama13. Con estos antecedentes nosotros planteamos la hipótesis, que c-Src participa en la señalización río abajo del receptor de HER2, previo a la activación de c-Abl y que ejerce su acción promoviendo la migración celular de cultivos de cáncer de mama.
Materiales y métodos
Líneas y cultivos celulares
Se utilizaron como líneas celulares los cultivos primarios denominados MBCD25, MBCDF, MBCD3 y MBCD5-B3, desarrollados a partir de tumores de mama avanzados con sobreexpresión de ErbB2. Se mantuvieron en RPM1-1640 suplementado con 10% de suero fetal bovino (SFB) en incubador humidificado a 37ºC, en ambiente de 95% de aire y 5% de CO2.
Ensayo de estimulación con factor de crecimiento epidérmico (EGF)
Las líneas celulares se sembraron a una densidad de 800,000 células por plato de 28 cm2 en RPM1-1640, suplementado con 10% de SFB. Se retiró el medio suplementado, se lavó con PBS y después se adicionaron 2 ml de medio con SFB al 0.1%, por un periodo de 4 horas. Posteriormente, se agregaron 10 ng/ml de EGF por diferentes tiempos 0', 5',15', 30' y 45'.
Tratamientos con inhibidores de tirosina cinasa
Las líneas celulares se sembraron a una densidad de 800,000 células en RPM1-1640, suplementado con 10% de SFB en platos de 60 x 15 mm. Se retiró el medio suplementado, y se lavó con PBS frío, adicionándose 2 ml de medio con SFB al 0.1%, por un periodo de 4 horas. Posteriormente, se adicionó el inhibidor de c-Src (Su-6656, calbiochem) a concentraciones crecientes 0, 0.001, 0.025, 0.1 y 1 µM por 45 minuto.
Ensayo de estimulación con EFG, inhibidor de HER2 (lapatinib) e inhibidor de c-Src (SU-6656) en cultivos primarios y líneas comerciales de cáncer de mama
Para este ensayo, se sembraron 800,000 células en platos de 60 x 15 mm de todos los cultivos utilizados en RPMI con 10% de SFB. A las 24 horas se retiró el SFB, se lavó con PBS y se adicionaron 2 ml de medio 0.1% de SFB, por un periodo de 4 horas. Se adicionaron los inhibidores de tirosina cinasa por 2 horas, previo a la estimulación con EGF 10 ng/ml por 15 minutos.
Inmunoblot
Para el ensayo de inmunoblot, se lisó el pellet de células con buffer de lisis (50 mM de HEPES (pH 7.4), 1 mM vanadato de sodio y 1X mezcla de inhibidores de proteasas (complete®, EDTA-free, rOcHE). Se cuantificó proteína por método de Bradford, 20 μg de proteína total se corrieron en geles de poliacrilamida (SDS-PAGE). Posteriormente, se transfirió a una membrana PVDF (Immobilon-P, Millipore). las membranas se bloquearon por una hora con 5% de leche en PBS-Tween. Se lavó el exceso de leche y se incubaron en agitación con los anticuerpos primarios toda la noche. Se utilizaron anticuerpos primarios; anticuerpo monoclonal anti-erbB2/HER2 (Santa cruz Briotechnology, Santa Cruz, CA), anticuerpo anti-AKT (Cell Signaling Technology), anticuerpo anti-c-Abl (Santa cruz Biotechnology, Santa cruz, cA), anticuerpo anti-MAPK (Cell Signaling Technology), anticuerpo anti-c-Src (Cell signaling Technology), anticuerpo anti-pHEr2 (Y877) (Cell Signaling Thechnology), Anti-p-AKT (S453) (Santa Cruz Biotechnology, Santa Cruz, CA), anti-p-MAPK (T202, Y284) (Cell Signaling Technology), anticuerpo anti-c-Src (Cell signaling Technology), anticuerpo anti-p-Src (Y416) (Y527) (Cell signaling Technology). Se retiró el anticuerpo primario y se adicionó el anticuerpo secundario por una hora. Posteriormente, se realizaron 3 lavados de 10 minutos con PBS-tween en agitación. Se agregó agente quimiolumiscente Thermo Sientific/ECL Plus® por 5 minutos, y se expuso a película radiográfica (Kodak®).
Ensayo de viabilidad celular con inhibidores de c-Src (SU-6656, dasatinib, nilotinib)
Para el ensayo de viabilidad, se sembraron 7,500 células/ cm2 en placas de 48 pozos de las líneas celulares en medio RPMI, suplementado con 0.5% de SFB. A las 24 horas, se adicionaron concentraciones crecientes de inhibidor de de c-Src (Su-6656), incubando por un periodo de 48 horas posteriores a la adición del fármaco. A este tiempo, se retiró el medio y se fijaron las células con glutaraldehído al 1.1% por un periodo de 25 minutos, y se tiñeron por el método de cristal violeta, lavando el excedente de colorante con agua corriente. Se agregó a cada pozo 200 ml de ácido acético al 10% para diluir el colorante por 25 minutos, y se midió la densidad óptica de la dilución a 590 nm en un lector de ELISA. Los resultados se expresaron en porcentaje de absorbancia de las células tratadas sobre las no tratadas. Los experimentos se realizaron por triplicado de manera independiente, obteniendo el promedio de los 3 resultados.
Ensayo de motilidad celular: herida en monocapa
Se sembraron 800,000 células/10 cm2 de los cultivos primarios en RPM1-1640, suplementado con 10% de SFB en platos de 60 x 15 mm. Se dejó 24 horas adherir la monocapa. Se realizó herida en monocapa con una punta estéril, se retiró el medio suplementado con SFB, y se lavó con PBS para descartar los restos celulares, adicionándose posteriormente 2 ml de medio con SFB al 10%. Se tomó fotografía considerando este momento como el tiempo 0. Se dividieron grupos, el primer grupo como control, el segundo grupo se adicionó inhibidor de HER2 (lapatinib) a concentración de 1 mM, el tercer grupo inhibidor de c-Src (Su6656 y dasatinib) a concentración de 1mM. las placas se incubaron en estufa gaseada a 37ºC, tomando fotografía a las 6 y 24 horas.
Resultados
Curso temporal de estimulación con EGF
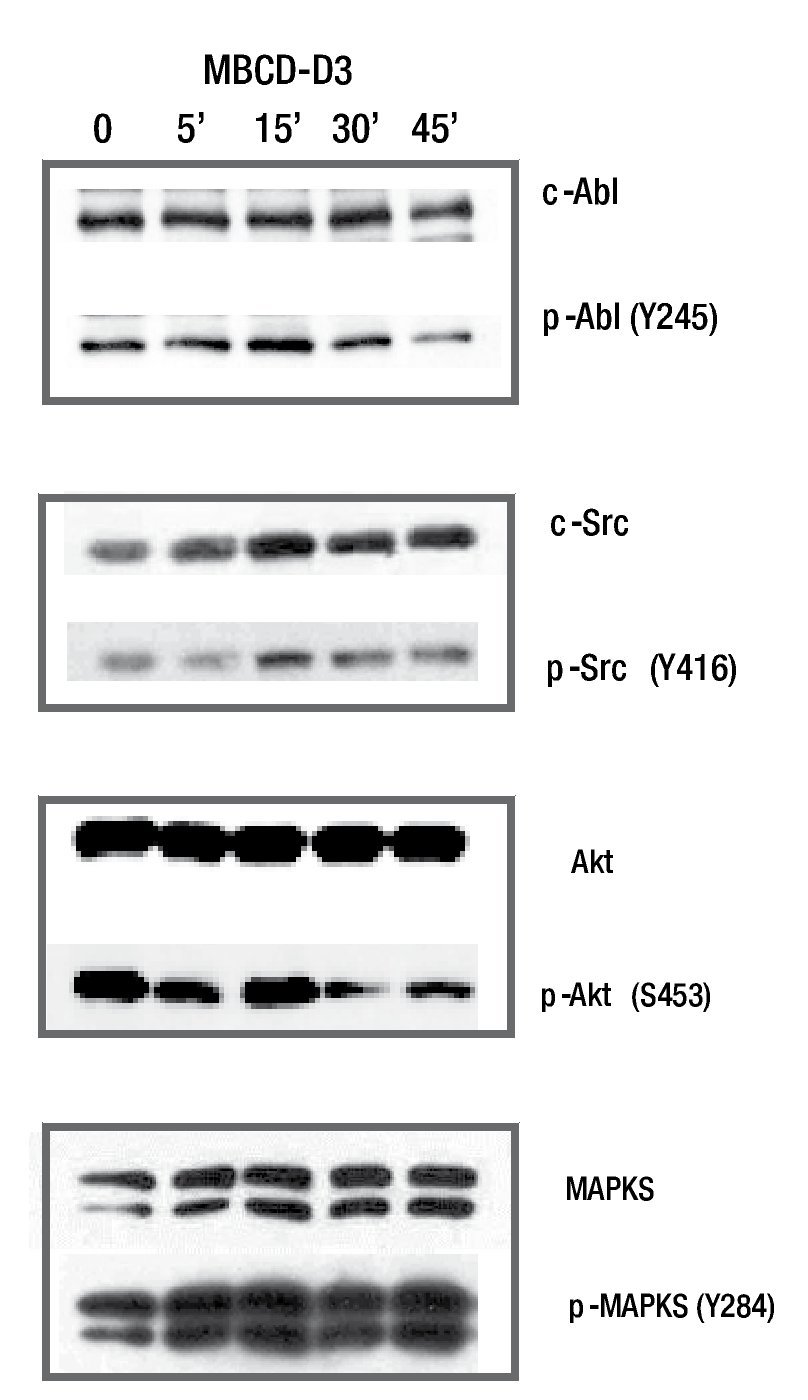
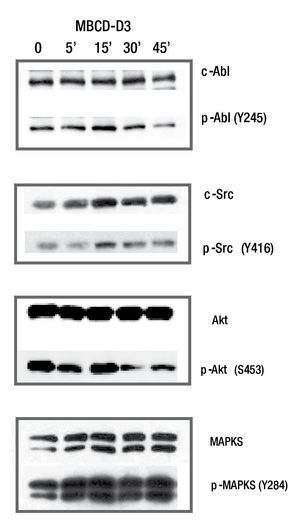
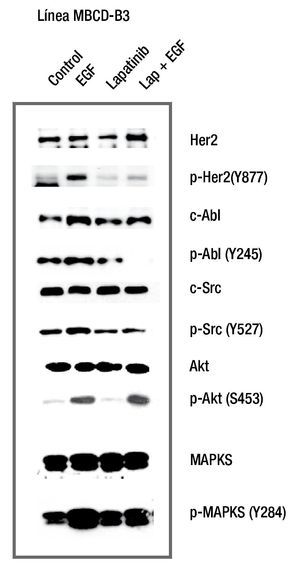
Para documentar la presencia de c-Src y c-Abl río abajo del receptor de HER2, se realizó un estímulo de señalización por medio de un ligando específico para ErbB2; el EGF. Para este ensayo se utilizaron cultivos primarios de cáncer de mama denominados MBCD-D25, MBCD-F, MBCD-D3 y MBCDB3. Los resultados mostraron que el estímulo de EGF induce fosforilación del receptor de HER2, con un pico máximo de activación a los 15 minutos. Además, c-Src (Y427) y c-Abl (Y245) incrementan su fosforilación en respuesta al estímulo del receptor con EcG, con un punto máximo de estímulo al minuto 15. De igual manera, AKT y MAPK tuvieron un incremento en relación al tiempo en respuesta al factor de crecimiento epidérmico, con un punto máximo a los 15 minutos. Con estos resultados se comprueba que c-Src y c-Abl se fosforilan en respuesta al estímulo de receptor HER2 (fig. 1).
Figura 1 El efecto del estímulo de EGF sobre la fosforilación de c-Src, c-Abl, AKT y MAPKS. En la línea celular MBCD-D3, hay un incremento en la fosforilación en c-Src, c-Abl, AKT y MAPKS, con un estímulo máximo alcanzado a los 15 minutos.
Tratamiento de líneas celulares con inhibidores de cinasa Para investigar el potencial mecanismo regulador de HER2, c-Src y c-Abl, se realizaron ensayos con lapatinib utilizado como modulador del receptor HER2 y bloqueadores comerciales de c-Src como Su6656 y dasatinib, además de un estímulo de ErB por medio de EGF.
Efecto de lapatinib sobre la forforilación inducida por EGF de HER2, c-Src, c-Abl, AKT y MAPKS
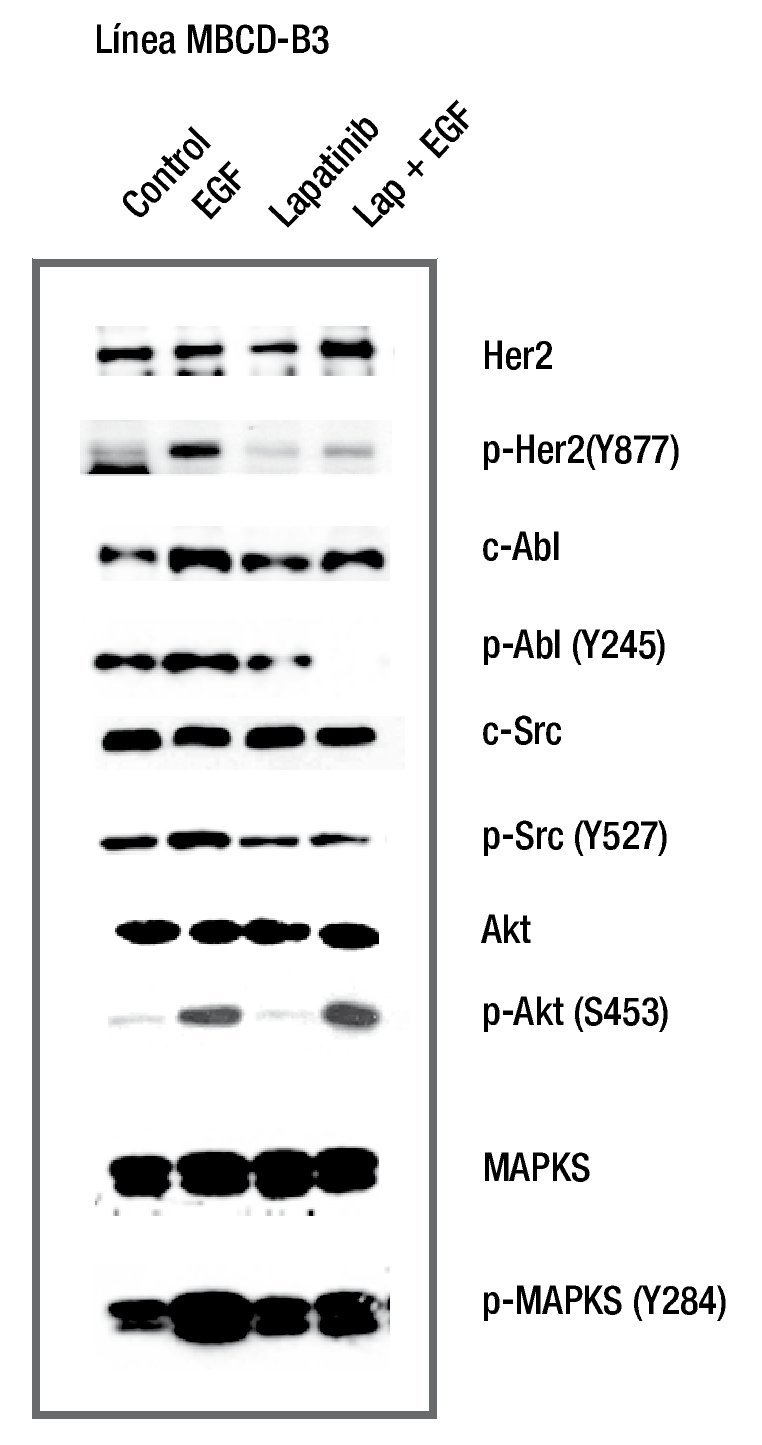
Para evaluar el efecto de lapatinib sobre la fosforilación de HER2, c-Src, c-Abl y MAPKS (ras), en los cultivos primarios se adicionó lapatinib 0.1 μM por 2 horas y un estímulo de EFG 10 ng/ml por 15 minutos. Los resultados mostraron que la línea MBCD-B3 incrementó la fosforilación del receptor HER2, al adicionarse EGF y se disminuyó al agregar lapatinib antes del estímulo de EGF. Encontramos que las cinasas AKT y MAPKS no disminuyen su forforilación al adicionar lapatinib, previo a EGF. La adición de lapatinib previo al estímulo del EGFR, disminuye la fosforilación de c-Src y c-Abl, lo que sugiere que la inhibición de HER2, bloquea la fosforilación tanto de c-Src como c-Abl (fig. 2).
Figura 2 El efecto de lapatinib sobre la fosforilación de HER2, c-Src, c-Abl, MAPK y AKT. Lapatinib inhibe la fosforilación del receptor HER2 y de las cinasas c-Src y c-Abl. AKT y MAPKS no presentan inhibición al ser evaluada en este periodo de tiempo corto.
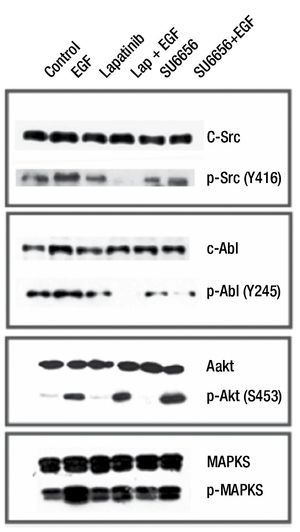
Efecto de inhibidor de c-Src (SU6656) sobre la forforilación inducida por EGF de c-Src, c-Abl, AKT y MAPKS
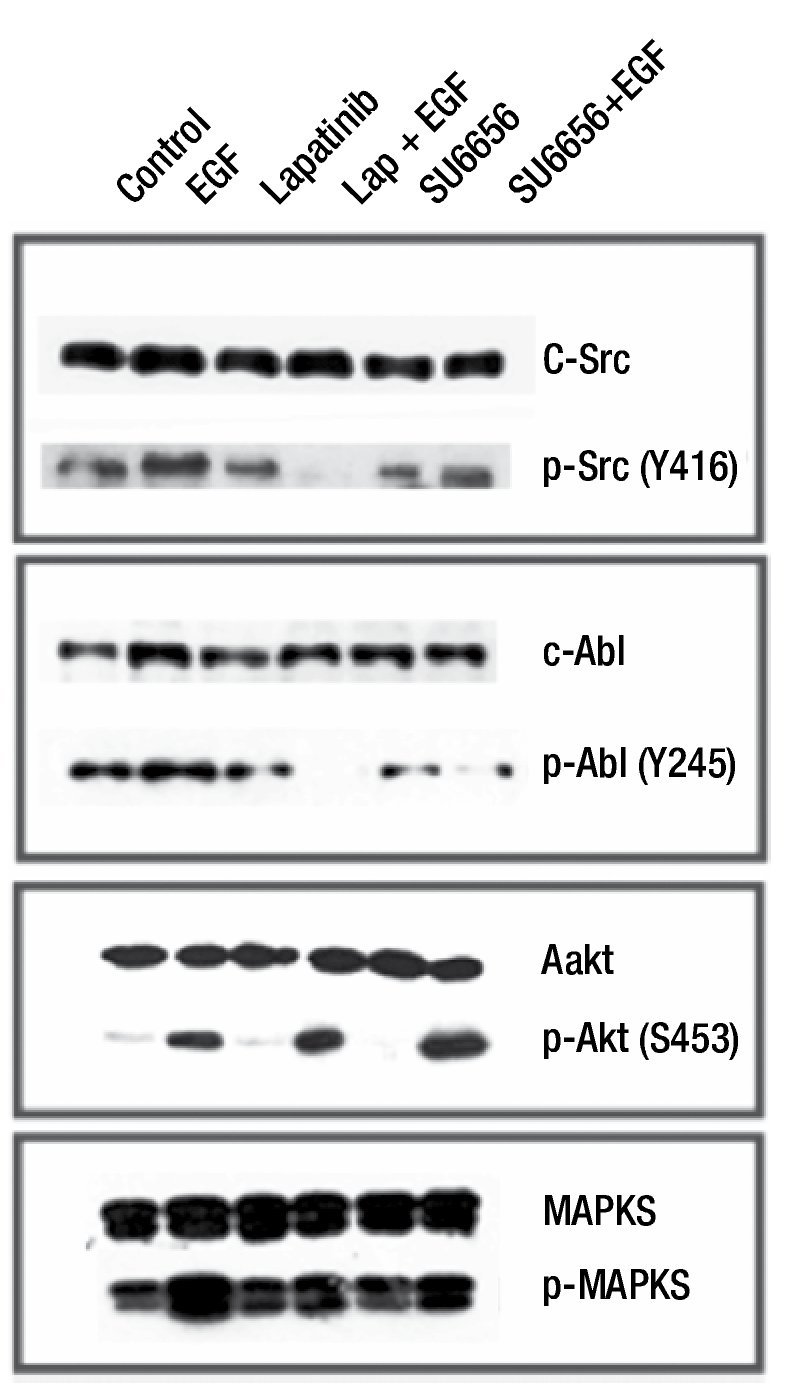
Para evaluar el efecto de Su6656 sobre la fosforilación de c-Src, c-Abl y MAPKS (ras), en los cultivos primarios se adicionó Su6656 0.1μM por 2 horas y un estímulo de EFG 10 ng/ ml por 15 minutos. los resultados mostraron que la línea MBCD-D3 incrementó la fosforilación del receptor HER2 al adicionarse EGF y se disminuyó al agregar lapatinib antes del estímulo de EGF. Encontramos que las cinanas AKT y MAPKS no disminuyen su forforilación al adicionar lapatinib, ni Su6656 previo a EGF. La adición de Su6656 previo al EGF disminuye la fosforilación de c-Src y c-Abl, lo que sugiere que la inhibición de c-Src bloquea la fosforilación tanto de c-Src como c-Abl (figs. 3 y 4).
Figura 3 El efecto de Su6656 sobre la fosforilación de c-Src, c-Abl, MAPK y AKT. Su6656 inhibe la fosforilación de c-Src y c-Abl. AKT y MAPKS no presentan inhibición al ser evaluada en este periodo de tiempo corto.
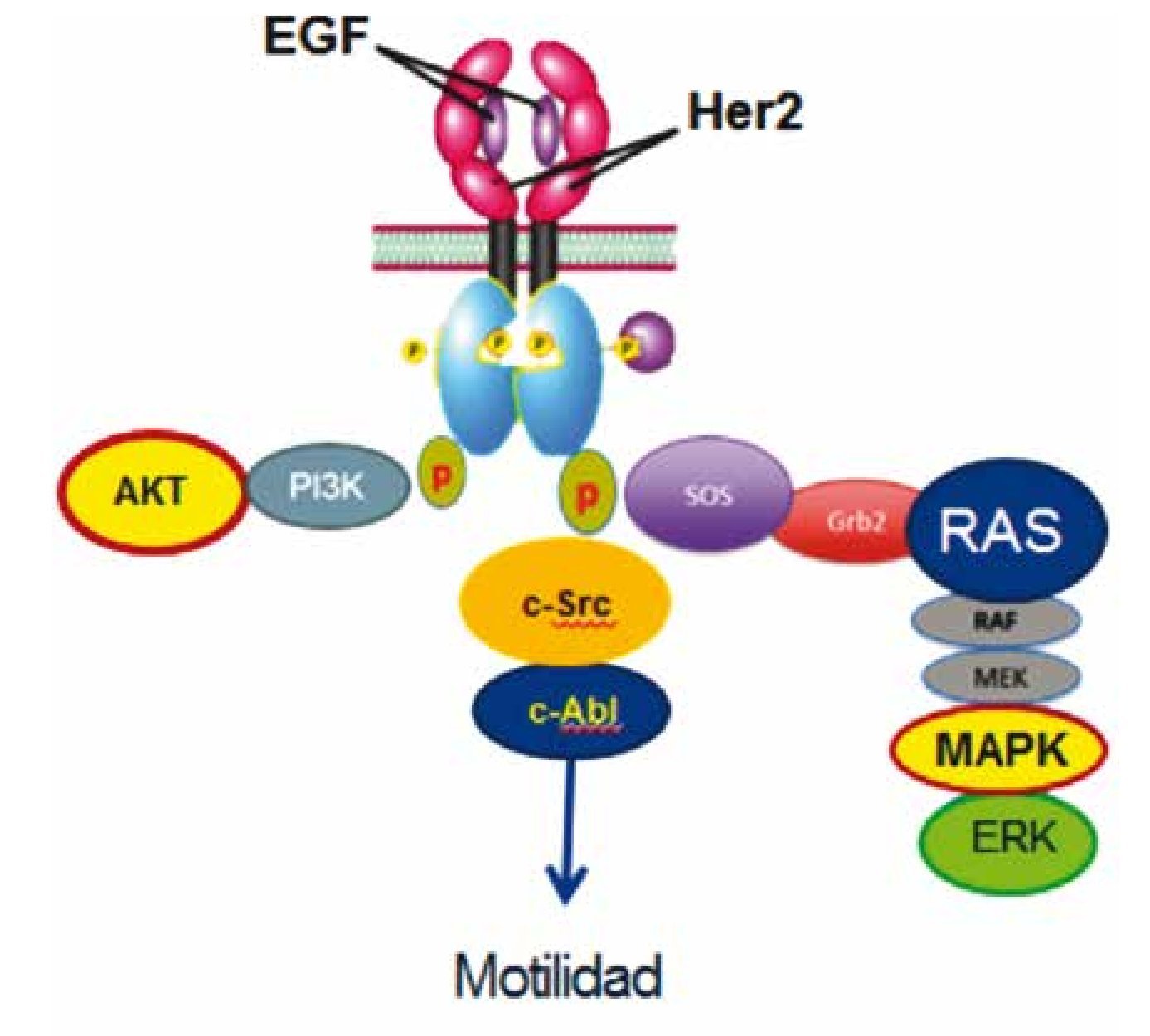
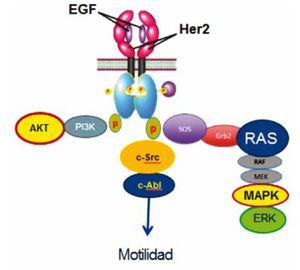
Figura 4 c-Src participa en la señalización río abajo de HER2 previo a la activación de c-Abl, modulando migración o motilidad celular, a través de una vía distinta a las descritas a través de AKT y MAPKS.
Viabilidad celular
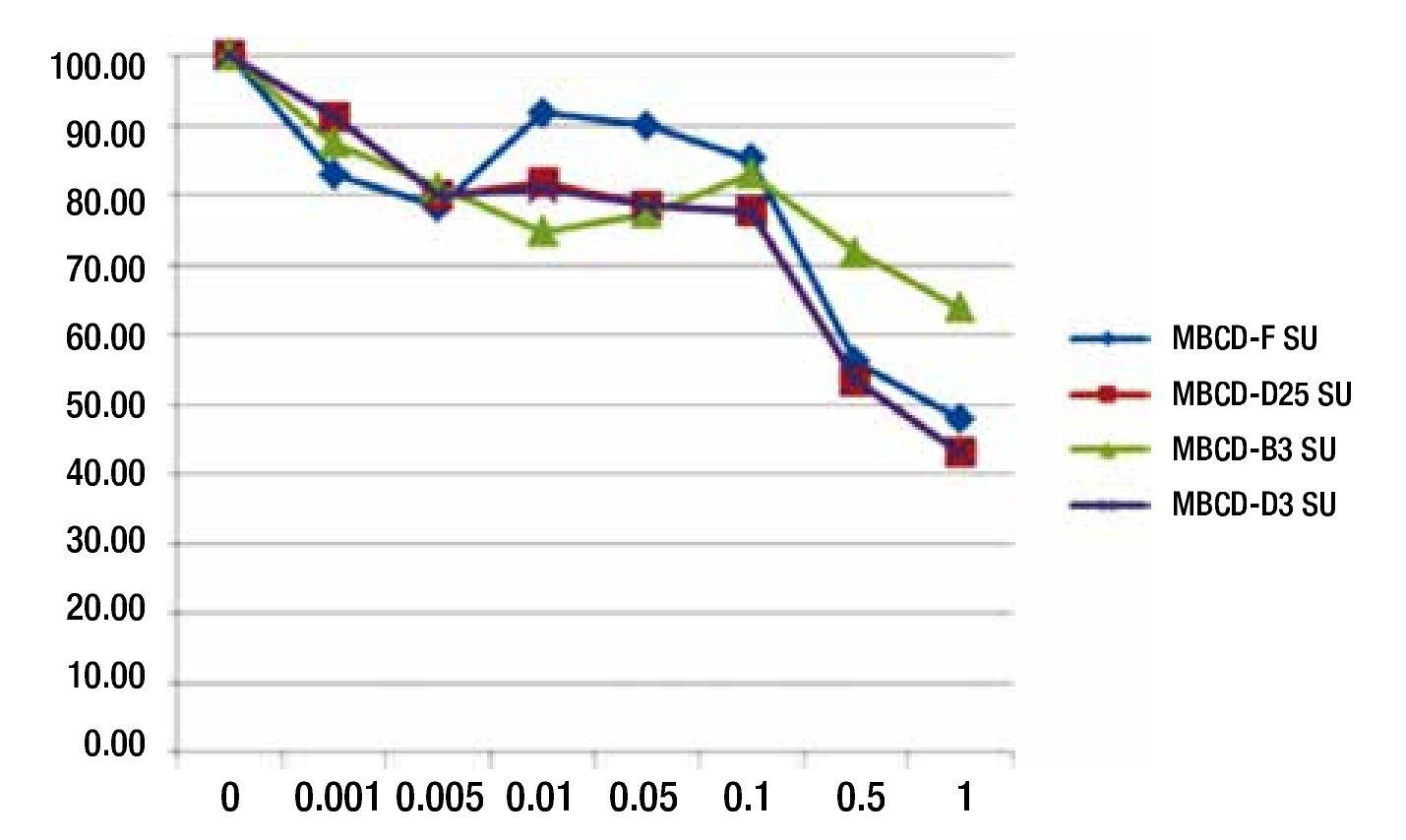
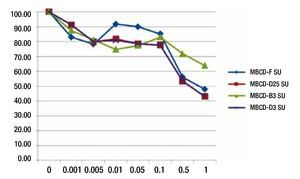
Para evaluar el efecto de la disminución de la fosforilación de c-Src y c-Abl por inhibidor comerciales de c-Src (Su6656, dasatinib, nilotinib), se realizaron ensayos de viabilidad celular en las 4 líneas de cultivos primarios. Se encontró que el ic50 es de 0.1 mM en las 4 líneas, que sobreexpresan HER2. Por lo que se concluye, que la inhibición de c-Src y por consiguiente, c-Abl por medio de estos inhibidores de cinasa, no influye en la supervivencia celular a dosis menores de 0.1 μM (fig. 5).
Figura 5 Ensayo de viabilidad con SU6656 en líneas celulares MBCD-D25, MBCD-F, MBCD-D3 y MBCD-B3. En la gráfica se aprecia que el IC50 es de 0.1μM.
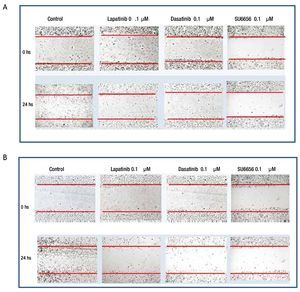
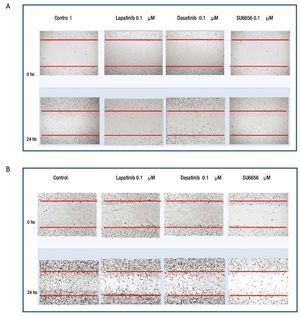
Ensayo de migración celular: herida de la monocapa
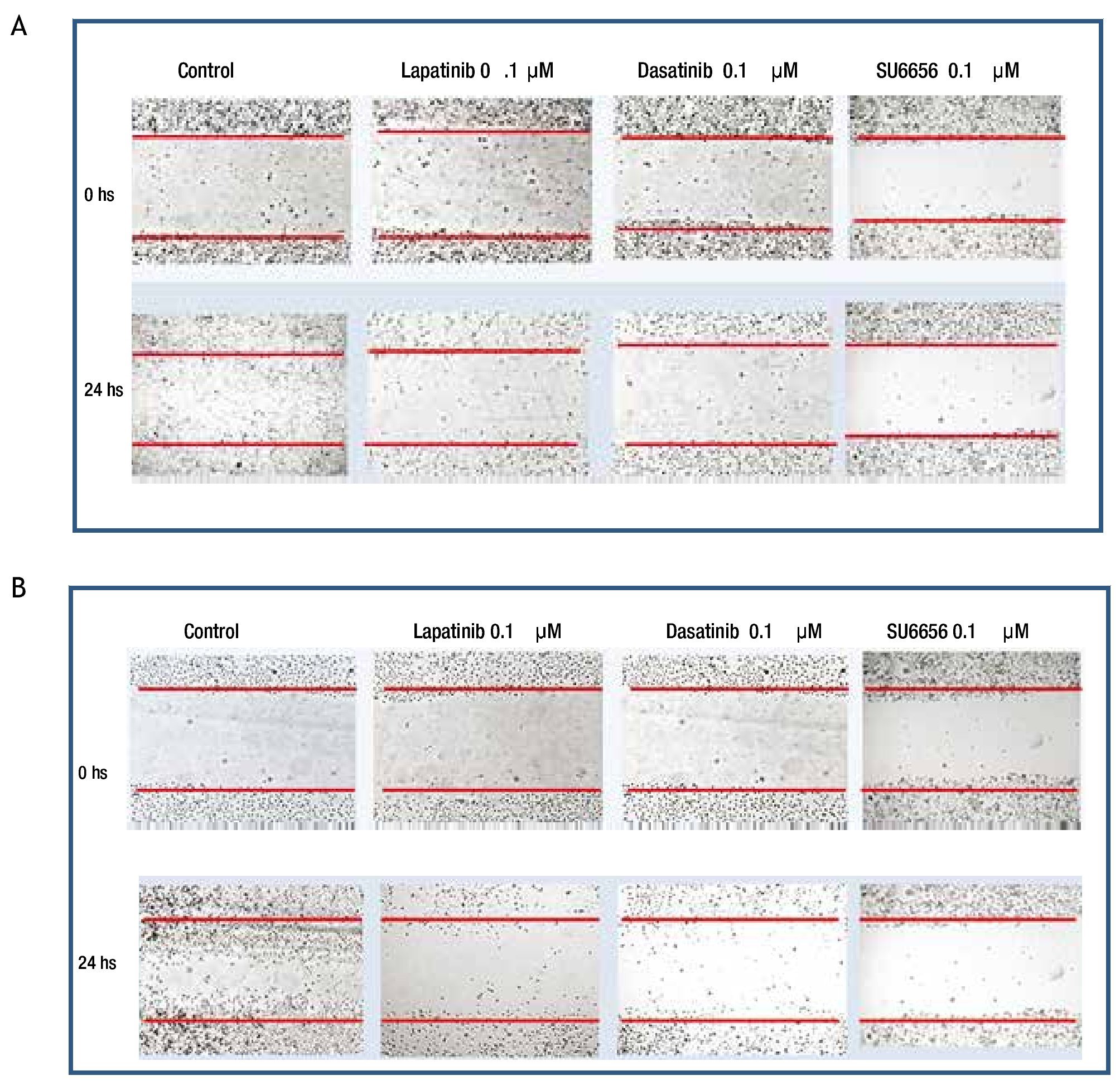
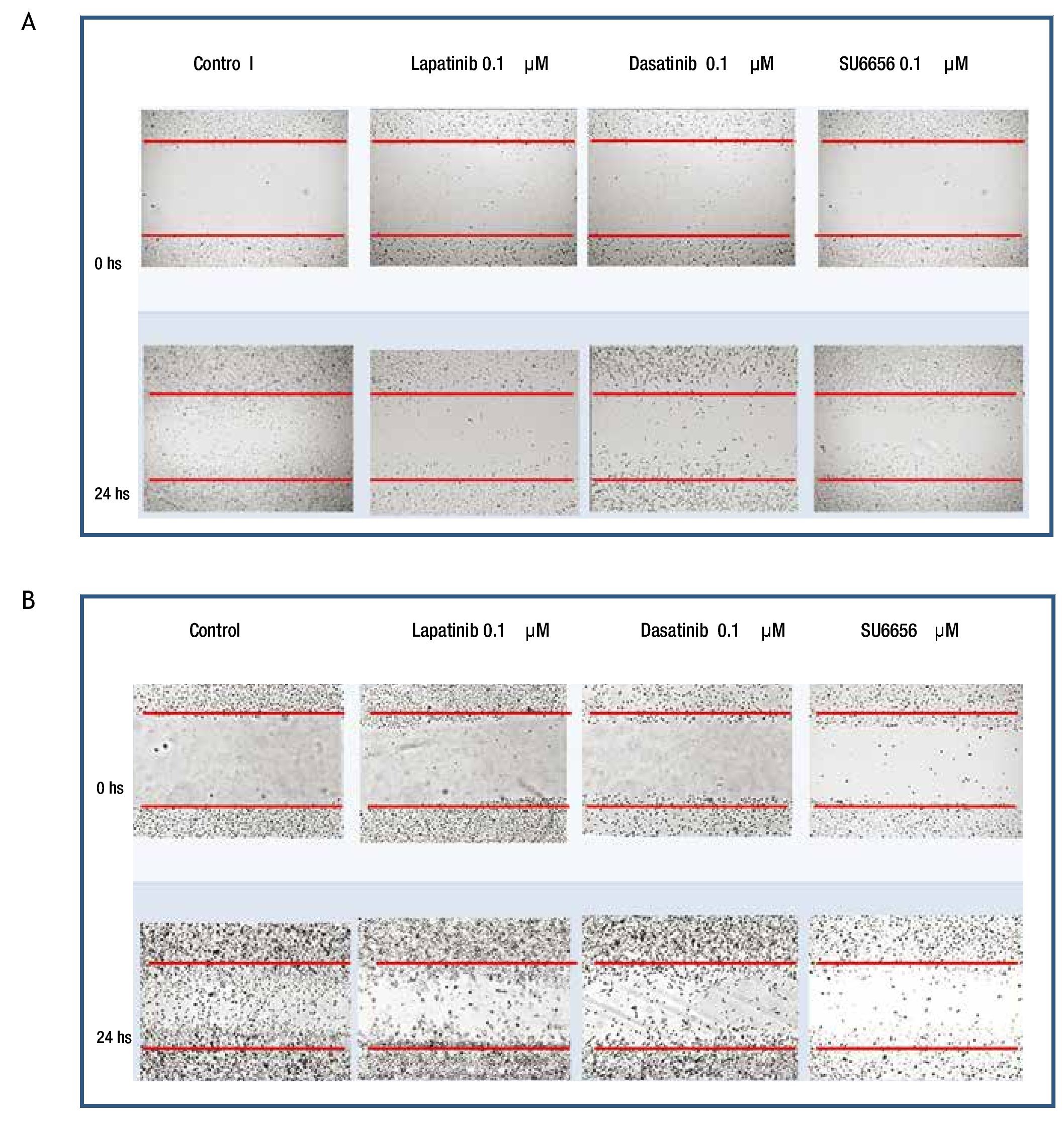
Para evaluar si la inhibición de la fosforilación de c-Src y c-Abl mediada a nivel de receptor por lapatinib, así como a nivel de c-Src por SU6656 y dasatinib influyen en la motilidad celular, se realizaron experimentos de migración por herida de monocapa celular en las 4 líneas de cultivos primarios. Se encontró en el caso de cultivos MBCD-D3 (HER2++/PDGFr-) y MBCD-B3 (HER2+++/PDGFr-), que a las 24 horas posteriores a realizar la herida en la monocapa, esta se cerró casi por completo y que la adición de 0.1 μM de lapatinib, 0.1 μM de dasatinib y 0.1 μM de Su6656, inhibió la migración casi por completo a las 24 horas (fig. 6). Este mismo fenómeno se observa en las líneas celulares MBCD-F (HER2++/PDGFr++) y MBCD-D25 (HER2+++/PDGFr++) bajo las mismas concentraciones, sin embargo la migración a las 24 horas se inhibe en forma parcial, ya que las células presentan una migración a la monocapa aproximadamente en un 30% en estas líneas. Es importante mencionar que no hubo cambios morfológicos en las células que indicaran mortalidad celular inducida por lapatinib, dasatinib o SU6656 (fig. 7).
Figura 6 A) la migración celular a la herida en la monocapa se ve inhibida casi por completo por lapatinib, dasatinib y Su6656 en la línea MBCD-B3. B) la migración celular a la herida en la monocapa se ve inhibida casi por completo por lapatinib, dasatinib y Su6656 en la línea MBCD-D3.
Figura 7 A) la migración celular a la herida en la monocapa se ve inhibida parcialmente por lapatinib, dasatinib y Su6656 en la línea MBCD-F. B) la migración celular a la herida en la monocapa se ve inhibida parcialmente por lapatinib, dasatinib y Su6656 en la línea MBCD-D25.
Discusión
El desarrollo exitoso de terapias blanco en el área oncológica se ha enfrentado a la carencia de marcadores predictivos de respuesta. En el caso de cáncer de mama, con excepción de los receptores hormonales y la sobreexpresión de HER2, no se han identificados marcadores pronósticos y predictivos de respuesta a terapia blanco14. La actividad de c-Src se ha encontrado aumentada en el cáncer de mama avanzado a diferencia del no invasor en líneas celulares, interviniendo principalmente en migración celular15. Aunque el mecanismo exacto por medio del cual el bloquear c-Src a través de inhibidores como Su6656, bloquea la migración celular en células neoplásicas de cáncer de mama no se encontraba estudiado por completo, nuestros datos documentan que se lleva a cabo a través de la señalización río abajo del receptor HER2. Esta aseveración viene de lo observado en nuestros resultados, en los cuales el bloqueo del receptor de HER2 por medio de lapatinib inhibe la forforilación tanto de EGFR del residuo Tyr-845, como de las cinasas c-Src, comprobado en su forma inhibida Tyr 527 y activadora Tyr 416, además de la cinasa c-Abl en su residuo Y245. Más aún, el hecho de que el inhibir c-Src por medio de Su6656 inhiba también la forforilación de c-Abl, sugiere que son parte de una misma vía de señalización, la cual se encuentra río abajo del HER2, posicionando a c-Src posterior al receptor y previo a la activación de c-Abl (fig. 4). Un punto importante a resaltar de nuestro trabajo es que la evaluación de la fosforilación de las cinanas fue realizado en tiempos cortos, en los momentos de mayor estímulo del receptor, ya que los hallazgos reportados previamente por el grupo de Plattner et al. se realizaron a las 24 horas, tiempo en donde la actividad de cinasa como se observó en los ensayos de estímulo puede estar abatido por el tiempo y no necesariamente como efecto del fármaco inhibidor.
Además, se documentó que dosis subletales de 0.1 mM de inhibidor de c-Src (Su6656 y dasatinib), inhiben la migración celular en las 4 líneas de cultivos primarios, esto modulando la señalización de ErbB2→c-Src→c-Abl. El inhibir la migración celular y por lo tanto, la progresión y diseminación del tumor ofrece un campo terapéutico exitoso en el tratamiento del cáncer de mama. Principalmente, porque las muertes asociadas al cáncer por enfermedad metastásica significan un mayor reto a afrontar el tratamiento del cáncer en etapas tempranas. Además, es bien sabido que la supervivencia de una paciente con enfermedad metastásica tiene relación directa al tiempo en que la enfermedad pueda ser controlada, evitando la progresión a más sitios de metástasis16,17.
Nuestro trabajo ofrece una vía de señalización río abajo del receptor transmembranal HER2, la cual no se conocía previamente, donde participan en la cascada las cinasas c-Src y c-Abl, teniendo como desenlace biológico un incremento en la migración celular en las 4 líneas de estudio, dando como resultado un tumor de biología más agresiva.
Estos ensayos enfatizan que, c-Src puede desde esta vía de señalización ser un poderoso determinante de la migración celular y el desarrollo de metástasis en el cáncer de mama. Nuestros resultados sugieren que terapias anti c-Src y anti c-Abl serán eficaces en retrasar la migración celular y por lo tanto, metástasis así como el crecimiento neoplásico. Aunque c-Src se encuentra implicado en el desarrollo del cáncer, la mayoría de la evidencia indica que c-Src pudiera no ser suficiente para la transformación oncogénica, sino que juega un papel importante en la progresión neoplásica. Por lo tanto, como blanco terapéutico puede considerarse como un agente de combinación donde puede tener una actividad sinérgica. En base a nuestros resultado y al documentar la presencia de c-Src en la señalización río abajo de HER2, esta combinación puede realizarse con agentes que bloquea la familia EGFR/HER como trastuzumab, lapatinib, gefitinib y erlotinib, entre otros. Además, al igual como lo muestran estudios recientes donde el uso de inhibidores de c-Src han mejorado la sensibilidad celular de tumores mamarios a tamoxifeno, la combinación de inhibidores del receptor de ErbB2 en conjunto con inhibidores de cinasa de c-Src pudieran mejorar los resultados, específicamente en el caso de tumores que desarrollen resistencia a bloqueadores de HER2 (herceptin, lapatinib)18,19. A un futuro consideramos debería de probarse in vitro, la sinergia del bloqueo de esta vía de señalización con distintas drogas citotóxicas. Sin embargo, es necesario de realizar más estudios in vitro y modelos murinos, para comprobar la efectividad de bloqueadores de cinasas en cáncer de mama, para poder extrapolarlo al uso clínico en pacientes.
Conclusiones
En conclusión, nuestro trabajo documenta por primera vez la partición de c-Src y c-Abl como una nueva vía de señalización celular río abajo del receptor HER2, en líneas celulares de cáncer de mama. La activación de c-Src posterior al receptor ErbB2 y previo a la activación de a-Abl, tienen como desenlace biológico modular la migración celular a través de esta nueva vía descrita (HER2→c-Src→c-Abl), la cual se da través de una vía ajena a las 2 vías bien conocidas de AKT y MAPKS. Esto abre una vía distinta de señalización celular asociada a HER2 en cáncer de mama avanzado, y por lo tanto, un potencial blanco terapéutico en el subtipo específico con sobreexpresión del receptor de HER2, con el objetivo de retrasar la progresión de la enfermedad y desarrollo de metástasis.
Financiamiento
Protocolo apoyado por el conacyt 102825
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Instituto nacional de ciencias Médicas y nutrición "Salvador Zubirán",
Vasco de Quiroga n° 15, Sección XVI, Delegación Tlalpan, C.P. 1400, México D.F., México.
Teléfono: 5573 5263. Celular: (044 55) 27557562.
Correo electrónico: saulcampos@gmail.com (S. Campos-Gómez).