Introducción: El meduloblastoma es un tumor neuroectodérmico primitivo derivado de meduloblastos indiferenciados, localizados en la capa granular externa del cerebelo. Dentro de los tumores de la fosa posterior, es el segundo tumor más común después del astrocitoma pilocítico, con un pico de incidencia a los 4 años. El tratamiento es multimodal, iniciando con cirugía y estratificando los casos en bajo y alto riesgo. La secuencia de la terapia adyuvante con quimioterapia y radioterapia es variable en cada institución. La tendencia actual con mejores resultados es la utilización de altas dosis de quimioterapia con rescate de médula ósea, así como la reducción de dosis de radioterapia.
Objetivo: reportar la experiencia de tratamiento adyuvante en meduloblastoma, y describir el impacto pronóstico de su secuencia de aplicación en nuestro medio.
Material y métodos: Entre enero de 2005 a diciembre de 2010 se recabaron 21 casos, 8 de bajo riesgo y 13 de alto riesgo. Todos los pacientes fueron tratados con teleterapia conformal en un acelerador lineal monoenergético de rayos X de 6MV, con sistema de planeación eclipse versión 7.3. Los medicamentos de quimioterapia utilizados fueron vincristina, cisplatino, ciclofosfamida, ifosfamida, carboplatino y etopósido. El tratamiento de quimioterapia y radioterapia se estratificó de acuerdo a los grupos de bajo y alto riesgo. Para la representación de sobrevida total se utilizó el método de Kaplan-Meier. El impacto de los factores pronósticos se obtuvo con la prueba de rangos logarítmicos.
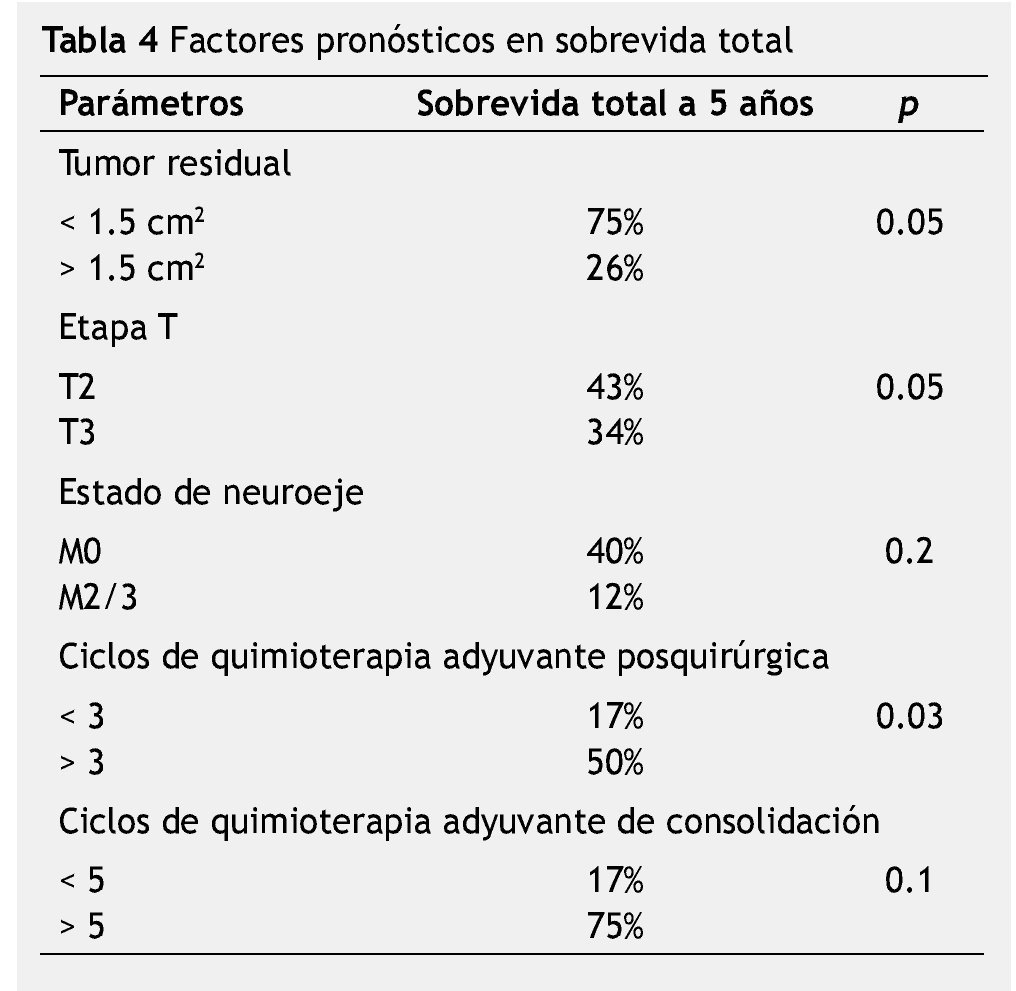
Resultados: Para los casos de bajo riesgo, el promedio de seguimiento fue de 38.8 meses, la sobrevida global a 3 y 5 años fue de 75%, se documentó un caso de progresión a nivel de c7 y hasta T3. En los casos de alto riesgo, el promedio de seguimiento fue de 32.1 meses, la sobrevida global a 3 y 5 años fue de 53% y 38%, respectivamente. Se documentó un caso de recurrencia local a fosa posterior, y 2 casos con persistencia de la enfermedad. Posterior al acto quirúrgico, los factores pronósticos asociados con mejor sobrevida fueron tumor residual menor a 1.5 cm2 (p=0.05), etapa T2 (p=0.05) y más de 3 ciclos de quimioterapia como primera modalidad adyuvante (p=0.03). Aunque la dosis de radioterapia a neuroeje de 23.4Gy, no se asoció con mayor riesgo de falla locorregional, no tuvo significancia estadística (p=0.06).
Conclusiones: Para los casos de meduloblastoma de bajo riesgo, la fase de tratamiento con radioterapia que incluye escalamiento de dosis a neuroeje, fosa posterior y lecho quirúrgico, es segura y eficaz, sin comprometer la sobrevida global ni el riesgo de falla local. Para los casos de alto riesgo aquellos que lograron recibir más de 3 ciclos de quimioterapia como primera modalidad adyuvante, tuvieron mejor sobrevida global.
Introduction: Medulloblastoma is a primitive neuroectodermal tumor derived from undifferentiated meduloblasts located in the layer granular external of the cerebellum. Within tumors of the posterior fossa, it is the second most common tumor after pilocytic astrocytoma with incidence peaking at age 4. The treatment is multimodal, starting with surgery and stratify patients into low and high risk. The sequence of adjuvant therapy with chemotherapy and radiation therapy is variable in each institution. The current trend with better results is the use of high dose chemotherapy with bone marrow rescue, as well as the reduction of doses of radiotherapy.
Objective: To report the experience of adjuvant therapy in medulloblastoma and describe the impact forecast of its sequence application.
Material and methods: From January 2005 to December of 2010 were gathered 21 cases, 8 low-risk and 13 high-risk. All patients were treated with conformal teletherapy in a monoenergetic linear accelerator x-ray 6MV with eclipse version 7.3 planning system. Used chemotherapy drugs were vincristine, cisplatin, cyclophosphamide, ifosfamide, carboplatin, and etoposide. The treatment of chemotherapy and radiotherapy are stratified according to the low and high risk groups. The method of Kaplan and Meier was used for representation of overall survival. The impact of the prognostic factors was obtained with the logarithmic range test.
Results: For the low-risk cases, follow-up averaged 38.8 months, overall survival at 3 and 5 years was 75%, one case of progression at the level of c7 and T3 was documented. In cases of high risk the follow-up averaged 32.1 months, overall survival at 3 and 5 years was 53% and 38%. Documented one case of posterior fossa local recurrence and 2 cases with persistence of the disease. After the surgery, the factors associated with better survival were less than 1.5 cm2 residual tumor (p=0.05), stage T2 (p=0.05) and more than 3 cycles of chemotherapy as first adjuvant modality (p=0.03). Although the dose of neuroaxis radiotherapy to 23.4Gy was not associated with increased risk of locoregional failure, did not have statistical significance (p=0.06).
Conclusions: in cases of low-risk medulloblastoma, the phase of radiotherapy treatment which includes escalation of dose to neuroaxis, posterior fossa and surgical bed, is safe and effective, without compromising overall survival and the risk of local failure. In the case of high risk those who managed to get more than 3 cycles of chemotherapy as first modality adjuvant had better overall survival.
Pagina nueva 1
Introducción
El meduloblastoma es un tumor neuroectodérmico primitivo derivado de meduloblastos indiferenciados localizados en la capa granular externa del cerebelo, o bien del centro germinal ubicado en el techo del cuarto ventrículo1-4.
Dentro de los tumores de la fosa posterior, es el segundo tumor más común después del astrocitoma pilocítico, tiene un pico de incidencia a los 4 años, representa el 16.8% en edad de 0 a 14 años y 6.7% de 15 a 19 años5-7.
Se asocia con diseminación a líquido cefalorraquídeo y siembras en espacio subaracnoideo en 14% a 43%, los principales sitios de falla local son la fosa posterior 31% y región supratentorial 24%.
La diseminación extraneural se reporta en un 4% a 14%, los sitios más afectados son: hueso (84%), médula ósea (27%), ganglios linfáticos (15%), pulmón (6%) e hígado (5%)8-10.
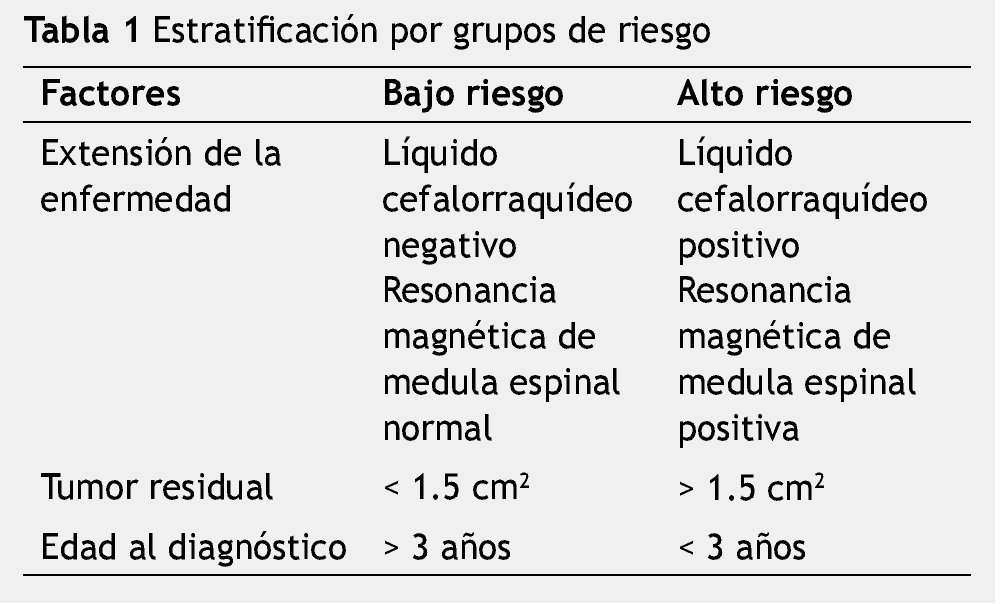
Para su clasificación se utiliza el sistema clínico quirúrgico de chang, y se catalogan de forma general como casos de bajo riesgo y alto riesgo11-14.
El tratamiento es multimodal, iniciando con cirugía bajo la intención de lograr la resección completa. La secuencia de la terapia adyuvante con quimioterapia y radioterapia varía para cada grupo de riesgo; la tendencia actual es la utilización de altas dosis de quimioterapia con rescate de médula ósea, así como la reducción de dosis de radioterapia.
La presente revisión es un estudio retrospectivo acerca de las modalidades de tratamiento utilizadas en nuestro medio, y su impacto pronóstico de su secuencia de aplicación.
Objetivos primarios
- Reportar la experiencia de tratamiento en meduloblastoma en el Servicio de radioterapia, del Hospital infantil de México "Federico Gómez".
- Describir la sobrevida total con las diferentes modalidades de tratamiento en meduloblastoma tratados en nuestro Hospital.
Objetivos secundarios
Reportar con estadística descriptiva los conceptos oncológicos generales en esta patología.
- Identificar los factores pronósticos relacionados con menor sobrevida total y aumento de riesgo de falla locorregional.
Material y métodos
Se trata de un estudio longitudinal, retrospectivo, observacional, con diseño factorial para evaluar los tipos de tratamiento neoadyuvante y adyuvante en pacientes con diagnóstico de meduloblastoma.
• Criterios de inclusión:
- Pacientes con diagnóstico y tratamiento completo dentro de la unidad hospitalaria.
- Estudios de diagnóstico y extensión completos.
- Seguimiento mínimo de 6 meses.
Criterios de exclusión:
- Pacientes con diagnóstico e inicio de tratamiento fuera de la unidad hospitalaria.
- Seguimiento inadecuado.
Entre enero de 2005 y diciembre de 2010, se recabaron 21 expedientes de pacientes con diagnóstico de meduloblastoma en el Servicio de radioterapia del Hospital infantil de México "Federico Gómez".
Procedimientos diagnósticos y estadificación
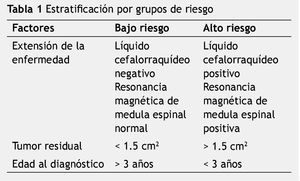
Los estudios iniciales de extensión incluyen historia clínica, exploración física, pruebas de laboratorio de rutina, gamagrama renal, filtración o depuración de creatinina de 24 horas, serie ósea metastásica, ultrasonido hepático, muestra de líquido cefalorraquídeo, biopsia de médula ósea, tomografía axial computada (TAC) de cráneo, resonancia magnética (RM) de cráneo y neuroeje, audiometría, ecocardiograma y pruebas de función tiroidea. El sistema de estadificación utilizado es de Chang et al., el cual incluye factores de edad, extensión local, tumor residual y metástasis; en base a los datos obtenidos los pacientes se estratifican en dos grupos: los de bajo riesgo y los de alto riesgo (tabla 1).
Tratamiento quirúrgico
Es recomendable la resección quirúrgica completa como tratamiento inicial, la colocación de sistema de drenaje de derivación ventricular se realizó de acuerdo al contexto clínico de cada paciente. La extensión de la cirugía se valoró con estudio de TAC a las 24 a 72 horas del postoperatorio.
Tratamiento con radioterapia
El equipo para tratamiento es un acelerador lineal monoenergético con modalidad de rayos X de 6MV, con sistema de planeación eclipse versión 7.3. El tratamiento con teleterapia se estratificó de acuerdo a los grupos de riesgo.
• Inmovilización, localización y simulación
Niños menores de 5 años, requieren anestesia. Posición en decúbito dorsal, en colchón al alto vacío, con máscara termoplástica y marcas radiopacas central y laterales.
Niños mayores de 5 años, no requieren anestesia. Posición en decúbito ventral, en colchón al alto vacío, con rampa prona, máscara termoplástica y marcas radiopacas central y laterales.
Se realiza estudio de TAC en 2 series. Primera serie: neuroeje, de tipo simple, con cortes de 5 mm. Segunda serie: cráneo, con medio de contraste intravenoso, con cortes de 3 mm. Se complementa con RM de cráneo en sus múltiples secuencias, con cortes de 3 mm.
Los estudios de TAC y RM de cráneo se fusionan para realizar la planeación de tratamiento.
• Volúmenes de tratamiento y órganos de riesgo
Cráneo: encéfalo, tercio posterior de globos oculares, retina, nervios ópticos y médula espinal cervical hasta nivel de segunda y tercera vértebra cervical.
Neuroeje: encéfalo, médula espinal y saco dural.
Fosa posterior: límite superior, tienda del cerebelo; límite anterior, apófisis clinoides, clivus; límite posterior, inion; límite inferior, en agujero occipital.
GTV: tumor residual, definido en RM ponderada en T1 con gadolinio.
CTV: lecho quirúrgico, definido en RM ponderada en T1 con gadolinio. GTV + 0.3-0.5 cm.
PTV: CTV más margen de 0.5-1 cm.
Órganos de riesgo: cristalinos, ojos, nervios ópticos, quiasma óptico, cócleas, lóbulos temporales, hipófisis, tallo cerebral, glándula tiroides.
• Dosis y fraccionamiento
Casos de bajo riesgo: 3 fases de teleterapia. la primera fase: neuroeje a dosis de 23.4 a 36Gy; segunda fase: incremento a fosa posterior de 12.6 a 19.8Gy; y tercera fase: incremento a lecho quirúrgico o tumor residual de 12.6 a 19.8Gy.
Casos de alto riesgo: 2 fases de teleterapia. Primera fase: neuroeje de 23.4 a 36Gy; segunda fase: incremento a fosa posterior a dosis de 18 a 25.9Gy; incremento a sitios metastásicos en neuroeje de 14 a 14.4Gy.
Tratamiento con quimioterapia
El tratamiento con quimioterapia también se adaptó de acuerdo al grupo de riesgo, este es recomendado dentro de los primeros 28 días posteriores del acto quirúrgico.
Las dosis de tratamiento con quimioterapia se mencionan a continuación:
Dosis de quimioterapia
Vincristina (Vcr): 1.5 mg/m2 (dosis máxima 2 mg), intravenoso directo. Días 0, 7, 14 de cada curso.
Cisplatino (cDDP): 75 mg/m2, infusión en 6 horas. Día 0.
Ciclofosfamida (CFA): 1,000 mg/m2, infusión en 60 minutos. Días 21 y 22 de cada curso.
Ifosfamida (IFO): 800 mg/m2, diario por 5 días.
Carboplatino (Cbp): 350 mg/m2, infusión para 60 minutos. Día 1 de cada ciclo.
Etopósido (Vp16): 100 mg/m2, infusión en 60 minutos. Diario por 5 días.
Vigilancia
El esquema de vigilancia se realiza con RM cerebral y de neuroeje, anual por 2 años, después sólo por razón clínica necesaria.
Primer año, mensual por 12 meses.
Segundo año, cada 3 meses.
Tercer año, cada 4 meses.
Cuarto año, cada 6 meses.
Quinto año, por una ocasión y alta.
Análisis estadístico
La sobrevida total se calculó desde la fecha del diagnóstico hasta la fecha de la última valoración o fallecimiento de paciente por cualquier causa.
Para la representación de sobrevida total se utilizó el método de Kaplan-Meier. Las curvas de sobrevida se compararon en grupos con análisis univariado, con la prueba de rangos logarítmicos para los diferentes factores pronósticos.
Resultados
Características generales y estadificación
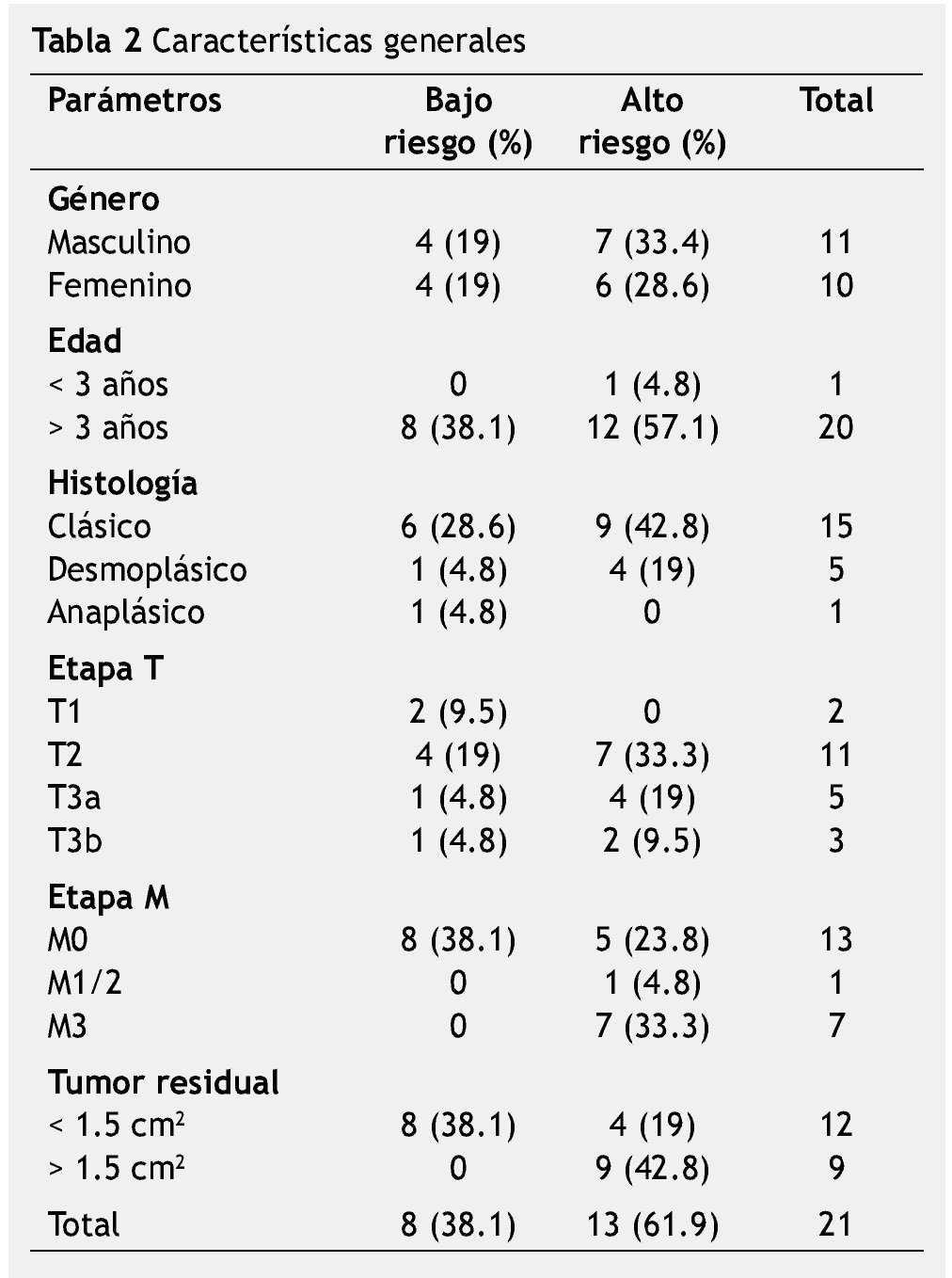
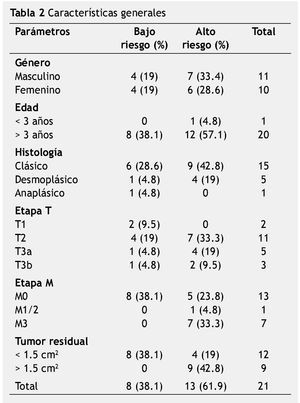
El total de población lo constituyen 21 pacientes, del género masculino 11 casos (52.4%) y del género femenino 10 casos (47.6%); la edad media al diagnóstico fue de 95 meses (7.9 años), con rango de 30 a 180 meses (2.5 a 15 años). Las características generales se mencionan en la tabla 2.
Cirugía
Todos los pacientes fueron llevados a cirugía, se documentaron 4 casos en hemisferios cerebelosos y 17 casos en línea media (vermis cerebeloso).
Tratamiento con radioterapia
Ya citado en apartado de dosis y fraccionamiento.
Tratamiento con quimioterapia
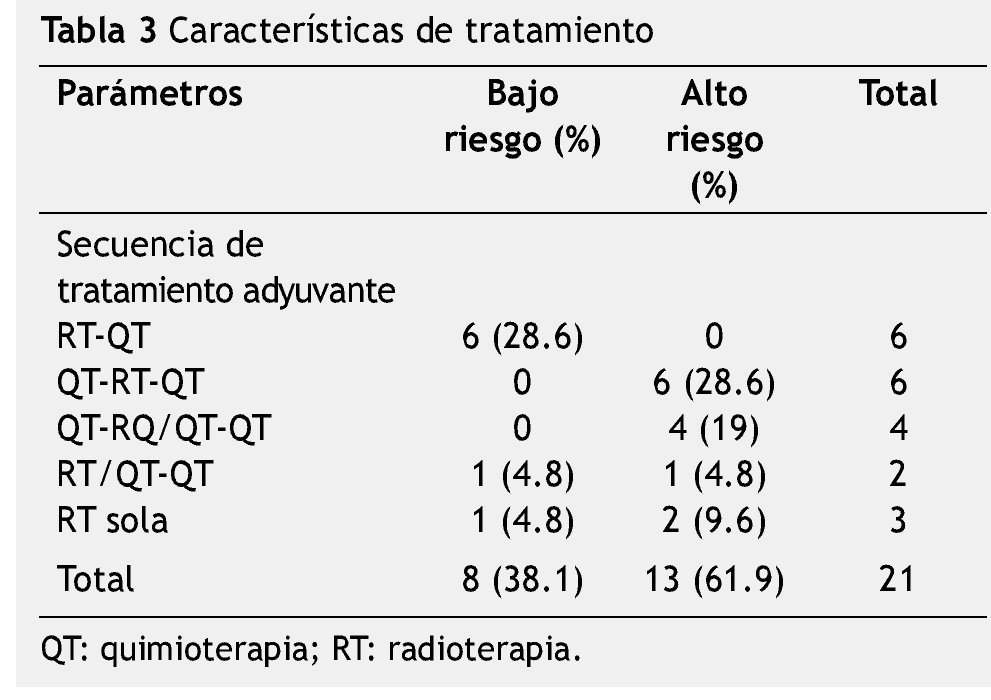
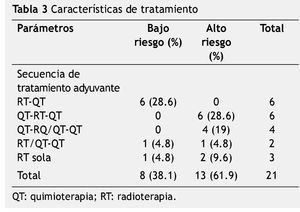
En los casos de bajo riesgo, sólo un paciente recibió quimioterapia y radioterapia concomitante a base de CFA, Cbp y Vp16. En 7 casos se otorgaron de 4 a 6 ciclos de quimioterapia de consolidación (6 casos con Cbp y Vp16, un caso con CFA, Cbp y Vp16), en un caso no se otorgó quimioterpia (múltiples infecciones).
Para el grupo de alto riesgo, sólo 10 casos recibieron quimioterapia como primera modalidad adyuvante (CFA, Cbp, Vp16=7; IFO, Cbp, Vp16=1; Cbp, Vp16=2) con 1 a 4 ciclos; en 4 casos se otorgó concomitancia (Cbp, Vp16) y 10 casos lograron concluir con quimioterapia de mantenimiento de 3 a 10 ciclos (CFA, Cbp, Vp16=6; Cbp, Vp16=3; IFO, Cbp, Vp16=1).
Las características de tratamiento se mencionan en la tabla 3.
Meduloblastoma de bajo riesgo
Para el grupo de bajo riesgo, se obtuvo un total de 8 casos, el promedio de seguimiento fue de 38.8 meses (rango de 12 a 76 meses).
Al momento actual se encontraron 6 pacientes vivos sin actividad tumoral, un paciente con pérdida de seguimiento sin actividad tumoral a los 12 meses.
Se documentó un caso de progresión a nivel de C7 y hasta T3 a los 16 meses de iniciado el protocolo de vigilancia, para un total de 12.5%. La sobrevida global a 3 y 5 años fue de 75%.
La dosis a neuroeje de 23.4Gy no se asoció con mayor riesgo de falla locorregional (p=0.06).
Meduloblastoma de alto riesgo
Para el grupo de alto riesgo, se obtuvo un total de 13 casos, el promedio de seguimiento fue de 32.1 meses (rango de 8 a 60 meses).
Al momento actual se encontraron 5 pacientes vivos sin actividad tumoral, 5 pacientes con pérdida de seguimiento sin actividad tumoral.
Se documentó un caso de recurrencia local a fosa posterior a los 6 meses de iniciado el protocolo de vigilancia, para un total de 7.6%. Finalmente, 2 casos con persistencia de la enfermedad (9.5%) con seguimiento de 8 y 18 meses, respectivamente. Los pacientes que recibieron más de 5 ciclos de quimioterapia de consolidación tuvieron menor riesgo de falla local (p=0.01). Y la sobrevida global a 3 y 5 años fue de 53% y 38%, respectivamente.
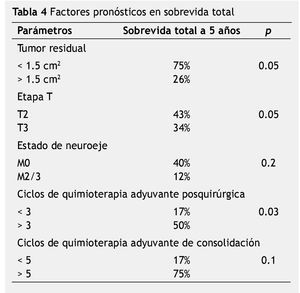
Los factores pronósticos más importantes en relación a sobrevida global se mencionan en la tabla 4.
Discusión
La presente revisión logra abarcar 21 casos con diagnóstico de meduloblastoma, la edad media al diagnóstico en nuestra población fue de 95 meses (7.9 años), el tipo histológico más común fue el de tipo clásico con 15 casos (71.4%), no hay predomino de género.
No fue posible definir cuál es la mejor secuencia de tratamiento para los casos de meduloblastoma de bajo riesgo, ya que en nuestro hospital la tendencia es cirugía seguido de radioterapia y quimioterapia, documentando sobrevida total a 6.3 años de 75%, resultados similares a los reportados en la literatura médica mundial15-21.
Sin embargo, los mejores resultados se logran con dosis altas de quimioterapia, rescate de médula ósea y dosis bajas de teleterapia. En un estudio mixto de Gajjar et al. para los casos de riesgo estándar, se otorga radioterapia a neuroeje 23.4Gy, fosa posterior 36Gy, incremento a lecho quirúrgico o tumor primario 55.8Gy. Posterior a 6 semanas se otorga 4 ciclos de altas dosis de quimioterapia (cisplatino, ciclofosfamida, vincristina), seguido de rescate de médula ósea, la sobrevida total a 5 años de 85%22.
De igual forma, Merchant T et al. demostró que las dosis de radioterapia a neuroeje 23.4Gy, FP 36Gy y sitio primario 55.8Gy con inicio de quimioterapia 6 semanas posterior a teleterapia, con 4 ciclos de altas dosis de ciclofosfamida, cisplatino y vincristina, cada ciclo seguido de rescate de células progenitoras, logra sobrevida libre de enfermedad a 5 años de 83% e incidencia de falla a fosa posterior 4.9%23.
Para los casos de meduloblastoma de alto riesgo la secuencia de tratamiento en nuestro hospital es cirugía seguido de quimioterapia, radioterapia y quimioterapia adyuvante, los porcentajes de sobrevida total a 3 y 5 años son de 53 y 38%, resultados equiparables a varios estudios multicéntricos24-34.
También para este grupo los mejores resultados se logran con dosis altas de quimioterapia, rescate de médula ósea y teleterapia adaptada a factores pronósticos.
En el estudio mixto de Gajjar et al. ya citado, los casos de alto riesgo reciben dosis radioterapia a neuroeje con M1 de 36Gy, para M2-3 de 39.6Gy, incremento a lecho quirúrgico 55.8Gy. Posterior a 6 semanas, se otorgan 4 ciclos de altas dosis de quimioterapia (cisplatino, ciclofosfamida, vincristina), seguido de rescate de médula ósea, con sobrevida total a 5 años de 70%.
El análisis de los factores pronósticos para el grupo de alto riesgo demostró que, aquellos con mejor sobrevida son los casos con tumor residual menor 1.5 cm2 (p=0.05) y etapa T2 (p=0.05), datos similares a los ya reportados en la literatura médica35-50.
Es importante mencionar que posterior al acto quirúrgico, aquellos pacientes que lograron recibir más de 3 ciclos de quimioterapia como primera modalidad adyuvante tuvieron mejor sobrevida (p=0.03).
El último parámetro analizado fue el número de ciclos de quimioterapia de consolidación, los pacientes que lograron recibir más de 5 ciclos tuvieron menor riesgo de falla local (p=0.01), aunque sin lograr impacto en la sobrevida total.
Conclusiones
Para los casos de meduloblastoma de bajo riesgo, la fase de tratamiento con radioterapia que incluye escalamiento de dosis a neuroeje, fosa posterior y lecho quirúrgico, es segura y eficaz, sin comprometer la sobrevida global ni el riesgo de falla local, sin embargo es necesario mayor número de pacientes y seguimiento a largo plazo. A pesar que los casos de alto riesgo tienen un pronóstico desfavorable, en nuestro estudio, aquellos que lograron recibir más de 3 ciclos de quimioterapia como primera modalidad adyuvante tuvieron mejor sobrevida global, el uso de teleterapia conformal con dosis adaptada a factores pronósticos permite buen control locorregional, así como optimizar las condiciones clínicas del paciente para su continuidad de tratamiento. En un futuro será necesario implementar dosis altas de quimioterapia, con rescate de médula ósea para mejorar los resultados terapéuticos.
Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Agradecimientos
A Dios, por brindarme el don de vivir, conocer, elegir y aprender.
A mis padres y a mis hermanos, por su apoyo incondicional, por brindarme la fortaleza cotidiana para cumplir mis sueños...les agradezco infinitamente.
A mi profesor titular el Dr. Heynar de Jesús Pérez Villanueva por la oportunidad de realizar el curso, por su tolerancia y paciencia, por su calidez humanitaria y su amplia cultura que comparte cada día.
A la Dra. Laura Asúnsolo por compartir sus conocimientos y su experiencia.
A mi compañera de alta especialidad, Dra. Marlene Serrano por su actitud inquisitiva en el proyecto académico.
A los Físicos Noé y Gonzalo, por la mejor disposición de enseñar y compartir.
Al maravilloso equipo de trabajo, Lili, Eugenia, Benjamín, Edgar... por enseñarme que el trabajo en equipo es el éxito.
Al Hospital infantil de México por ser el hogar de mi formación profesional, a los niños, porque a pesar de su dolor siempre comparten su respuesta con una sonrisa.
* Autor para correspondencia:
San luis Potosí n° 75, Interior 104,
Delegación cuauhtémoc, C.P. 06700, México D.F., México.
Teléfono: (55) 6303 7564. Celular: (55) 2502 5439.
Correo electrónico:neurojoma@hotmail.com (J. M. García-Ramírez).