¿ INTRODUCCIÓN
Las antraciclinas y taxanos son los agentes citotóxicos más activos para el tratamiento del cáncer de mama metastásico.1 Los taxanos inducen citotoxicidad promoviendo la unión de la tubulina en los microtúbulos e inhiben su despolimerización.2 Las antraciclinas actúan a nivel del DNA, inhibiendo a la topoisomerasa II.3 La epirrubicina es un agente del grupo de las antraciclinas que ha demostrado una eficacia similar a la doxorrubicina en cáncer de mama metastásico (CMM) con respuestas globales de 25% a 62%.4 Sin embargo su perfil de toxicidad es mejor en lo que respecta a cardiotoxicidad.5,6 Docetaxel ha alcanzado respuestas globales como monoterapia de 54% a 68%, en pacientes con CMM previamente tratadas.7-9 La eficacia que proporciona la combinación de antraciclinas más taxanos como parte del tratamiento del Cáncer de Mama es razonable debido a que no existe una resistencia cruzada al combinarlos por los mecanismos de acción diferentes.
Como tratamiento combinado en CMM, el uso de epirrubicina más docetaxel ha generado respuestas globales de 66%.10,11 Como tratamiento neoadyuvante, existe evidencia científica al utilizar esquemas que incluyan antraciclinas y taxanos administrados de manera secuencial o concomitante mejorando las respuestas globales (respuestas clínicas completas, parciales y patológicas completas) en comparación con esquemas basados sólo en antraciclinas.12-17 En el grupo de pacientes que alcanzaron una respuesta patológica completa (rPC) existe un beneficio estadísticamente significativo en superviviencia global (SG) al compararse con el grupo con carcinoma residual. En base a los antecedentes se diseñó este estudio con el objetivo primario de conocer el porcentaje de respuestas patológicas completas en la población mexicana.
¿MÉTODOS
Este estudio prospectivo, abierto no comparativo, se realizó con la participación del Instituto Mexicano del Seguro Social (IMSS) y del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE) con base en las buenas prácticas clínicas y aprobación del protocolo por el comité de ética en cada Institución participante. Todas las pacientes proporcionaron su consentimiento informado por escrito.
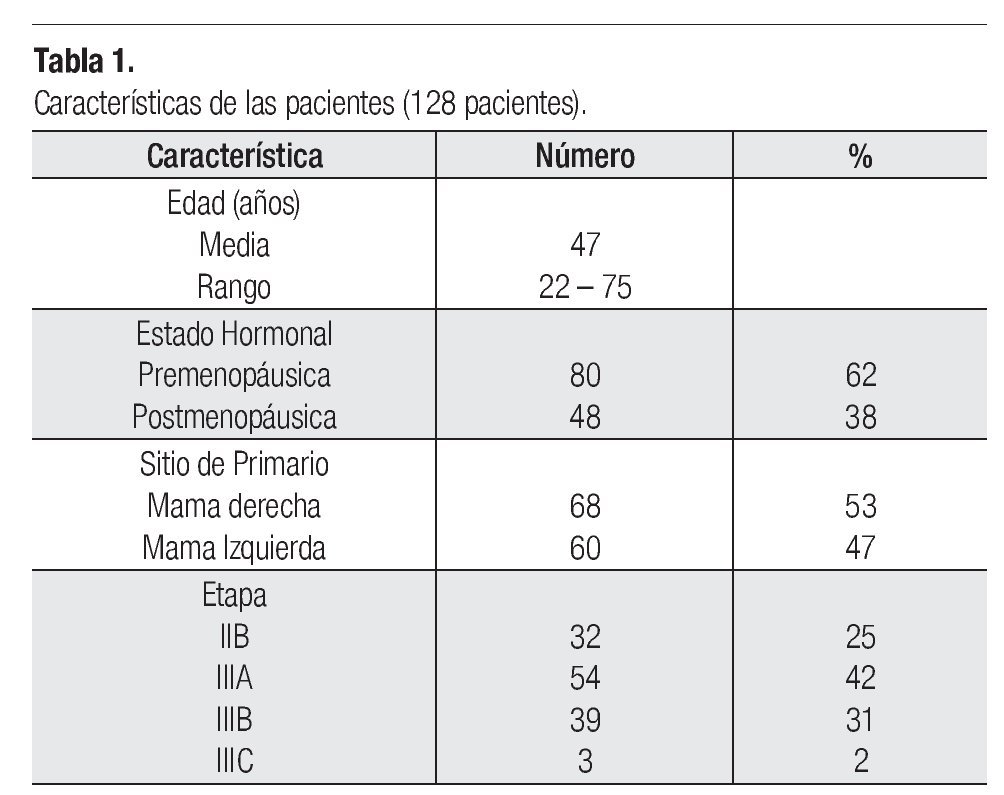
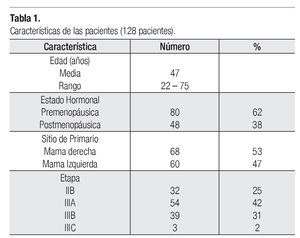
Pacientes: Las elegibles para este estudio debían reunir los siguientes criterios: Ser mujeres con cáncer de mama operable (Etapas clínicas IIB, IIIA, IIIB y IIIC), sin el antecedente previo de quimioterapia, proporcionar su consentimiento por escrito, confirmación histológica, de 18 a 70 años (las pacientes mayores de 70 años podían incluirse a consideración del investigador), estado funcional escala Karnofsky mayor o igual a 80%, función cardiaca normal confirmado por FEVI (MUGA scan), electrocardiograma o ecocardiograma, biometría hemática con neutrófilos ≥ 2000/mm3, plaquetas ≥ 100 000/mm3 y hemoglobina ≥ 10 g/dL, función renal: creatinina sérica ≤ 1.5 mg/dL, función hepática: bilirrubina total igual o menor a los límites normales superiores (LNS), AST (TGO) y ALT (TGP) ≤ 2.5 veces a LNS, fosfatasa alcalina igual o menor de cinco veces LNS. Las pacientes con ASAT y/o ALAT mayor a 1.5 veces a LNS asociados con fosfatasa alcalina mayor a 2.5 veces de LNS, no se consideraron aptas para el estudio y con una prueba negativa de embarazo (en orina o sangre) obtenida dentro de los siete días anteriores al registro para todas las mujeres con potencial reproductivo.
Dentro de las determinaciones de laboratorio, se realizaron exámenes de hematología (cuenta de leucocitos totales, cuenta de neutrófilos, plaquetas y hemoglobina), química sanguínea (bilirrubina total, fosfatasa alcalina, TGO, TGP y creatinina) antes y a lo largo de la terapia. Se registraron todos los eventos adversos. Cada paciente se evaluó regularmente para detectar eventos adversos potencialmente serios de acuerdo a los criterios del NCI-CTC (2ª versión, abril 1999) de toxicidad. La toxicidad que no pudo ser evaluada según los criterios de toxicidad comunes del NCI se evaluó de la siguiente manera:
Leve (asintomática)
Moderada (sintomática pero que no interfiere significativamente con la función)
Severa (que interfiera seriamente con la función)
Pone en riesgo y se va amenaza la vida del paciente.
Tratamiento: El esquema de tratamiento consistía en aplicar cuatro ciclos de quimioterapia preoperatoria con epirrubicina 75 mg/m2 diluidos en 100 mL de solución salina, en infusión intravenosa de 15 minutos, día uno, seguido de docetaxel 75 mg/m2 diluidos en 2500 mL de solución salina, en infusión intravenosa en una hora día uno. Los ciclos se aplicaban con intervalos de tres semanas (21 días). Dentro de la premedicación profiláctica estaba indicado (antes de la infusión de docetaxel) dexametasona 8 mg por vía oral cada 12 horas un día antes y el día de la infusión, además de: ranitidina 300 mg vía oral y algún antiemético de acuerdo a las guías de tratamiento de ambas instituciones. Se permitía el uso de factores estimulantes de colonias granulocíticas profiláctico a criterio del investigador, utilizando la dosis de 150 mcg/día del segundo al sexto día de haber administrado el tratamiento. Cuando se presentaba edema de grado moderado a severo se prescribía furosemida 20 mg/día, hasta la mejoría.
Dentro de las indicaciones sólo se modificaba el esquema de tratamiento cuando los niveles de neutrófilos eran menores a 1500 y/o plaquetas menores a 100 000, difiriendo la aplicación del tratamiento por siete días, con un máximo de 14 días.
Cuando se presentaron reacciones de hipersensibilidad, a pesar de la premedicación descrita, se agregaba algún antihistamínico de acuerdo a las guías de tratamiento de ambas instituciones. Todos los casos con una reducción de la FEVI por debajo de límites normales (50%) o con una reducción mayor de 15% respecto al valor previo, tenían la indicación de suspender el tratamiento con epirrubicina.
El tratamiento quirúrgico (mastectomía radical modificada o cuadrantectomía con disección radical de axila) se realizaba en un periodo no mayor a seis semanas después de haber recibido el último ciclo de quimioterapia preoperatoria.
Quimioterapia de consolidación: consistía en administrar cuatro ciclos más del mismo esquema preoperatorio posterior al tratamiento quirúrgico.
Radioterapia: se indicaba el ciclo mamario completo en pacientes con cirugía conservadora inmediatamente después de la cirugía y en pacientes con tratamiento radical posterior a haber concluido los 4 ciclos de quimioterapia de consolidación.
Hormonoterapia: posterior a la determinación de receptores hormonales se dejaba a criterio del investigador de acuerdo a los recursos y guías de cada institución.
Análisis estadístico: El objetivo primario fue evaluar la tasa de respuestas patológicas completas posterior al tratamiento neoadyuvante. El abordaje estadístico general incluía en todas las pruebas estadísticas rechazar la hipótesis nula si el nivel de significancia descriptivo de la prueba fue menor a 0.05. Se consideraron pruebas de dos colas. En el caso de variables continuas se obtuvieron la media, desviación estándar, mediana, mínimo y máximo. En el caso de variables categóricas, se obtuvieron frecuencias y porcentajes. La variable primaria se consideró como la tasa de respuesta patológica completa obtenida después de cirugía. La incidencia de eventos adversos y el grado de toxicidad y pruebas de laboratorio fueron resumidas en frecuencias y porcentajes en el caso de variables discretas y medias y desviación estándar para variables continuas.
¿ RESULTADOS
Entre junio de 2004 a enero de 2007, 129 pacientes fueron incluidas en el estudio y 128 (99.22%) asignadas a recibir tratamiento. Las características de la población se describen en la Tabla 1.
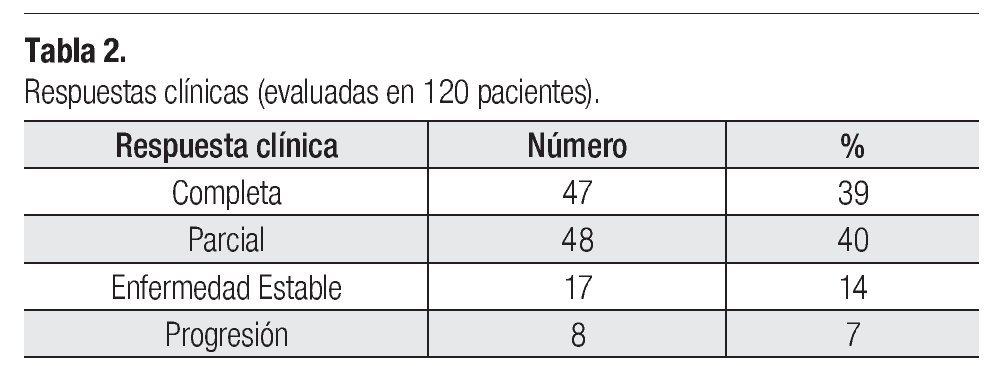
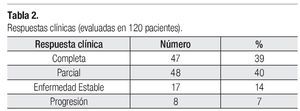
Eficacia: Las respuestas patológicas completas que se presentaron en la población posterior a haber completado los cuatro ciclos de tratamiento preoperatorio fueron de 32.5% (38 pacientes). Las respuestas clínicas observadas fueron: respuestas globales de 79% (respuesta parcial de 40% y respuestas completas de 39%). De las pacientes, 14% presentó enfermedad estable y 7% progresión (Tabla 2).
La mayoría de las pacientes (106/88.3%), se sometieron al tratamiento quirúrgico posterior a los cuatro ciclos de tratamiento, realizando mastectomía radical modificada más disección radical de axila en (103/86%). Sólo en cinco pacientes, los márgenes fueron positivos de las 106 operadas. Cincuenta y nueve pacientes recibieron tratamiento complementario a base de radioterapia y la mayoría fue posterior a haber finalizado la quimioterapia adyuvante (51 pacientes).
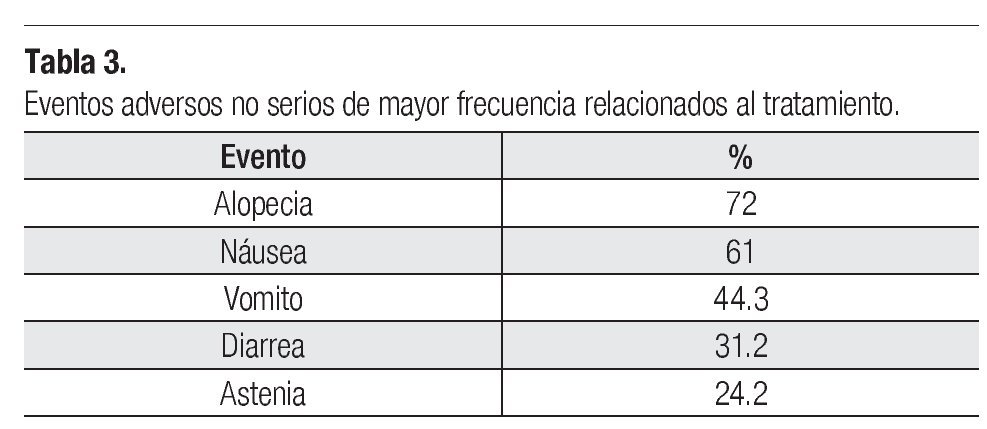
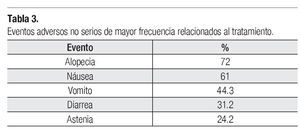
Toxicidad: De las 128 pacientes evaluables para eventos adversos, 103 (80.47%) presentó algún evento adverso de cualquier grado, ocho pacientes (6.25%) con un evento adverso serio. Los eventos adversos serios fueron por toxicidad hematológica y gastrointestinal. Los eventos adversos no serios se muestran en la Tabla 3.
¿ DISCUSIÓN
La combinación de epirrubicina más docetaxel como tratamiento neoadyuvante en el estudio, generó respuestas patológicas completas de 32.5% posterior a cuatro ciclos de tratamiento, respuestas altas si consideramos que 73% de las pacientes tenían estadios III a y III b. En los estudios con tratamientos neoadyuvantes, que utilizan la combinación de docetaxel más antraciclinas, las respuestas patológicas reportadas están en rangos de 18% a 22%.14,18 El NSABP-B27 es el estudio con mayor población que analiza la utilidad de dar un tratamiento neoadyuvante con un esquema de antraciclinas seguido de docetaxel. Las respuestas patológicas que se informaron son de 9.6% vs. 18.9%,13 duplicando la probabilidad de una respuesta patológica completa al agregar docetaxel. En este grupo de pacientes esta respuesta se consideró un factor predictor para sobrevida global (IR_ 0.33; IC95%, 0.23 a 0.47; p<0.0001).
En cuanto al número de ciclos a utilizar, es un punto de controversia. En la mayoría de los estudios, se utilizan de tres a cuatro ciclos con la combinación de antraciclinas y taxanos; y de manera secuencial seis a ocho ciclos. En el estudio de ABCSG-14 se comparó tres ciclos de epirrubicina más docetaxel neoadyuvante vs. seis ciclos de tratamiento, las rPC que se reportaron son de 18.6% vs. 7.7%: p < 0.0045, además de un alto porcentaje de ganglios axilares negativos (56.6% vs. 42.8%: p< 0.02) a favor de seis ciclos, concluyendo que con éste número, se mejora la probabilidad de presentar una rPC.19 Sin embargo, estos estudios han utilizado factores estimulantes de colonias granulocíticas de manera profiláctica por el riesgo de neutropenia, aumentando los costos y al compararse con esquemas secuenciales las rPC son similares.
La sobreexpresión del Receptor del Factor de Crecimiento Epidérmico 2 (Her2Neu) se presenta en 20% a 30% de los casos de cáncer de mama.20-22 La sobre expresión del Her2Neu se ha asociado con una supervivencia libre de progresión y global menor.23-27 Desde el estudio de Slamon28 en CMM, en donde la población que sobre expresaba el Her2Neu recibió trastuzumab más quimioterapia vs. quimioterapia solamente, observándose un beneficio en respuestas, SLP y SG a favor de trastuzumab.
Era inminente la utilización de trastuzumab en el ámbito neoadyuvante en combinación con quimioterapia para evaluar las respuestas con esta nueva modalidad de tratamiento. El estudio de Buzdar29 fue uno de los primeros en resolver esta interrogante al utilizar un esquema de quimioterapia neoadyuvante con cuatro ciclos de paclitaxel seguido de cuatro ciclos de FEC con trastuzumab semanal por 24 aplicaciones, obteniendo rPC de 41% vs. 21% a favor de trastuzumab. Cuando se inició este protocolo, la determinación de Her2Neu no se realizaba de manera rutinaria en las instituciones públicas por lo que no fue un criterio de inclusión. Solo se determinaron receptores hormonales en 30% de las pacientes.
Actualmente, el tratamiento del cáncer de mama en los últimos 10 años se ha personalizado con la determinación de receptores hormonales, Her2Neu y firmas genéticas. El futuro de la terapéutica radica en encontrar marcadores no sólo pronósticos, sino predictivos que permitan identificar qué grupo de pacientes obtendrá un mayor beneficio.
¿ CONCLUSIÓN
La combinación de epirrubicina más docetaxel como tratamiento neoadyuvante es activa y genera respuestas patológicas completas comparables con otros estudios. Se requiere de un mayor seguimiento para determinar el impacto en la SLE y SG.
ESTE ESTUDIO RECIBIÓ FONDOS DE SANOFI-AVENTIS
¿ AGRADECIMIENTOS
Deseamos agradecer a los Investigadores que contribuyeron para el desarrollo de este estudio (Neoadyuvancia):
Aguilar C, Ávila E, Cervantes G, Delgadillo F, Erazo A, Jiménez C, Juárez A, López J, Martínez R, Oliveros L, Ortiz L, Palacios G, Palomo A, Ramirez M, Rodríguez G, Sauza F, Serna M, Silva A, Torres C.
Correspondencia: Dr. Alejandro Silva.
Av. Cuauhtémoc N° 330 Col. Doctores, Del. Cuauhtémoc, 06720, México, D.F.
Tel. 55-31- 65-38.
Correo electrónico: drsilva@mexis.com; carlosalejandro.diaz@sanofi-aventis.com