¿INTRODUCCIÓN
El cáncer cérvico-uterino es la patología gineco-oncológica más frecuente en nuestro medio y representa la primera causa de mortalidad en mujeres. Continúa como un problema importante de salud pública. El factor etiológico identificado hasta en 90% de los casos, es la infección del virus del papiloma humano (VPH). La lesión inicial precursora corresponde a carcinoma in situ o neoplasia intra-epitelial cervical, que también se asocia al mismo agente etiológico.
El carcinoma epidermoide representa 80% a 85% de los casos, seguido del adenocarcinoma (15% a 20%), que es más agresivo. Otros con pronóstico desfavorable son el neuroectodérmico, de células claras, anaplásico, entre otros. El diagnóstico es clínico para estadificar y la biopsia para corroborar la estirpe histológica. En etapas clínicas más avanzadas, se requieren estudios de imagen y de endoscopia para determinar la extensión de la enfermedad y descartar afección a distancia (tomografía abdomino-pélvica contrastada, rectosigmoidoscopia, cistoscopia, radiografía de tórax). La diseminación del cáncer cérvico-uterino de primera instancia es por extensión directa y afección ganglionar, la diseminación hematógena se presenta en estadios más avanzados. El drenaje linfático es siempre ascendente, desde los ganglios paracervicales, siguiendo a los obturadores, hipogástricos, presacros, ganglios de la iliaca común y los para-aórticos. La estadificación de la enfermedad se basa en la clasificación clínica de la Federación Internacional de Ginecología y Obstetricia de 2002 (FIGO).1-3
El tratamiento del carcinoma cérvico-uterino depende de la etapa clínica, lesiones iniciales tratadas quirúrgicamente con finalidad curativa es la mejor opción.
Etapa Clínica (EC) IA1, la Histerectomía extrafascial es suficiente con rangos de curación del 95%, en invasión estromal de menos de 3 mm sin invasión linfovascular, no se indica adyuvancia, pero IA2 con invasión estromal mayor a 3 mm e invasión linfovascular( ILV), debe administrarse radioterapia.1,3,4
Los factores pronósticos adversos después de histerectomía radical y linfadenectomía incluyen: estado ganglionar, tamaño tumoral, profundidad de invasión e invasión linfovascular.
La Sociedad Americana de Braquiterapia, recomienda radioterapia adyuvante en pacientes que tienen por lo menos dos de los siguientes factores de riesgo: (a) más de 1/3 de invasión estromal, (b) invasión linfo-vascular, (c) diámetro tumoral mayor de 4 cm, y quimio-radioterapia posoperatoria en pacientes que tienen por lo menos uno de los siguientes factores: ganglios linfáticos positivos, márgenes cercanos o quirúrgicos positivos, enfermedad microscópica parametrial; hay mejoría en el intervalo libre de enfermedad y sobrevida total. El reporte histopatológico de adenocarcinoma también requiere de adyuvancia. Aún con ganglios linfáticos negativos el resto de los factores son importantes para la recaída.5
EC 1B2- IVA: Ha sido manejado por muchos años con Radioterapia (RT) como tratamiento estándar,1,4,6 recientemente se ha determinado que el tratamiento combinado de RT y Quimioterapia (QT) ofrece mejores beneficios ya que incrementa la tasa de control local del volumen irradiado.1-7
En 1905 se dio inicio al manejo del carcinoma cérvico-uterino con Radio; se le llamó Curiterapia, y marcó el inicio de la braquiterapia propiamente dicha.
La braquiterapia (BQT) es una modalidad de RT, que consiste en colocar material radioactivo directamente en el sitio del tumor y administrar la dosis necesaria en el mismo, con dosis tolerables a órganos adyacentes.
La radioterapia externa (RTE) o teleterapia, consiste en dar tratamiento desde un equipo que contiene una fuente radioactiva, el haz de radiación se dirige al volumen blanco de tratamiento en el cuerpo. La teleterapia era administrada con radio y no fue sino hasta los años cincuentas que se sustituyó por Cobalto60 y Cesio137 con emisión de rayos gamma. Posteriormente se crearon equipos de Aceleración Lineal, que producen energía de electrones y rayos X artificiales de alta energía (megavoltaje) que mejora la dosis en profundidad; este tratamiento se ha utilizado por lo menos en los últimos 50 años para cáncer cérvico uterino.2,3 En cáncer cérvico-uterino el manejo incluye RTE y BQT. BQT con Cesio137 se ha utilizado por muchos años, pero actualmente se ha sustituido casi completamente por Iridio192.1,7,8
La RTE se dirige al volumen tumoral y a los sitios potenciales de infiltración tumoral, incluyendo la pelvis total. En el tratamiento convencional, con objeto de determinar los campos de radiación, se necesita la toma de estudios radiográficos para identificar anatómicamente el sitio a irradiar (simulación). Generalmente se utilizan cuatro campos de tratamiento: AP (antero-posterior), PA (póstero-anterior), dos campos laterales (derecho e izquierdo); también se conoce como técnica de caja por la similitud con ésta.2,3
El rango de dosis con RTE es de 45 a 50 Gy (Gray son las unidades actualmente utilizadas de radiación), con una dosis por día de 1.8 a 2 Gy para un total de cinco semanas de tratamiento. La energía debe ser mayor a 10 MV (Mega-Volts), idealmente de 15 a 8 MV. En caso de Rayos X de 4 a 6 MV o Cobalto60 se indica de preferencia técnica de caja.3,5,7,9 Algunas pacientes con persistencia de enfermedad parametrial, reciben incremento a este sitio con 10 Gy con campos localizados y con protección central en caso de incremento bilateral.
En el proceso de BQT, se coloca la fuente radiactiva en una proximidad o en contacto con el tejido tumoral. En la modalidad intersticial, se implanta la fuente encapsulada implantada directamente en el sitio del tumor, se utiliza cuando la intracavitaria no puede aplicarse. La BQT intracavitaria se realiza mediante la colocación de una fuente radioactiva encapsulada dentro de un aplicador ubicado en una cavidad con una proximidad cercana al tumor. Dos grandes modalidades de BQT se han utilizado: alta o baja tasa de dosis (tasa de dosis se refiere al tiempo de exposición para una dosis determinada.4,9
En baja tasa se libera una dosis continua desde la fuente en un tiempo más prolongado (promedio 40 a 50 cGy/hora) en tejidos paracentrales. La regla en BQT es que a menor distancia de la fuente radioactiva mayor dosis en tejidos centrales y a mayor distancia, menor dosis. Cesio137 reemplazó al Radio en BQT de baja tasa. Los aplicadores más utilizados para colocar las fuentes radioactivas son los Fletcher (sonda o tandem intrauterino y un par de ovoides o colpostatos) este arreglo es el que se utiliza en pacientes no operadas.6,9,10
La sonda intrauterina va directamente dentro de la cavidad uterina (6 cm a 8 cm) y los colpostatos en los fórnix de la vagina, con una longitud de 2 cm en promedio. Se debe realiza un empaquetamiento con gasas marcadas en la cavidad vaginal para disminuir la dosis en órganos de riesgo (recto y vejiga); se coloca una sonda Foley con 7 mL de material de contraste en el globo y una sonda rectal marcada.6,9,10 Al término del procedimiento se toman placas de rayos X para verificar que los aplicadores estén colocados adecuadamente y poder realizar la dosimetría.
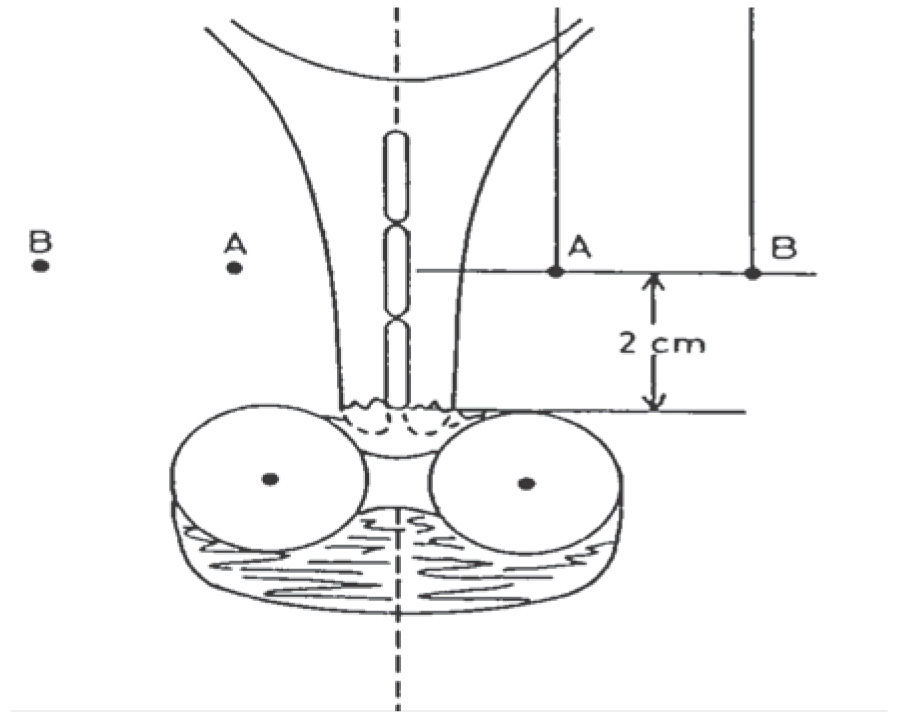
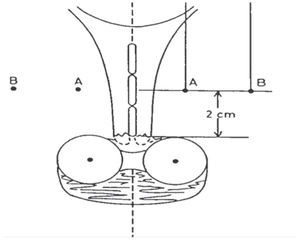
La prescripción de dosis se ha realizado por años con base en el sistema de Manchester considerando puntos importantes para ésta los "A", los cuales se colocan 2 cm laterales del orificio cervical externo y 2 cm arriba. Mederit los modifica y determina que se colocan a partir de la arandela de la sonda intrauterina, estos puntos son el cruce de la arteria uterina con el uretero; otros puntos son los "B", que se localizan 3 cm lateral a los puntos "A" e indican dosis a ganglios iliacos internos (Figura 1). Dosis total (RTE más BQT), de 80 a 85 Gy a puntos "A"; y en tumores voluminosos, mayores a 90 Gy. La dosis a órganos de riesgo se determina localizando el punto de vejiga en la superficie del globo vesical justo dentro del trígono de la vejiga y el de recto a 0.5cm posterior a la pared vaginal.9,11
Figura 1. Prescripción de dosis. Puntos "A" de Manchester.
Para la BQT de alta tasa, se utilizan actualmente fuentes de Iridio192, la dosis liberada en unidad de tiempo es muy alta. El procedimiento para la colocación de los aplicadores Fletcher es similar a la de baja tasa: se determinan dosis a recto y vejiga y en esta modalidad se prescribe a puntos "H" que son similares a los "A" (se localizan a 2 cm superiores a lo largo del tándem y 2 cm perpendicular al mismo en dirección lateral). Mediante un sistema de cómputo se realiza una adecuada distribución de la dosis prescrita a través de optimización, se obtiene una cobertura apropiada del volumen tumoral y menor dosis a los órganos de riesgo.5
Las ventajas de la BQT de alta vs baja tasa son que el personal no tiene exposición a la radiación, es corto el tiempo de tratamiento y no requiere de hospitalización, disminuyen los eventos de trombosis ya que no hay un tiempo de internamiento prolongado. Aunque las complicaciones tardías son mayores en alta tasa, se puede minimizar más fácilmente que las de baja tasa por medio de optimización de dosis; es por esto que en los últimos años ha tenido gran auge. El control local y la Sobrevida son similares en baja y alta tasa, pero hay cierta discrepancia en la toxicidad.5,9
Los factores pronóstico adversos en cáncer cérvicouterino (CACU) son: Relacionados al tumor, al paciente y finalmente al tratamiento.
Factores relacionados al tumor: EC, tamaño tumoral, profundidad de la invasión estromal, invasión parametrial, metástasis ganglionares, extensión uterina, afección del espacio linfo-vascular, grado y tipo histológico, índice DNA elevado, fracción de síntesis, Proto-oncogen C-MyC.7,8
Desde los años noventa, se ha establecido que el tamaño tumoral es un factor pronóstico. El Grupo Cooperativo Francés determina que es el factor más importante.12 Las lesiones mayores de 5 cm tienen más riesgo de recurrencia; el tamaño es pronóstico sobre todo en estadios clínicos iniciales, en lesiones menores a 3 cm, tienen 92% de sobrevida libre de enfermedad (SVLE) pélvica; los de 3 cm a 5 cm, resulta de 85% y los mayores a 5 cm, de 79%.7,10,13 El tamaño tumoral voluminoso en EC IIIB es también un factor adverso.7,10,14 El porcentaje de metástasis a distancia es de 25% en lesiones mayores de 5 cm; las metástasis a ganglios linfáticos son alrededor de 50% en lesiones mayores a 4 cm.10 El EC es el parámetro más importante que influye en la sobrevida (SV) y en el control local. La SV a cinco años es de 89% para EC IB, 85% IIA, 75% IIB, 50% EC III y 10 a 20% EC IV.7,10,12
Las pacientes que tienen invasión estromal, tienen, un pronóstico pobre y un alto porcentje de metástasis a distancia comparado con las pacientes sin invasión. La invasión estromal es estadísticamente significativa en EC IIB porque aumenta la afección parametrial y de vagina. La SV a cinco años es de 90% en EC IB sin invasión estromal vs. 50% cuando existe. El involucro de parametrios es un factor determinante de la sobrevida; en pacientes con EC IIB con involucro de uno solo, es de 58% a cuatro años y cuando son ambos, de 47% (p = 0.006). La falla local con involucro bilateral (38%) vs. unilateral (21%).
La SV a 5 años en EC IIIB cuando hay fijación de un parametrio y el contralateral tiene extensión a menos de la mitad es de 66% y cuando va más allá de la mitad de 15%. La afección de parametrios incrementa el riesgo de metástasis a distancia.12,13
Las metástasis de los ganglios linfáticos depende del EC, los primeros relevos ganglionares son los pélvicos, en EC IA1 del 0.1%, EC 1A2 8%, EC IB1 del 10%, EC IB2 del 15%, EC IIB del 25-30%, EC III del 45% y EC IV del 55-60%. Los ganglios para-aórticos se afectan en menor porcentaje, EC IA menor de 1%, EC IB de 5%, EC IIA de 10%, EC IIB de 20%, EC III de 30% y EC IV de 40%.2,3,7,8
La infiltración ganglionar disminuye la SV, cuando hay ganglios linfáticos positivos a pesar del EC hay 30% de disminución en la SVLE y 20% en la SVLE pélvica. El involucro de ganglios linfáticos es el factor pronóstico más poderoso para la sobrevida libre específica de pronóstico (SVLEP); para la sobrevida libre específica de enfermedad (SVLEE) son los ganglios positivos.7,8,14 La estadificación ganglionar es complicada, pero existen métodos que ayudan a determinar el involucro de los mismos, como tomografía computarizada (TC), resonancia magnética (RM), linfangiografia y cirugía estadificadora, método invasivo con morbilidad aumentada; es por eso que la estadificación sigue siendo, en la mayoría, clínica.7-14
La Invasión Linfo-vascular (ILV) es un factor importante en la recurrencia loco-regional y de SVLE; la presencia de un solo factor tiene un riesgo de 15% a 20% de afección de ganglios pélvicos, si se presentan los dos, el riesgo es mayor de 35% y puede alcanzar hasta 50%.7,8,10,12
El subtipo epidermoide es el más frecuente, pero si hay células pequeñas el pronóstico empeora por ser agresivo y tener alto porcentaje de recurrencia. La mayoría de las series señalan que el adenocarcinoma tiene una pobre supervivencia comparada con el epidermoide; carcinoma indiferenciado y adenocarcinoma tienen una SV a cinco años de 67% comprada con 78% con otras histologías. En el informe de Anderson, señala que la SV a cinco años disminuye hasta 32% en pacientes con adenocarcinoma en EC II porque tiene mayor riesgo de metástasis a distancia, por lo cual es un factor predictivo, pero no influye en la falla local en EC III y IV.4, 7, 8
¿ FACTORES RELACIONADOS AL PACIENTE
Edad, nivel de hemoglobina, enfermedades concomitantes como diabetes mellitus o hipertensión arterial. La edad ha sido un factor pronóstico controversial; pacientes mayores de 70 años tiene sólo 1.8% de incremento de riesgo de muerte comparado con mujeres de menos de 40 años. Una edad superior a los 70 años, influye en la SV específica, pero no es un factor pronóstico para la SVLE y la SVLE pélvica.
EL nivel de hemoglobina (Hb) es importante, ya que las células tumorales hipóxicas son resistentes al tratamiento con radiación y es importante tener un valor de Hb aceptable. El nivel de Hb es un factor pronóstico significativo sobre todo en estadios localmente avanzados ya que tiene relación con el control tumoral porque tiene un valor altamente significativo para la recaída. Las pacientes con Hb de 10 a 12.5 g/dL que no se transfunden, tienen mayor riesgo de recurrencia vs los que se transfunden o no tienen anemia. El factor más importante es la concentración de Hb durante el tratamiento, valores menores de 10 g/dL tiene riesgo de falla local y a distancia; la transfusión está indicada si Hb está en el límite o si hay sangrado transvaginal durante la RT.6,10,11 El estado funcional (Karnofsky) se ha reconocido como un factor importante, ya que cuando es mayor de 80%, tienen una SV mayor que los pacientes con un estado funcional menor.6,10,12
¿ FACTORES RELACIONADOS AL TRATAMIENTO
Incluye dosis total a los puntos "A" (RTE y BQT), intervalo entre RTE y BQT, técnica de tratamiento de RTE, impacto de BQT alta o baja tasa; tiempo total de tratamiento (RTE y BQT), radioterapia con campos extendidos, radioterapia asociada con quimioterapia.
Los porcentajes de SV a cinco años tratados con RT sola, depende del EC, así el EC IB y IIA va de 85% a 90%, el EC IB voluminoso baja a 60%, EC IIB es de 75%, EC III A y B tiene rangos de 45% y EC IV es menor de 20%.
El tratamiento de CACU incluye RTE y BQT, la tasa de control local es mejor cuando se combinan; la falla a nivel central en la mayoría de las publicaciones se reportan que disminuye a casi 50% comparado con RTE sola. En EC II y III la tasa de recurrencia con RTE sola es de 15% a 32% y 30% a 50%, respectivamente. EC IIIB la sobrevida específica de enfermedad (SVEE) es de 24% con RTE sola. Los factores de falla más importantes en pacientes tratados sólo con RTE son tamaño tumoral y estado ganglionar.10,12,13
La dosis de radiación a puntos "A" previamente descritos depende del estadio. En EC IB y IIA las dosis de 70 a 80 Gy tienen hasta 10% de falla pélvica, IIB con menos de 70 Gy, la falla es de 50% vs. 20% a 30% con dosis mayores a 80 Gy, EC III con menos de 70 Gy la falla es 50% y la mayor de 85 Gy de 35% a 37%. La dosis en EC IB y IIA debe ser 70 a 80 Gy; y en EC IIB-IVA, la mínima 85 Gy y máxima 90 Gy.5, 9,10,13,14
El intervalo de tiempo entre el término de RTE y la aplicación de BQT es un factor pronóstico en el control tumoral y los resultados en relación a la falla pélvica, dependen de la etapa clínica. La falla es de 5% en EC IB y IIA si el tiempo es menor de 4.5 semanas vs. 10% mayor de 4.5 semanas, EC IIB de 12% y 34% y EC III de 34% y 40% respectivamente. Otros estudios señalan falla de 13% si es menor de 14 días vs. 27% si es mayor de 14. El impacto de tiempo entre RTE y BQT de alta tasa en SV es similar si el tiempo es mayor o menor de siete días, pero el control local es 90% y 84% respectivamente, siendo estadísticamente significativo (p = 0.005).
El tiempo total de tratamiento o protracción es uno de los factores pronósticos significativos (p <0.001), con impacto en el control tumoral. El CACU tiene un tiempo de doblaje tumoral corto (tres a cinco días); la reducción del control tumoral si la BQT es retardada se puede predecir si la tasa de regresión tumoral es baja y el valor del tiempo potencial de doblaje es corto, cuando la tasa de regresión tumoral es relativamente pequeña, el tiempo preciso de iniciar BQT después de RTE influye en la probabilidad de curación del tumor, sobre todo cuando la tasa de regresión tumoral es relativamente baja porque se reduce en forma progresiva la muerte celular. Es ideal que la aplicación de BQT sea de cero a 14 días después de la RTE (teleterapia), si el tiempo se alarga se produce una reparación del daño producido por RTE y en consecuencia la dosis de BQT será mayor para obtener un mejor control; también el retardo en el inicio BQT aumenta el riesgo de metástasis a distancia.15-18
Fyles en 1992 fue uno de los primeros autores en determinar que el tiempo total de tratamiento (mayor a 30 días), tenía una pérdida del control tumoral de 1% por cada día adicional de tratamiento; Girinsky, Lanciano, Pérez y Petereit señalan que el tiempo no debe ser mayor de 52 días y los rangos de pérdida del control tumoral van de 0.68% a 1.1%. La falla local en semanas se ha informado por Lanciano (1993), Pérez y Sugawara2,7,8 y corresponde a 5% cuando el tiempo es menos de seis semanas; 10% a 20% (seis a 10 semanas) y 20% a 36%, mayor de 10 semanas. Lo recomendado es que el tiempo total de protracción sea menor a ocho semanas. Si el tiempo total es de 52 días la SV total, SVLE y sobrevida libre de recurrencia (SVLR) es de 33%, 32% y 55% respectivamente. La recurrencia se señala en 8% si el tiempo de tratamiento es de menos de siete semanas, y de 22% si es mayor (p = 0.001). El riesgo de metástasis es de 23% si el tiempo es mayor de siete semanas y de 15% si es menor.15-17
El tamaño tumoral tiene impacto cuando se correlaciona con el tiempo del tratamiento; con una lesión de 5cm la falla es del 10% si el tiempo de tratamiento es menor de siete semanas y de 50% a 60% si es mayor.13
En la mayoría de las publicaciones se señala que BQT de alta o baja tasa de dosis son similares en la SV a cinco años y control local. La SV a cinco años con BQT de alta tasa en EC I, es 85% a 94%, EC II 58% a 76%) y EC III (35% a 53%) y los resultados para baja tasa son 93%, 78% y 47% respectivamente.
Las dosis con BQT de baja tasa van de 30 Gy a 60 Gy en una o dos aplicaciones con un tiempo de tratamiento de 25 Gy a 50 horas. La dosis en BQT de alta tasa (25 Gy a 30Gy) es equivalente a baja tasa y la equivalencia se obtiene mediante un modelo matemático llamado lineal cuadrático; el número de aplicaciones ha variado desde una aplicación semanal (dosis 700 a 750 cGy a los puntos "A") para un total de cinco o seis; finalmente 500 a 600 cGy en cuatro o cinco tratamientos es el esquema más frecuente.18-23 Dosis mayores de 750 cGy en una sola sesión, incrementa el porcentaje de complicaciones.
En BQT de baja tasa el cálculo dosimétrico es manual y las dosis a recto y vejiga no pueden ser controladas como en alta tasa donde existe un sistema de planeación computarizado que optimiza la dosis al volumen de tratamiento para que la distribución sea la más adecuada y la toxicidad menor; con el modelo lineal cuadrático la dosis a vejiga y recto se reduce de 1% a 20% con una media de 13%.5,9,19-23
Algunas series señalan SV libre de recurrencia a tres años en EC IIIB con BQT de baja tasa de 63% y de 30% con alta y la falla pélvica incrementa con alta en 56% vs. 25% en baja tasa; las metástasis a distancia son de 35% vs. 17% respectivamente. EC IIIB voluminoso, es un factor pronóstico adverso. La SV loco-regional, control pélvico y metástasis a distancia son similares en el resto de los estadios, pero en IIIB el tratamiento con BQT de alta tasa tiene pobre control24 y sólo dos series mencionan lo contrario.22-24
En rangos generales la tasa de morbilidad para BQT es de 2.23% en alta tasa y 5% a 5.34% en baja, aunque algunos informes mencionan que es mayor la toxicidad en alta.22,25-27 Los órganos de riesgo son recto y vejiga. La toxicad en grados se determina mediante la siguiente escala incluida en los criterios de toxicidad según el Grupo Oncológico de Radioterapia (RTOG):28
Proctitis. Grado 0: sin alteración. Grado 1: incremento en la frecuencia de las evacuaciones, evacuaciones con sangrado ocasional o incomodidad (hemorroides); no requiere de medicación. Grado 2: incremento en la frecuencia de las evacuaciones, sangrado o descarga mucosa, incomodidad rectal que requiere de medicación, fisura anal. Grado 3: incremento en la frecuencia de evacuaciones o diarrea que requieren de aporte parenteral, sangrado rectal que requiere de transfusión o persistencia de descarga de moco. Grado 4: perforación, sangrado o necrosis que requieren de intervención quirúrgica (colostomía)
Cistitis-Disuria. Grado 0: ninguna. Grado 1: síntomas moderados que no requieren intervención. Grado 2: síntomas que se alivian con terapia. Grado 3: síntomas que no se alivian después de tratamiento.
Fístula (vesico-vaginal). Grado 0: ninguna. Grado 3: requiere intervención. Grado 4: requiere cirugía.
Hematuria. Grado 0: ninguna. Grado 1: microscópica únicamente. Grado 2: sangrado grueso intermitente o coágulos. Grado 3: persistencia de sangrado grueso intermitente o coágulos que requieren de cateterización, instrumentación o transfusión. Grado 4: necrosis o ulceración profunda que requiere de manejo quirúrgico.
La mayor complicación que se presente es la intestinal ( proctitis), seguida de la urinaria (cistitis); en grados 1 y 2 se presenta más frecuentemente; 3 y 4 en 3.4% a 5%; cuando no hay respuesta al tratamiento médico, se indica cirugía derivativa.25-27
La toxicidad es aguda si se presentan antes de los seis meses y crónica después de éstos, en la mayoría de las series las complicaciones se presentan a los dos años. Conforme a la Comisión Internacional de Unidades y Medidas de Radiación (ICRU 38), se determina que la tolerancia de dosis a recto es de 70 a 75 Gy y de la vejiga de 75 a 80 Gy; para el caso de BQT de alta tasa no debe exceder 70% de la dosis prescrita en cada tratamiento.5 La toxicidad tardía, sobre todo a nivel de recto, es mayor con BQT de alta tasa. Petereity y Perecy indican que no hay correlación entre la complicación tardía y las dosis a los puntos "A".21,29
Otra modalidad de radiación que puede impactar en el carcinoma cérvico-uterino es RT de campos extendidos (RTCE), donde el campo de radiación cubre superiormente los ganglios para-aórticos (PA). La progresión de ganglios pélvicos es hacia los para-aórticos, éstos son predictor de enfermedad sistémica y tienen impacto en el control de la enfermedad. Indicar RTCE beneficia a las pacientes que tienen un riesgo alto de enfermedad microscópica a este nivel. La progresión de ganglios pélvicos es hacia los para-aórticos, éstos son predictor de enfermedad sistémica y por tanto impactan en el control de la enfermedad. Indicar RTCE beneficia a las pacientes que tienen un riesgo alto de enfermedad microscópica a este nivel.
La SV a cinco años, cuando hay ganglios PA positivos, es de 48%. El RTOG informa SV absoluta a cinco años con RTCE de 67% vs. 55% con RT a pelvis y a 10 años de 55% vs. 44% respectivamente. La SVLE a cuatro años es de 49.8% (RT pelvis) vs. 53.3% (RTCE). Las metástasis a distancia es 2.8 veces más en pacientes que solo se trata pelvis. El mayor beneficio en la profilaxis con RTCE son IB, IIA, IIB. No hay beneficio en SV cuando se da tratamiento con ganglios positivos.30-34
Combinar RTCE más quimioterapia (QT) con base en 5-fluorouracilo (5-FU) y cisplatino, aumenta la SV actuarial a cinco años (73%) y mejora la SVLE (67%), pero la toxicidad es mayor: RTCE sola, incrementa las complicaciones de tipo gastro-intestinal (toxicidad grado tres o cuatro) y es mayor con antecedente de cirugía abdomino-pélvica o enfermedad intestinal inflamatoria.29-34
La utilización de QT en CACU mejora el control de la enfermedad y el agente más activo es cisplatino, con una tasa de respuesta de 20% a 40% (p = 0.001), con regímenes combinados de cisplatino la respuesta parcial (50%). QT neoadyuvante no tiene impacto. El tratamiento concomitante o simultáneo de QT y RT ofrecen mejor resultado; el riesgo de recurrencia se reduce a 20% o 30%, en otras series, de 30% a 40%. QT es un radiosensibilizador y predice la respuesta de RT; reduce el número de células tumorales, inhibe la reparación del daño subletal inducido por RT, promueve sincronización del ciclo celular en fases radiosensibles y reduce la fracción de células hipóxicas resistentes a la radiación.2,7,8,29,34-37
Cisplatino mejora el control local, SV y SV libre de progresión (SVLP), disminuye el riesgo de muerte (30% a 50%). La dosis de cisplatino es 40 mg/m2 semanal, concomitante con RT (promedio: seis semanas). La SV a cinco años, con tratamiento combinado alcanza de 65% a 81% y 20% más en EC IB-IIA. Peters indica que los más beneficiados son los casos EC1B2-IIA.2,29 La toxicidad más frecuente con este esquema simultáneo es gastro-intestinal (grado tres y cuatro) y hematológica. Nuevos agentes como carboplatino, paclitaxel, tirapazamine, topotecan, vinorelbine son candidatos para estudio de QT concomitante con RT.1-3,35
La radioterapia paliativa se indica en presencia de sangrado, dolor y obstrucción por actividad tumoral; los esquemas de RT más utilizados son 30 Gy en 10 sesiones o 20 Gy en cinco fracciones.2 El control de la enfermedad, de la SV y de las complicaciones, depende de las técnicas de planeación, (RTE/BQT). Estudios recientes señalan mejoría del índice terapéutico al incrementar la dosis de radiación a la pelvis y disminuirla en sitios de riesgo. Con campos de tratamiento estándar se observan fallas marginales de hasta 28% y hay una cobertura inadecuada de campos de radiación en 49% y de ganglios de la iliaca externa de 45% a 62% porque hay una subdosificación regional hasta en 32%; con el advenimiento de métodos de tratamiento como tomografía computarizada (TC) o por emisión de positrones (PET) y resonancia magnética (RM), se logra visualizar el tumor primario y los órganos adyacentes al delinearlos en la imagen. La radioterapia conformal (3D) y de intensidad modulada, mejora la distribución de dosis en el mismo y reduce la dosis a los órganos sanos (por ejemplo: disminución del volumen intestinal [50%] y de recto y vejiga [25%]) comparada con RT convencional.38-41 BQT 3D guiada con imagen también ha dado mejores curvas de dosis e histogramas que determinan dosis-volumen en el tejido tumoral y normal.42-47
Los objetivos del presente estudio son determinar el beneficio del tratamiento con radioterapia en cáncer cérvico-uterino y establecer factores involucrados en la respuesta al tratamiento o su modificación. Así también, el control local de la enfermedad y la toxicidad asociada a la terapéutica.
¿ MÉTODOS
Se trata de un estudio restrospectivo, longitudinal, descriptivo y observacional de pacientes con cáncer cérvico-uterino tratadas con radioterapia en la Unidad de Radio-Oncología del Hospital General de México, del periodo comprendido de 1998 a 2003.
Se incluyeron todas las pacientes con diagnóstico de cáncer cérvico-uterino EC I-IVA, con etapificación clínica y reporte histopatológico del Hospital General de México, estudios de laboratorio completos incluyendo filtrado glomerular. Radiografía de tórax para descartar enfermedad a distancia, rectosigmoidoscopia o cistoscopia para evidenciar extensión en aquellas pacientes que estuviera indicado.
Criterios de inclusión: Pacientes de cualquier edad tratadas con RTE con o sin BQT. ECI-IVA, pacientes con cirugía previa y factores de riesgo para recurrencia, seguimiento mínimo de seis meses. Se excluyeron pacientes con RTE fuera de la Unidad, con enfermedad a distancia, radioterapia con finalidad paliativa y menor de seis meses de seguimiento.
Metodología: Se realizó la revisión de expedientes clínicos del archivo médico del Servicio de Oncología del Hospital General de México. La recolección de datos fue inicialmente en Excel y posteriormente se analizaron en el sistema SPSS V.10; se realizó una estadística descriptiva, con medidas de frecuencia y tendencia central, así como análisis de varianza.
¿ RESULTADOS
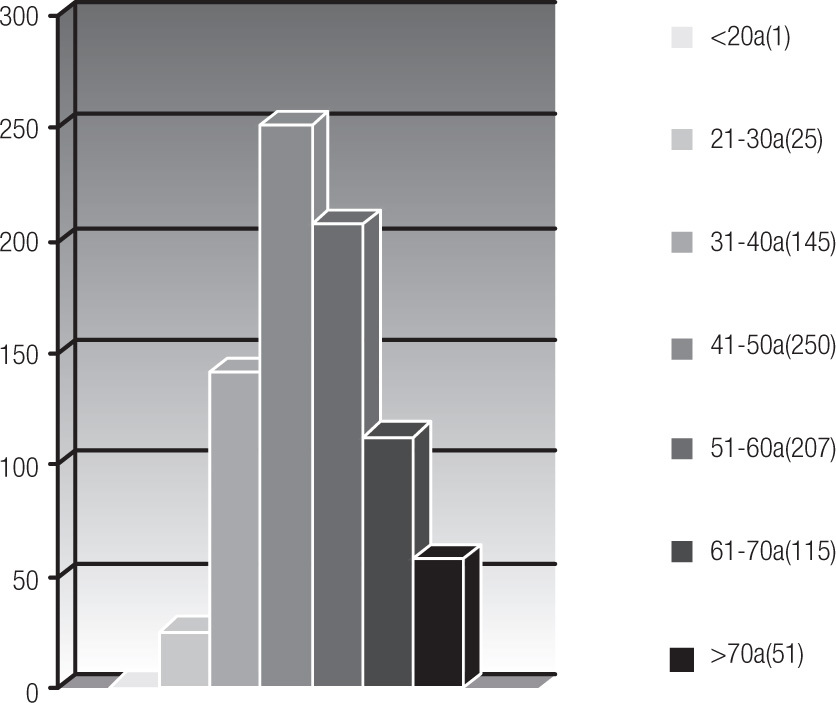
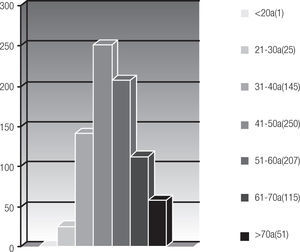
Se analizaron 849 expedientes y se excluyeron 55 pacientes por no contar con los criterios de inclusión. El rango de edad más afectado fue 41 a 50 años en 250 pacientes (31.4%), seguido de 51 a 60 años en 207 (26%). Una paciente de 19 años (0.12%) y 51 pacientes mayores de 70 años (6.42%); el resto de la distribución de edad se muestra en la (Figura 2).
Figura 2. Distribución por grupos de edad.
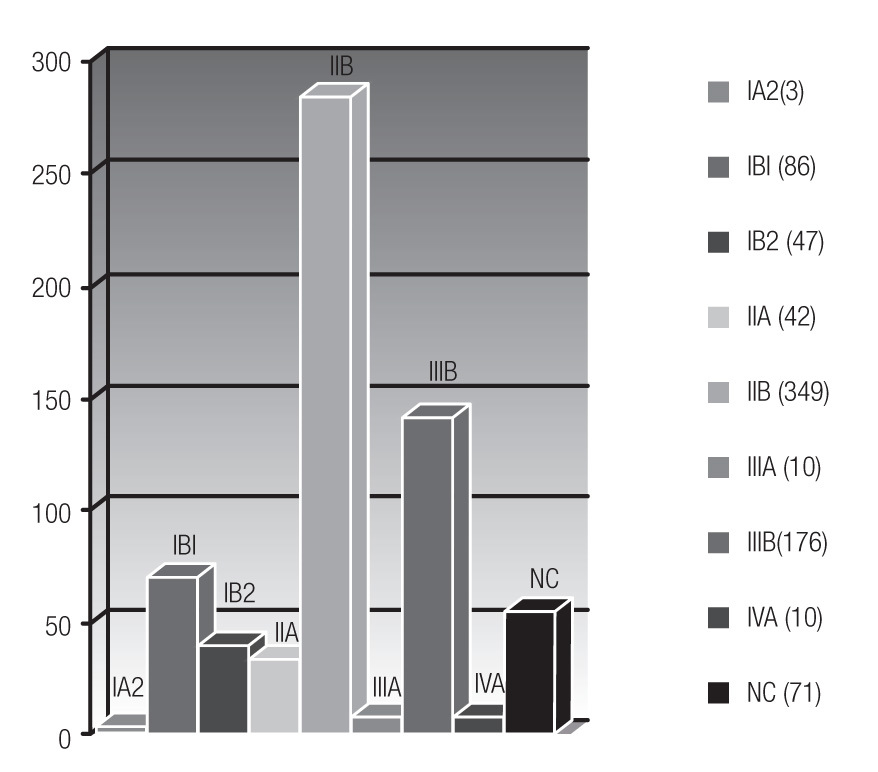
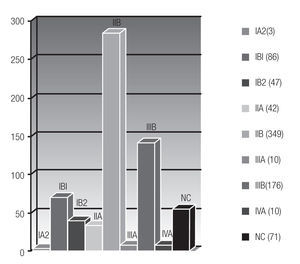
La EC de mayor presentación fue IIB en 349 pacientes (43.9%), IIIB en 176 (22.1%); el resto de EC se presentan en la (Figura 3). Tres pacientes con estadio IA2 (0.4%) y enfermedad asociada no se manejaron con cirugía inicial y recibieron RT. La estirpe histológica predominante fue carcinoma epidermoide moderadamente diferenciado en 738 casos (92.9%), adenocarcinoma en 51 casos (6.4%) y el resto 0.6% incluyeron subtipo indiferenciado y neuroendocrino.
Figura 3. Distribución por estadio clínico.
La presencia de VPH se logró documentar sólo en 41casos ya que no se realiza de manera rutinaria la búsqueda de virus de papiloma humano. En 155 pacientes con cirugía inicial (histerectomía extrafascial o radical) y con factores adversos recibieron RT adyuvante.
Previo al inicio del tratamiento con radioterapia externa se realizó una evaluación clínica y hematológica completa; documentamos Hb inicial en 777 pacientes (97.8%); 93% de éstas (722) tuvieron niveles de hemoglobina por arriba de 10 g/dL al momento de iniciar RTE, en el resto se indicó transfusión para alcanzar estos niveles. Las 722 pacientes mantuvieron este nivel de Hb durante la RTE, pero en 69 se indicó transfusión antes de aplicar BQT. En el análisis de varianza el nivel de Hb mayor o menor de 10 g /dL, fue un factor significativo (p = 0.005) en el tratamiento de RT.
Radioterapia externa: Documentamos cuatro esquemas de radiación: 766 (50 Gy/25 fracciones), 11 (60 Gy/30 fracciones), 14 (45 Gy/25 fracciones) y tres pacientes (40 Gy/20 fracciones). En relación con el equipo de tratamiento, 682 pacientes (85.8%) fueron tratadas en Cobalto60 y 112 (14.2%), en acelerador lineal, con energía de 10 MV. Las técnicas de tratamiento utilizadas fue a cuatro campos (en caja) en 761 pacientes y dos campos AP-PA en 33 pacientes. Los límites del campo de radiación incluyeron la pelvis total. No se revisó el tratamiento concomitante de quimio-radioterapia como tratamiento radical en pacientes no operables, debido a que no se tenía un protocolo debidamente establecido en la Unidad en ese periodo de tiempo y aquellas que si se manejaron recibieron diferentes esquemas de manejo, por lo que no es una variable incluida.
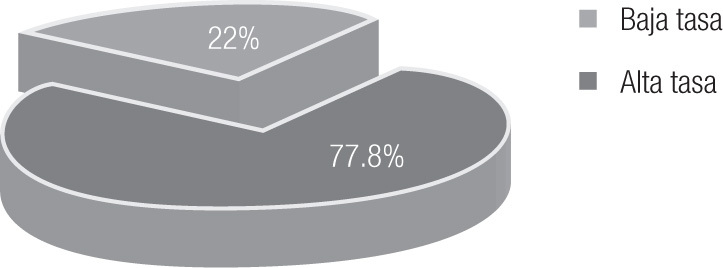
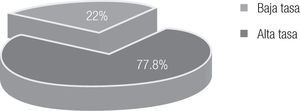
Braquiterapia: Al finalizar RT externa, las pacientes fueron valoradas para recibir BQT. 791 pacientes recibieron RTE y BQT, tres pacientes no recibieron BQT por tener residual posradioterapia mayor a 3 cm. Recibieron BQT de baja tasa de dosis 618 pacientes (77.8%) y de alta tasa 173 (22%) (Figura 4). La dosis inicial de prescripción fue 30 Gy a puntos "A" de Manchester; sin embargo en algunos casos se disminuye la dosis por diversas circunstancias, la más frecuente fue dosis altas en recto o vejiga no aceptada por las recomendaciones del ICRU 38.
Figura 4.Tratamiento de Braquiterapia.
Recibieron 30 Gy 613 pacientes (77.2%), 173 (21.8%) menos de 30 Gy (rango 20 Gy a 25 Gy) y cinco pacientes más de 30 Gy (0.63%). La planeación del tratamiento en BQT de baja tasa se realizó mediante placas ortogonales AP y lateral y en alta tasa se tomaron cuatro placas en cada aplicación (AP, lateral y dos oblicuas). En 631 pacientes (79.5%) se colocó colpostatos y sonda uterina; 130 (16.4%) únicamente colpostatos, 25 (3.16%) cilindro vaginal y en cinco pacientes sólo se colocó sonda intrauterina (arreglo llamado "R4"), pero la dosis colocada fue equivalente a 30 Gy.
La principal complicación durante la colocación del equipo de braquiterapia fue laceración de mucosa vaginal en 15 casos: 10 en alta tasa de dosis y cinco en baja tasa. La dosis máxima a recto y vejiga se respetó de acuerdo a lo establecido por el ICRU 38.
Dosis total a puntos "A": Tres pacientes con EC IVA recibieron 40 Gy en 20Fx y por residual menor a 3 cm no se dio BQT. Recibieron 80 Gy 629 pacientes a los puntos "A" de Manchester: cinco recibieron 35 Gy con BQT y 45 Gy en la primera fase, 11 (60 Gy con RTE y 20 Gy con BQT), 613 recibieron 50 Gy en la primera fase y 30 Gy con BQT. En 162 pacientes la dosis total a puntos "A" fue 70 Gy: 153 de éstas recibieron 50 Gy con RTE y 20 Gy con BQT y nueve pacientes con 45 y 25 Gy respectivamente.
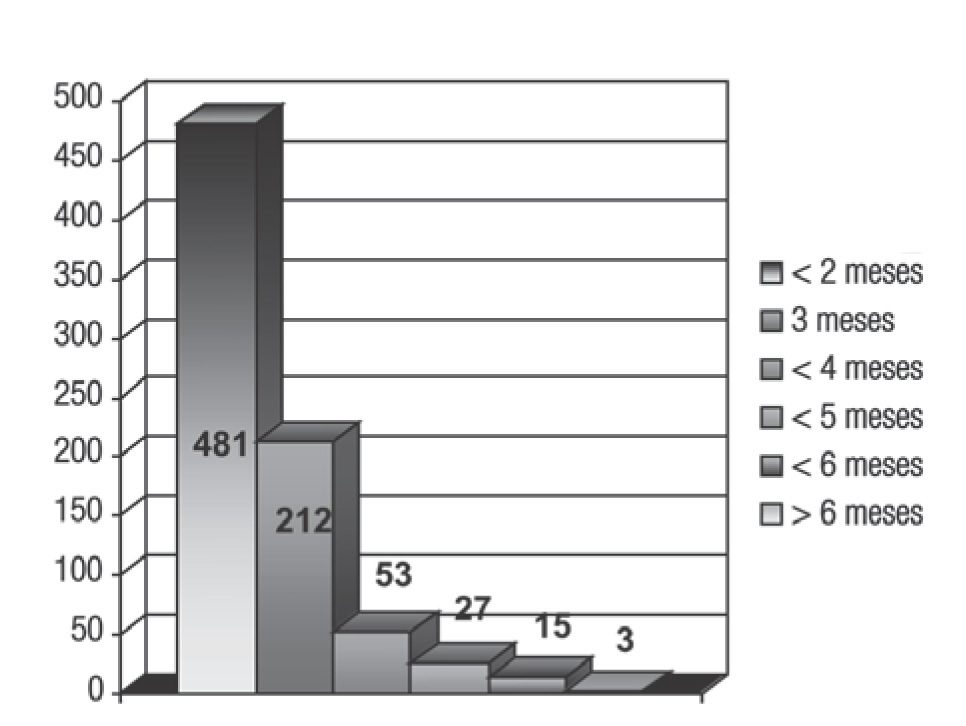
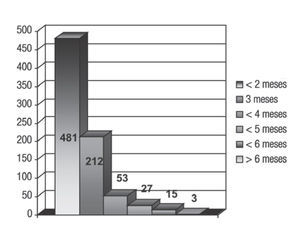
Tiempo de tratamiento: El tiempo total de tratamiento fue evaluado desde el inicio de la RTE hasta el retiro del material de BQT en baja tasa o la última aplicación en alta tasa; 481 pacientes (56.6%) recibieron el tratamiento completo en un lapso menor a dos meses, 212 (24.9%) en un periodo de tres meses, 53 (6.2%) en cuatro meses, 27 pacientes (3.4%) en cinco meses, 15 pacientes (1.8%) en seis meses y en tres (0.37%) mayor a seis meses (Figura 5). En el análisis de varianza este factor resultó con p = 0.005 debido a que el tiempo tiene un rango amplio. El tiempo entre RTE y BQT fue de una semana en 76 pacientes, dos semanas en 405, tres en 100 pacientes, cinco semanas en 112, seis semanas en 80, siete en 15 pacientes y ocho en tres pacientes.
Figura 5. Distribución del tiempo total de tratamiento.
Evaluación postratamiento: La evaluación de toxicidad aguda y crónica se realizó de acuerdo a los criterios de RTOG; en toxicidad aguda: la morbilidad predominante fue proctitis grado 1 en 176 pacientes (22.16%), grado 2 en 37 (4.6%); cistitis grado 1 en 26 pacientes (3.2%) y grado 2 en 40 (5%); la toxicidad aguda global fue de 35% (279 pacientes): 25.5% y 10.5% para BQT alta y baja tasa respectivamente. La toxicidad crónica fue observada en 160 pacientes, proctitis grado 1 en 67 pacientes (8.4%); grado 2 en 52 (6.5%) y grado 3 en 16 (2%); cistitis grado 1 en 14 pacientes (1.6%), grado 2 y 3 en dos pacientes respectivamente. Siete pacientes (0.8%) presentaron fístula recto-vaginal como morbilidad asociada al tratamiento en ausencia de actividad tumoral. De forma global la toxicidad tardía fue de 20.15%: 16% y 4.1% para BQT alta y baja tasa respectivamente. La mayor parte de la toxicidad se resolvió de manera conservadora; 30 pacientes (3.5%) fueron sometidas a colostomías por toxicidad crónica.
Control tumoral: Al final del tratamiento 474 pacientes (59.7%) lograron control completo, libres de actividad tumoral (locorregional y a distancia), 164 pacientes (20.65%) tuvieron control pélvico pero con enfermedad a distancia: progresión a para-aórticos en 90 pacientes (11.2%); pulmón 32, hueso 18, hígado 15 y cerebro nueve. Las pacientes con enfermedad a distancia recibieron quimioterapia o radioterapia paliativa. En 156 pacientes no hubo control locorregional, debido a persistencia tumoral en 113 (14.2%) y recurrencia a nivel de parametrios en 43 (5.4%). Al realizar un análisis a través de productos cruzados de las pacientes con persistencia encontramos que los factores asociados más importantes fueron la dosis de BQT menor a 30 Gy y un tiempo de protracción mayor a dos meses. En relación con la recurrencia parametrial, se agrega a estos dos factores el volumen tumoral. Por lo tanto en nuestra serie el control local a nivel de pelvis alcanzó 80.3% (638 pacientes).
Estado general: El periodo de seguimiento de las pacientes fue tomado desde la primera visita al servicio de gineco-oncología hasta la última visita de revisión clínica, la media fue de 39 meses (rango seis a 73). Al final del estudio 368 pacientes se encontraban en control sin actividad tumoral (46.3%): 167 pacientes (IIB), 80 (IB1), 40 pacientes en cada una (IB2, IIA y IIIB), 8 (IIIA) y 3 (IA2). 43 pacientes vivas con actividad tumoral en control (5.4%), la mayoría a nivel de paraórticos. Fallecidas por actividad: 83 pacientes (10%); 217 pacientes perdidas sin actividad tumoral (27.3%), 80% de éstas se perdió después de tres años y finalmente 83 pacientes perdidas con actividad tumoral (10%).
¿ DISCUSIÓN
Al analizar nuestros resultados se encuentra que la edad promedio de carcinoma cervical invasor es de 50 años, como se describe en la bibliografía, aunque en los últimos años ha habido un incremento en pacientes jóvenes. El Registro Histopatológico de Neoplasias, en su informe correspondiente al año 2004, publicó que en México la incidencia del carcinoma in situ es de 28 por 100 000 mujeres entre los 15 y 44 años y que la mayor incidencia del cáncer invasor se registra a partir de los 45 años de edad.
En cuanto a las características tumorales, la estirpe con mayor incidencia fue carcinoma epidermoide y en sólo 6.4%, adenocarcinoma. Se ha descrito que el adenocarcinoma presenta peor pronóstico que el epidermoide, por mayor progresión a ganglios para-áorticos.1,2,7,8 En nuestra serie, el número de pacientes con este subtipo fue menor, por lo cual no pudimos determinar esta asociación.
La mayor parte de nuestras pacientes se presentaron en estadios clínicos localmente avanzados. A diferencia de países desarrollados, en nuestro medio casi 50% de las pacientes acuden con tumores localmente avanzados. El tamaño tumoral es un factor pronóstico de control, 70% de la recurrencia locorregional o enfermedad a distancia en esta revisión, se observó en pacientes con ECIIB y con tamaño tumoral mayor a 5 cm, con este tamaño la posibilidad de metástasis ganglionar y a distancia es de 50% y de 25% respectivamente. Eifel y colaboradores7 han demostrado una asociación muy estrecha entre el tamaño tumoral primario y la incidencia de recurrencias pélvicas después de la radioterapia. El control tumoral y la SV total disminuyen en relación a la EC, la SV es de 70% a 75% en EC IIB y 50% para ECIII.1,4,7,8
Otro factor analizado es el nivel de hemoglobina pre-tratamiento. Hay una mayor incidencia de recurrencia pélvica y menor índice de sobrevida en pacientes con niveles de hemoglobina menores de 10 a 11 g/dL, comparado con pacientes con niveles más elevados. En nuestra revisión, 722 pacientes iniciaron RTE con niveles de hemoglobina mayores de 10g/dL y lograron mantener esta cifra antes de iniciar BQT. Cincuenta y cinco pacientes restantes presentaron hemorragia aguda o no aceptaron transfusiones durante RTE y sus niveles estuvieron debajo de 10 g/dL. Este factor tuvo significancia en nuestra serie para el control tumoral ya que niveles mayores de 10 g/dL otorga beneficio en el tratamiento con R.2,3,5,7,8 RT adyuvante se indicó en 155 pacientes por factores adversos: ganglios pélvicos positivos, márgenes de resección cercanos o positivos (menor de 3 mm), invasión estromal profunda y permeación vascular y linfática.5 Estos factores son adversos y tienen impacto en el control locorregional e ILE en cáncer cervico-uterino.5,7,8,10,12
El tratamiento de radioterapia fue administrado con rayos gama (cobalto) o rayos X (l0 MV); En la literatura se sugiere utilizar fotones de alta energía, ya que disminuye la dosis de radiación liberada a tejido normal periférico (particularmente vejiga y recto) y provee una dosis de distribución mucho más homogénea en la pelvis central. Al utilizar cobalto o energías de 4 a 6MV la dosis máxima debe ser dada a través de múltiples campos (como técnica de 4 campos), para minimiza dosis a vejiga y recto. En nuestro estudio 682 pacientes fueron manejadas con cobalto60 y en 95% se utilizó la técnica de caja y sólo en 5%, la técnica de dos campos opuestos (generalmente en EC IIIA). En 112 pacientes se utilizó acelerador lineal y técnica de cuatro campos; 618 pacientes fueron manejadas con BQT de baja tasa de dosis y 173 con alta tasa. La prescripción fue de 30 Gy o su equivalencia en BQT de alta tasa, en 631 pacientes se logró aplicar (arreglo simultáneo) en: 130 casos ovoides vaginales (colpostatos), 25 (cilindro vaginal) y arreglo "R4" en cinco pacientes. En pacientes con cirugía previamente se colocó cilindro o colpostatos. Actualmente existe un gran interés por el manejo de BQT de alta tasa porque resulta más cómoda para la paciente y con ventaja de radioprotección para el personal ocupacionalmente expuesto. Existen diversos estudios realizados con la finalidad de demostrar las diferencias entre alta y baja tasa; desafortunadamente los resultados de los estudios teóricos son altamente imprecisos, pero la optimización de BQT de alta tasa puede mejorar la dosis al volumen blanco y disminuir toxicidad a órganos de riesgo aún cuando la dosis por fracción es alta; la equivalencia con baja tasa se logra mediante el modelo lineal cuadrático.
En relación con la dosis a los puntos "A", como uno de los factores pronósticos importantes en el control local, se demuestra en este estudio que 79.5% recibieron dosis de 80 Gy a puntos "A" y dosis menores se asociaron a persistencia tumoral.
El tiempo total de tratamiento impacta en el control locorregional, que se altera por cada día adicional del tiempo inicial planeado en un promedio de 1%,10-14 pero también se ve comprometida la SV total, SVLE y SVLR. Sólo 60% de nuestra revisión estuvo dentro del rango ideal; el resto con alto riesgo de recurrencia locorregional como se menciona en la bibliografía. El intervalo entre RTE y BQT fue del rango de una a dos semanas en 60%, el resto fue mayor a tres semanas. En tres pacientes el lapso fue mayor de seis meses con riesgo mayor de recurrencia local como ya se indicó. La extensión del tiempo de protracción fue en la mayoría de los casos por suspensión de RTE (causas del paciente o del equipo de radiación).
En un análisis multivariado la toxicidad y la complicación durante la aplicación de BQT fue mayor en alta tasa de dosis que en baja tasa, pero puede haber discrepancia ya que el número de pacientes no fue similar en cada grupo; la principal complicación fue la laceración de la mucosa vaginal y la proctitis grado 1 fue la mayor toxicidad tanto aguda como crónica de acuerdo al RTOG. Orton y colaboradores23 encontraron resultados similares al analizar la morbilidad en pacientes tratadas con BQT de alta tasa de dosis.
La radio-quimioterapia concomitante, no se valoró en nuestra serie por no tener un grupo homogéneo; aunque se sabe que puede incrementarse hasta 20% de control local comparado con RT sola. La radioterapia sigue siendo uno de los pilares en el tratamiento del CACU. Los resultados obtenidos son muy similares a los reportados en la literatura mundial, con una tasa de control tumoral que van de la mano con el estadio clínico. En esta revisión se obtiene de forma global 46.3% de pacientes vivas sin actividad tumoral y el control local se logró en 80.3%, considerar que estos resultados están influidos por factores del tratamiento, del paciente y del tumor mismo. El tratamiento de RT por lo tanto incluye RTE y BQT; el impacto de este manejo es el control locorregional. Las nuevas técnicas de tratamiento y de planeación del mismo han modificado los resultados de los últimos años, dando un beneficio en las estadísticas de salud.
Correspondencia: Dra. Yicel Bautista Hernández.
Encinos N° 2. Col. Ampliación Tlacoyaque. Álvaro Obregón. 01859. México, D. F.
Teléfono: 5810 6552.
Correo electrónico: yiselbautista@prodigy.net.mx