El aumento en la calidad y uso de estudios de imagen abdominal han llevado a un incremento en la detección de neoplasias quísticas del páncreas. Esta revisión describe las características clínicas, de imagen e histopatológicas de las neoplasias quísticas del páncreas exocrino más frecuentes. Estas incluyen, las neoplasias quísticas mucinosas, serosas e intraductales papilares mucinosas. Se resalta la importancia de la correlación clínico-patológica en la evaluación de estas neoplasias.
The increased quality and use of abdominal imaging has led to an increasing frequency in the detection of pancreatic cystic neoplasms. This review describes the clinic, imaging and histopathologic characteristics of the most frequent cystic neoplasms of the exocrine pancreas. These include the serous, the mucinous cystic and the intraductal papillary mucinous neoplasms. The importance of clinical and pathologic correlation in the evaluation of these lesions was appreciated.
NEOPLASIAS QUÍSTICAS DEL PÁNCREAS
En los últimos años se ha observado un incremento en la resección de tumores quísticos del páncreas, esto debido al 1) desarrollo de técnicas de imagen que permiten la detección de lesiones asintomáticas, 2) las lesiones pueden ser resecadas por no ser infiltrantes, 3) con los avances en las técnicas quirúrgicas y los cuidados preoperatorios hay una disminución en la mortalidad en resecciones pancreáticas.1,2
Las neoplasias quísticas del páncreas más comunes son las neoplasias serosas, las mucinosas quísticas y la intraductal papilar mucinosa.3-5 Otras descritas con muy baja frecuencia incluyen a las neoplasias neuroendocrinas quísticas, lesiones con revestimiento escamoso como los quistes linfoepiteliales, quistes epidermoides y quistes dermoides. Quistes revestidos por células acinares, como los cistadenocarcinomas acinares y los cistadenomas de células acinares. Quistes con revestimiento endotelial, como los linfangiomas y los teratomas quísticos.2,6
Dado que el comportamiento biológico de las diferentes neoplasias quísticas del páncreas es muy variado y que muchos pacientes son asintomáticos, la detección de estas lesiones puede representar un dilema en la práctica clínica. Por lo cual, es necesario conocer las características topográficas, de imagen, morfológicas y clínicas para tomar las decisiones terapéuticas más apropiadas en cada paciente.
En esta revisión nos limitaremos a la descripción de las neoplasias quísticas del páncreas exocrino más frecuentes.
NEOPLASIAS QUÍSTICAS MUCINOSAS
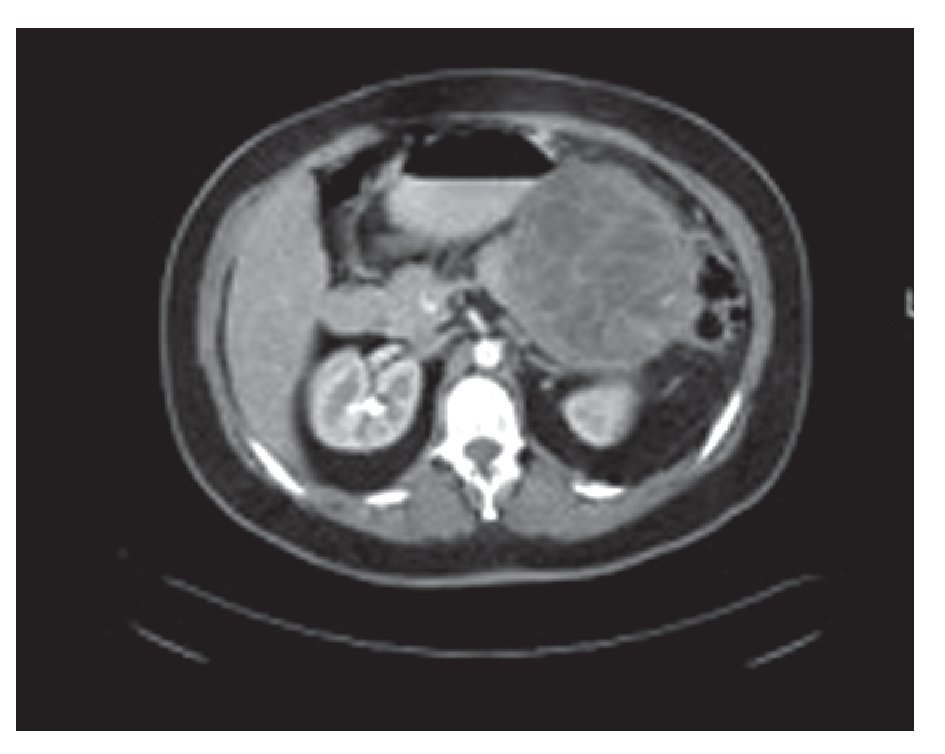
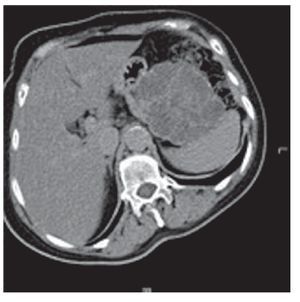
Es uno de los grupos de neoplasias quísticas del páncreas más común, representa el 50% de estas. Corresponde a un espectro de lesiones que se diferencian por las características histológicas de su epitelio, que indican comportamientos biológicos diferentes, incluye a los cistadenomas, cistadenocarcinomas y las lesiones mucinosas limítrofes. Se observan casi exclusivamente en mujeres, la edad promedio de presentación es a los 53 años,7,8 se localizan con mayor frecuencia en cuerpo y cola de páncreas y pueden llegar a medir hasta 35 cm con una media de 8 cm. Aproximadamente, el 25% de las lesiones tienen un anillo calcificado que se puede observar en estudios tomográficos, la mayoría son macroquistes de forma esférica con arquitectura interna compleja en estudios de imagen (Figura 1).
Figura 1. Cistadenoma mucinoso. Imagen tomográfica con lesión quística de lóculos grandes con estructura interna compleja.
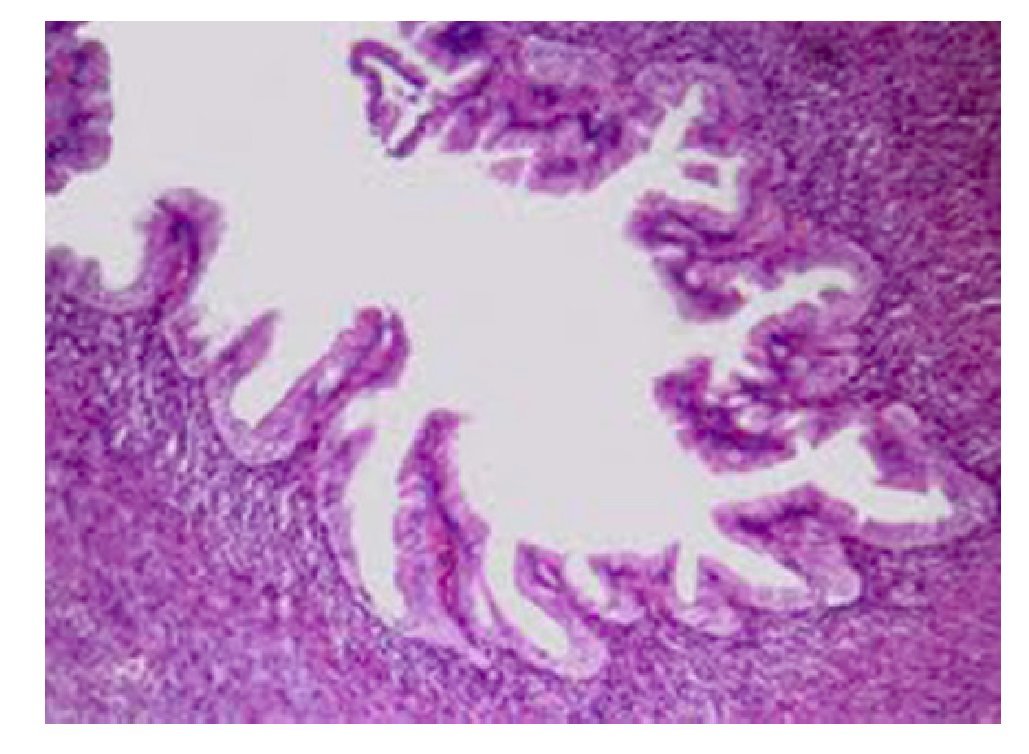
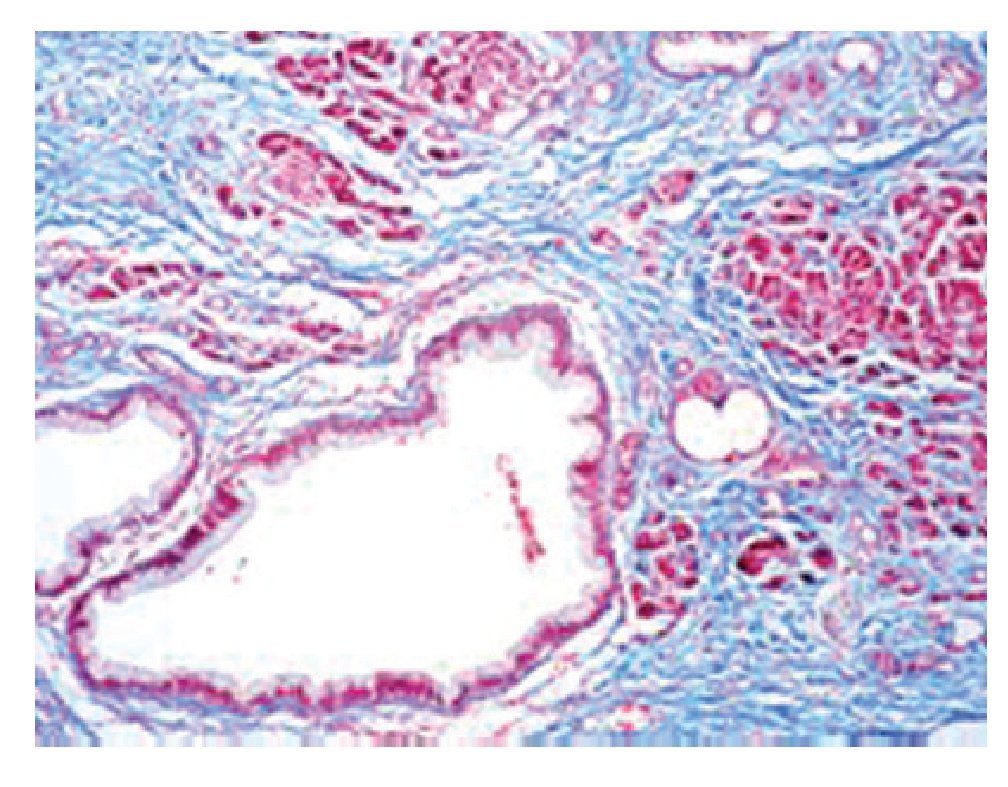
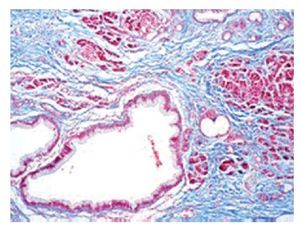
Macroscópicamente, estas neoplasias se componen de grandes quistes que pueden ser multiloculados (20%).8 Varían en tamaño de uno a varios centímetros y cuentan con pared fibrosa. No hay comunicación visible entre el quiste y el sistema de conductos, a menos que exista erosión hacia este.9 La pared del quiste puede tener nódulos sólidos, papilas y ser trabeculada, las áreas sólidas deben ser muestreadas extensamente, ya que pueden corresponder a zonas de carcinoma invasor. El contenido del quiste con frecuencia es mucoide, sin embargo puede ser hemorrágico o cetrino. Microscópicamente, los quistes semejan a las neoplasias mucinosas de ovario, este parecido incluye la presencia de un estroma distintivo tipo ovárico alrededor del quiste, que es un elemento necesario para poder realizar el diagnóstico de neoplasia quística mucinosa de páncreas (NMQP) (Figura 2). Los quistes están revestidos por epitelio cilíndrico productor de moco con diferentes grados de atipia arquitectural y citológica, que pueden coexistir en la misma lesión, en un espectro que va desde displasia leve hasta carcinoma in situ. El criterio utilizado para catalogar a una lesión como cistadenocarcinoma es la invasión del estroma, lo que le confiere una conducta más agresiva. El epitelio puede ser plano o papilar llegando a formar masas polipoides con arquitectura cribiforme. Se pueden encontrar células con diferenciación foveolar, células caliciformes y escasas células neuroendocrinas.2,9
Figura 2. Cistadenoma mucinoso. Estroma tipo ovárico con revestimiento epitelial cilíndrico con mucoproducción.
Las neoplasias quísticas mucinosas se clasifican tomando en cuenta, las características del epitelio en base al mayor grado de displasia observada. El sistema de clasificación propuesto por la Clínica Mayo,10 las separa en tres subgrupos: 1) cistadenomas mucinosos (65% de NMQP), que contienen un epitelio simple columnar mucoproductor de aspecto benigno, 2) neoplasias quísticas mucinosas proliferativas no invasoras (30% de NMQP) compuestas por epitelio con grados variables de atipia, displasia y proliferación papilar, aún con cambios francos de carcinoma in situ, pero sin invasión al estroma y 3) cistadenocarcinomas mucinosos (6% a 20%) pueden tener las características descritas en las lesiones previas más invasión estromal.8 Los focos de carcinoma invasor o carcinoma in situ pueden ser focales, y presentar una transición abrupta con epitelio sin atipia y epitelio con displasia acentuada, por lo que se requiere un muestreo extenso para la evaluación adecuada de estas neoplasias. El componente invasor usualmente está constituido por un adenocarcinoma ductal o tubular, pero han sido descritas otras variantes como el carcinoma indiferenciado, carcinoma adenoescamoso, carcinoma coloide y carcinoma sarcomatoide.9,11,12
El epitelio de revestimiento en el componente mucinoso es positivo para citoqueratina 7, 8, 18 y 19, antígeno de membrana epitelial y ocasionalmente, para citoqueratina 20. Las células del estroma reaccionan para receptores de estrógenos, receptores de progesterona, inhibina, vimentina y calretinina.9
Las características radiológicas que se han asociado con carcinoma invasor incluyen: la presencia de un área quística con calcificaciones o nódulo excéntrico, múltiples proyecciones papilares, engrosamiento septal o de papilas, invasión local a estructuras adyacentes, asociación con lesiones metastásicas, ascitis y datos que sugieran oclusión venosa. El tamaño de los nódulos murales o de las proyecciones papilares se correlaciona directamente con la posibilidad de invasión estromal, asimismo quistes mayores de 8 cm se han propuesto como un indicador de malignidad.13
El espectro de cambios en el epitelio de NQMP implica que muchas de estas, pueden presentar al momento del diagnóstico áreas malignas, o evolucionar a carcinoma sino son tratadas. Por tanto, se acepta que todas las NQMP presentes en la porción distal o proximal del páncreas, deben de ser resecadas independientemente de su tamaño de 8 cm.
NEOPLASIAS QUÍSTICAS SEROSA
Corresponden al 1% de las neoplasias no endocrinas del páncreas, y a más del 30% de las neoplasias quísticas.14 La edad promedio de diagnóstico es a los 62 años, predomina en mujeres y se localiza principalmente en la cabeza del páncreas.15
Existen descritas cinco variedades de neoplasias serosas quísticas: 1) el adenoma microquístico, 2) la neoplasia quística asociada al síndrome de von Hippel-Lindau, 3) el adenoma seroso oligoquístico y 4) el cistadenocarcinoma seroso.16
ADENOMA SEROSO
Es la neoplasia quística serosa más común, generalmente son solitarias y miden entre 10 y 30 cm. En 50% de los casos son descubiertas en forma incidental (por estudios de imagen), el resto de los pacientes pueden presentar síntomas como dolor abdominal, masa palpable, náusea y vómito, pérdida de peso o ictericia obstructiva. Las manifestaciones clínicas se observan más frecuentemente en lesiones mayores de 4 cm, relacionándose con efecto de masa.15,17
Las lesiones se hacen evidentes en la mayoría de los casos después de la realización de estudios de imagen (ultrasónico, tomografía axial computada o resonancia magnética), generalmente durante la evaluación de un padecimiento no relacionado.
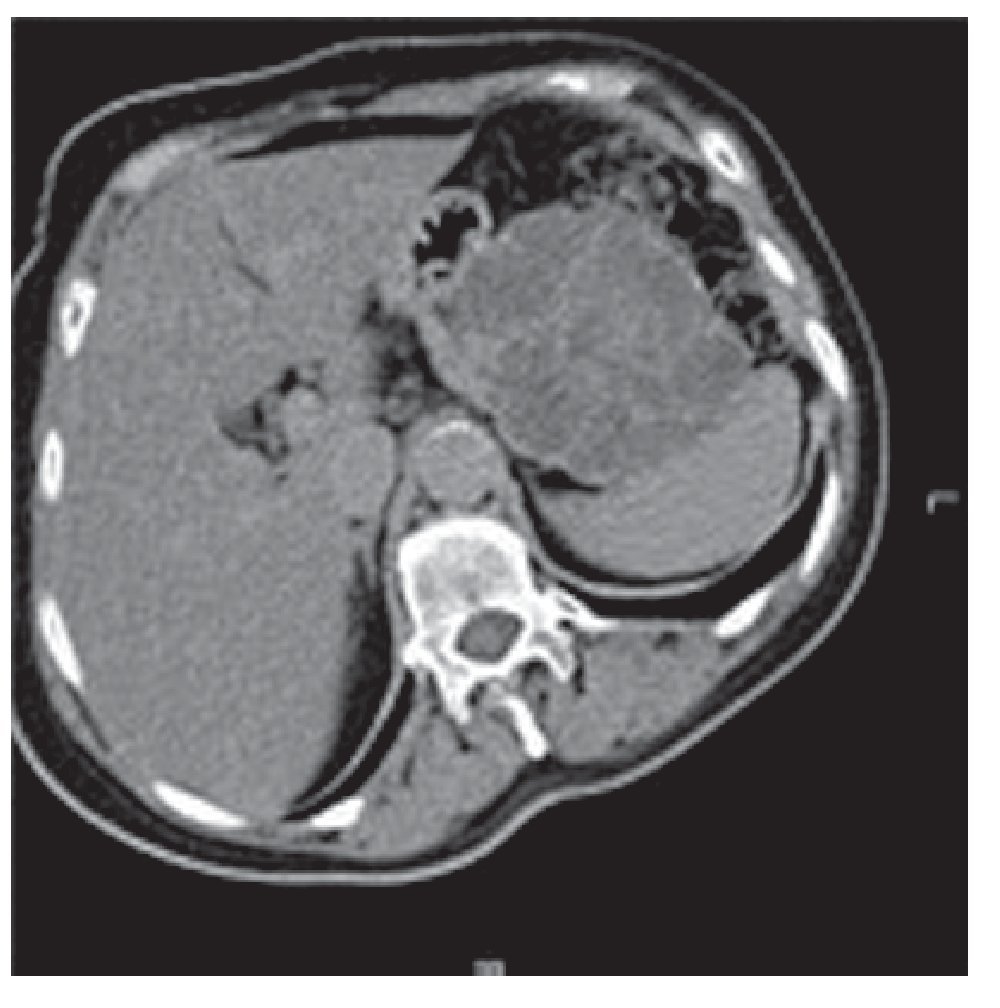
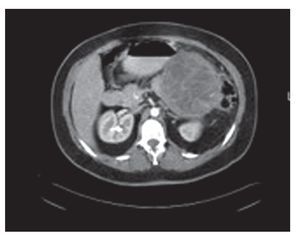
En estudios tomográficos se caracteriza por la detección de múltiples quistes (usualmente menos de 6), de menos de 2 cm. Hasta en el 30% de los casos pueden presentar una zona central fibrosa estelar con calcificación, en ocasiones puede observarse un aspecto en panal de abeja muy característico (Figura 3).
Figura 3. Adenoma seroso microquístico. Imagen tomográfica de neoplasia quística con aspecto en panal de abeja.
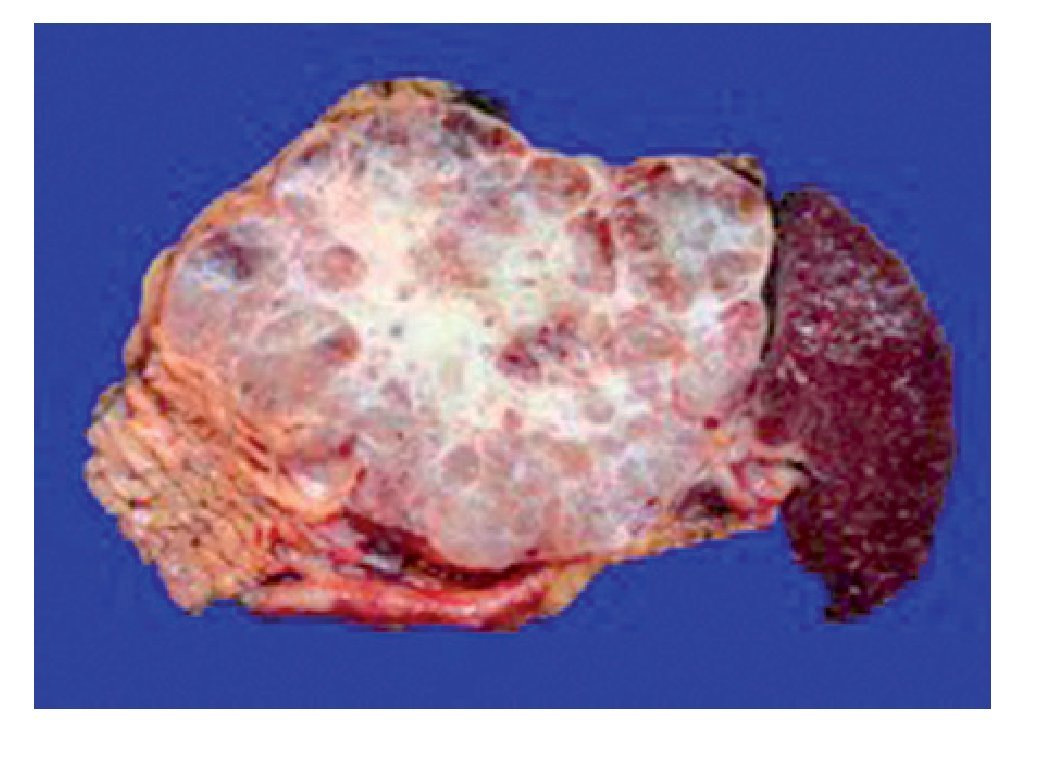
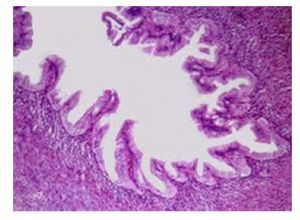
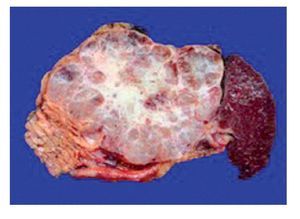
Macroscópicamente se caracteriza por ser una lesión bien circunscrita, de bordes romos, redondeada, con seudocápsula, compuesta por quistes que contienen material claro dispuesto alrededor de una cicatriz estelar (con frecuencia calcificada), de donde emergen septos fibrosos hacia la periferia (Figura 4). Microscópicamente, las células que revisten los quistes tienen citoplasma claro rico en glucógeno, bordes bien definidos y un núcleo pequeño, redondo con cromatina homogénea. Se presume que estas lesiones se originan de células centroacinares del sistema de conductos intercalares del componente exocrino del páncreas.2 Por inmunohistoquímica, las células demuestran positividad para antígeno de membrana epitelial, citoqueratina 7, 8, 18 y 19, CA19-9, B72.3, beta catenina y alfa inhibina y son negativas para antígeno carcinoembrionario, citoqueratina 20, cromogranina A y tripsina.9
Figura 4. Adenoma seroso microquístico. Múltiples lóculos con centro fibroso de aspecto estelar.
CISTADENOMA SEROSO OLIGOQUÍSITICO
Es menos común que el cistadenoma microquístico y se presenta en pacientes de menor edad (50 años), se localiza en la cabeza del páncreas y su tamaño puede variar entre 2 y 15 cm. Macroscópicamente está conformado por escasos quistes de lóculos grandes,18 ocasionalmente por un solo quiste de gran tamaño, por lo que puede confundirse con lesiones mucinosas o seudoquistes. El quiste es revestido por una sola capa de células cúbicas de citoplasma claro, sin embargo el epitelio de revestimiento puede estar denudado requiriendo de un muestreo extenso para identificarlo.9
LESIONES QUÍSTICAS ASOCIADAS A SÍNDROME DE VON HIPPEL-LINDAU
Las lesiones quísticas asociadas al síndrome de von Hippel-Lindou con frecuencia son múltiples, comprometen al páncreas en forma difusa. Se presentan como cistadenomas serosos, neoplasias endocrinas o como neoplasias mixtas con componente endocrino y seroso. Los quistes tienen revestimiento idéntico a las lesiones serosas. En ambas lesiones se ha observado alteración en el gen VHL.
CISTADENOCARCINOMAS SEROSOS
La existencia de neoplasias quísticas serosas malignas es controvertida, ya que en los informes realizados de estas neoplasias no se ha podido descartar la posibilidad de multifocalidad, y las muertes de los pacientes no se han podido atribuir directamente a la neoplasia. Sin embargo, existen casos reportados de neoplasias serosas quísticas que se presentan metástasis sincrónicas o metacrónicas en hígado, peritoneo o ganglios linfáticos.19,20
La naturaleza benigna de la mayoría de las neoplasias serosas permite considerar el tratamiento conservador en pacientes seleccionados (lesiones pequeñas, lesiones asintomáticas en cabeza de páncreas, pacientes ancianos). La confirmación de que la lesión quística es de estirpe serosa a través de biopsia por trucut, permitiría tener una conducta de seguimiento con estudios de imagen anuales o cada seis meses.21
Actualmente, las indicaciones de intervención quirúrgica incluyen: presencia de síntomas, tamaño mayor a 4 cm e incertidumbre en relación a la naturaleza serosa de la lesión.6
NEOPLASIA INTRADUCTAL PAPILAR MUCINOSA
La neoplasia intraductal papilar mucinosa (NIPM) del páncreas es definida por la Organización Mundial de la Salud (OMS) como una neoplasia intraductal, productora de moco con células columnares mucoproductores, que pueden o no tener proyecciones papilares y que compromete a los conductos pancreáticos y carece de estroma tipo ovárico.22 Las células neoplásicas en estas lesiones tienen grados variables de displasia, y en algunos casos se pueden asociar a carcinomas invasores.
Aunque se ha reportado que representa el 25% de las neoplasias quísticas del páncreas, con el uso de la tecnología actual en estudios de imagen su prevalencia puede incrementarse.13,23 Es más común en varones, la edad de presentación es entre la sexta y séptima década de la vida, se localiza con mayor frecuencia en la cabeza del páncreas, pudiéndose encontrar en cualquier topografía del mismo y ocasionalmente, puede comprometer todo el sistema de conductos pancreáticos.23 El conducto principal o el sistema de conductos secundarios están dilatados en forma difusa o segmentaria, y ocupados por moco. Ocasionalmente, se observan macroscópicamente proyecciones papilares y el parénquima adyacente es firme y fibrótico.
CLASIFICACIÓN CLÍNICA
Con base en los estudios de imagen y aspecto macroscópico, la NIPM se ha dividido en NIPM de conducto principal (21%-36%), NIPM de conductos secundarios (38%-48%) y NIPM mixta (28%-41%).24,25
NIPM DE CONDUCTO PRINCIPAL (NIPM-CP)
Compromete sólo el conducto principal sin extensión a los conductos secundarios. La mayoría son sintomáticos, se localizan en la cabeza del páncreas aunque algunas veces causa ectasia difusa del conducto principal por obstrucción del conducto, por el moco producido por las células neoplásicas. Un tercio de estas lesiones pueden localizarse en cuerpo y cola, produciendo ectasia segmentaria del conducto principal. Ocasionalmente se puede afectar todo el conducto principal dilatándolo en forma difusa y torutuosa.26
NIPM DE CONDUCTOS SECUNDARIOS (NIPM-CS)
Se limita a las ramificaciones del conducto principal. La mayoría son asintomáticos y son hallazgos incidentales en estudios de imagen realizados como control de otras enfermedades no relacionadas. Se localizan en la cabeza y el proceso uncinado del páncreas. Su comportamiento tiende a ser indolente, en los casos resecados siguiendo los criterios de resección de Sendai,27 25% tienen displasia de alto grado y 20% se asocian con carcinoma invasor.26
NIPM MIXTA
Se encuentra en el conducto principal y los conductos secundarios, la presentación clínica y el comportamiento biológico de estas lesiones es semejante al de NIPM-CP.
Los síntomas comunes asociados son dolor abdominal, dolor lumbar, náusea, vómito y pérdida de peso. Se pueden presentar cuadros recurrentes de pancreatitis, debido a la obstrucción de los conductos pancreáticos producida por la secreción de moco. Con el tiempo, algunos pacientes desarrollan insuficiencia pancreática con esteatorrea y diabetes mellitus. La ictericia es más común en aquellos pacientes con carcinoma invasor asociado.22,27
La NIPM se puede asociar a neoplasias endocrinas pancreáticas o a neoplasias extra pancreáticas como carcinoma de colon, estómago y pulmón,28,29 y a síndromes familiares como el síndrome de Peutz-Jeghers y la poliposis familiar adenomatosa.30,31
Con la tomografía axial computada, la NIPM-CP distiende el conducto pancreático principal mientras que la NIPM-CS produce quistes multiloculados con aspecto en racimo de uvas.22 Los estudios de tomografía con 2D permiten evaluar la comunicación al conducto principal, nódulos murales, dilatación del conducto pancreático principal y engrosamiento de septos de los quistes.32 En estudios endoscópicos, la salida de moco a través del ámpula de Vater es un dato que apoya el diagnóstico de NIPM.
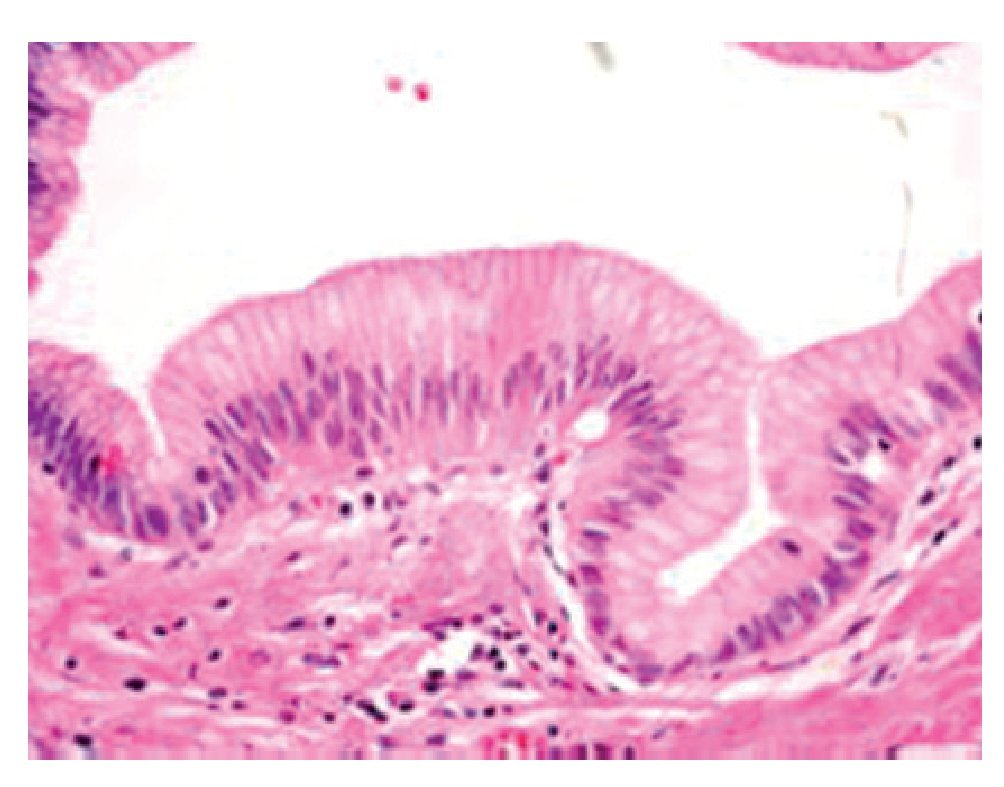
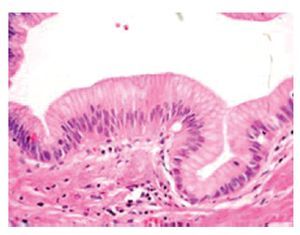
Microscópicamente, los conductos dilatados están revestidos por células epiteliales columnares con mucoproducción, que forman papilas con tallo fibrovascular o se disponen en un revestimiento plano (Figura 5). Pueden presentar atipia citológica y arquitectural variable que va desde displasia leve hasta carcinoma in situ. Tiene patrones arquitecturales diversos que se van haciendo más complejos, a medida que aumenta el grado de displasia.9
Figura 5. Neoplasia intraductal papilar mucinosa. Conductos dilatados revestidos por epitelio cilíndrico mucosecretor.
TIPOS HISTOLÓGICOS
NIPM TIPO FOVEOLAR
Las células en este subtipo tienen mucina apical con núcleo basal semejando al epitelio foveolar gástrico. Usualmente son lesiones planas, de bajo grado y no se asocian a carcinoma invasor. Las células neoplásicas se extienden por el sistema de conductos hacia el parénquima adyacente, sustituyendo las células acinares por células mucoproductoras26 (Figura 6).
Figura 6. Neoplasia intraductal papilar mucinosa tipo foveolar.
NIPM TIPO INTESTINAL
La NIPM es semejante al adenoma velloso del colon. Está compuesto por proyecciones digitiformes revestidas por células columnares, con producción de moco y núcleos ovales. Este subtipo tiene displasia moderada o de alto grado. En los casos de alto grado se observa patrones arquitecturales complejos. Cuando se asocia a carcinoma invasor, este es del tipo coloide.26
NIPM TIPO PANCREATOBILIAR
Se compone de células cúbicas con núcleo atípico y nucléolo prominente, forma papilas complejas con puentes entre ellas y patrón cribiforme. Generalmente, son lesiones con displasia de alto grado y el carcinoma que se asocia con esta lesión es adenocarcinoma ductal con patrón tubular clásico del páncreas.33
NIPM TIPO ONCOCÍTICA
Las células neoplásicas de esta lesión tienen abundante citoplasma eosinófilo granular con abundantes mitocondrias en su citoplasma. Su arquitectura es compleja con formación de papilas, nidos sólidos y áreas cribiformes. Por su arquitectura atípica se clasifican como lesiones de alto grado. El carcinoma invasor asociado a esta neoplasia mantiene las características citológicas oncocíticas.
NIPM TIPO TÚBULO-PAPILAR
Puede formar un nódulo sésil o pediculado dentro de los conductos que se dilatan por obstrucción. Está compuesta por glándulas con diferenciación foveolar, intestinal o pancreatobiliar con atipia leve a severa.
En el 2006 se informaron las guías para el manejo de la NIPM.27 En estas, se acordó que en pacientes en condiciones para realizarles cirugía, todas las NIPM-CM deben de ser resecadas. Ya que las NIPM-CS presentan con menor frecuencia displasia severa o carcinoma invasor, se establecieron los criterios para decidir cuáles NIPM-CS resecar y cuáles se pueden observar, concluyendo que las NIPM-CS sintomáticas, mayores de 3 cm y con nódulos murales asociados deben resecadas.26
Las neoplasias pancreáticas que se manifiestan como lesiones quísticas son múltiples, varían en su comportamiento biológico en forma significativa por lo que es importante conocer las características clínicas, radiológicas y morfológicas de cada una de ellas, para tener el abordaje terapéutico apropiado en cada paciente.
Correspondencia:
Unidad Médica de Alta Especialidad, Hospital de Oncología, CMN SXXI, IMSS.
Av. Cuauhtémoc 330, Colonia Doctores.
C.P. 06720. México D.F., México.
Fax: (+52) (55) 5761 0952.
Correo electrónico: alemantimora@yahoo.com.mx