El cáncer de mama es la principal causa de muerte por cáncer, en mujeres de todo el mundo. Más del 66% de los carcinomas de mama expresan receptores de estrógenos alfa (RE-a), y responden a las terapias antiestrógeno. La mayoría de estos tumores ER+ también expresan los receptores de progesterona (RP). Evidencias epidemiológicas, clínicas y experimentales muestran que la progesterona juega un papel importante en cáncer de mama. Muchas acciones rápidas no genómicas de la progesterona han sido identificadas, incluyendo una acción rápida mediante mecanismos de transducción de señales citoplasmáticas mediada por cinasas en cáncer de mama. En la actualidad, hay tres receptores candidatos para mediar acciones rápidas de progesterona: 1) receptor de membrana progesterona, 2) componentes de la membrana de los receptores de progesterona, y 3) los receptores nucleares de progesterona. En este artículo, revisaremos las evidencias que sugieren que los RP son blancos válidos para el tratamiento del cáncer de mama.
Breast cancer is the most frequently diagnosed cancer and the leading cause of cancer death in females worldwide. More than 66% of breast carcinomas express estrogen receptor alpha (ERα) and respond to anti-estrogen therapies. Most of these ER+ tumors also express progesterone receptors (PRs). Epidemiological, clinical and experimental evidences shows that progesterone plays an important role in breast cancer. Many rapid nongenomic actions of progesterone have been identified, including rapid actions of breast cancer cell signaling. Currently, there are three receptor candidates for mediating rapid progesterone actions: 1) membrane progesterone receptor (mPRs), 2) progesterone receptor membrane components (PGRMCs), and 3) nuclear progesterone receptors (nPRs). In this paper we will review the evidence suggesting that PRs are valid targets for breast cancer therapy.
INTRODUCCIÓN
TEJIDO MAMARIO NORMAL
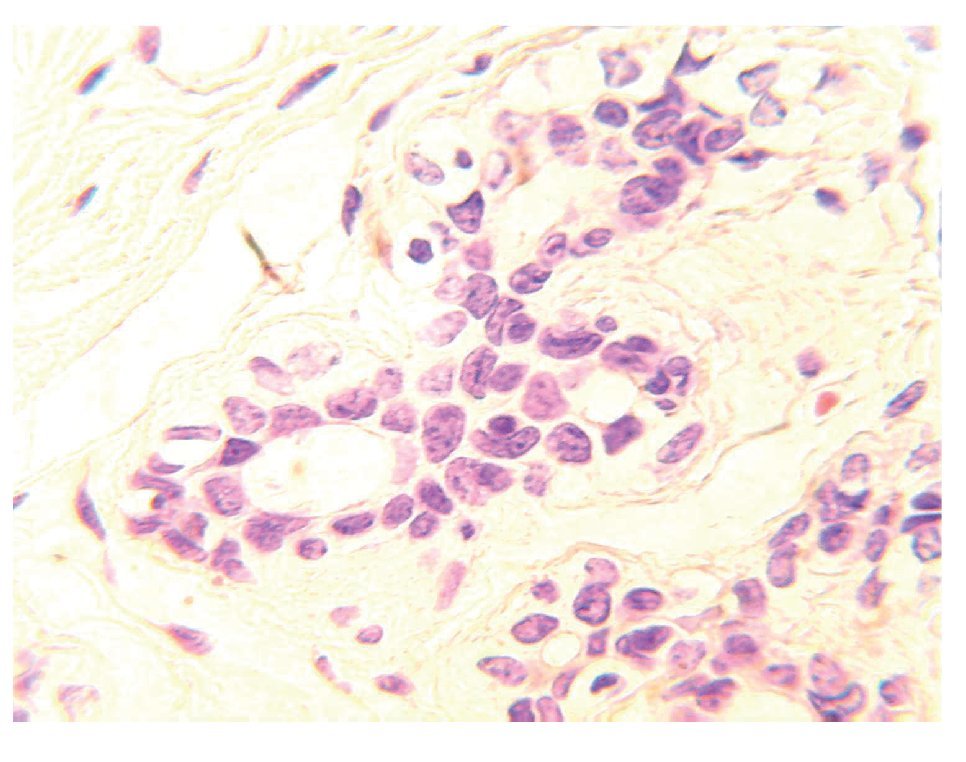
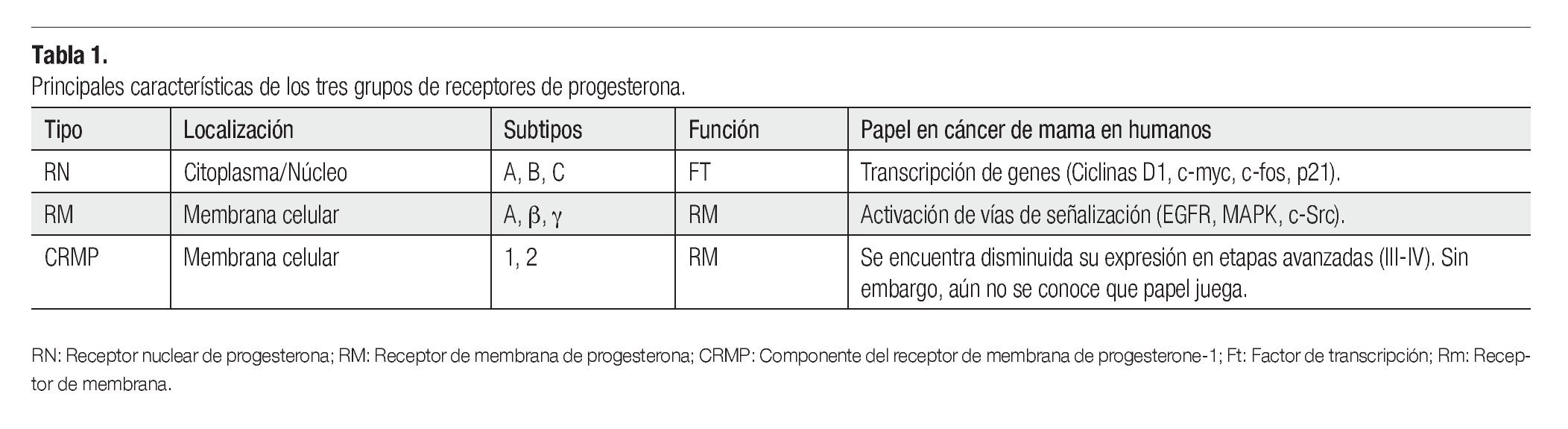
El tejido mamario está conformado por glándulas productoras de leche denominadas lóbulos, y por pequeños túbulos que la transportan hasta el pezón llamados conductos. Las unidades ducto lobulares terminales son conductos que se subdividen dentro de varios conductos intralobares, conocidos como acinos. Estos constituyen la parte secretora del árbol glandular. Esta región es también la zona proliferativa más activa de todo el lóbulo.1 Un lóbulo es definido como una unidad funcional formada por acinos. Los conductos y lóbulos están constituidos por dos capas de células espiteliales. En la capa interna se localizan las células epiteliales luminales, mientras que en la parte externa se encuentra la capa de células mioepiteliales, las cuales están en contacto con la membrana basal (Figura 1). Estas estructuras están rodeadas por estroma compuesto por tejido fibroadiposo, vasos sanguíneos, vasos linfáticos y fibroblastos.2
Figura 1.Unidad ducto-lobulillar. Los conductos y lóbulos están constituidos por una bicapa de células. En la capa interna se localizan las células epiteliales luminales de conductos y lóbulos, mientras que en la parte externa se encuentra la capa de células mioepiteliales, las cuales están en contacto con la membrana basal.
Durante el desarrollo normal de la glándula mama-ria, se requiere de estrógenos, progesterona y factores de crecimiento. Por una parte, el receptor de estrógenos-a (RE-a) promueve el crecimiento y elongación de los conductos inmersos en el tejido adiposo mamario, mien-tras que los receptores de progesterona (RP) por su parte inducen el desarrollo de unidades terminales o acinos (alveologénesis), localizados al final de los conductos y que posteriormente, serán las estructuras productoras de leche. Además, el factor de crecimiento epidérmico (EGF) potencia los efectos proliferativos de la progesterona y de los estrógenos en las yemas terminales, incrementado la formación de conductos inducida por estrógenos y la ramificación inducida por progesterona.2,3
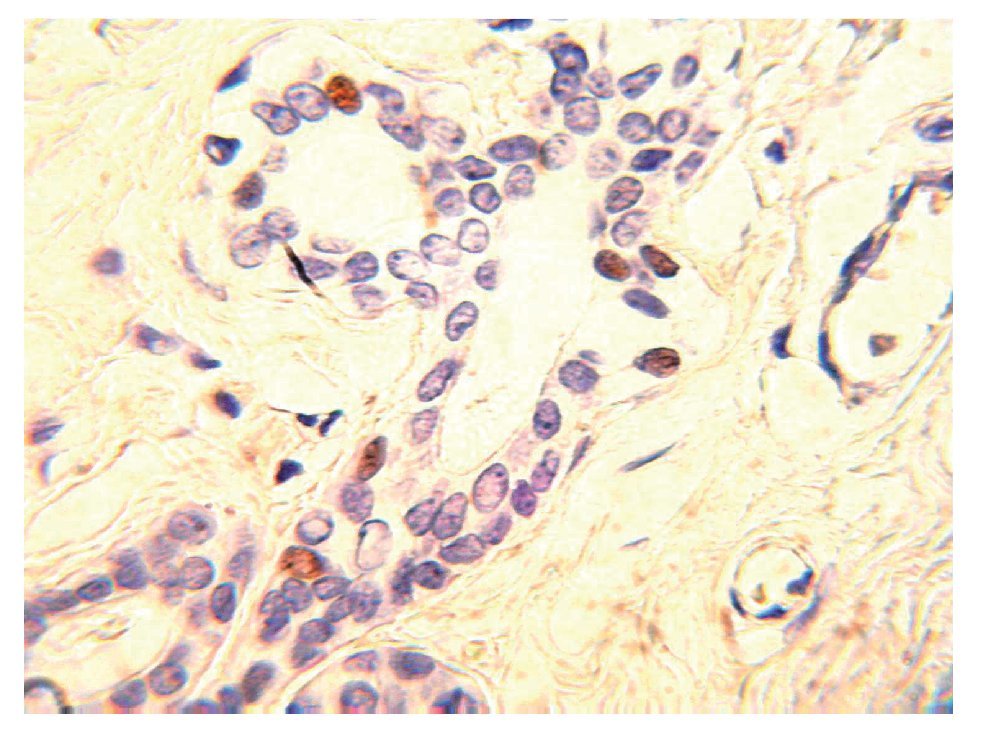
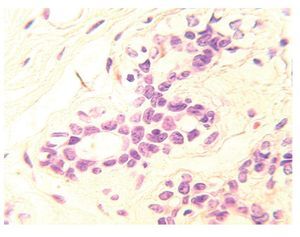
En condiciones normales, sólo 20% de las células luminales se encuentra en contacto con la lámina basal y el resto está en contacto directo con las células mioepiteliales. En el tejido mamario del adulto, las células que expresan receptores de estrógenos y progesterona (RE+/ RP+) representan sólo 7% a 10% de toda la población de células epiteliales (Figura 2). Las células ER+/PR+ son capaces de proliferar, sin embargo, se encuentran quiescentes debido a la expresión de moléculas inhibidoras, tales como TGF-b o altos niveles de p21 y p27 y por inhibidores de proteína cinasa dependiente de ciclinas.2 También existen evidencias de que la matriz extracelular (MEC) tiene funciones de supresión tumoral. El mantenimiento de la membrana basal es una esas funciones, la cual proporciona una barrera física entre las células epiteliales, y el estroma que las rodea y mantiene la polaridad de las células. Asimismo, la MEC produce factores con efecto parácrino, tales como inhibidores de crecimiento, invasión y angiogénesis.4,5
Figura 2.Unidad ducto-lobulillar. En el tejido mamario del adulto las células que expresan ER+/PR+ representan 10% de toda la población de células epiteliales.
CÁNCER DE MAMA
El cáncer de mama puede originarse a partir de cualquier tipo celular que compone al tejido mamario. Sin embargo, los tumores más frecuentes son los que se originan del epitelio que reviste estructuras duc-tales terminales indiferenciadas.6 Por tanto, 80% de todos los tumores malignos corresponden a carcinomas ductales infiltrantes. Se ha propuesto que inicia con una proliferación acelerada, desregulada, de células de la región ducto lobular terminal, llevando a la formación de cúmulos celulares, que después de un tiempo forman un tumor.7
EPIDEMIOLOGÍA DEL CÁNCER MAMARIO
El cáncer de mama representa 23% de todos los casos de cáncer. Es una de las neoplasias más comunes, que afecta con mayor frecuencia a mujeres y es la principal causa de muerte en mujeres de todo el mundo.8 En Estados Unidos, se estimaron 192 370 nuevos casos diagnosticados y 40 170 muertes reportadas en 2009.9 En el caso particular de México, representa 16.4% de todos los casos de cáncer en mujeres. Es de llamar la atención que las mujeres mexicanas desarrollan cáncer de mama una década antes que las europeas o las norteamericanas (51 años vs 63 años, respectivamente).10
ETIOLOGÍA DEL CÁNCER MAMARIO
La etiología del cáncer de mama está directamente asociada a diversos factores de riesgo, como son genéticos, así como relacionados con el estilo de vida, ambientales y hormonales que en conjunto conducen a la desregulación celular.6,8
FACTORES GENÉTICOS
El cáncer de mama es un grupo heterogéneo de enfermedades que albergan diferentes alteraciones genéticas, que se pueden clasificar en diversos subtipos moleculares basadas en los perfiles de expresión de microarreglos de ADN.11 Los subtipos identificados son luminal A (RE+, bajo grado), luminal B (ER+, alto grado), con sobreexpresión del receptor de factor de crecimiento epidérmico-2 (Her2+), el de tipo parecido a tejido mamario normal, tipo basal y bajo en claudina.11 Estos subtipos responden de manera diferente a la terapia, asociándose con diferentes desenlaces y tiempos de supervivencia.12
FACTORES HORMONALES
El desarrollo de cáncer de mama se encuentra íntimamente relacionado con el estado hormonal de las mujeres y el tiempo de exposición. Existen evidencias epidemiológicas de que los esteroides sexuales juegan un papel importante. Se ha observado que mujeres que tienen su primera menstruación antes de 11 años, tienen un riesgo de 10% a 30% mayor de desarrollar cáncer mamario. Mientras que, si se experimenta menopausia después de los 55 años, hay 50% más riesgo de desarrolla cáncer de mama. Por otra parte, estudios epidemiológicos han mostrado de forma consistente que los niveles elevados de estrógenos, progesterona y andrógenos en mujeres posmenopáusicas están relacionados con un aumento en el riesgo de cáncer mamario.4,8 Por su parte, el embarazo antes de los 30 años reduce la incidencia de cáncer mamario. Por el contrario, mujeres que nunca experimentan un embarazo o que tienen su primer hijo después de los 30 años presentan mayor riesgo de desarrollar cáncer mamario.6
MARCADORES PREDICTIVOS DE RESPUESTA A TERAPIA EN CÁNCER DE MAMA
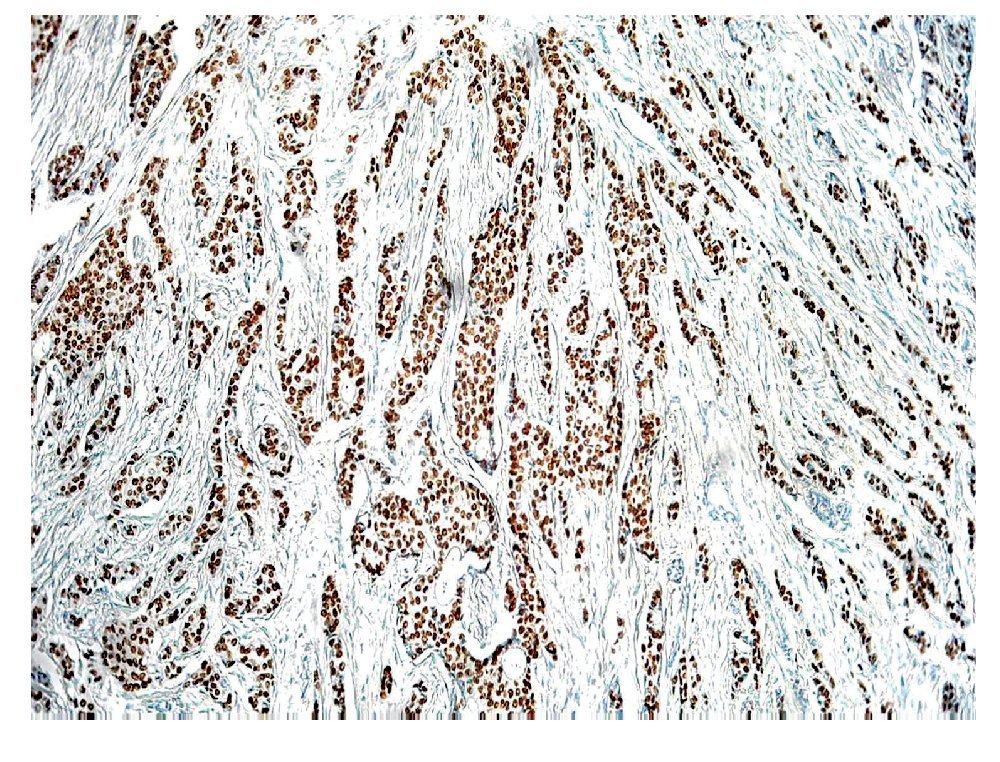
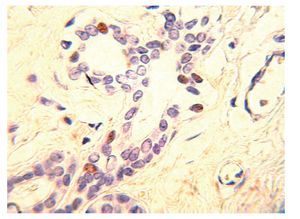
Los RE-a y los RP son biomarcadores predictivos que juegan un papel importante, en la determinación de la terapia de las pacientes con cáncer de mama invasivo. Los RE-a y los RP son débiles factores pronósticos, pero son factores predictivos muy fuertes de respuesta a las terapias endocrinas. Por tanto, actualmente es obligatorio evaluar la expresión del ER y del RP en todos los carcinomas mamarios invasores, con el fin de predecir la respuesta terapéutica. En la práctica actual, la técnica de inmunohistoquímica en tejidos fijados en formalina y embebidos en parafina es el principal método utilizado para evaluar los RE-a y RP. ER-a regula la expresión de RP, por lo que la presencia del RP por lo general, indica que la vía de ER se encuentra funcionalmente intacta. El RP es activado por la hormona progesterona para ayudar a regular varias funciones celulares normales, incluyendo la proliferación celular. EL RP se expresa en los núcleos de 60% a 70% de carcinomas invasores de mama (Figura 3), la expresión puede variar en un continuo que va desde 0% hasta cerca de 100% de células positivas. Existe una correlación directa entre los niveles del RP y la respuesta a la terapia hormonal. Los tumores con niveles aún muy bajos expresión del RP (31%) tienen una importante oportunidad de responder.13 La expresión del RP también se asocia con reducción de la recurrencia local en pacientes con carcinoma ductal in situ, tratadas con lumpectomía y radioterapia seguida de la terapia endocrina.14 En un estudio que comparó a pacientes con carcinoma mamario invasor tratadas con tamoxifeno adyuvante, el riesgo relativo de recurrencia de la enfermedad fue de 28% mayor en las pacientes con REa+/RP- que los casos con tumores RE+/RP+. Distinguir estos resultados significativamente diferentes es la razón principal de que tanto RE-a y RP, se midan en la práctica clínica habitual.15,16
Figura 3. Carcinoma ductal infiltrante. El tumor muestra positividad para receptor de progesterona en 100% de las células neoplásicas.
PAPEL DE LA PROGESTERONA EN CÁNCER DE MAMA
La progesterona es una hormona esteroide implicada en el ciclo menstrual, el embarazo y la embriogénesis.17 Se compone de cuatro hidrocarburos cíclicos interconectados. La progesterona, al igual que todas las demás hormonas esteroides, se sintetiza en pregnenolona, un derivado del colesterol. Se produce principalmente en los ovarios (cuerpo lúteo) y durante el embarazo en la placenta. En las mujeres, los niveles de progesterona en suero tienden a ser <2 ng/mL antes de la ovulación y >5 ng/mL después de la ovulación. Durante el embarazo pueden llegar a ser de 100 a 200 ng/mL.18
Por otra parte, la progesterona es esencial para el desarrollo de la glándula mamaria normal durante la pubertad y en la preparación de la mama para la lactación. Está implicada en el desarrollo y progresión del cáncer de mama. In vitro, tanto estrógenos como progesterona inducen proliferación de líneas celulares derivadas de tumores de mama de seres humanos, mientras que en mujeres posmenopáusicas que tomaron terapia de reemplazo hormonal (TRH) combinada con estrógenos y progesterona, tienen una mayor incidencia de cáncer de mama que las mujeres que sólo tomaron estrógenos.19,20 Estas observaciones implican fuertemente a la progesterona en la etiología de la enfermedad, aunque la acción y los mecanismos moleculares por medio de los cuales la progesterona promueve crecimiento aún no están bien comprendidos.
LA ACCIÓN DE LA PROGESTERONA
La acción de la progesterona está mediada por RP. A través de una vía genómica o no genómica. La vía genómica fue la primera que se estudio, se lleva a cabo directamente en el núcleo de las células. Sin embargo, recientemente se ha identificado una acción no genómica o no transcripcional de la progesterona, mediante mecanismos de transducción de señales a través de receptores de membrana citoplasmática o citoplasma de las células.
ACCIÓN DE LA PROGESTERONA A TRAVÉS DE LA VÍA GENÓMICA
La vía genómica tradicionalmente se conoce como la forma clásica, media la regulación de los procesos de transcripción, que implica la traslocación nuclear y la unión a elementos de respuesta a progesterona (ERP) y en última instancia, conduce a la regulación de la expresión de genes blanco, como son c-myc y el gen de la sintetasa de ácidos grasos. Está primariamente media-da por receptores de alta afinidad. Estos receptores son miembros de la superfamilia de receptores nucleares esteroides, considerados como factores de transcripción activados mediante unión a hormona. El gen del RP se encuentra en el cromosoma 11 q22-23. Presenta tres isoformas como resultado de la transcripción de este gen, y el uso de tres sitios de inicio transcripcional diferentes.21,22 El RP-B es la isoforma larga de la proteína (116 kDa), RP-A es la isoforma truncada que carece de 165 aminoácidos en la región N-terminal (94 kDa) y el RP-C (60 kDa), contiene una región N-terminal larga truncada que interrumpe el dominio de unión al ADN.23 Es así que, sólo RP-A y RP-B contienen componentes críticos para la función del receptor, que incluyen el dominio de unión al ligando (LBD), la región de bisagra (H), dominio de unión al ADN y dos de tres dominios con función activadora (AF).24 Datos experimentales sugieren que las dos isoformas de RP-A y RP-B, tienen funciones diferentes en el crecimiento celular del cáncer de mama. Por otra parte, en la práctica clínica ya se han utilizado anti-progestinas en las pacientes que han fracasado con otras terapias. Se postula que la terapia antiprogestina puede ser adecuada, para pacientes con altos niveles de PR-A.25
Los RP pueden ejercer sus efectos biológicos a través de varios mecanismos potenciales. En ausencia de hor-mona, una gran proporción del RP se encuentra en el citoplasma, formando complejos proteicos con chaperonas y proteínas de choque térmico (Hsp), incluyendo Hsp40, Hsp70 y Hsp90. El incremento del RP nuclear ocurre en presencia de progesterona.26 Una vez que el receptor se une a progesterona o progestinas sintéticas tales como R5020, se liberan y sufren un cambio conformacional, se disocia de las Hsp y se homodimeriza.26 En la forma clásica o directa, este homodímero se transloca al núcleo y se une a ERP en la región promotora de genes blanco regulados por RP. Las isoformas del RP se expresan en respuesta a RE-a, mediante eventos transcripcionales, pero también puede ocurrir en forma independiente al RE.27 En la forma indirecta, el RP con su ligando activa la transcripción de promotores de genes que carecen de ERP, a través de interacciones con otros factores de transcripción, actuando como puente entre factores de transcripción y coactivadores en promotores de genes que codifican para una proteína especifica,26 resultando en cambios en los niveles de RNAm de genes blanco y de sus proteínas, tales como ciclina D1, c-fos y p21.22
ACCIÓN NO GENÓMICA O DIRECTA DE LA PROGESTERONA
La acción esteroide genómica clásica que implica la transcripción de ADN y la síntesis de proteínas, es un proceso relativamente lento que puede tomar horas a días para provocar una respuesta biológica. Sin embargo, muchas acciones de la progesterona se producen en cuestión de segundos o minutos (<30 min). Estas acciones no genómicas, han sido bien reconocidas y estudiadas extensamente durante las últimas décadas.
En la forma no genómica, el RP puede rápidamente estimular el uso de vías de señalización citoplasmática mediada por cinasas.28 Estos efectos biológicos incluyen cambios en la secreción de hormona, el transporte de moléculas pequeñas, activación de canales iónicos y estimulación de enzimas citoplasmáticas tales como MAPK, PKA y PI3K, los cuales no explican la actividad transcripcional del RP.29 La progesterona causa activación de MAPK a través de la activación directa o indirecta de la cinasa c-Src, y la activación de MAPK por expresión de la cinasa de MAPK activa exógena 1 o mediante la activación transcripcional dependiente de ligando del RP. La activación de c-Src/MAPK por RP es mediado indirectamente por la interacción del dominio SH2 de Src, con la fosfotirosina 537 del RE-a.30
CANDIDATOS PARA LOS RECEPTORES DE MEMBRANA DE PROGESTERONA
Interesantemente, en la forma no genómica algunas de las acciones se producen en ausencia del RP nuclear. En este sentido, recientemente se han identificado sitios de unión específicos de progesterona en la membrana celular.31 Actualmente, se reconocen tres formas de RP que median la acción no genómica: 1) los receptores de membrana de progesterona (RPm),32 2) los receptores de progesterona de componente de membrana 1 (PGRMC1),33 y 3) los receptores nucleares de progesterona (NPR).34 Al parecer el RP, también puede residir en la membrana celular externa en un subconjunto de carcinomas mamarios. En la Tabla 1 se resumen las principales características de cada forma de RP.
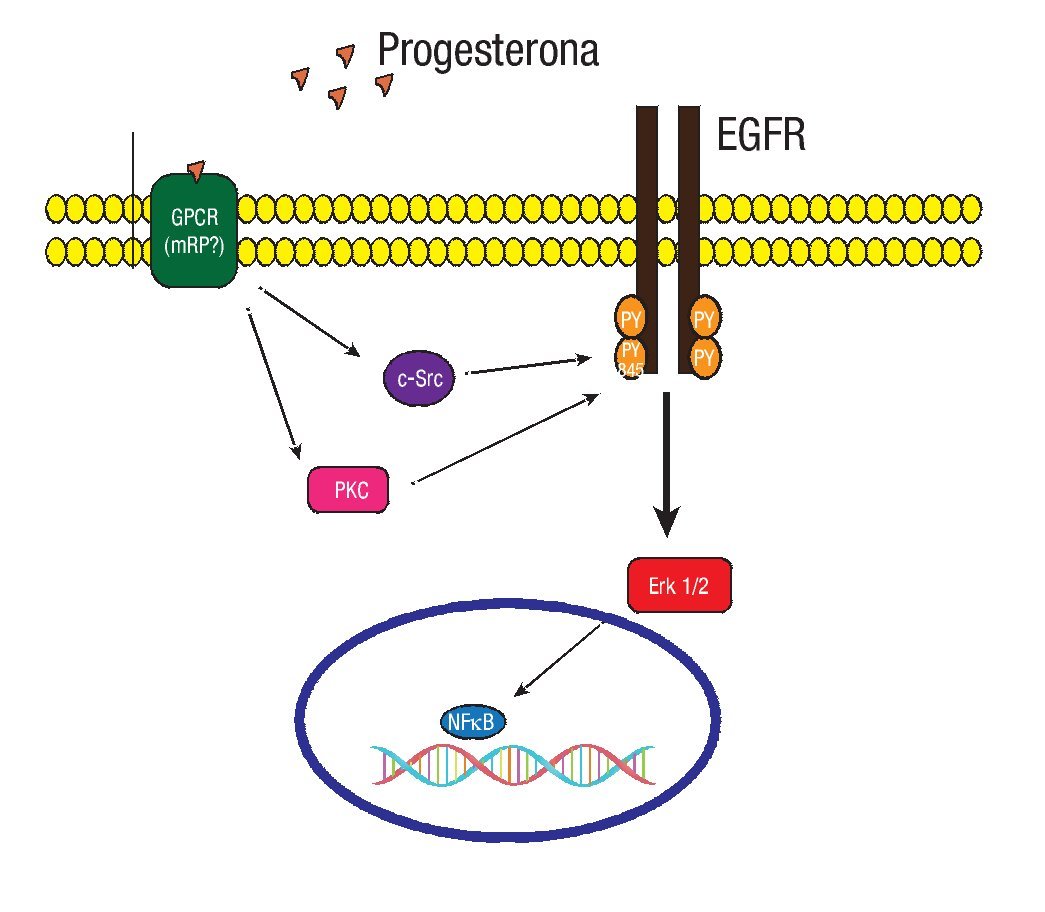
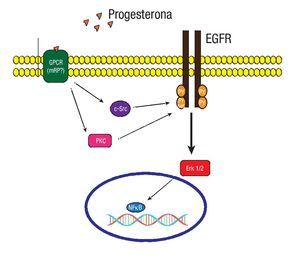
Los RPm recientemente descritos son proteínas que tienen siete dominios transmembranales integrales, que median su función a través de proteínas G acopladas a vías de señalización. Pertenecen a la familia del receptor único de la progesterona y el receptor de adiponectina (PAQR). Se han identificado los subtipos RPma, RPmb y RPmg. Al parecer cada uno con diferentes funciones. Los tres subtipos de receptores han sido detectados en células humanas de cáncer de mama.35 Evidencias experimentales en líneas celulares de cáncer de mama sugieren que la progesterona puede activar vías de señalización a través del receptor del factor de crecimiento epidérmico (EGFR), y de las proteínas G heterotriméricas dependientes del RPm (Figura 4).36
Figura 4. En un modelo experimental con la línea celular MCF-7 de cáncer de mama. La progesterona induce a la activación de la MAPK ERK1/2 a través de la participación de la cinasa Src, dependiente de la transactivación del EGFR y de las proteínas G.
Por su parte, los PGRMCs están compuestos por dos subtipos PGRMC1 y PGRMC2 los cuales tienen un dominio transmembranal individual con homología a Src, que sirve para la activación de segundos mensajeros. Sin embargo, aún no se sabe qué papel juegan en cáncer de mama. Causey y colaboradores37 encontraron que los niveles de RNAm de PGRMC2 se encuentran disminuidos en etapas avanzadas del cáncer de mama. Los NPR clásicos, además de tener actividad transcripcional bien definida, también pueden mediar la rápida activación de vías de señalización. No obstante, los detalles de los mecanismos por los cuales estos tres grupos de RP participan en la biología del cáncer de mama aún no está bien comprendidos.
PERSPECTIVA A FUTURO
Si bien, muchos aspectos de la acción del RP original-mente se han descubierto en modelos animales o en líneas celulares de cáncer de mama. También existen evidencias clínicas que sugieren un papel directo para los RP en cáncer de mama. El estudio de la Iniciativa de Salud de las Mujeres (Women's Health Initiative) y el estudio de un Millón de Mujeres (Million Women Study), demostraron que las mujeres posmenopáusicas que recibieron TRH a base de progesterona en combinación con estrógenos, experimentaron un mayor riesgo relativo de desarrollar cáncer de mama en comparación con las que sólo tomaron estrógenos. Además, los tumores fueron más grandes y de alto grado.38,39 El estudio de un Millón de Mujeres también encontró que las mujeres que tomaban TRH en el momento del diagnóstico, mostraron un mayor riesgo para morir por cáncer de mama. Los datos preclínicos sugieren fuertemente un papel importante de los RP, en la biología del cáncer de mama. Por tanto, es necesaria la validación de estos hallazgos para establecer una estrategia clínica para bloquear la función de los RP en cáncer de mama en humanos.
En conclusión, los estudios epidemiológicos, los datos clínicos y las evidencias experimentales sugieren que la progesterona juega un papel importante en el desarrollo y progresión del cáncer de mama. Esto abre la posibilidad del uso de nuevas terapias alternas, como es el uso de antiprogestinas en combinación con el tamoxifeno en un subgrupo de pacientes con cáncer de mama.
Correspondencia:
Dr. Fernando Candanedo-González.
Departamento de Patología, Hospital de Oncología, Centro Médico Nacional Siglo XXI, IMSS.
Av. Cuauhtémoc 330, Colonia Doctores.
C.P. 06720. México D.F., México.
Teléfono: 5627 6900, extensión 22733. Fax: (55) 5513 5395.
Correo electrónico: fcandanedo@hotmail.com