El acetaldehído asociado con el consumo crónico de bebidas alcohólicas y el tabaco ha sido recientemente clasificado como un carcinógeno del grupo 1 para los seres humanos. Los microbios se consideran responsables de la mayor parte de la producción de acetaldehído derivado del etanol, tanto en la saliva como en el jugo gástrico de pacientes con aclorhidria o infectados por Helicobacter pylori. El acetaldehído es el carcinógeno más abundante en el humo del tabaco y fácilmente se disuelve en la saliva durante el fumar. Muchos productos alimenticios y bebidas no alcohólicas son fuentes importantes, pero no reconocidas, de la exposición a acetaldehído. El riesgo acumulado para cáncer, asociado con el aumento de la exposición a acetaldehído, señala la necesidad de una detección a nivel mundial de los niveles de etanol y acetaldehído de bebidas alcohólicas y de alimentos producidos a través de fermentación. Los grupos de riesgo, como pacientes con polimorfismos del gen de las enzimas alcohol deshidrogenasa (ADH) y acetaldehído deshidrogenasa 2 (ALDH2), infectados por Helicobacter pylori o con gastritis atrófica o aclorhidria, deben ser evaluados y educados en este problema de salud. Las formulaciones de L-cisteína para remover el acetaldehído carcinogénico a nivel local, como en el estómago, representan nuevas intervenciones terapéuticas que deben ser estudiadas.
Acetaldehyde, associated with chronic consumption of alcoholic beverages and smoking, has recently been classified as a Group 1 carcinogen to humans. Microbes are responsible for the bulk of acetaldehyde production from ethanol both in saliva and gastric juice in Helicobacter pylori-infected and achlorhydria patients. Acetaldehyde is the most abundant carcinogen in tobacco smoke, and it readily dissolves in the saliva during smoking. Many foodstuffs and ‘non-alcoholic’ beverages are significant but unrecognised sources of local acetaldehyde exposure. The cumulative cancer risk associated with increasing acetaldehyde exposure suggests the need for worldwide screening of the acetaldehyde levels of alcoholic beverages, as well of the ethanol and acetaldehyde of food produced by fermentation. Risk groups with alcohol dehydrogenase (ADH)-and aldehyde dehydrogenase 2 (ALDH2) gene polymorphisms, H. pylori infection or achlorhydria atrophic gastritis, or both, should be screened and educated in this health issue. L-cysteine formulations binding carcinogenic acetaldehyde locally in the stomach provide new means for intervention studies.
La identificación de factores etiológicos específicos, posibles grupos de riesgo y mecanismos carcinogenéticos es esencial para la prevención del cáncer1. Por ejemplo, se conoce que en los países occidentales el alcohol y el tabaco son los principales factores de riesgo para las neoplasias de cavidad oral, pulmón, faringe y esófago2. Además, existe evidencia convincente que señala que el tabaco es un factor de riesgo independiente también para el cáncer de estómago3,4 y el alcohol es un factor de riesgo significativo para el cáncer colorrectal5. En octubre de 2009, la Agencia Internacional para la Investigación del Cáncer (IARC) de la Organización Mundial de la Salud (OMS) concluyó que el acetaldehído (asociado con la ingesta de bebidas alcohólicas) es carcinógeno para los seres humanos (grupo 1). Por otra parte, la IARC declaró que la exposición a acetaldehído es resultado de la producción de este a partir del consumo de alcohol y de la formación endógena de etanol6.
¿Qué es el acetaldehído?El acetaldehído (CH3CHO) es un componente volátil, potente y genotóxico, el cual es sintetizado y detoxificado por la aldehído deshidrogenasa (ALDH), que ha sido utilizado como saborizante de alimentos y bebidas7. Surge como subproducto de la fermentación de la levadura durante la producción de bebidas alcohólicas y, mientras que el azúcar es el sustrato primario de la formación de acetaldehído, el metabolismo de los aminoácidos como alanina o la oxidación de etanol también contribuyen a la formación de acetaldehído8.
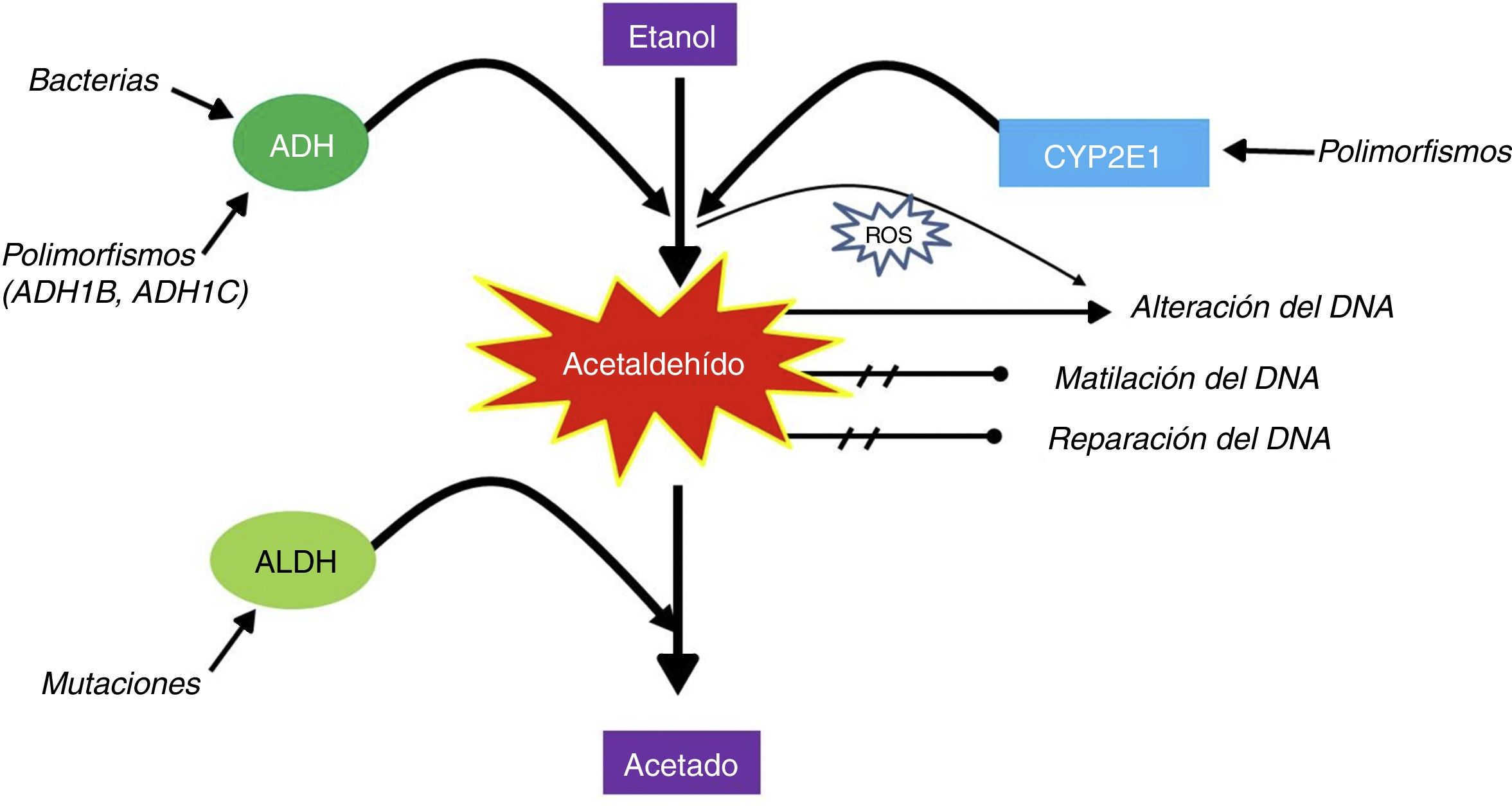
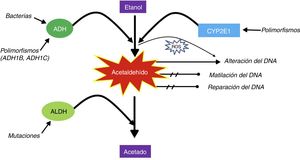
Bajo condiciones anaeróbicas, los microbios que contienen alcohol deshidrogenasa (ADH) son capaces de producir energía a partir de glucosa, esto a través de la fermentación alcohólica. Sin embargo, bajo condiciones aeróbicas o microaeróbicas, la última reacción química mediada por ADH puede dirigirse en dirección opuesta y tener como producto final acetaldehído9–11 (fig. 1)12. La existencia de mutaciones a nivel de polimorfismos de nucleótido único de ADH1B, ADH1C y ALDH2 hacen que la cantidad de la producción o la oxidación del acetaldehído tenga variaciones entre los individuos. Además, la isoenzima CYP2E1 (la cual es inducible por la ingesta crónica de etanol) también tiene polimorfismos de nucleótido único que afectan la actividad enzimática. El aumento de la actividad CYP2E1 no solo conduce a una mayor generación de especies reactivas de oxígeno, sino también a un aumento de la activación de varios procarcinógenos ambientales, presentes en el humo de tabaco y en ciertas dietas, tales como los hidrocarburos policíclicos, hidrazinas y nitrosaminas que requieren CYP2E1 para ser activados. La CYP2E1 también disminuye los niveles tisulares de retinol y ácido retinoico, que tienen funciones importantes en la regulación del crecimiento celular y la transdiferenciación. El acetaldehído puede unirse al ADN, formando aductos estables y especies reactivas de oxígeno. La oxidación del etanol por la catalasa parece ser de importancia secundaria12.
También se ha demostrado que se puede formar acetaldehído a partir de etanol en situaciones in vitro (a través de la incubación de lo obtenido en lavados broncopulmonares), y en experimentos in vivo (a partir de voluntarios que utilizaron enjuagues bucales con etanol). En ambas situaciones se sospechó una fermentación de origen bacteriano13. Esta teoría se comprobó al proveer, previamente al estudio, un enjuague bucal con clorhexidina, que redujo el contenido de bacterias en la cavidad oral y, por lo tanto, redujo de forma significativa la producción de acetaldehído14.
Acetaldehído y su papel precancerígenoEl papel precancerígeno del etanol aún no está establecido, a pesar de que se ha postulado que el etanol actúa como un solvente capaz de incrementar la penetración de sustancias corrosivas o precancerígenas. Sin embargo, su primer metabolito, el acetaldehído, ha mostrado características mutagénicas y carcinogénicas en estudios in vitro e in vivo tanto en animales15,16 como en células procariotas y eucariotas17. En estudios previos se ha comprobado que el daño ocurre con concentraciones estimadas de 40 a 1,000μM de acetaldehído, dosis que son similares a las encontradas en bebidas alcohólicas9.
Este compuesto ha mostrado ser capaz de causar mutaciones de punto o de formar enlaces covalentes con el ADN, dando como resultado final carcinogénesis18. Se considera que interfiere con los mecanismos de reparación del ADN a través de la inhabilitación de la enzima O6-metilguanina transferasa, que es sumamente importante en la reparación del daño causado por agentes alcalinizantes e induce mutaciones en el gen supresor tumoral TP53. Dicha alteración genética es bastante común en el desarrollo de diversos tipos de cáncer en humanos, especialmente en el esofágico19 e incluso se ha relacionado con cáncer de mama20,21.
En estudios recientes se ha demostrado que el acetaldehído puede causar modificaciones mutagénicas celulares a partir de una concentración de 100μM o más18. Basados en estudios realizados previamente, se ha concluido que el acetaldehído interfiere con los mecanismos de checkpoint del ADN, al inhibir las respectivas enzimas reparadoras.
El enlace covalente de ADN y la formación de aductos estables es uno de los mecanismos por los cuales el acetaldehído podría desatar la ocurrencia de errores de replicación en oncogenes22. Así mismo, de acuerdo con estudios previos se cree que puede interferir con la reparación de ADN al inhibir la O6-metilguaninatransferasa23. Además, se ha demostrado que el acetaldehído causa mutaciones puntuales en la guanina-hipoxantina-fosforiltransferasa en los linfocitos humanos24. De la misma forma, se ha considerado que puede inducir cambios de tipo «hermana-hermana» en las cromátides y grandes aberraciones cromosomales25.
Incluso se han realizado estudios in vitro con células de tipo CACO-2, donde se demostró que hay una disminución de los bordes en cepillo celulares y disminución en la actividad enzimática, la cual puede afectar propiedades celulares tales como la velocidad de proliferación y la diferenciación celular26,27.
Igualmente, se han estudiado las deficiencias en enzimas características de ciertos grupos poblacionales, por lo que se sabe que las mutaciones en el gen ADH y ALDH2, las cuales afectan a millones de personas en el mundo, proporcionan un excelente modelo de estudio en humanos acerca de la exposición a acetaldehído28. Una mutación puntual en el gen del ALDH2da como resultado una enzima con una marcada deficiencia para remover el primer metabolito de la oxidación del etanol: el acetaldehído29. Las personas con deficiencia homocigota de ALDH2 (menos del 5% de la población en Asia) evitan el alcohol por el efecto que ocurre una vez iniciado su consumo (experimentan un cuasiefecto «antabuse» [sonrojo, taquicardia, náuseas])30, mientras que aquellas con deficiencia heterocigota de ALDH2 pueden adaptarse y consumir alcohol en cantidades de moderadas a excesivas31. Algunos estudios epidemiológicos en genética demuestran que los individuos heterocigotos portadores del genotipo mutado ALDH2 tienden sustancialmente al desarrollo de cáncer esofágico relacionado con el consumo de alcohol32,33. Los portadores de este genotipo procesan el acetaldehído de forma más lenta, lo que contribuye al aumento de los niveles de este en sangre, posteriormente a la ingesta de alcohol34,35. Estudios recientes han mostrado que los individuos con mutación en la enzima ALDH2 tienen 2 o 3 veces mayor nivel de acetaldehído en saliva, esto posterior a la ingesta moderada de alcohol in vivo, en comparación con los niveles que se podrían encontrar en alguien con ALDH2 normal28. Por lo tanto, los bebedores crónicos con deficiencia de ALDH2 están expuestos por años o décadas a mayores niveles locales de acetaldehído que alguien con genotipo ALDH2 normal36.
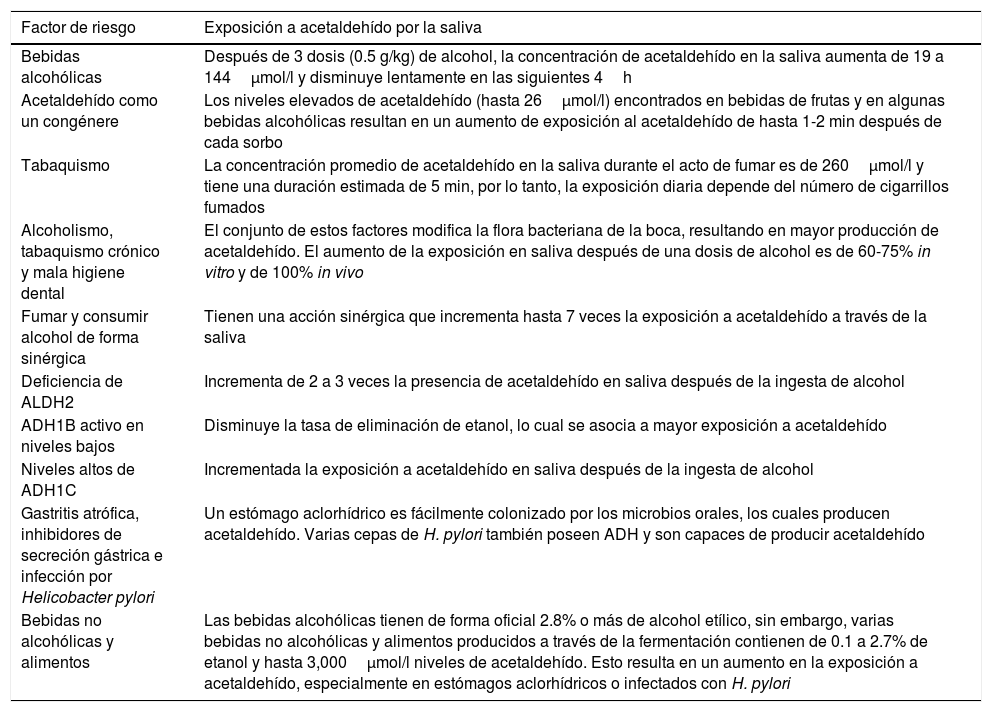
Por último, se ha estudiado de forma intensiva la relación con el consumo crónico de alcohol y tabaco, y se ha concluido que son circunstancias que modifican la flora de la cavidad bucal, la cual puede metabolizar más etanol y modificar el contenido de acetaldehído en la cavidad oral. Igualmente los malos hábitos higiénicos orales y algunos factores ambientales y nutritivos son considerados factores de riesgo importantes, especialmente en países en vías de desarrollo37,38 (tabla 1).
Exposición a acetañdehído por la saliva
| Factor de riesgo | Exposición a acetaldehído por la saliva |
|---|---|
| Bebidas alcohólicas | Después de 3 dosis (0.5 g/kg) de alcohol, la concentración de acetaldehído en la saliva aumenta de 19 a 144μmol/l y disminuye lentamente en las siguientes 4h |
| Acetaldehído como un congénere | Los niveles elevados de acetaldehído (hasta 26μmol/l) encontrados en bebidas de frutas y en algunas bebidas alcohólicas resultan en un aumento de exposición al acetaldehído de hasta 1-2 min después de cada sorbo |
| Tabaquismo | La concentración promedio de acetaldehído en la saliva durante el acto de fumar es de 260μmol/l y tiene una duración estimada de 5 min, por lo tanto, la exposición diaria depende del número de cigarrillos fumados |
| Alcoholismo, tabaquismo crónico y mala higiene dental | El conjunto de estos factores modifica la flora bacteriana de la boca, resultando en mayor producción de acetaldehído. El aumento de la exposición en saliva después de una dosis de alcohol es de 60-75% in vitro y de 100% in vivo |
| Fumar y consumir alcohol de forma sinérgica | Tienen una acción sinérgica que incrementa hasta 7 veces la exposición a acetaldehído a través de la saliva |
| Deficiencia de ALDH2 | Incrementa de 2 a 3 veces la presencia de acetaldehído en saliva después de la ingesta de alcohol |
| ADH1B activo en niveles bajos | Disminuye la tasa de eliminación de etanol, lo cual se asocia a mayor exposición a acetaldehído |
| Niveles altos de ADH1C | Incrementada la exposición a acetaldehído en saliva después de la ingesta de alcohol |
| Gastritis atrófica, inhibidores de secreción gástrica e infección por Helicobacter pylori | Un estómago aclorhídrico es fácilmente colonizado por los microbios orales, los cuales producen acetaldehído. Varias cepas de H. pylori también poseen ADH y son capaces de producir acetaldehído |
| Bebidas no alcohólicas y alimentos | Las bebidas alcohólicas tienen de forma oficial 2.8% o más de alcohol etílico, sin embargo, varias bebidas no alcohólicas y alimentos producidos a través de la fermentación contienen de 0.1 a 2.7% de etanol y hasta 3,000μmol/l niveles de acetaldehído. Esto resulta en un aumento en la exposición a acetaldehído, especialmente en estómagos aclorhídricos o infectados con H. pylori |
La exposición a acetaldehído a partir de orígenes ambientales y genéticos se considera acumulativa e incluye, por lo general, todos los factores de riesgo conocidos para cáncer del tracto digestivo38,39.
Muchas bebidas, bebidas alcohólicas y alimentos contienen altas cantidades de acetaldehído, sin embargo, su rol como carcinógenos aún debe ser estudiado; la concentración de acetaldehído en algunos alimentos y bebidas aún no se reporta, porque es «generalmente considerado seguro»39. Debido a esto, se pueden encontrar alimentos con niveles permisibles de acetaldehído, tales como yogur, kéfir, jugo de manzana, productos con soya, tofu, vegetales fermentados y vinagre, entre otros40.
Algunos alimentos producidos a partir de la fermentación pueden contener de 0.1 a 2.5% de etanol o concentraciones mutagénicas de acetaldehído, casi comparables a los 2.8% encontrados en bebidas alcohólicas9. Inclusive, se considera la producción de acetaldehído a partir de algunas frutas, y su uso como aditivo para alimentos y como agente aromático40.
Ingesta de alcohol y acetaldehídoLa microflora de la cavidad oral es el determinante principal de la concentración de acetaldehído en la saliva, pero la fuente principal de acetaldehído es el etanol. El etanol entra a la cavidad oral después de cada sorbo de alcohol, donde la microbiota de la cavidad oral lo metaboliza de forma casi instantánea en acetaldehído. Esta producción puede durar hasta 10 min. La alta concentración de etanol en bebidas alcohólicas resulta en un pico incrementado de acetaldehído, por lo tanto, en mayor tiempo de exposición6.
Después de su consumo oral, el alcohol es absorbido en el sistema portal desde el estómago e intestino delgado; acto seguido es transportado por la circulación; posteriormente al consumo de alcohol, debido a su alto nivel de solubilidad, el etanol es distribuido de forma equitativa en el cuerpo humano28, por lo que el contenido de este en saliva y colon es equiparable al encontrado en el torrente sanguíneo e hígado, donde es procesado y convertido en acetaldehído41. Sin embargo, comparado con el hígado, el aclaramiento de acetaldehído en saliva y colon es limitado, lo que resulta en niveles de concentración que son considerados precancerígenos para el aparato digestivo42.
Bajo condiciones normales no es posible medir la cantidad de acetaldehído en la saliva, sin embargo, concentraciones consideradas cancerígenas pueden ser encontradas en la cavidad oral de forma casi instantánea tras la ingesta de 5mL o más de una bebida alcohólica43.
Se cree que, a nivel celular, una concentración de alcohol superior al 20% puede llegar a dañar la membrana mucosa, lo cual puede predisponer a una división celular acelerada y regeneración, la cual, subsecuentemente, puede desatar errores en la replicación de ADN44,45
En experimentos con animales se ha demostrado que la ingesta de alcohol de forma crónica causa hiperplasia e hiperproliferación celular en lengua, epiglotis y estómago. Por otro lado, se demostró que de forma inhalada ocurren cambios celulares considerados precancerígenos en la mucosa nasal y laríngea46,47.
Hace más de 17 años se manifestó que el riesgo de cáncer del tracto digestivo superior se incrementa hasta 10 veces en personas que consumen alcohol de forma crónica32 y recientemente la evidencia epidemiológica mostró un riesgo relativo de 1.32/100g de ingesta diaria de alcohol para la asociación entre consumo de alcohol y cáncer gástrico48. Sin embargo, también se ha manifestado que las personas con una deficiencia de ALDH tienen niveles más altos de acetaldehído en la sangre y saliva después de la ingesta de alcohol.
Tabaquismo y acetaldehídoEn un estudio realizado en Estados Unidos, el consumo de tabaco se asoció con un aumento de riesgo de cáncer esofágico (adenocarcinoma y de células escamosas)49, así como con cáncer del cardias. Si bien la relación específica entre cáncer esofágico, tabaquismo y acetaldehído no se encuentra bien estudiada, el acetaldehído también se encuentra en el humo del tabaco, el cual es un agente altamente soluble en agua y, por lo tanto, se disuelve en la saliva, la cual da una concentración de 250 μM, que perdura mientras se continúe fumando. Actualmente se sabe que el riesgo relativo de cáncer oral, faríngeo y laríngeo es de 3.9 en personas que consumen 10-19g/día y de 15.4 en personas que fuman más de 30g al día de tabaco. Se estima que el riesgo de cáncer oral es 7-10 veces más alto en fumadores que en personas que nunca han fumado50.
Acetaldehído en el tracto digestivoAlgunos microbios natos de la cavidad oral son capaces de metabolizar el etanol en acetaldehído, pero su capacidad de aclaramiento es limitada, esto lleva a la acumulación de acetaldehído en la saliva después del consumo de alcohol o tabaco. Después, a través del mecanismo de deglución, el acetaldehído presente en la saliva se transporta a la mucosa de la faringe, al esófago y, por consiguiente, al estómago51. Intervienen en el acto otros factores como lo es la calidad de la higiene en cavidad bucal y el grado de consumo de bebidas alcohólicas52,53.
La mucosa de la cavidad oral y el esófago han demostrado tener alta función de K ADH, pero carecen de actividad de K ALDH2, factores que favorecen la acumulación de acetaldehído en la saliva y en el tracto digestivo superior. Durante el consumo de alcohol un importante mecanismo es la formación de acetaldehído local por la microbiota oral o intestinal, cuyo papel carcinogénico es independiente de los niveles encontrados en sangre. A nivel celular se inducen respuestas importantes, las cuales se cree que están implicadas en el desarrollo de cáncer. Esto explica la predilección de este metabolito en el cáncer del tracto gastrointestinal superior y en diversos tumores de cabeza y cuello10,28.
La formación de acetaldehído a partir de etanol de forma microbiana comienza en la cavidad oral en segundos y hasta 10 min después de cada trago de bebida alcohólica o alimento que contenga etanol o acetaldehído. Dependiendo de la capacidad de vaciamiento gástrico, del nivel de infección por Helicobacter pylori (H. pylori) o de un estómago aclorhídrico, este puede estar expuesto a este mecanismo de acetaldehído por horas54.
Gastritis atrófica, infección por Helicobacter pylori y acetaldehídoUno de los factores de riesgo más importantes para cáncer gástrico es la existencia de una gastritis atrófica, ya sea por infección por H. pylori o por un desorden autoinmune55; muchas teorías de los mecanismos patogénicos detrás del riesgo de cáncer gástrico en pacientes con gastritis atrófica han sido publicadas, pero no hay una explicación final.
Sin embargo, una de las teorías mejor establecidas señala que una disminución en la secreción de ácido gástrico se encuentra relacionada con la mayor colonización de microbios en el jugo gástrico56, y que esto se debe a que la atrofia facilita la colonización de la cavidad estomacal por bacterias orales, asociándose a la producción endógena de acetaldehído derivado, ya sea de etanol o de fermentación de glucosa. El sobrecrecimiento bacteriano en el cuerpo gástrico y en el duodeno es un hallazgo común dentro de las personas que consumen inhibidores de la bomba de protones o inhibidores H2 a largo plazo. Situación que también ha sido observada en la gastritis atrófica57,58.
En situaciones como el sobrecrecimiento bacteriano o infección por levaduras se cree que la producción de etanol endógeno en el intestino a través de la fermentación es mediada por la producción de ADH por la microflora. Esta teoría ha sido confirmada bajo condiciones tanto aeróbicas como anaeróbicas, y se sabe que, ante la presencia de alcohol, la ADH producida por la microflora intestinal activa una reacción en dirección opuesta, que resulta en una producción marcada de acetaldehído, en estudios in vitro e in vivo con animales y humanos59–61.
Väkeväinen et al.55, en un estudio in vivo, demostraron en 5 voluntarios sanos y en 7 pacientes con gastritis atrófica que después de una infusión por vía nasogástrica de etanol, la concentración de acetaldehído era de 4.5 veces (a los 30 min) y 6.5 veces (a los 60 min) mayor en los pacientes con gastritis que en los controles. En este mismo estudio también se analizaron las concentraciones in vitro de acetaldehído en jugo gástrico posteriores a la incubación con etanol obtenidas de 14 pacientes y 16 controles y se encontró que hubo una diferencia de 7.6 veces más en los pacientes que en los controles. Otro hallazgo interesante fue el hecho de que una amplia selección de especies de bacterias provenientes de la cavidad oral, enterobacterias y levaduras fueron encontradas en el jugo gástrico. Los autores concluyen que la inducción microbiana de acetaldehído a partir de etanol puede ser un cofactor en el desarrollo de cáncer gástrico en pacientes con gastritis atrófica.
Como se mencionó anteriormente, la eliminación de acetaldehído puede depender de cuestiones genéticas como la deficiencia de ALDH2 (presente en el 30-50% de la población asiática oriental), lo que incrementa de forma significativa el riesgo para los cánceres del tracto digestivo superior, cabeza y cuello. Sin embargo, la evidencia en cáncer de estómago es limitada. Maejima et al.62, en un estudio excepcional, evaluaron a 10 pacientes con actividad normal de ALDH2 y a 10 sujetos deficientes de ALDH2, a los cuales se les midió la concentración de acetaldehído en 3 situaciones: 1) basal), 2) posterior a la administración de rabeprazol 10 mg b.i.d por 7 días y 3) antes y después de la administración de cápsulas de 200 mcg de L-cisteína y una infusión con etanol. En este estudio se demostró por primera vez que la deficiencia de ALDH2 resulta en aumento notable de la exposición de la mucosa gástrica a acetaldehído después de la administración intragástrica de alcohol (5.6 veces más que en los no deficientes). Este hallazgo proporciona evidencia concreta de una relación causal entre el acetaldehído y la carcinogénesis gástrica. Una explicación plausible es que el primer paso en la metabolización del alcohol se realiza en el estómago, ya que la mucosa gástrica expresa la enzima ADH, que cataliza la oxidación del etanol a acetaldehído, especialmente a las altas concentraciones de etanol que prevalecen en el estómago después de terminado el consumo de bebidas alcohólicas55,63. La mucosa gástrica también posee la enzima ALDH2, indispensable para la eliminación de acetaldehído. En los pacientes deficientes de ALDH2, la eliminación de acetaldehído derivado del etanol se reduce, lo que resulta en su acumulación en el jugo gástrico. También los autores demuestran que, además de la deficiencia de la enzima ALDH2, el uso de inhibidor de la bomba de protones causa cambios independientes en los niveles de acetaldehído (de 1.5 a 3 veces más) y jugo gástrico salival, lo que indica que el acetaldehído intragástrico es regulado a nivel local por las enzimas de la mucosa gástrica, pero también por bacterias que colonizan un estómago con aclorhidria.
Así pues, la intervención del acetaldehído en esta cascada de progresión a cancér gástrico (gastritis atrófica-metaplasia-displasia-cáncer) puede ser determinante,; sin embargo, en la actualidad es muy poco conocido este concepto.
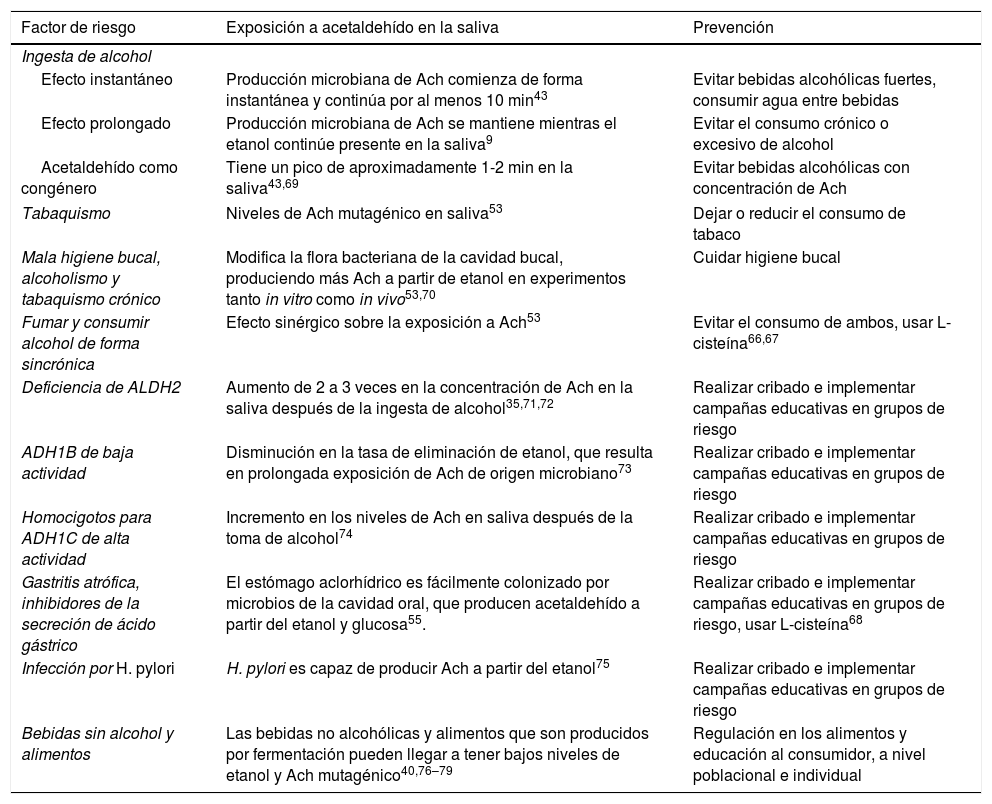
¿Cómo disminuir la exposición a acetaldehído?La exposición a acetaldehído puede reducirse notablemente tanto a nivel individual como a nivel poblacional. Es importante recordar que en ambos casos la exposición a acetaldehído es acumulativa y depende tanto del medio ambiente como de factores genéticos64 (tabla 2). A nivel poblacional restringir, limitar y disminuir el consumo de tabaco y alcohol debe seguir siendo la medida más importante. Por otra parte, debería ser prioritario implementar medidas de regulación y orientación de los consumidores en todo el mundo, para la detección de los niveles de etanol y acetaldehído de miles de bebidas y productos alimenticios. La higiene oral se puede mejorar en muchos aspectos, sobre todo en los consumidores crónicos de alcohol y tabaco. Debe también hacerse hincapié en la identificación de los grupos de alto riesgo como aquellos con polimorfismos del gen ADH y ALDH2. Los pacientes con gastritis atrófica, hipo- o aclorhidria deberían someterse a un tamizaje pero también habría que concienciarlos sobre los posibles riesgos que conlleva una exposición acumulativa de acetaldehído64.
Exposición carcinógena a acetaldehído y acciones preventivas
| Factor de riesgo | Exposición a acetaldehído en la saliva | Prevención |
|---|---|---|
| Ingesta de alcohol | ||
| Efecto instantáneo | Producción microbiana de Ach comienza de forma instantánea y continúa por al menos 10 min43 | Evitar bebidas alcohólicas fuertes, consumir agua entre bebidas |
| Efecto prolongado | Producción microbiana de Ach se mantiene mientras el etanol continúe presente en la saliva9 | Evitar el consumo crónico o excesivo de alcohol |
| Acetaldehído como congénero | Tiene un pico de aproximadamente 1-2 min en la saliva43,69 | Evitar bebidas alcohólicas con concentración de Ach |
| Tabaquismo | Niveles de Ach mutagénico en saliva53 | Dejar o reducir el consumo de tabaco |
| Mala higiene bucal, alcoholismo y tabaquismo crónico | Modifica la flora bacteriana de la cavidad bucal, produciendo más Ach a partir de etanol en experimentos tanto in vitro como in vivo53,70 | Cuidar higiene bucal |
| Fumar y consumir alcohol de forma sincrónica | Efecto sinérgico sobre la exposición a Ach53 | Evitar el consumo de ambos, usar L-cisteína66,67 |
| Deficiencia de ALDH2 | Aumento de 2 a 3 veces en la concentración de Ach en la saliva después de la ingesta de alcohol35,71,72 | Realizar cribado e implementar campañas educativas en grupos de riesgo |
| ADH1B de baja actividad | Disminución en la tasa de eliminación de etanol, que resulta en prolongada exposición de Ach de origen microbiano73 | Realizar cribado e implementar campañas educativas en grupos de riesgo |
| Homocigotos para ADH1C de alta actividad | Incremento en los niveles de Ach en saliva después de la toma de alcohol74 | Realizar cribado e implementar campañas educativas en grupos de riesgo |
| Gastritis atrófica, inhibidores de la secreción de ácido gástrico | El estómago aclorhídrico es fácilmente colonizado por microbios de la cavidad oral, que producen acetaldehído a partir del etanol y glucosa55. | Realizar cribado e implementar campañas educativas en grupos de riesgo, usar L-cisteína68 |
| Infección por H. pylori | H. pylori es capaz de producir Ach a partir del etanol75 | Realizar cribado e implementar campañas educativas en grupos de riesgo |
| Bebidas sin alcohol y alimentos | Las bebidas no alcohólicas y alimentos que son producidos por fermentación pueden llegar a tener bajos niveles de etanol y Ach mutagénico40,76–79 | Regulación en los alimentos y educación al consumidor, a nivel poblacional e individual |
Ach: acetaldehído.
Desde el punto de vista farmacológico, se ha demostrado que la L-cisteína, un aminoácido no esencial, puede reaccionar covalentemente con el acetaldehído carcinogénico para formar una molécula más estable, la cual no es tóxica, el 2-metil-tiazolidina-4-ácido carboxílico65. Este compuesto inerte y no tóxico es eliminado del cuerpo a través de las heces y la orina, sin ser absorbido en la circulación sanguínea.
Varias formulaciones de L-cisteína se han probado con la finalidad de disminuir el potencial tóxico del acetaldehído. Por ejemplo, una tableta masticable que libera lentamente cisteína es capaz de remover hasta 2/3 del acetaldehído salival derivado de las bacterias de la cavidad oral después de la ingesta de alcohol66. En otro estudio del mismo grupo de autores, se vio que el uso de una goma de mascar que contiene 5mg de L-cisteína es capaz de eliminar el acetaldehído casi en su totalidad después de fumar67. Más recientemente se ha demostrado que cápsulas de 100mg de L-cisteína pueden usarse para disminuir las concentraciones de acetaldehído en el jugo gástrico de pacientes con aclorhidria o gastritis atrófica68.
Se ha demostrado que la administración de esta formulación es capaz de disminuir hasta un 63% la concentración de acetaldehído comparada con el placebo.
ConclusionesEl acetaldehído derivado de la oxidación microbiana o de la mucosa proveniente del humo del tabaco, de las bebidas alcohólicas o de los alimentos interactúa con en el tracto digestivo superior de los humanos y produce un efecto carcinógeno acumulativo. Medidas de prevención, detección y tratamiento oportuno en sujetos de alto riesgo ante la exposición de este carcinógeno tipo I deberían implementarse y difundirse.
El etanol se metaboliza a acetaldehído vía la ADH y vía la citocromo P450 2E1 (CYP2E1). Posteriormente, el acetaldehído se metaboliza vía la ALDH a un acetato, el cual no es tóxico. La metabolización de ADH a acetaldehído puede estar mediada por bacterias y depende de polimorfismos; por ejemplo, la cinética de producción es diferente entre los sujetos ADH1B y ADH1C. El acetaldehído se considera tóxico, carcinogénico y mutagénico por sus efectos directos sobre inhibir la reparación y metilación del ADN, además de tener un efecto directo sobre este. Además, la oxidación de acetaldehído mediante la CYP2E1 produce especies reactivas de oxígeno5 que afectan el ADN.
Conflicto de interesesDr. José María Remes-Troche es Miembro del Consejo Asesor de Takeda Pharmaceuticals, Alfa-Wasserman y Janssen. Ponente para Nycomed-Takeda, Astra-Zeneca y Bristol-Myers-Squibb. Los demas autors no tienen conflictos de interés.