¿ INTRODUCCIÓN
Se ha demostrado en estudios previos que el letrozol y el tamoxifeno, son efectivos como fármacos en mujeres posmenopáusicas con tumores localmente avanzados, etapa III y hormonodependientes. Investigamos el papel del letrozol y del tamoxifeno, como terapia neoadyuvante. Presentamos un avance del estudio comparativo realizado en un Hospital General de Zona del IMSS, a mujeres con cáncer de mama. El objetivo de este trabajo fue demostrar la bondad de la hormonoterapia utilizada en forma de inducción o neoadyuvante, precisamente en aquellas mujeres posmenopáusicas, con etapas de la enfermedad, localmente avanzada y con receptores hormonales, tanto de estrógeno como de progesterona, positivos.
¿ OBJETIVO
Presentar la frecuencia de respuesta objetiva, clínica completa y la respuesta patológica completa con el uso de hormonoterapia neoadyuvante (HTNA) en mujeres posmenopáusicas (PM) con cáncer de mama (CA mama), localmente avanzado (etapas II y III).
¿ MATERIAL Y MÉTODO
En el Hospital General de Zona N° 57 del IMSS, previa aceptación por el comité local de investigación, el comité de ética y recabadas las firmas de consentimiento informado para el protocolo por parte de las pacientes posmenopáusicas con diagnóstico de cáncer de mama incluidas, se desarrolló un meta-análisis en 40 pacientes con cáncer de mama, etapas II y III, tratadas en un estudio prospectivo, doble ciego, utilizando todas las pacientes con estirpe de canalicular infiltrante, con reportes receptores hormonales de estrógeno y progesterona mayores de 30%. Se utilizaron dos grupos al azar; los fármacos para hormonoterapia de inducción o neoadyuvante, administrados durante 36 meses consecutivos fueron 20 pacientes con tamoxifeno, conocido ampliamente como modulador selectivo de receptores de estrógeno, a dosis de 20 mg diarios, por vía oral. El otro grupo recibió letrozol: 20 pacientes, a dosis de 2 mg diarios, vía oral. Se tomaron reportes al inicio, posterior a tres, seis y doce meses, para evaluar la frecuencia de respuestas completas. Las pacientes quienes no mostraron respuesta a la terapia neoadyuvante con letrozol ni con tamoxifeno, fueron sometidas a tratamiento con radioterapia. Las enfermas que mostraron respuesta parcial por patología o respuesta clínica parcial, fueron candidatas a mastectomía radical. De acuerdo con el protocolo del estudio, las pacientes que después de la cirugía mostraron respuesta parcial, clínica y por patología, continuaron con manejo adyuvante, con letrozol y tamoxifeno, por dos años consecutivos o hasta la presencia de progresión de la enfermedad.
Se utilizó como método estadístico Ji cuadrada con p de Mantel-Haenszel para evaluar respuesta objetiva. Como antiemético fue utilizado ondansetrón, por vía oral: 4 mg en todas las pacientes, durante las primeras dos semanas de iniciada la hormonoterapia.
¿ RESULTADOS
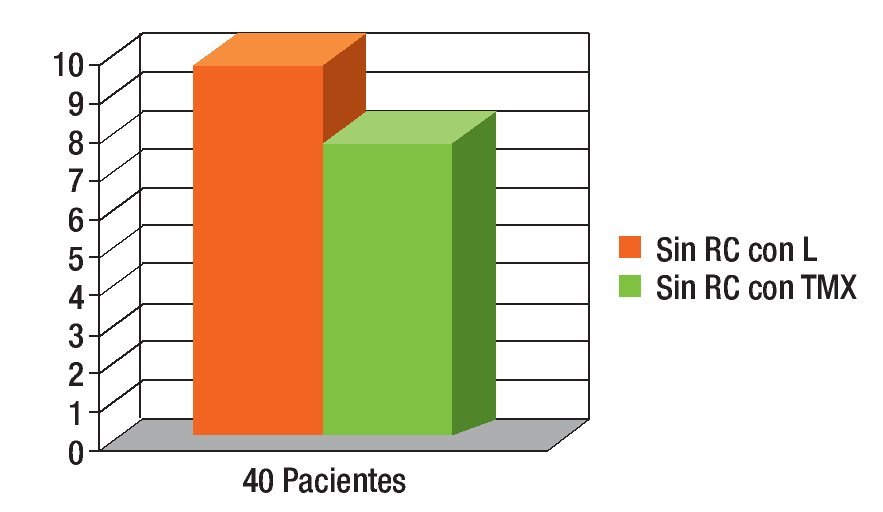
Durante el periodo de enero del 2003 a enero del 2006, se estudiaron dos grupos de pacientes, asignadas al azar y doble ciego: 40 enfermas en total; 20 pacientes recibieron tamoxifeno y 20 pacientes letrozol. La edad promedio fue de 65.5 años, con un rango de 55 a 75 años con cáncer de mama en etapas IIA a IIIB. No se evidenció respuesta completa en 25% de los casos del grupo con tamoxifeno y de 20% con letrozol (Figuras 1 a 4).
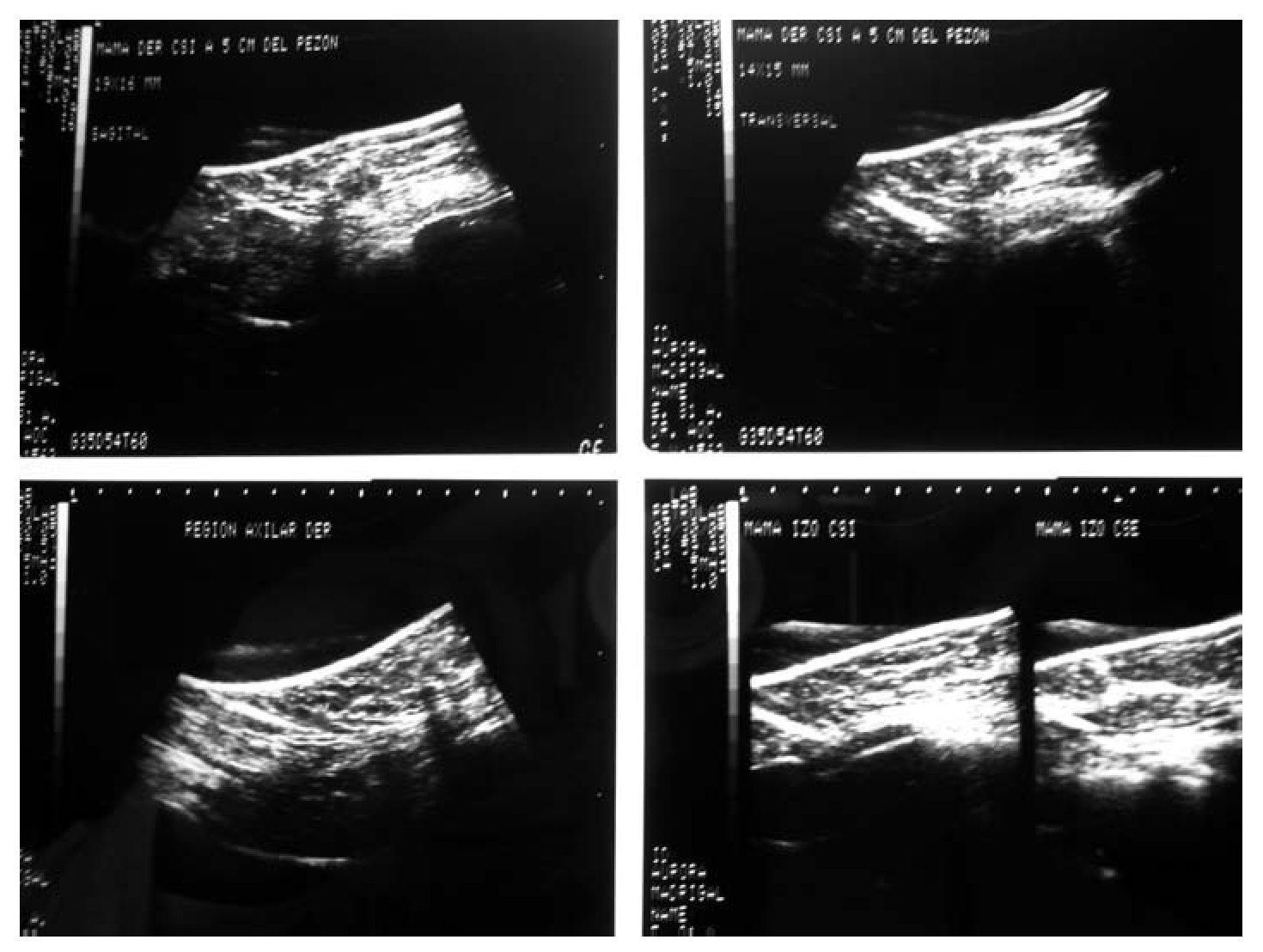
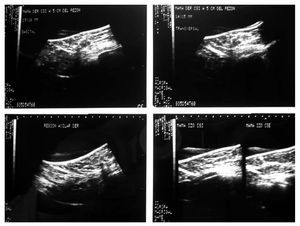
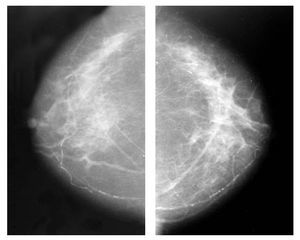
Figura 1. Biopsia de mama dirigida por ultrasonido.
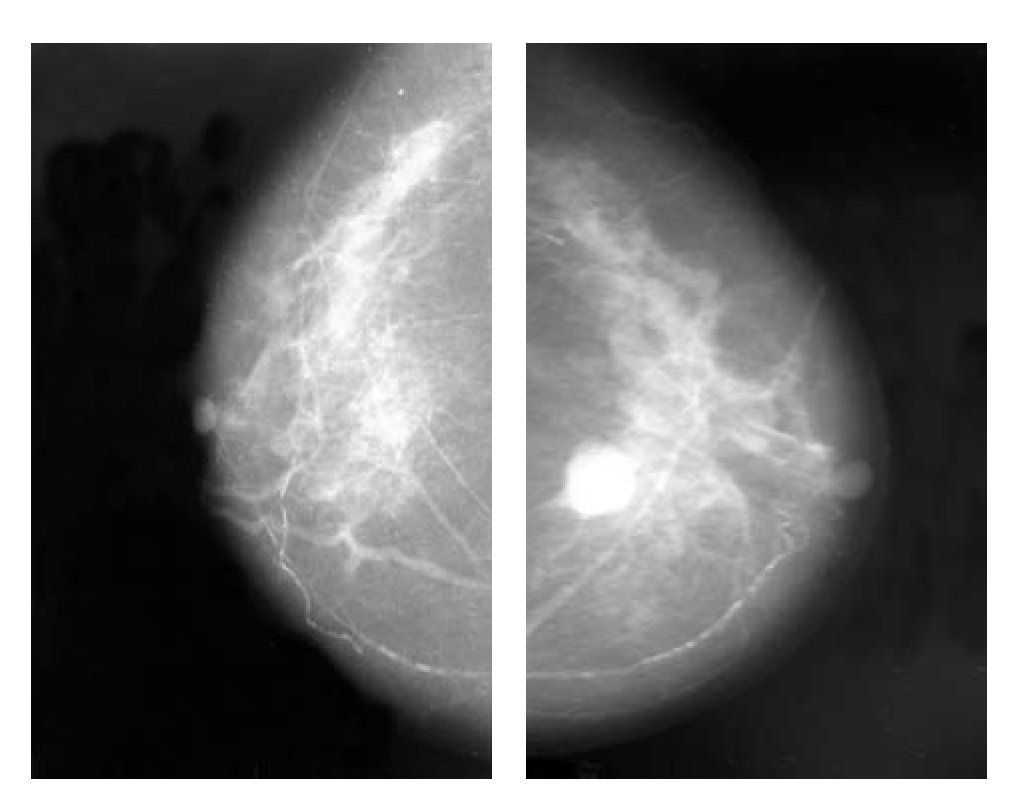
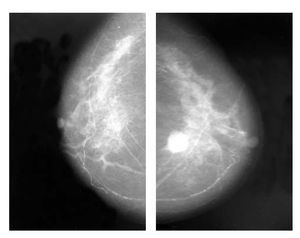
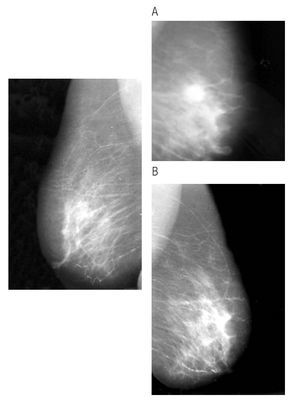
Figura 2. Cáncer de mama derecha antes de hormonoterapia, proyección CC.
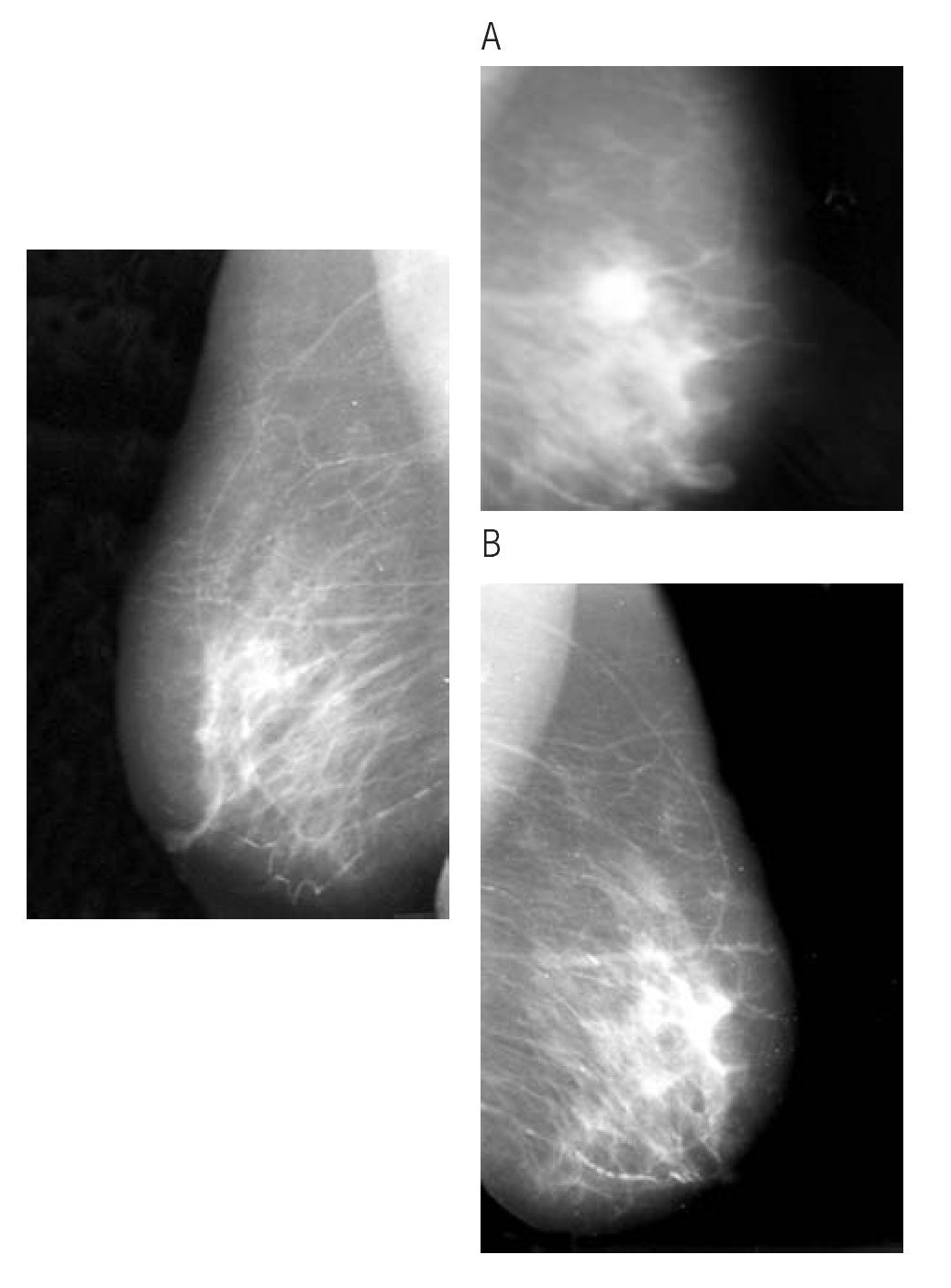
Figura 3. Paciente con respuesta clínica parcial (A) y con respuesta completa, clínica y por mastografía, posterior a tratamiento con inhibidor de aromatasa (B).
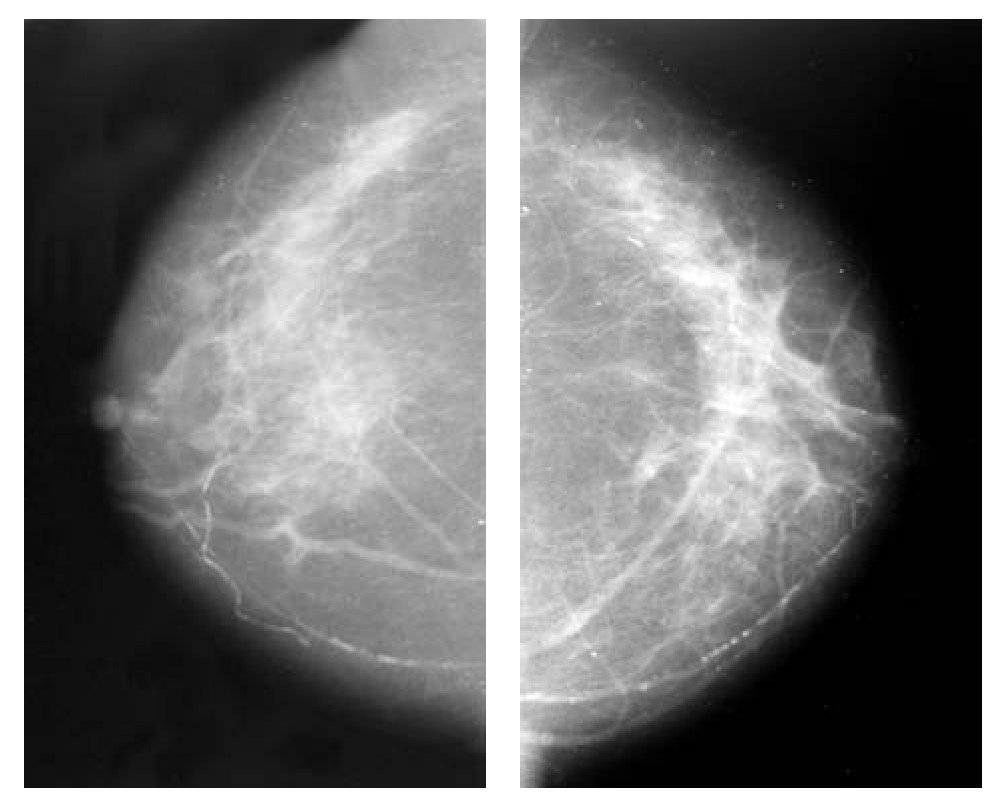
Figura 4. Mastografía con proyección CC. Nótese la ausencia radiológica de tumor, posterior a un año de hormonoterapia neoadyuvante.
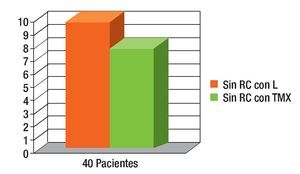
Respuesta clínica (RC): Se presentó en 45% con tamoxifeno y 55% con letrozol (19 y 21 pacientes, respectivamente (Figura 5).
Figura 5. Sin respuesta clínica (RC) se observó en 25% del grupo con tamoxifeno (TMX) y 20% con letrozol (L); las pacientes pasaron a radioterapia
Respuesta por patología (RP): Las pacientes con letrozol, mostraron una repuesta objetiva: en 15% de ellas, hubo respuesta por patología completa. Las del grupo que recibió tamoxifeno, 5% tuvieron respuesta por patología completa (p = 0.5).
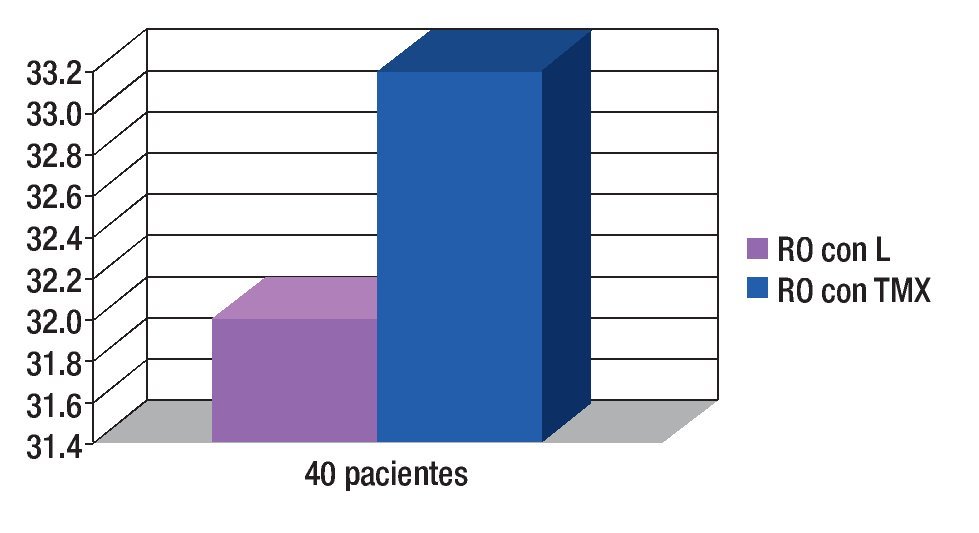
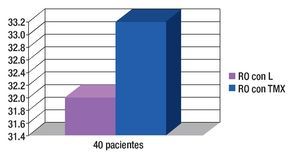
Respuesta objetiva (RO): Respuestas clínicas parciales más respuestas clínicas completas de 80% y 83% respectivamente (p = 0.59). Todas las enfermas candidatas a cirugía, recibieron tratamiento con mastectomía radical (Figura 6).
Figura 6. Respuesta objetiva (RO) (respuestas clínicas completas más respuestas patológicas completas) de 80% y 83%, respectivamente.
Efectos colaterales: Con el uso de monoterapia con letrozol, se presentaron en 55% y con el uso tamoxifeno en 60% en las pacientes con cáncer de mama localmente avanzado (p = 0.5). No respondieron a la terapia neoadyuvante (receptores hormonales < al 30%): con letrozol, 19% de ellas y con tamoxifeno 25%; por lo que recibieron manejo con radioterapia.
¿ DISCUSIÓN
Además de la etapa de la enfermedad, el estado de los receptores hormonales juegan un papel primordial en el pronóstico de sobrevida en las enfermas con cáncer de mama, pues es bien conocido, con base en evidencia, el beneficio de utilizar en ellas hormonoterapia, ya sea con antiestrógenos o con inhibidores de aromatasa, para pacientes con receptores de estrógeno y receptores de progesterona positivos.
El beneficio con el uso de antiestrógenos utilizados por vía oral, como tamoxifeno, de forma adyuvante para la paciente posmenopáusica, ha demostrado, con el paso del tiempo su gran beneficio y vigencia hasta la actualidad.1 Hoy, es la terapia adyuvante estándar para enfermas con cáncer de mama en la posmenopausia, independiente de su etapa.2
Algunos ensayos clínicos han demostrado el beneficio del uso neoadyuvante de la quimioterapia, particularmente en pacientes con factores de mal pronóstico, como el "triple negativo", premenopáusicas y casos con receptores hormonales negativos.3
En México, no ubicamos algún informe relativo al uso de hormonoterapia en forma neoadyuvante, para pacientes posmenopáusicas con cáncer de mama y con receptores hormonales positivos; ello motivó nuestro interés para comunicar los resultados de este trabajo.
De manera comparativa, se utilizó el beneficio de los dos medicamentos más utilizados en nuestro medio, reconocidos mundialmente en el ámbito de manejo hormonal adyuvante: tamoxifeno, así como un agente inhibidor de aromatasa de tercera generación, letrozol; ambos, utilizados en forma neoadyuvante.
Tamoxifeno es un modulador selectivo de los receptores estrogénicos en el tejido mamario; es un antagonista competitivo del receptor estrogénico nuclear, de tal manera que inhibe la actividad mediada por estrógenos una vez que se une al receptor. Bloquea los eventos de transcripción y post-transcripcionales. En el hueso, el hígado y el tejido endometrial, la transcripción de genes regulada por estrógenos es inalterada; después, el tamoxifeno actúa en estos sitios como un agonista estrogénico.
Letrozol ha tenido el mayor impacto en el tratamiento del cáncer de mama, sobre todo en mujeres en las que la función de las gónadas ha mermado o culminado, ya sea en forma natural por la menopausia o inducida en forma artificial (quimioterapia) o quirúrgica. Este inhibidor de aromatasa inhibe la aromatización de la enzima P450 que cataliza la conversión de andrógenos en estrógenos en los tejidos periféricos, como la grasa, hígado, mama y células musculares,4 así como en el tejido tumoral de la mama; por sí solo, reduce la síntesis y el gasto de estrógenos en la mujer posmenopáusica.
En la paciente posmenopáusica, tamoxifeno, induce aumento de los niveles de estradiol, a 3000 pmol/L o más, lo cual reduce la ocupación de los RE por éste y sus metabolitos. Dicho aumento se previene con los agonistas GnRH, los cuales pueden participar superioridad observada en la combinación con enfermedad avanzada.5
En la mujer posmenopáusica, ocupa 99.9% de los receptores de estrógeno. Su efecto agonista estrogénico puede ser dominante como cuando tamoxifeno está presente con un inhibidor de aromatasa.6
El tamoxifeno actúa como un agonista estrogénico en las células con cáncer de mama, expresando niveles elevados de un co-activador, AIB1 y HER2/neu, resultando en resistencia al tamoxifeno de novo.7
El pronóstico de sobrevida está asociado con el tamaño, grado de diferenciación, los márgenes de resección y los niveles de expresión de los receptores de estrógeno y la edad. Tamoxifeno reduce la recurrencia de receptores positivos en el carcinoma ductal in situ, y muestra discreta evidencia de beneficio en la enfermedad con receptores negativos.8
La radioterapia reduce la recurrencia del tumor in situ y del invasor, pero algunas ocasiones se omite, especialmente para lesiones con bajo grado.9
Es importante tomar en cuenta el costo, riesgo/beneficio de la enferma, antes (neoadyuvante) o después (adyuvante) de iniciar hormonoterapia y complementar su manejo al utilizar como método quirúrgico paliativo la mastectomía toilette, para enfermas con cáncer de mama localmente avanzado.10
¿ CONCLUSIONES
La hormonoterapia de inducción en pacientes posmenopáusicas con cáncer de mama localmente avanzado, se constituye como una buena alternativa de tratamiento.
La hormonoterapia neoadyuvante demostró una alta frecuencia en respuesta objetiva, por lo que debe ser considerada una buena alternativa, con alta efectividad y menor morbilidad, en mujeres con cáncer de mama en la posmenopausia.
El estudio demostró la eficacia de la hormonoterapia de inducción como herramienta para identificar enfermas con cáncer de mama con receptores hormonales positivos y enfermedad localmente avanzada en la posmenopausia, tener mejor pronóstico de sobrevida y poder ser rescatadas con mastectomía.
Correspondencia: Dr. Arturo Novoa Vargas.
Tuxpan N° 29, 5º piso, consultorio 516. Colonia Roma Sur. CP: 06760, México, D. F. Teléfono y Fax: 0155 5265 2949.
Correo electrónico:novoaart@prodigy.net.mx