Introducción: El gen del factor de crecimiento humano epidérmico 2 (por sus siglas en inglés, Her2-neu), tiene implicaciones pronósticas en mujeres con cáncer de mama. Actualmente en nuestro medio, determinamos la sobreexpresión del Her2-neu mediante inmunohistoquímica (IHQ). Sin embargo, en diagnósticos indeterminados se requiere confirmación con hibridación in situ (ISH).
La hibridación in situ fluorescente (FISH) es el estándar de oro, para verificar la amplificación del gen Her2-neu, sin embargo, al ser un método costoso y complicado, utilizamos hibridación in situ cromogénica (CISH) como alternativa. Se refiere que esta técnica es tan eficiente como el FISH. Nuestro objetivo principal fue evaluar la correlación en la determinación de la amplificación del gen Her2-neu, entre las técnicas de IHQ y CISH.
Material y métodos: Se seleccionaron bloques de parafina de 114 mujeres con cáncer de mama en dos instituciones, se evaluó la expresión de Her2-neu por IHQ y, posteriormente por CISH, cuyos resultados se basaron en la cuenta de señales por núcleo. Se correlacionaron los resultados de ambas técnicas.
Resultados: Los resultados de IHQ comparados con los de CISH, mostraron una concordancia hasta en 98% de los casos, confirmando la amplificación del gen en el 96% de los casos que resultaron positivos (3+) con IHQ, la no amplificación del gen en 97% de los casos negativos (0, 1+) y una amplificación variable (37%) del gen Her2-neu en los casos indeterminados (2+).
Conclusiones: El CISH demostró ser una técnica altamente sensible y específica en la determinación de la amplificación del gen Her2-neu, especialmente en aquellos casos con resultado de IHQ indeterminado (2+).
Introduction: The gene of human epidermal growth factor 2 (Her2-neu), has prognostic implications in women with breast cancer. In our current practice, we determine overexpression of Her2-neu by immunohistochemistry (IHC). However, indeterminate results require in situ hybridization (ISH).
The fluorescence in situ hybridization (FISH) is the gold standard to verify the amplification of the Her2-neu gene, however, this technique is expensive and difficult to do, so, we use Cromogenic in situ hybridization (CISH) as an alternative method. There are concerns regarding this technique has as good performance as FISH Our main goal was to evaluate the correlation between IHC and CISH for those cases with indeterminate results
Material and methods: Paraffin blocks were selected from 114 women with breast cancer at two institutions, Her2-neu determination by IHC and CISH was performed later. The CISH results were based on the count of signals per nucleus and then correlated the results of both methods.
Results: Correlation between both methods results was that of 98% , confirming gene amplification in 96% of patients that were positive (3+) with IHC, no amplification of the gene was found in 97% of the negative cases (0, 1+) and 37% of indeterminate cases (2+).
Conclusions: The CISH technique proved to be a highly sensitive and specific technique in determining the amplification of the Her2-neu gene, especially in cases with indeterminate immunohistochemistry results (2+).
INTRODUCCIÓN
El gen del factor de crecimiento epidérmico 2 (por sus siglas en inglés, human epidermal growth factor receptor 2, Her2, también conocido como ERBB2 o NEU) es un receptor de membrana tirosinquinasa, que tiene homología con el receptor del factor de crecimiento epidérmico (EGFR o Her1).1,2 La proteína Her2-neu es un componente normal expresado por varios tipos de células epiteliales.3
En aproximadamente 20% de las pacientes con cáncer de mama, la proteína Her2-neu está sobreexpresada como parte del proceso de transformación maligna y progreso del tumor. La sobreexpresión de la proteína Her2-neu en la superficie de las células de cáncer de mama, sugirió que podría ser un blanco para un tratamiento de anticuerpos.4
La sobreexpresión del Her2-neu en los pacientes con cáncer de mama, es un factor de mal pronóstico. Aquellas pacientes con amplificación del Her2-neu tienen tumores poco diferenciados con una tasa de proliferación elevada, adenopatías axilares positivas y una disminución en la expresión de los receptores de estrógenos y progesterona. Estas características se asocian con un incremento en el riesgo de recurrencia y muerte.5
Entre el 20% al 30% de los tumores de mama sobreexpresan fuertemente Her2.6 Estas pacientes que sobreexpresan el Her2 tienen un 60% más posibilidades para fallecer por cáncer de mama, que las mujeres que no expresan este gen.7 Por otro lado, se ha demostrado el incremento de la sobrevida y el periodo libre de enfermedad cuando son tratados con terapias específicas (trastuzumab),8 y en estadios tempranos se ha reportado una reducción en el riesgo de recaída de aproximadamente del 50%.9 En consecuencia, se evalúa el estatus de Her2 en todos los pacientes con cáncer de mama al momento del diagnóstico, con el fin orientar un tratamiento específico y mejorar las expectativas de vida.10,11
La técnica habitual para la determinación del Her2-neu es inmunohistoquímica (IHQ), la cual tiene como principal desventaja altos falsos positivos, debido a la llamada "basura", esto es una tinción débil, por lo que se ha propuesto un algoritmo para mejorar la calidad del diagnóstico utilizando técnicas más sensibles.8
La prueba más sensible, y por lo tanto considerada como el estándar de referencia para la determinación del gen Her2-neu es la técnica de hibridación in situ fluorescente (FISH).8-12
Para llevar a cabo esta técnica, existen diferentes kits comerciales, el más preciso es el HercepTest®.13 Los algoritmos de decisión terapéutica acordados y utilizados hasta la actualidad, asumiendo un alto nivel de concordancia entre IHQ y FISH, recomiendan la utilización de IHQ como test primario, indicando FISH sólo en los casos de positividades intermedias, no concluyentes (2+). Los casos de alta positividad (3+) y los de positividad baja (1+) o nula se informan como positivos o negativos, respectivamente.14 Sin embargo, esta técnica requiere de microscopios especiales, patólogos experimentados y es más costosa que la técnica habitual de IHQ. Además, de que aún continúa la incertidumbre sobre cuál es el mejor sistema (hibridación in situ cromogénica CISH vs FISH) y hoy día, se sugiere que este algoritmo se adapte en cada centro oncológico.15 Por lo anterior, se está probando una técnica que combina características de la IHQ y el FISH, técnica conocida como CISH.
La técnica CISH ofrece grandes ventajas ya que a pesar de requerir más tiempo de incubación, tiene menor costo y no requiere de microscopio especial, resulta altamente sensible.16
En países como el nuestro, la técnica FISH resulta de uso limitado principalmente por su alto costo y requerimientos de equipo y personal especializado, requiere de microscopios con filtros especiales (St. Vicents®), y dado que la fluorescencia dura poco, se requiere de un archivo fotográfico para perpetuar la evidencia del diagnóstico con la dificultad de contar con controles de calidad externos.
Es por estas dificultades tanto económicas como técnicas que la prueba de CISH aparece como una alternativa diagnóstica, dado que puede ser realizada con los recursos existentes en los Laboratorios de Patología, las laminillas mantienen la tinción de modo permanente y la interpretación es igual a la IHQ. La concordancia (kappa) entre ambas pruebas varía de acuerdo a los estudios reportados entre el 0.8617 y el 0.97,18 sin duda alguna se ve afectada por la prevalencia de casos intermedios, lo que obliga a realizar un mayor número de estudios con prevalencias distintas de los distintos niveles de expresión del gen. Por lo tanto, proponemos en el presente estudio evaluar las características de la prueba con proporciones similares de casos positivos, negativos e indeterminados.
Actualmente, el algoritmo diagnóstico en los casos en que el IHQ resulte dudosa (2+) es mediante la confirmación con la técnica FISH. Con los resultados de este estudio, se propone validar la utilización de la técnica de CISH como prueba de confirmación en lugar de la técnica FISH.
JUSTIFICACIÓN
La determinación del Her-2 además de tener implicaciones pronósticas, tiene fuertes implicaciones terapéuticas al ser indispensable para la selección del tratamiento apropiado.
El encontrar una alta concordancia entre CISH e IHQ, podría ser de utilidad para el manejo adecuado de las pacientes con cáncer de mama en nuestro centro, puesto que el CISH es una técnica de fácil implementación en el medio, que parece ser menos costosa y puede representar ahorros tanto en recursos humanos, como en materiales necesarios para su realización, originando una optimización de recursos al ser empleada en la determinación del Her2 en muestras 2+ en la IHQ.
El objetivo de nuestro estudio fue determinar la concordancia entre las pruebas CISH e IHQ para la detección del Her-2, en muestras de pacientes con cáncer de mama.
MATERIAL Y MÉTODOS
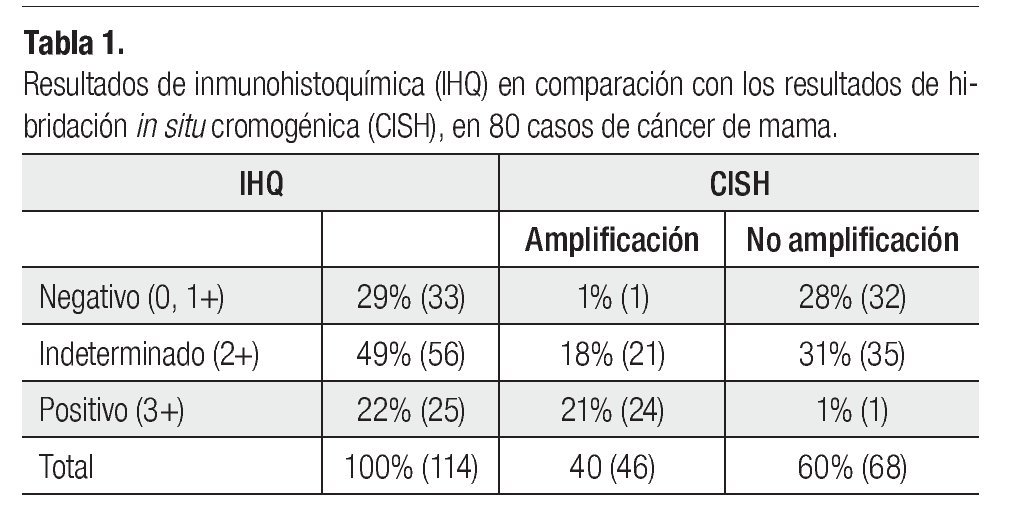
Se seleccionaron bloques de parafina de 114 pacientes con carcinoma mamario (primario), en dos instituciones, Fundación del Cáncer de Mama (FUCAM), (34 casos) y Hospital de Oncología CMN Siglo XXI (80 casos), previamente estudiados para sobreexpresión de Her2 por IHQ, como 0 o 1+ n=33, 2+ n=57 y 3+ n=24.
El estudio se llevó a cabo de acuerdo a la declaración de Helsinki, y de las buenas prácticas clínicas de Laboratorio.19
Todas las muestras seleccionadas para fines de este estudio fueron casos procesados mediante IHQ (HercepTest®; DakoCytomation, Capentaria, CA), y se clasificaron para la sobreexpresión de Her2 a través de IHQ. Según los siguientes criterios (Figura 1):
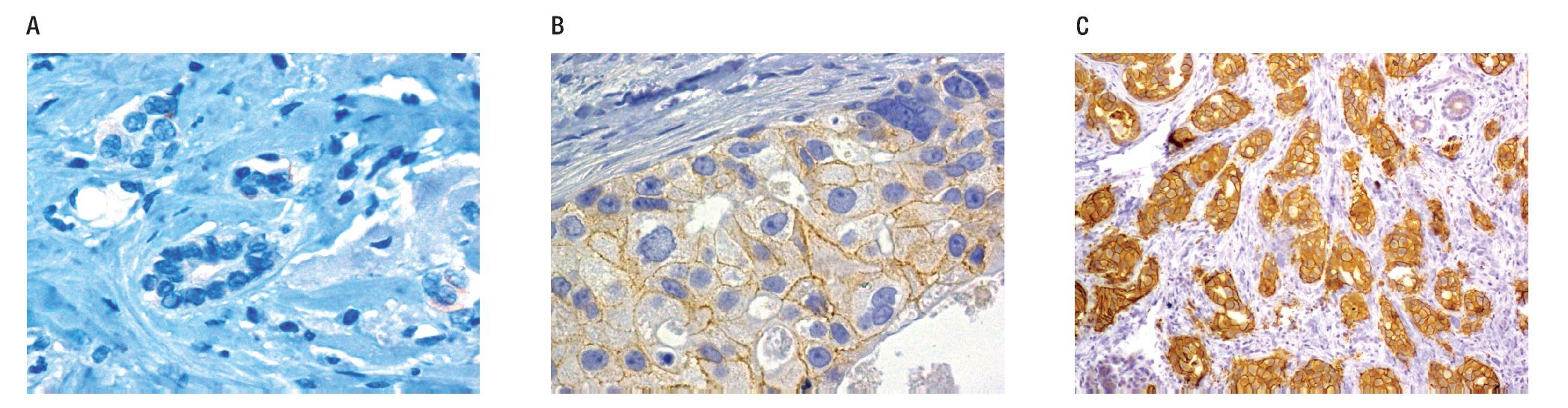
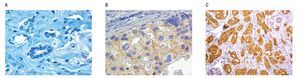
Figura 1.Resultados de inmunohistoquímica (IHQ) para Her2-neu, negativo (0), indetermindado (2+), positivo (3+). A) Corte histológico con IHQ, Her2-neu negativo 0, nótese ausencia de tinción en la membrana de las células neoplásicas. B) Corte histológico con IHQ Her2-neu inespecífico (2+), nótese la tinción incompleta de la membrana, débil. C) Corte histológico con IHQ, Her2-neu positivo (3+). Muestra tinción completa, intensa de la membrana citoplásmica.
Her-2 positivo: En IHQ cuando el patólogo refiera a la muestra con positividad de membrana intensa y uniforme (3+), en más del 30% de células neoplásicas.
Her-2 equívoco: En IHQ y en CISH son los casos etiquetados como expresión 2+, que representan aproximadamente el 15%, y se definen como la positividad de membrana no uniforme o de intensidad débil, pero completa o circunferencial en el 10% o más de células.
Her-2 negativo: En IHQ consistirá en la ausencia de tinción (0) o positividad 1+, definida como expresión de membrana débil, incompleta, en cualquier proporción de células.
Posteriormente, se realizó CISH (Zymed®SPOT®-Light Her-2 CISHTM, Invitrogen Corporation, Camarillo, CA), cuyos resultados se basaron en la cuenta de señales por núcleo, de la siguiente manera (Figura 2):
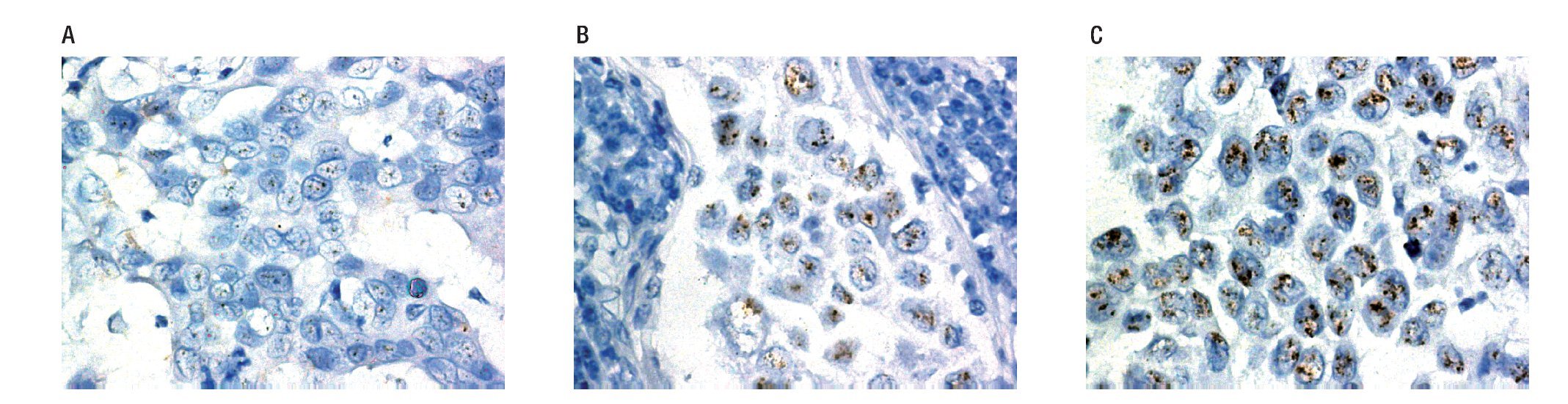
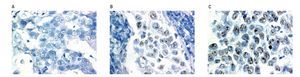
Figura 2. Resultados de CISH, sin amplificación del gen Her-2neu, con amplificación del gen Her-2neu. A) Corte histológico con CISH, que no muestra amplificación para el gen Her2-neu. Menos de cinco señales (puntos café) en 30 células. B) Corte histológico con CISH con amplificación para el gen Her2-neu. C) Corte histológico con CISH, nótese los grupos de señales, puntos café en el interior de cada núcleo.
Se contaron por lo menos 30 células neoplásicas en cada caso de Her2, utilizando microscopio de luz con un objetivo de seco fuerte 40x.
El gen Her-2 se consideró no amplificado si el promedio de señales por núcleo oscilaba entre uno y cinco, amplificado si el promedio de señales por núcleo fue superior a cinco o las señales agrupadas (puntos grandes).
Si el promedio de las señales en 30 núcleos oscilaba entre cuatro y seis por núcleo, otro grupo de 30 células fue contado, y el promedio de señales fue calculado en un total de 60 células.
RESULTADOS
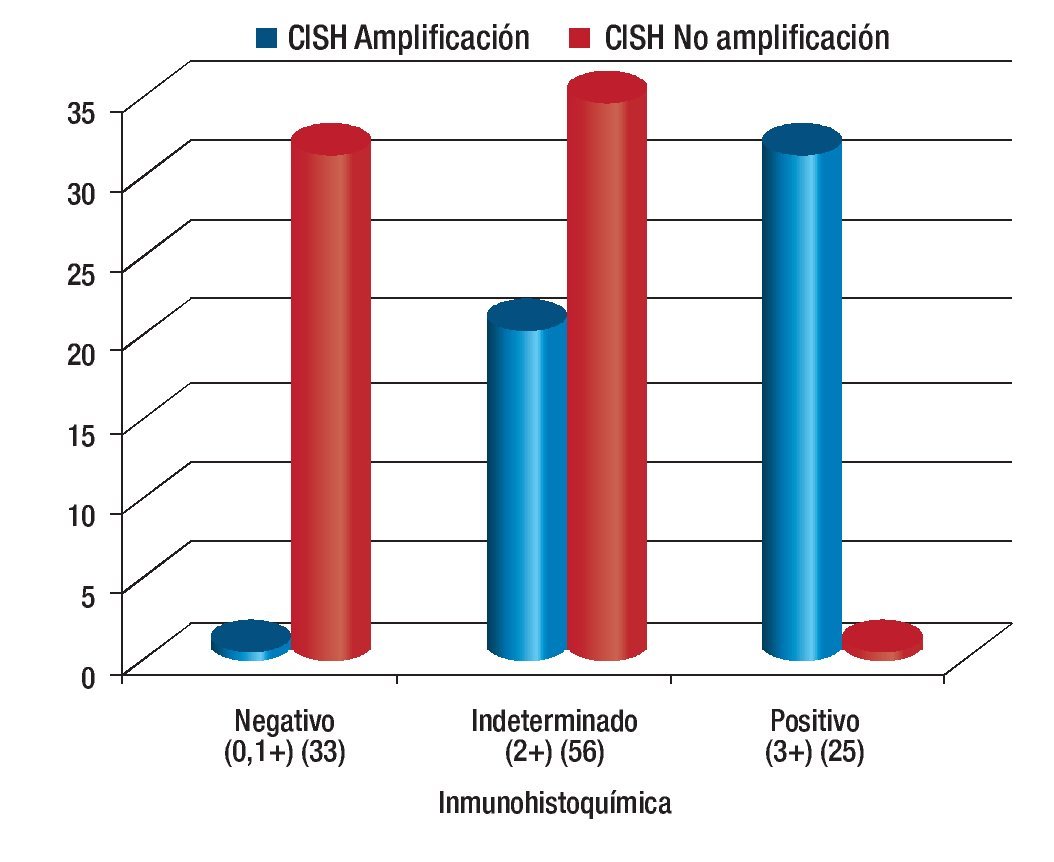
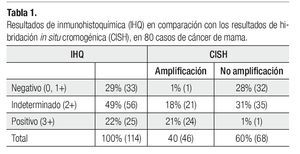
Los 114 casos estudiados, correspondieron a carcinomas primarios de mama. De los 114 tumores valorados para Her2-neu con IHQ como 0 o 1+, 2+, 3+ se observaron 33 (29%), 56 (49%) y 25 (22%), respectivamente.
De los casos, clasificados como negativo (0, 1+), 97% (32 casos) (Figura 1A) no tuvieron amplificación del gen Her2-neu con CISH, y 3% (1 caso) mostró amplificación con CISH para el gen Her2-neu.
De los casos clasificados por IHQ como indeterminados (2+), 37.5% (21 casos) (Figura 1B) mostraron amplificación al gen Her2-neu con la técnica de CISH, mientras que 62.5% (35 casos) no tuvieron amplificación al gen Her2-neu con CISH
Finalmente de los casos clasificados por IHQ positivos para Her2-neu (3+) 96% (24 casos) (Figura 1C) demostraron amplificación para el gen Her2-neu mediante la técnica de CISH, mientras que en 4% (1 caso) no se corroboró por CISH la amplificación del gen Her2-neu (Tabla 1).
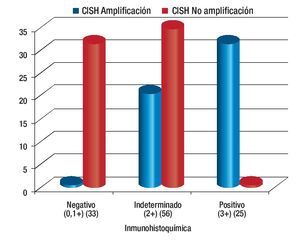
De los resultados de IHQ negativos (0, 1+), el 96% (32 casos) no mostró amplificación con la técnica de CISH (Figura 2A), tal como era esperado, mientras que entre los resultados de IHQ francamente positivos (3+), 92% de los casos mostró amplificación al gen Her2-neu con la técnica del CISH (Figuras 2B y 2C).
Obteniendo así una correlación entre la IHQ y el CISH de 94% (Figura 3).
Figura 3.Comparación de resultados entre inmunohistoquímica y hibridación in situ cromogénica (CISH).
DISCUSIÓN
El objetivo principal de nuestro estudio fue comparar los resultados de IHQ y de CISH, en el análisis de la sobreexpresión del gen Her2-neu, en mujeres con cáncer de mama. Aun cuando la literatura médica internacional en nuestros días, considera al FISH la técnica estándar de oro para evaluar la sobreexpresión de este gen, múltiples estudios, comparan las técnicas de FISH y CISH, y la concordancia que existe entre ambas obteniendo resultados variables entre 80% y 90%.
El FISH, como ya hemos mencionado tiene la desventaja de ser costoso, requerir equipo especial (Microscopio de fluorescencia, cámara fotográfica, etc.), tejido congelado, entre otros. Mientras que el CISH, al ser una técnica similar en su proceso a la IHQ, y utilizar bloques de parafina, resulta mucho más accesible a nuestro medio.
Comparamos al CISH con la IHQ obteniendo una concordancia superior al 90%, y aun cuando, a través de esta técnica no es posible determinar las polisomias, sí ayuda a resolver casos con resultados indeterminados Her2-neu 2+.
Actualmente se han desarrollado técnicas de CISH con doble color, para marcar el centrómero del cromosoma 17, y ser más específicos al interpretar los resultados, que valdría la pena explorar.
CONCLUSIONES
El CISH demostró ser una técnica de biología molecular, altamente sensible y específica en la determinación de la amplificación del gen Her2-neu, en pacientes con cáncer de mama, especialmente en aquellos casos con resultado de IHQ indeterminado (2+), ya que permite segregar un grupo de pacientes, con enfermedad de comportamiento biológico más agresivo y candidatas a terapia blanco molecular.
Además, el CISH tiene múltiples ventajas en cuanto a la técnica puesto que es similar a la IHQ, y el costo es notablemente menor en comparación con otras técnicas de hibridación in situ como el FISH.
Agradecimientos
QFB Oscar Martínez Quirarte, por su apoyo en la realización de las técnicas de CISH e IHQ.
Correspondencia:
Dra. Raquel Valencia-Cedillo.
Departamento de Patología, Hospital de Oncología CMN SXXI, IMSS.
Cuauhtémoc 330, Colonia Doctores, Delegación Cuauhtémoc.
C.P. 06700. México D.F., México.
Teléfono: 55 5574 2322.
Correo electrónico: leuqar.8gmail.com