INTRODUCCIÓN
La infección por el virus del papiloma humano (HPV, por sus siglas en inglés) en países en vías de desarrollo tiene un predominio en las mujeres jóvenes con una frecuencia del 24% entre las pacientes de 25 a 44 años, una incidencia de 90 por cada 100,000 habitantes y una tendencia a incrementarse en ese grupo de edad en un 28% por año. Ésta representa la principal infección por transmisión sexual, con una tasa de incidencia general de 44.9 por cada 100,000 habitantes.1,2
En México, cada dos horas muere una mujer por cáncer cervicouterino (CaCu). La tasa de mortalidad es de 16 mujeres por cada 100,000 habitantes.1 Se registran 3452 casos nuevos por fuente de notificación, de los cuales 108 corresponden a la Secretaría de la Defensa Nacional (SEDENA); la mayoría de los casos se diagnostica en estadios localmente avanzados (IB2-IVA) de acuerdo con la Federación Internacional de Ginecología y Obstetricia (FIGO). El CaCu es uno de los tipos de cáncer más común en mujeres (6% de todas las neoplasias malignas en mujeres). Ocupa el segundo lugar sólo después del cáncer de mama en tasa de mortalidad.
Los procedimientos de diagnóstico molecular se utilizan cada vez más en la valoración de las pacientes con diferentes tipos de cáncer, incluidos los ginecológicos, y en un futuro podrían guiar el tratamiento. Cuando éstos son sensibles y específicos, pueden ser de gran utilidad para el manejo de los pacientes con cáncer; una de las perspectivas más promisorias es la determinación de marcadores moleculares para predecir de manera temprana las recaídas. Puede mencionarse un ejemplo de estos procedimientos moleculares. Benítez-Bribiesca y colaboradores, en pacientes con diagnóstico de CaCu, observaron un incremento de la proteasa catepsina B, la cual se correlacionó directamente con la etapa clínica de la neoplasia; sin embargo, ésta no es específica del CaCu dado que la sintetiza la mayoría de los tumores malignos.3 En la actualidad, no existe un marcador molecular para el diagnóstico de CaCu que sea sensible, específico y utilizable en el manejo y seguimiento de las pacientes.
Hsiu Ting Tsai y colaboradores realizaron un estudio de casos y controles en etapas precancerosas del cérvix y encontraron que una carga viral elevada de HPV-16 puede ser un indicador de la progresión a una lesión intraepitelial de alto grado (LIEAG) a cáncer.4 Otras investigaciones mencionan que la relación entre la carga viral del HPV y la gravedad de las lesiones histológicas en el CaCu es controversial; por ejemplo, en el estudio de Sherman y colaboradores (2002) se identificó un número de copias virales bajas en el grupo de LIEAG en comparación con el grupo que tenía lesión intraepitelial de bajo grado (LIEBG), pero se necesita evidencia científica para corroborar esta información. Se concluyó que la infección por HPV de alto riesgo, sin tomar en cuenta la del HPV-16, se relaciona a menudo con el desarrollo de lesiones intraepiteliales en el cérvix uterino. El mayor número de copias virales vinculado con la LIEBG en comparación con la LIEAG debe ser objeto de investigación.5
En otros estudios, como los de Lombard (1998) y Burger (1996), el objetivo fue la tipificación del HPV intratumoral; estos especialistas demostraron la frecuencia de HPV en un periodo de cinco años; en el 100% de los pacientes se presentó el genotipo de HPV de riesgo intermedio, HPV-16 en el 58% y HPV-18 en el 38% . En este estudio, la mortalidad fue 2.4 veces mayor para los pacientes con tumores relacionados con HPV-18 respecto de los pacientes con HPV-16 y 4.4 veces más para individuos con tumores vinculados con otro tipo de HPV.6,7
En el estudio realizado por Wichai y colaboradores (2001), en el que se cuantificó el número de copias virales deHPV en plasma y tejido tumoral cervical de pacientes con diagnóstico de CaCu, se sugirió que la presencia de ADN del HPV en el plasma de las pacientes puede utilizarse como un marcador molecular de enfermedad; estos autores reconocieron que el mismo tipo de HPV que descubrieron en plasma lo localizaron en tejido tumoral cervical. En las pacientes con estadio III, que tenían metástasis al inicio de la cuantificación, hallaron un mayor número de copias virales en comparación con las que no tenían tal anomalía; las pacientes positivas para HPV en plasma tuvieron una mayor tendencia a la enfermedad recurrente, ya que cuatro de cada nueve continuaron con CaCu después de un año de seguimiento. Este estudio indica que el número de copias virales del HPV en plasma es específica, pero no sensible, como marcador molecular del diagnóstico de CaCu; asimismo, se observó que puede existir un nexo entre el número de copias virales de HPV con el grado de metástasis o bien una relación con la enfermedad local avanzada, ya que en estadios tempranos del CaCu se observó que el plasma está libre de ADN del HPV.8
En un estudio mexicano realizado por el Instituto Nacional de Cancerología (INCAN) en 1999 se buscó también ADN de HPV en plasma de 34 pacientes con diagnóstico de CaCu; se observó que el 70% de los pacientes (24) era positivo a HPV, lo cual representó 70% de la sensibilidad de la prueba, con una especificidad del 100% ya que en las 24 pacientes sin cáncer la prueba fue negativa; los genotipos encontrados fueron: 17 de las 34 pacientes presentaron HPV-16 (50%), mientras que ocho mostraron HPV-18 (20%) y nueve correspondieron a otros tipos virales.9 Se sabe que el ADN de HPV circulante no es consecuencia de destrucción celular (necrosis o apoptosis), dado que este ADN estaría degradado y por lo tanto no podría amplificarse. Por último, llegaron a la conclusión de que la detección en plasma del ADN de HPV es específica de aquellos pacientes con cáncer invasor y que esta prueba se podría tomar como un marcador de enfermedad residual mínima o como un marcador molecular temprano de recaídas. Tales resultados preliminares pueden ser de gran interés, puesto que la determinación mediante amplificación por reacción en cadena de la polimerasa (PCR) del HPV en las pacientes con CaCu representaría un marcador sensible y altamente específico; empero, sería necesario valorar el comportamiento de la carga viral del HPV durante el tratamiento de la paciente y después la relación con la respuesta a corto y largo plazos al finalizar el tratamiento. La determinación por PCR del HPV en plasma de las pacientes con cáncer de cérvix podría ser un marcador molecular de enfermedad residual y con ello el clínico podría sustentar sus decisiones terapéuticas.
Los resultados anteriores muestran cada vez mayor evidencia de que el número de copias virales es determinante en el pronóstico de la paciente y se ha sugerido que la presencia de neoplasia cervical puede relacionarse con el número de copias virales. Hart y colaboradores llevaron a cabo un estudio prospectivo para relacionar la lesión intraepitelial, el tipo de virus y la carga viral y hallaron que el número de copias virales se vinculaba con la gravedad de la enfermedad y viceversa.10
No existen en la literatura trabajos previos en los que se demuestre el comportamiento de la carga viral del HPV durante el tratamiento del CaCu con radioterapia (RT) o radioterapia/quimioterapia (RT/QT) concomitantes; asimismo, no se conoce el efecto que tienen el genotipo del HPV y el número de copias virales residuales sobre la respuesta al finalizar el tratamiento de las pacientes con CaCu, ni tampoco si esto podría ser un factor predictivo o un marcador de enfermedad residual mínima y un indicador de recaídas para guiar una decisión terapéutica. En consecuencia, el objetivo de este estudio fue determinar el número de copias absolutas del HPV (-16 y -18) durante el tratamiento de las pacientes con CaCu en estadios IIIA y IIIB (enfermedad localmente avanzada) tratadas con RT/QT o RT en el Hospital Central Militar (HCM). Para ello se determinó lo siguiente: a) presencia de HPV-16 o HPV-18 en pacientes con CaCu en estadios IIIA y IIIB, según la FIGO; b) número de copias del HPV-16 o HPV-18 al inicio y término de los tratamientos de RT/QT y braquiterapia; y c) análisis de los datos basado en el estadio histopatológico, genotipo de HPV y comportamiento del número de copias en relación con la fase de tratamiento.
MATERIAL Y MÉTODOS
Participantes y tratamientos. Se obtuvieron, previa autorización por consentimiento informado de las pacientes, 69 muestras (biopsias). Se realizó un estudio clínico observacional descriptivo prospectivo en pacientes con diagnóstico de CaCu, derechohabientes del HCM que acudieron al servicio de radioterapia durante el periodo comprendido entre noviembre de 2006 y febrero de 2007 y que reunieron los siguientes criterios: firma del consentimiento informado por parte de las pacientes, aceptación voluntaria para participar en el estudio y pacientes derechohabientes del HCM con CaCu en etapas clínicas IIIA y IIIB.
Se obtuvo historial clínico completo y se efectuó una exploración general y ginecológica de 23 pacientes. Se estadificaron de acuerdo con la clasificación de la FIGO. Se tomó una biopsia para confirmar la estirpe histológica. Se solicitaron estudios básicos y de extensión, biometría hemática, química sanguínea, examen general de orina, pruebas de funcionamiento hepático, telerradiografía de tórax, ultrasonografía hepática y urograma excretor en caso de requerirlo. Se registró a cada paciente y se inició el esquema de tratamiento.
En la primera fase de tratamiento (F1), todas las pacientes recibieron 20 sesiones de RT externa con acelerador lineal 10 MEV con técnica isocéntrica, dos campos pélvicos paralelos y opuestos, anterior y posterior; la dosis total fue de 4500 cGy en 20 fracciones, tratamiento diario de 225 cGy, con la paciente colocada en decúbito supino. Las pacientes se valoraron en el servicio de oncología médica y fueron objeto de RT/QT concomitante: tres ciclos de QT con 50 mg de cisplatino diluidos en 500 cm3 de solución salina isotónica. En la segunda fase de tratamiento (F2), luego de un descanso de dos semanas y de acuerdo con las condiciones locorregionales de contar con canal cervical permeable, se inició braquiterapia de alta tasa de dosis de radiación con iridio 192. Se efectuó la exploración general de la paciente y se procedió al examen ginecorrectal completo. Se identificó el cérvix uterino y el canal endocervical y se tomó la segunda biopsia para cuantificación del número de copias del HPV. Se efectuó una histerometría y se realizó la planeación para valorar la dosis de radiación máxima a recto y vejiga. La dosis total de radiación con iridio 192 hacia los puntos A de Manchester fue de 2400 cGy fraccionados en cuatro sesiones, cada una semanal. Al finalizar las sesiones de braquiterapia se tomó la tercera muestra, las biopsias se mantuvieron bajo congelación a -83 °C (Revco® Legaci ULT2186 3-35 Dupont SVVA Refrigerants) hasta su posterior procesamiento.
Extracción y cuantificación del ADN. El ácido desoxirribonucleico (ADN) total fue extraído mediante el equipo SV Total DNA Isolation System (Promega, Madison, WI, USA); se tomaron 150 mg de cada una de las muestras con técnica estéril, sin contaminación de las DNAsas, que se homogenizaron con un politrón (Omni µH International), de acuerdo con las indicaciones del proveedor y sin incluir el ADN total; por último, se guardaron a -20 °C para posteriores análisis. La verificación de la integridad del ADN total se realizó por medio de electroforesis en un gel de agarosa al 1.5%; se colocaron 6 µl del ADN total extraído por muestra y se observó el DNA con luz ultravioleta (UV) con el sistema de análisis de electroforesis EDAS 290 (EDAS 290 KODAK, New Havn, CP). La cuantificación del ADN total se realizó por medio de fluorescencia con SYBR Green, con el multidetector Synergy HT-I (BIO-TEK Instruments, Inc. Higland Park, Vermont, USA).
Estandarización de la técnica de PCR en tiempo real (Rotor Gene RG-3000). Para el desarrollo de la PCR en tiempo real se diseñaron oligonucleótidos específicos: para HPV-16, HPV-18 (región L1 del HPV-16 y HPV-18) y para el gen de la enzima gliceraldehído-3 fosfato deshidrogenasa (GAPDH), la cual se utilizó para normalizar la carga de ADN (número de células en tejido procesado). Las secuencias se obtuvieron del GenBankTM. La búsqueda de las secuencias se realizó en http://www.ncbi.nlm.nih. gov/BLAST/ para confirmar su especificidad. Los primers se sintetizaron (InvitrogenTM Carsbad CA, USA), libres de sales y altamente purificados y se optimizaron a una temperatura de alineamiento de 50 °C. Para HPV-16 fueron los siguientes: primer sentido (Fw), TTTGTTACTGTTGTTGATACTAC; primer antisentido (Rev), GAAAAATAAACTGTAAATCATATTC. Para HPV-18 fueron: Fw, TTTGTTACTGTGGTAGATACC, Rev, GAAAAATAAACTGCAAATCATATTC y GAPDH: Fw, GAGCCAAAAGGGTCATCATCTC, Rev, CCTTCCACGATACCAAAGTTGTC.
Las condiciones para la PCR se optimizaron con un termociclador de gradiente (gradient Px2 Thermal Cycler Hybaid, Franklin, MA) mediante el dispositivo SYBR Green PCR Master Mix (Applied, Biosystems CA). Las secuencias tomadas corresponden a los registros del GenBankTM bajo el siguiente número de accesiones: HPV-16, NC_001526. HPV-18, NC_001357, GAPDH, NM_002046. Los productos de amplificación por PCR en tiempo real se verificaron, se visualizó su peso molecular en pares de base (pb) por electroforesis en un gel de agarosa al 2% con un marcador de 50 pb DNA Ladder (10416-014, Invitrogen Life Technologies, 1600 Faraday Av. Carlsbad, California 92008 EU) y se estudiaron con el sistema de análisis electroforesis EDAS 290 (KODAK, New Haven, CT). Los resultados obtenidos de las amplificaciones, como las condiciones de temperatura, concentraciones de primers, dNTP (nucleótidos) y volúmenes, se transfirieron al protocolo de amplificación en tiempo real del sistema de detección Rotor Gene 6.0 (Corbett Life Science, Sidney City, Australia).
Protocolo de PCR en tiempo real Rotor-Gene 3000. Las reacciones de la PCR en tiempo real se realizaron con 10 ng de ADN total; las diluciones para el gen control (GAPDH) y para la cuantificación absoluta de HPV-16 y HPV-18 se efectuaron mediante el dispositivo SYBR Green PCR Master Mix, con la concentración final de los siguientes reactivos: 1X de amortiguador SYBR Green PCR, 25 mM MgCl2, 1 U/µl de AmpErase®UNG (Uracil-N-glucosilasa), 5 U/µl de AmpliTaq Gold DNA polimerasa, mezcla de dNTP (2.5 mM de ATP, 2.5 mM de CTP, 2.5 mM de GTP y 5.0 mM de dUTP), 0.4 µl del primer forward (0.4 µM), 0.4 µl del primer reverso (0.4 µM), y 0.8 µl de agua grado molecular, 12.5 µl de volumen final. La reacción se llevó a cabo inicialmente a 94 °C por cinco minutos, seguido de 35 ciclos en la fase de PCR, cada ciclo de 95 °C por 20 seg, 50 °C por 20 seg, 72 °C por 20 seg, con una fase de extensión de 72 °C por cinco minutos y finalmente una fase de desnaturalización con un intervalo de temperatura de 60-98 °C. Para la cuantificación absoluta se construyeron tres curvas estándar con controles positivos (HPV-16, HPV-18 y GAPDH) de genomas de los HPV y del plásmido con el inserto del fragmento blanco del gen GAPDH (fragmento de amplificación de los primeros diseñados para GAPDH), con número de copias conocidas (100,000,000 a 1000 copias/4ml, 10,000,000 a 100 copias/4 µl y 100,000,000 a 100 copias/ 4 µl, respectivamente), con la ejecución de seis diluciones seriadas con los rangos mencionados para cada control positivo. Las reacciones de PCR en tiempo real para la cuantificación de las amplificaciones (HPV-16, HPV-18 y GAPDH) se realizaron por triplicado para cada muestra individual, para su análisis posterior. Se amplificó y cuantificó el fragmento del gen control (GAPDH) mediante su curva estándar y se determinó de esa forma el número de células contenidas en los tejidos procesados; este dato se empleó para normalizar el número de copias absolutas de los fragmentos amplificados de los HPV, según el tipo detectado en cada muestra (cociente = HPV-16 o HPV-18/GAPDH). Se verificó el tamaño de los fragmentos amplificados por medio de electroforesis en un gel de agarosa al 2%, tras colocar 4 µl del volumen de amplificación y visualizar las bandas en el gel de agarosa con luz UV, con el sistema de análisis de electroforesis EDAS 290 (EDAS 290 KODAK).
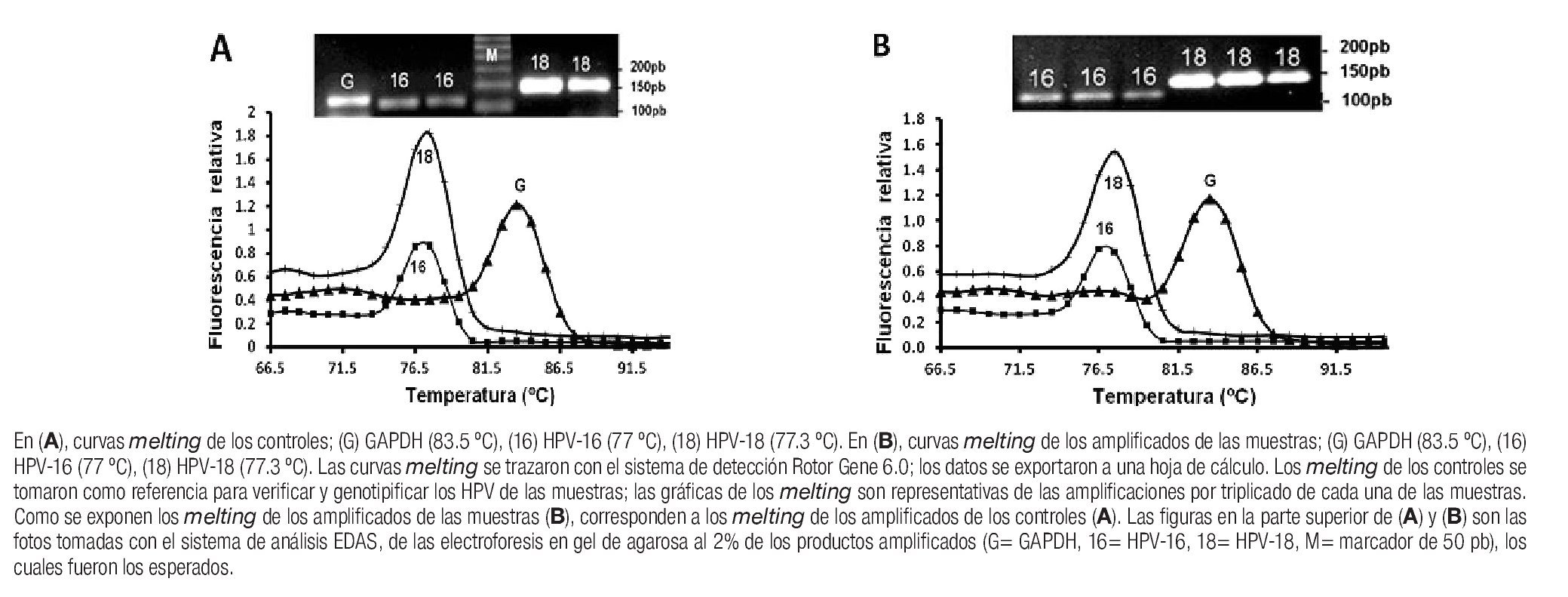
Análisis de los datos. Los datos de los CT (el CT se definió como el número de ciclos en el cual la intensidad de fluorescencia aumenta por arriba de la fluorescencia basal de dicha muestra) se analizaron y convirtieron a valores absolutos (número de copias) con el software Rotor-Gene 6.0 (Corbett Life Science, Sidney City, Australia); para el cálculo del número de copias se utilizaron las curvas estándar construidas y se normalizaron con el gen control, como se describió con anterioridad. Los productos generados durante el proceso de la PCR se sometieron al protocolo de disociación con intervalo de temperatura de 60-98 °C y se analizaron con el software Rotor Gene 6.0; los datos se exportaron y graficaron mediante una tabla de Excel para mostrar la temperatura de disociación (melting) característica de cada producto amplificado. La verificación de la especificidad de los primers para cada genotipo se realizó tras considerar la función de genotipificación del software Rotor Gene 6.0 (Corbett Life Science, Sidney City, Australia), el cual toma como referencia el melting de los fragmentos amplificados de los controles positivos (HPV-16, HPV-18 y GAPDH) y los compara con los melting de los fragmentos amplificados en cada una de las muestras analizadas.
RESULTADOS
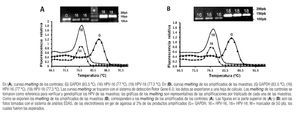
PCR en tiempo real, Rotor-Gene 3000 (amplificaciones, cuantificación absoluta y genotipos). Se tomaron 69 biopsias (al inicio, primera y segunda fases de tratamiento), se obtuvo ADN íntegro y suficiente, se cuantificó por fluorescencia (véase Materiales y métodos) y se realizaron las reacciones de amplificación, cuantificación por PCR en tiempo real y determinación de genotipos; las amplificaciones de los fragmentos (pb) de HPV-16, HPV-18 y GAPDH en cada muestra fueron los esperados (Imagen 1), con un incremento exponencial de la fluorescencia seguido de fase de meseta. Las muestras después de la fase de PCR en tiempo real se sometieron al protocolo de disociación de 60-95 °C, el cual indicó el número de productos y tipo de HPV amplificado (Imagen 1) en cada tubo, ya que el software toma como referencia los melting de los controles y los compara con los melting de las amplificaciones desconocidas (Imagen 1), que en este caso fueron de las 69 muestras obtenidas. Para la cuantificación absoluta se determinó el umbral de fluorescencia para las muestras en la fase de amplificación exponencial para obtener el valor de los CT (en los tubos con el DNA de las biopsias, curvas estándar y controles positivos); los CT de cada una de las muestras se convirtieron a valores absolutos tomando como referencia las curvas estándar construidas (HPV-16, r= 0.99020; HPV-18, r= 0.99098; GAPDH, r=0.99788) y se procedió al análisis de los datos según el estadio histopatológico, genotipo de HPV y comportamiento del número de copias de acuerdo con la fase de tratamiento.
Imagen 1. Curvas melting de amplificados de HPV-16, HPV-18 y GAPDH de controles y muestras.
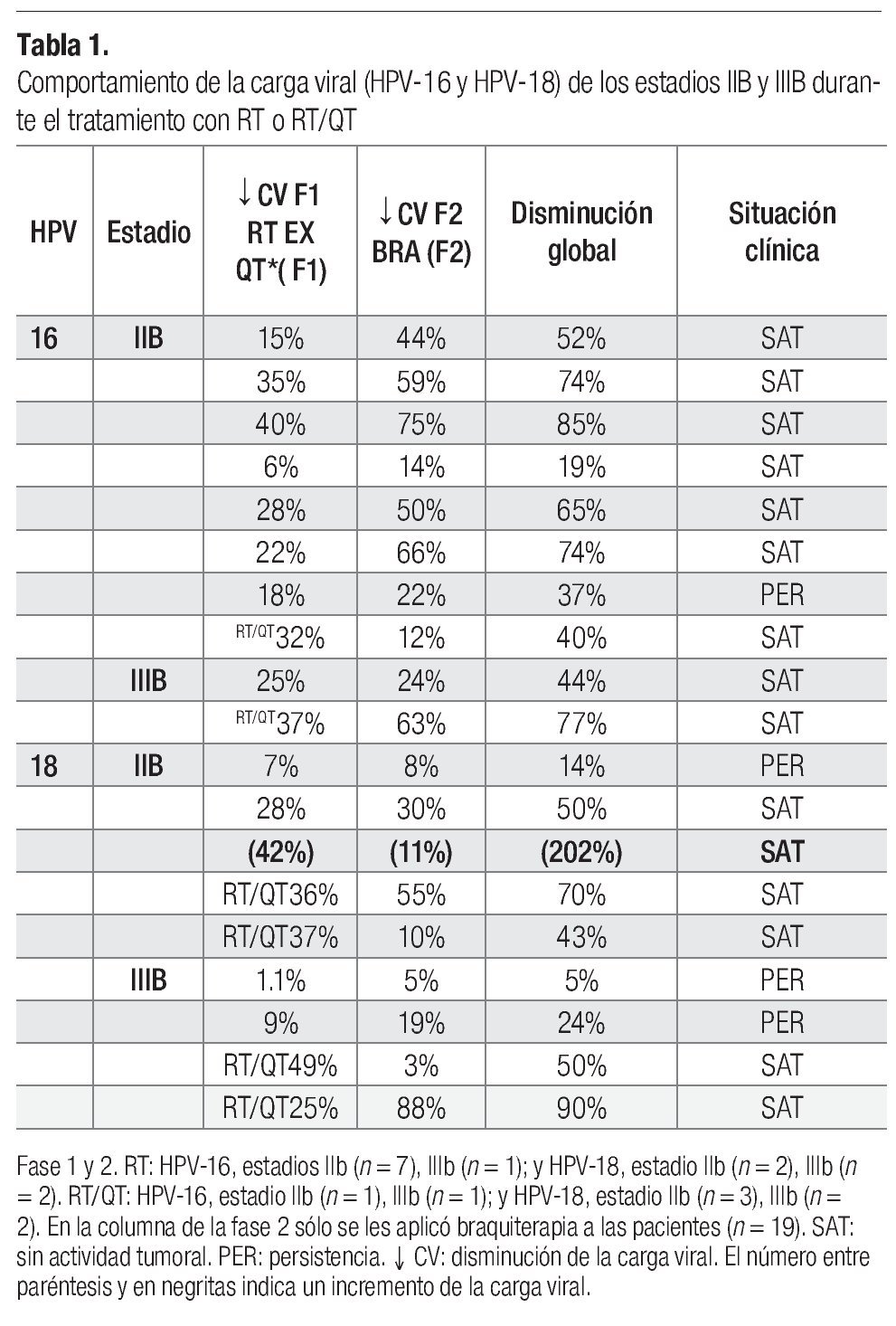
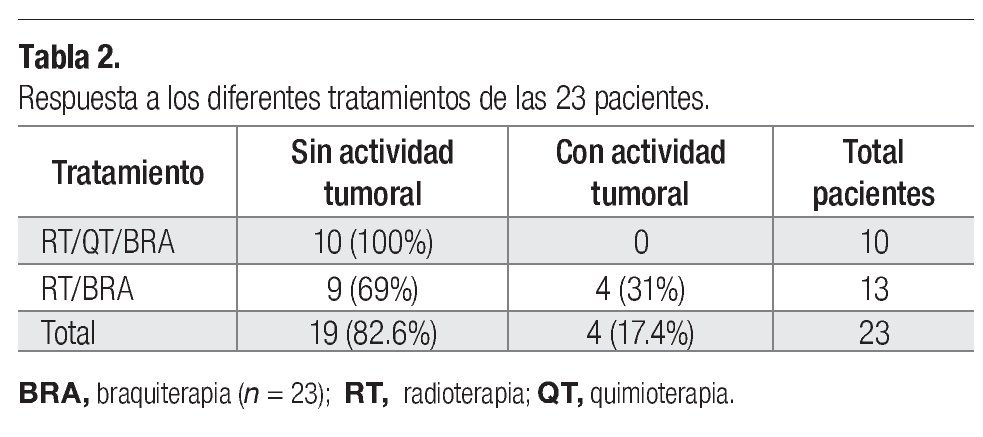
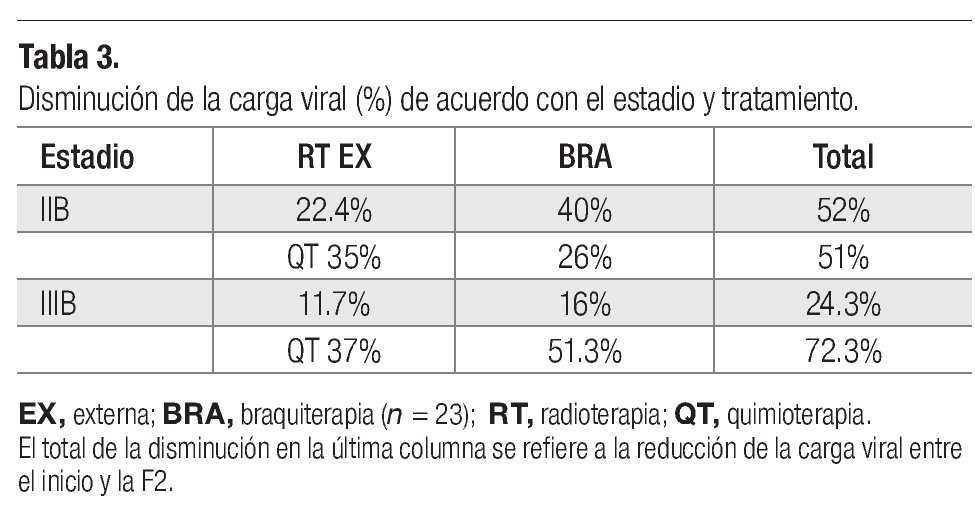
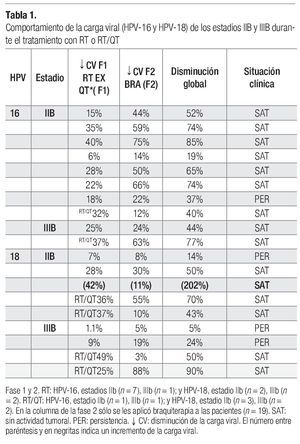
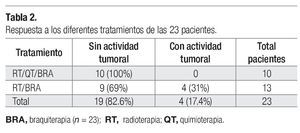
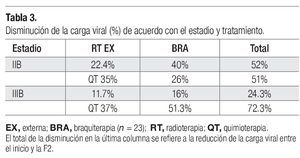
Comportamiento del HPV-16 y HPV-18 en las diferentes fases de tratamiento. De las 23 pacientes que ingresaron, se encontró carcinoma epidermoide con predominio de células grandes no queratinizadas en 16 casos (69.5%), células grandes queratinizadas en seis casos (26%) y células pequeñas en un solo caso (4.34%). Al inicio del tratamiento se determinó el número de copias de los dos tipos virales y en sólo cuatro de ellas no se determinó la carga viral porque no tenían los tipos estudiados y, de acuerdo con el estadio histopatológico, se estudió la carga viral en las diferentes fases de tratamiento (Tablas 1 y 2). En general, se observó que al final de la primera fase de tratamiento (F1), el número de copias virales disminuyó tanto para el HPV-16 como para el HPV-18 (Tablas 1 y 2). En la segunda fase de tratamiento (final de F2), se reconoció que la cantidad de copias virales continuó en descenso para ambos tipos de HPV (Tabla 1); además, se advirtió que el estadio histopatológico no se relacionó con un comportamiento característico sobre la cantidad de copias virales, ya que disminuyeron durante ambas fases de tratamiento (Tabla 1). Tampoco se presentó un comportamiento característico del número de copias virales en relación con el tamaño tumoral y la influencia de la persistencia del tumor, dado que no se observó un aumento o disminución del número de copias según fuera que el tumor disminuyera o persistiera (Tabla 1). Sin embargo, el tipo de tratamiento, en general, influyó en la carga viral y en la actividad tumoral; se observó que las pacientes tratadas con RT/QT más braquiterapia no presentaron una persistencia del desarrollo tumoral y se reconció una mayor disminución del número de copias virales en el estadio IIIB (Tablas 2 y 3).
DISCUSIÓN
La PCR convencional es una de las técnicas más sensibles y adecuadas, desde el punto de vista metodológico, para la detección y cuantificación del HPV.11,12 Por otro lado, la hibridación in situ permite la detección de HPV en forma episomal o integrado al ADN, pero es incapaz de determinar la carga viral; esta limitante no se observa con la metodología de la PCR en tiempo real, la cual hace posible la detección (genotipo) y cuantificación absoluta de los productos generados durante el proceso de la PCR; los reactivos más usados para esta metodología son: ensayos con exonucleasa 5',13 sondas taqman,14 sondas beacon15 y la tecnología de SYBR Green16. En este estudio se empleó la tecnología del SYBR Green, que consiste en el uso de un fluoróforo, el cual se intercala en el surco mayor de la doble cadena de ADN, y emite determinada fluorescencia bajo ciertas condiciones.
En el presente trabajo con la metodología de PCR en tiempo real se identificó el genotipo de HPV en las muestras biológicas y se cuantificaron en forma absoluta las copias de HPV. Asimismo, este protocolo fue similar al que realizaron Gravitt y colaboradores, en el cual fue posible determinar por PCR en tiempo real cargas virales indetectables con la técnica de captura de híbridos.17 En el presente estudio, con objeto de evitar el sesgo respecto del tamaño tumoral, se utilizó un gen control (GAPDH), el cual se presenta como copia única en cada genoma; con ello se controló la cantidad de células contenidas en cada biopsia.17- 23
En la bibliografía se menciona que una proporción significativa de infección por HPV se atribuye a cuatro tipos virales: 6, 11, 16 y 18. Los tipos HPV-16 y HPV-18 son los causantes de casi el 70% de todos los casos de cáncer cervical. El tipo histológico tumoral en todas las pacientes correspondió al grupo de carcinoma epidermoide; dicho resultado concuerda con lo reportado en la literatura acerca de la prevalencia de este tipo de carcinoma en el CaCu. 24,25 En un estudio que condujeron Dueñas y colaboradores, con una población de 34 pacientes y con la técnica de PCR en tiempo real, se encontró positiva a HPV la totalidad de las pacientes con diagnóstico de CaCu (el estudio se realizó con tejido tumoral cervical). Este resultado fue similar al notificado en el trabajo presente. En el mismo estudio se indicó que 50% de las pacientes fue positivo para HPV-16, 23% para HPV-18 y 27% para otros tipos.9 En otro trabajo, Pulido y colaboradores encontraron un 61.9% de positividad para HPV-16.26 Lai y colaboradores cuantificaron bajo ciertas limitaciones el número de copias de HPV mediante la técnica de captura de híbridos al inicio del tratamiento con RT en una población de 114 pacientes y registraron un 28.1% de pacientes negativas para HPV de alto riesgo, 71.9% positivo para HPV de alto riesgo y de estas últimas el 69.5% fue positivo para HPV-16.27 En el presente estudio se observó que los tipos predominantes en el CaCu fueron el HPV-16 (43.4%), el HPV-18 (39.1%) y otros genotipos (17.3%). Todo ello demuestra que los genotipos más comunes fueron el 16 y 18, tal y como lo constatan también las publicaciones internacionales. Peitsaro y colaboradores determinaron el número de copias virales de muestras de tejido cervical en 24 mujeres con neoplasias intraepiteliales de grados uno a tres mediante PCR en tiempo real y notificaron un número de copias virales totalmente heterogéneas con rangos de 1474 a 4,687,719 copias virales.28 En el estudio presente, los resultados de cargas virales fueron heterogéneas para un mismo estadio y es probable que no se encuentre relación; los estudios de Dueñas, Moberg y Lukaszuk identificaron resultados similares, lo que hace suponer que el número de copias virales es independiente del estadio.9, 29, 30
Tanto en este trabajo como en los realizados por Lai y Yoko Harima se estudió la posible vinculación entre la carga del HPV y la respuesta de la RT, pero no se determinó el comportamiento de la carga viral durante el tratamiento;27,31 además, se observó que en las pacientes que persistieron con la enfermedad (17.4 %) al finalizar el tratamiento único de RT (F1), disminuyó el valor global del número de copias virales a menos de 40%, aunque se observó una persistencia del volumen tumoral. La explicación de este comportamiento puede encontrarse en factores intrínsecos del paciente, que no permiten establecer un nexo con el estadio de la enfermedad. Otra explicación puede ser la que propusieron Herrera y colaboradores, quienes señalan que el HPV es un inductor de mutaciones en el epitelio cervical; sin embargo, éste no es el único factor que influye en el proceso de carcinogénesis, dado que también son necesarios los factores promotores de la proliferación policlonal y la progresión tumoral;32 esta explicación se sustenta en la teoría de la regresión propuesta por Hildesheim y colaboradores y Ho y colaboradores, según la cual sólo el 25% de las infecciones primarias por HPV progresa a malignidad, con reducción del número de copias virales. De acuerdo con este teoría, durante el curso clínico de la enfermedad ya están presentes células en progresión hacia el fenotipo maligno, al margen de que el tratamiento inactive al virus. Por lo tanto, aunque el número de copias virales disminuya durante el tratamiento, la enfermedad puede progresar por el daño previo inducido.33,34
En el 82.6% de las pacientes estudiadas aquí se observó una reducción del número de copias virales en el CaCu después del tratamiento con RT o RT/QT, lo que apoya los beneficios terapéuticos del uso concomitante de la RT/QT y concuerda con el trabajo de Fakhry y colaboradores (2008), quienes demostraron que existe una relación entre el estado tumoral del carcinoma de células escamosas de orofaringe positivo para HPV-16, 33 y 35 y la respuesta terapéutica, con un incremento registrado del 95% de la supervivencia de los pacientes tratados con quimioterapia.35 De acuerdo con los resultados obtenidos de este estudio, sería conveniente evaluar la respuesta de las pacientes con CaCu a largo plazo y considerar la evolución clínica, la vinculación en el número de copias virales/estadio de la enfermedad y la relación costo-beneficio para que la carga viral sea un factor pronóstico determinante, dato que cada vez está más fundamentado en las publicaciones y se lo considera ya un factor pronóstico determinante en la sobrevida global y la sobrevida libre del CaCu.27,30
Correspondencia:
Dr. Esaú Floriano Sánchez.
Departamento de Bioquímica y Biología Molecular, Escuela Médico Militar.
Cerrada de Palomas/Esquina Periférico. Col. Lomas de Sotelo. C.P. 11200.
Universidad del Ejército y Fuerza Aérea. México, D.F.
Teléfono: 5540-7728, ext. 175.
Correo electrónico:floriano_esa@yahoo.com