Las escalas de fragilidad, desarrolladas para evaluar a pacientes ancianos, se están implementando en pacientes críticos. Una de las más utilizadas es la Clinical Frailty Scale, adaptada recientemente al español (CFS-España).
ObjetivoEvaluar la validez y la sensibilidad al cambio de la CFS-España, en una cohorte de pacientes críticos ≥18 años.
MetodologíaEstudio observacional prospectivo, multicéntrico, de carácter métrico llevado a cabo entre enero de 2020 y julio de 2024. Fueron incluidos pacientes adultos con estancias en UCI>48h y seguidos durante la estancia y hasta un año del alta. Variables: fragilidad, características sociodemográficas, calidad de vida, comorbilidades, gravedad (SAPS3), variables de evolución en UCI, estancia y destino al alta. Análisis estadístico: exploratorio, regresión bivariante para evaluar la relación entre fragilidad y las variables registradas; regresión multivariante de variables significativas en bivariante. Correlación de Spearman de CFS-España con variables cuantitativas. Comparación de medias con t de Student para sensibilidad al cambio.
ResultadosFueron incluidos 493 pacientes, 17,4% frágiles (CFS-España=5-9). La edad, ser mujer y ser dependiente aumentan el riesgo de fragilidad, además de los días de ingresos previos, comorbilidades, peor calidad de vida física, bajo nivel académico y rentas anuales bajas. La fragilidad es predictiva de debilidad muscular, hipoglucemias, necesidad de depuración extrarrenal, ventilación mecánica invasiva, fármacos vasoactivos, reanimación cardiopulmonar o limitación del tratamiento de soporte vital y se asocia con mortalidad. La fragilidad no muestra relación con la calidad de vida mental, SAPS3, SOFA o estancia en UCI ni en hospital. El mayor cambio observado ha sido entre el ingreso y los 3 meses del alta. El tamaño del efecto de los cambios de la CFS-España entre ingreso, puntos intermedios y alta fue elevado (d=0,832).
ConclusionesLa CFS-España muestra buena validez convergente con edad, mujeres, dependencia, peor calidad de vida física, días de hospitalización previa, nivel académico y rentas anuales bajas. También muestra validez predictiva para el nivel de soporte vital en UCI, mortalidad y destino al alta hospitalaria.
Frailty scales, developed to assess elderly patients, are being implemented in critically ill patients. One of the most widely used is Clinical Frailty Scale, wrecently adapted to Spanish (CFS-Spain).
ObjectiveTo evaluate the validity and sensitivity to change of the CFS-España in a cohort of critically ill patients aged ≥18 years.
MethodologyA prospective, multicenter, observational, metric-based study was conducted between January-2020 and July-2024. Adult patients with ICU stays>48hours were included. Follow-up was performed during the stay and up to one year after discharge. Variables: frailty, sociodemographic characteristics, quality of life, comorbidities, severity (SAPS3), ICU outcome variables, length of stay, and discharge destination. Statistical analysis: exploratory, bivariate regression to assess the relationship between frailty and the recorded variables; multivariate regression of significant variables in bivariate. Spearman correlation of CFS-Spain with quantitative variables. Comparison of means with Student's t-test for sensitivity to change.
ResultsA total of 493 patients were included, 17.4% of whom were frail (CFS-Spain=5-9). Age, being female, and being dependent increased the risk of frailty, as did previous hospitalizations, comorbidities, poorer physical quality of life, low academic level, and low annual income. Frailty predicts muscle weakness, hypoglycemia, the need for extrarenal blood pressure, invasive mechanical ventilation, vasoactive drugs, cardiopulmonary resuscitation, or limitation of life-sustaining treatment, and is associated with mortality. Frailty was not associated with mental quality of life, SAPS3, SOFA or ICU/hospital stay. The greatest change observed was between admission and 3 months after discharge. The effect size for changes in CFS-Es between admission, midpoints, and discharge was high (d=0.832).
ConclusionsThe CFS-Spain shows good convergent validity with age, women, dependency, poorer physical quality of life, days of previous hospitalization, academic level and low annual income. Good predictive validity for the level of vital support in ICU, mortality and destination at hospital discharge.
La fragilidad es un concepto desarrollado por los geriatras para evaluar el grado de deterioro fisiológico relacionado con la edad que sufre nuestro organismo. Los pacientes críticos podrían tener similitudes teóricas con los ancianos frágiles y, por ello, se están implementando las escalas de fragilidad en los pacientes críticos. La Clinical Frailty Scale ha sido adaptada a más de 20 idiomas, entre ellos al español de España (CFS-España).
Qué aportaEs importante adaptar culturalmente las escalas a la población en la que se va a implementar y también es fundamental determinar sus propiedades métricas para conocer sus limitaciones. En el presente estudio se evalúa la validez de la versión española de la escala Clinical Frailty Scale (CFS-España) cuando se implementa en pacientes críticos.
En la actual cohorte se ha observado que los pacientes frágiles (CFS-España en niveles de 5 a 9) son de mayor edad, mujeres, dependientes, con peor calidad de vida física y con nivel académico bajo y rentas anuales bajas. Además, precisan mayor nivel de soporte vital en UCI, tienen mayor mortalidad y menor probabilidad de alta a domicilio.
Implicaciones para la prácticaLa validación de las escalas en los diferentes ámbitos de aplicación es indispensable para tener la seguridad de medidas confiables. En este estudio se presenta la validación de la CFS-España en el ámbito de los cuidados intensivos (UCI). Evaluar la fragilidad de un paciente al ingreso en la UCI con la escala CFS-España puede ayudarnos a desarrollar planes de cuidados específicos según su fragilidad. La validez predictiva de la escala nos permite conocer el riesgo de determinados desenlaces negativos y, por lo tanto, desarrollar estrategias para evitarlos.
La fragilidad puede definirse como un aumento de la vulnerabilidad. Las personas frágiles, ante hechos aparentemente triviales, como un medicamento nuevo, una infección leve o un procedimiento quirúrgico menor, pueden tener una evolución clínica desfavorable1.
Para evaluar la fragilidad se han desarrollado un gran número de herramientas2. Las más utilizadas para la evaluación de la fragilidad en pacientes críticos3-6 son la Clinical Frailty Scale,Frailty phenotype de Fried, Frailty Index o la Edmonton frail scale. De ellas, la más implementada es la Clinical Frailty Scale (CFS)7, que ha sido adaptada a más de 20 idiomas8, entre ellos al español (CFS-España)9.
La CFS fue desarrollada y validada en el segundo estudio canadiense de salud y envejecimiento (Canadian Study of Health and Aging, CSHA) para evaluar la fragilidad de los ancianos. A esta escala de 2005, los autores añadieron 2 niveles en 2007, por lo que pasó de tener 7 niveles a 9. Los pacientes que se encuentran en los niveles 1 a 3 se definen como no frágiles, en el nivel 4 son vulnerables y del nivel 5 al 8 son pacientes frágiles (fragilidad leve, moderada, grave o muy grave según el nivel). En el nivel 9 se encuentran los pacientes en situación terminal, con esperanza de vida inferior a 6 meses, sean frágiles o no. Se estratifica a los pacientes con demencia como pacientes con fragilidad leve (nivel 5), moderada (nivel 6) o grave (nivel 7). En 2020, se redefinieron los niveles: los individuos que se encontraban en el nivel 4 pasaron de ser vulnerables a tener una fragilidad muy leve. No obstante, la definición de este nivel se mantuvo invariable10.
Se podría considerar que los pacientes críticos pueden tener similitudes teóricas con los pacientes ancianos frágiles11, por lo que desde hace más de una década se han empezado a implementar las escalas de fragilidad en pacientes críticos adultos. Tener una valoración de fragilidad al ingreso en la unidad de cuidados intensivos (UCI) orienta sobre los recursos y cuidados específicos que van a precisar estos pacientes, por lo que se pueden ajustar los planes de cuidado y tratamientos médicos e intentar minimizar las consecuencias negativas de su paso por la UCI.
En este sentido, se ha evaluado la CFS3,5,12 como una herramienta útil para identificar pacientes con mayor vulnerabilidad y mayor riesgo de incrementar la estancia en la UCI y en el hospital y, también, la mortalidad. Para garantizar su aplicabilidad en diferentes poblaciones, es fundamental contar con versiones adaptadas y validadas culturalmente. La fiabilidad interobservador e intraobservador de la CFS-España, entre enfermeras y médicos de la UCI, ya ha sido evaluada13. El objetivo de este estudio fue evaluar la validez y sensibilidad al cambio de la CFS-España9 en una cohorte de pacientes críticos de 18 años o más.
MetodologíaDiseño y participantesEstudio observacional prospectivo y de carácter métrico de una cohorte de pacientes críticos realizado en 10 UCI de España entre enero de 2020 y julio de 2024. Se informa del estudio psicométrico siguiendo el listado de verificación COSMIN14.
La captación de pacientes se realizó desde enero de 2020 hasta julio de 2023 (interrumpida entre marzo de 2020 y abril de 2021 por la pandemia de la covid-19) y se les hizo un seguimiento hasta un año (julio de 2024), mediante llamadas telefónicas a los 3, 6, 9 y 12 meses del alta hospitalaria. Fueron incluidos todos los pacientes de 18 años o más, con estancias> 48 h en UCI y que aceptaron participar. No se incluyó a pacientes con diagnóstico de muerte encefálica presente o inminente, con limitación del tratamiento de soporte vital al ingreso, con reingresos, procedentes de otras UCI, cuya comunicación con ellos y con sus familiares no fuera posible ni a aquellos ingresados por covid-19. Los centros participantes en el estudio fueron seleccionados con intención de diversidad geográfica y según disponibilidad.
Implementacion del instrumentoLa valoración de la fragilidad con la escala CFS-España fue realizada por los miembros del equipo investigador de cada unidad participante, al ingreso en la UCI y en cada una de las llamadas telefónicas del seguimiento. La valoración fue hecha de forma directa al paciente o a los familiares directos, en caso de incapacidad del paciente para comunicarse. Se evaluó el nivel de fragilidad según la mejor situación en el mes anterior (al ingreso) o en el momento de la llamada durante el seguimiento. Los investigadores no tuvieron un entrenamiento previo de capacitación para implementar la escala. En la figura 1 se muestra la clasificación y las definiciones de la CFS-España.
Cálculo de la muestraPara garantizar la validez y fiabilidad de los resultados obtenidos en este estudio se ha determinado un tamaño muestral de 430 participantes. Esta decisión se basa en las recomendaciones de diversos autores, que proponen tener entre 5 y 10 pacientes por ítem para los análisis factoriales confirmatorios. Además, contar con al menos 300 participantes permite obtener soluciones fiables y robustas, y asegura que los resultados sean representativos de la población de estudio. Este tamaño muestral también cumple con la regla general de tener al menos 300 participantes para obtener estimaciones precisas y consistentes15.
Recolección de datosSe registraron al ingreso en UCI y en las llamadas del seguimiento las siguientes variables: el nivel de fragilidad (CFS-España), características sociodemográficas del paciente (edad, sexo, índice de masa corporal [IMC], estado civil, nivel educativo, situación laboral, renta anual), dependencia (Barthel16 y Lawton-Brody17), calidad de vida (SF-1218) y los ingresos en el año anterior en hospital o UCI (al ingreso) o en los 3 últimos meses (en las llamadas de seguimiento).
Se registraron solo al ingreso en UCI: índice de comorbilidad (Charlson19), osteoporosis, gravedad (SAPS320) y diariamente durante la estancia en UCI: glucemia (máxima y mínima), dolor (máximo y mínimo; EVN o ESCID21), nivel de agitación/sedación (máximo y mínimo; RASS22), delirio (CAM-ICU23,24), utilización de contenciones mecánicas, movilización máxima (IMS-Es25), depuración extrarrenal, administración de fármacos vasoactivos, transfusiones, oxigenoterapia (ventilación mecánica invasiva y no invasiva, de alto flujo con cánulas nasales), reanimación cardiopulmonar, limitación de medidas del soporte vital, eventos adversos (retirada accidental del tubo traqueal, reintubación por extubación fallida, bacteriemia relacionada con catéteres venosos centrales, neumonía asociada a la ventilación mecánica, infección urinaria relacionada con la sonda vesical), fallo orgánico (SOFA26) y fisioterapia. Semanalmente, desde el momento que hubiese colaboración del paciente, la escala de debilidad muscular (MRC-SS27). Asimismo, se registraron los días de estancia en UCI y en hospital y el destino al alta. En el material adicional se incluye la definición operativa de las variables registradas.
Análisis estadísticoLas variables cualitativas se presentan con frecuencias absolutas (n) y relativas (%). Las variables cuantitativas se describen como mediana y rango intercuartílico [Q1-Q3], tras comprobar la ausencia de normalidad aplicando la prueba de Shapiro-Wilk.
Para determinar la validez de la escala CFS-España, se calculó una regresión bivariante de cada variable con la CFS-España estratificada, según pacientes no frágiles (CFS-España de 1 a 4) y frágiles (CFS-España de 5 a 9) y un análisis multivariante de las variables significativas. Se presentan las oddsratio (OR) de fragilidad, con el intervalo de confianza del 95% (IC95%) y la significación estadística (p). Además, se correlacionó la valoración de la CFS-España con las variables cuantitativas mediante una correlación de Spearman, considerando correlación nula con valores <0,10, débil con 0,10-0,29, moderada si 0,30-0,50) y fuerte con>0,5028.
La sensibilidad al cambio se evaluó mediante la prueba t de Student, comparando la diferencia de medias (desviación estándar) de la CFS-España en los 5momentos registrados (en la situación basal antes del ingreso y a los 3, 6, 9 y 12 meses del alta hospitalaria). Se evaluó con el tamaño del efecto (d), calculado con base en 3situaciones: 1) considerando solo los pacientes que fueron evaluados hasta los 12 meses del alta; 2) considerando a los pacientes fallecidos con la máxima puntuación de fragilidad (CFS-9) y 3) considerando a los pacientes fallecidos con la puntuación de la última valoración. Valores d de Cohen<0,49 indican efecto de pequeño tamaño; efecto moderado 0,5-0,79 y efecto elevado ≥0,8029.
Para evaluar el efecto de suelo y techo se determinó la proporción de pacientes con las mínimas puntuaciones (CFS-España=1) y las máximas (CFS-España=9) en el ingreso y en cada una de las valoraciones del seguimiento. Los efectos de suelo y techo <15% son considerados como aceptables30.
Los análisis fueron realizados con SPSS Statistics® para Windows (versión 23.0 IBM Corp; EE. UU.) y Stata® (versión IC14, StataCorp LLC; EE. UU.).
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética de Investigación con Medicamentos del hospital de referencia (CEIm19/42) y por los comités de ética o comisiones de viabilidad de los centros colaboradores. Se precisó el consentimiento del paciente, o familiar más cercano, mientras no pudiera dar su consentimiento personalmente.
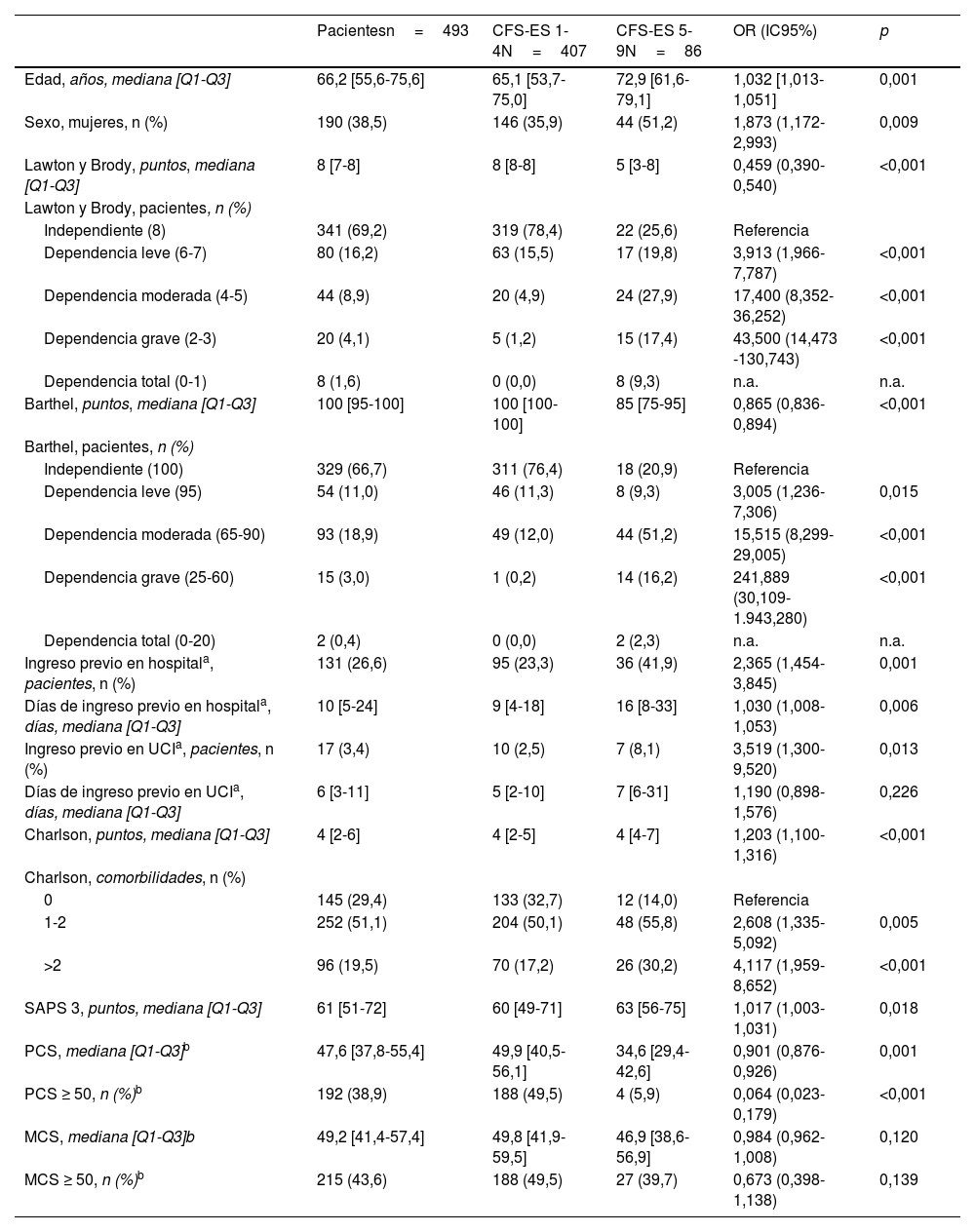
ResultadosSe incluyeron en el estudio 493 pacientes (fig. 2). Las características de los pacientes pueden verse en la tabla 1 y las características de las unidades en el material adicional (tabla S1 del Anexo B). La prevalencia de fragilidad observada al ingreso en UCI fue del 17,4%. De todas las llamadas de seguimiento (1.929), se perdieron 61 (3,2%) por no poder contactar con pacientes o familiares.
Validez convergente y divergente de la Clinical Frailty Scale-España
| Pacientesn=493 | CFS-ES 1-4N=407 | CFS-ES 5-9N=86 | OR (IC95%) | p | |
|---|---|---|---|---|---|
| Edad, años, mediana [Q1-Q3] | 66,2 [55,6-75,6] | 65,1 [53,7-75,0] | 72,9 [61,6-79,1] | 1,032 [1,013-1,051] | 0,001 |
| Sexo, mujeres, n (%) | 190 (38,5) | 146 (35,9) | 44 (51,2) | 1,873 (1,172-2,993) | 0,009 |
| Lawton y Brody, puntos, mediana [Q1-Q3] | 8 [7-8] | 8 [8-8] | 5 [3-8] | 0,459 (0,390-0,540) | <0,001 |
| Lawton y Brody, pacientes, n (%) | |||||
| Independiente (8) | 341 (69,2) | 319 (78,4) | 22 (25,6) | Referencia | |
| Dependencia leve (6-7) | 80 (16,2) | 63 (15,5) | 17 (19,8) | 3,913 (1,966-7,787) | <0,001 |
| Dependencia moderada (4-5) | 44 (8,9) | 20 (4,9) | 24 (27,9) | 17,400 (8,352-36,252) | <0,001 |
| Dependencia grave (2-3) | 20 (4,1) | 5 (1,2) | 15 (17,4) | 43,500 (14,473 -130,743) | <0,001 |
| Dependencia total (0-1) | 8 (1,6) | 0 (0,0) | 8 (9,3) | n.a. | n.a. |
| Barthel, puntos, mediana [Q1-Q3] | 100 [95-100] | 100 [100-100] | 85 [75-95] | 0,865 (0,836-0,894) | <0,001 |
| Barthel, pacientes, n (%) | |||||
| Independiente (100) | 329 (66,7) | 311 (76,4) | 18 (20,9) | Referencia | |
| Dependencia leve (95) | 54 (11,0) | 46 (11,3) | 8 (9,3) | 3,005 (1,236-7,306) | 0,015 |
| Dependencia moderada (65-90) | 93 (18,9) | 49 (12,0) | 44 (51,2) | 15,515 (8,299-29,005) | <0,001 |
| Dependencia grave (25-60) | 15 (3,0) | 1 (0,2) | 14 (16,2) | 241,889 (30,109-1.943,280) | <0,001 |
| Dependencia total (0-20) | 2 (0,4) | 0 (0,0) | 2 (2,3) | n.a. | n.a. |
| Ingreso previo en hospitala, pacientes, n (%) | 131 (26,6) | 95 (23,3) | 36 (41,9) | 2,365 (1,454-3,845) | 0,001 |
| Días de ingreso previo en hospitala, días, mediana [Q1-Q3] | 10 [5-24] | 9 [4-18] | 16 [8-33] | 1,030 (1,008-1,053) | 0,006 |
| Ingreso previo en UCIa, pacientes, n (%) | 17 (3,4) | 10 (2,5) | 7 (8,1) | 3,519 (1,300-9,520) | 0,013 |
| Días de ingreso previo en UCIa, días, mediana [Q1-Q3] | 6 [3-11] | 5 [2-10] | 7 [6-31] | 1,190 (0,898-1,576) | 0,226 |
| Charlson, puntos, mediana [Q1-Q3] | 4 [2-6] | 4 [2-5] | 4 [4-7] | 1,203 (1,100-1,316) | <0,001 |
| Charlson, comorbilidades, n (%) | |||||
| 0 | 145 (29,4) | 133 (32,7) | 12 (14,0) | Referencia | |
| 1-2 | 252 (51,1) | 204 (50,1) | 48 (55,8) | 2,608 (1,335-5,092) | 0,005 |
| >2 | 96 (19,5) | 70 (17,2) | 26 (30,2) | 4,117 (1,959-8,652) | <0,001 |
| SAPS 3, puntos, mediana [Q1-Q3] | 61 [51-72] | 60 [49-71] | 63 [56-75] | 1,017 (1,003-1,031) | 0,018 |
| PCS, mediana [Q1-Q3]b | 47,6 [37,8-55,4] | 49,9 [40,5-56,1] | 34,6 [29,4-42,6] | 0,901 (0,876-0,926) | 0,001 |
| PCS ≥ 50, n (%)b | 192 (38,9) | 188 (49,5) | 4 (5,9) | 0,064 (0,023-0,179) | <0,001 |
| MCS, mediana [Q1-Q3]b | 49,2 [41,4-57,4] | 49,8 [41,9-59,5] | 46,9 [38,6-56,9] | 0,984 (0,962-1,008) | 0,120 |
| MCS ≥ 50, n (%)b | 215 (43,6) | 188 (49,5) | 27 (39,7) | 0,673 (0,398-1,138) | 0,139 |
CFS-Es 1-4: pacientes no frágiles; CFS-Es 5-9: pacientes frágiles; CFS-Es: ClinicalFrailtyScale-España; IC: intervalo de confianza; MCS: componente mental del cuestionario de calidad de vida percibida SF-12; SF-12: 12-item Short Form Survey; n.a.: no aplicable; OR: oddsratio; PCS: componente físico del cuestionario de calidad de vida percibida SF-12; SAPS: Simplified Acute Physiologic Score.
En el análisis bivariante, se observa que la edad aumenta el riesgo de fragilidad (oddsratio por año de incremento 1,032 [IC95%: 1,013-1,051]) con diferencias significativas según grupos de edad: los pacientes mayores de 65 años tienen 1,765 veces mayor riesgo de fragilidad que los menores de 65 años y 2,850 veces mayor riesgo que los menores de 50 años; las mujeres tienen mayor riesgo de fragilidad que los varones (OR 1,873; IC95: 1,172-2,993), así como los pacientes con obesidad mórbida (IMC>40) (OR 4,433; IC95%: 1,337-14,703) y las personas viudas (OR 3,286; IC95%: 1,291-8,361). Por el contrario, se asocian con una menor probabilidad de tener fragilidad al ingreso: haber cursado estudios de secundaria o universitarios, vivir en una familia conyugal o tener rentas anuales, personales o familiares, superiores a 12.500 €.
Los pacientes dependientes tienen mayor riesgo de ser frágiles, tanto evaluando la dependencia para las actividades instrumentales (escala de Lawton y Brody) como para las actividades básicas de la vida diaria (escala de Barthel). Se han observado diferencias significativas para cada una de las actividades evaluadas en ambas escalas. Tener 1 o 2 comorbilidades del índice de Charlson incrementa el riesgo de ser frágil 2,608 veces y tener más de 2 comorbilidades en 4,117 veces; el riesgo se ve incrementado especialmente con las comorbilidades de demencia, úlcera gastroduodenal, enfermedad hepática leve, diabetes con lesión en órganos diana y también en pacientes con osteoporosis.
En el análisis multivariante, ajustado por las variables descritas en la tabla 2, se asocia a tener fragilidad al ingreso en la UCI el ser mujer, tener dependencia moderada para las actividades de la vida diaria e instrumentales y el número de los días que permanecieron ingresados en un hospital en el año previo al ingreso actual.
Análisis multivariante de variables relacionadas con la fragilidad al ingreso en UCI
| OR (IC95%) | p | |
|---|---|---|
| Edad | 0,994 (0,945-1,046) | 0,823 |
| Sexo femenino | 3,809 (1,160-12,506) | 0,027 |
| Dependencia, Lawton y Brody | ||
| Independiente (8) | Referencia | |
| Dependencia leve (6-7) | 1,347 (0,318-5,790) | 0,680 |
| Dependencia moderada (4-5) | 5,446 (1,026-28,918) | 0,047 |
| Dependencia grave (2-3) | 2,322 (0,119-45,257) | 0,578 |
| Dependencia total (0-1) | n.a. | n.a |
| Dependencia, Barthel | ||
| Independiente (100) | Referencia | |
| Dependencia leve (95) | 1,736 (0,295-10,235) | 0,542 |
| Dependencia moderada (65-90) | 7,462 (1,699-32,762) | 0,008 |
| Dependencia grave (25-60) | n.a. | n.a. |
| Dependencia total (0-20) | n.a. | n.a. |
| Comorbilidades, Charlson | ||
| 0 | Referencia | |
| 1-2 | 1,653 (0,220-12,399) | 0,625 |
| >2 | 1,328 (0,146-12,100) | 0,802 |
| Días de ingreso hospitalario en el año anterior | 1,043 (1,008-1,079) | 0,043 |
IC: intervalo de confianza; n.a.: no aplicable; OR: oddsratio.
Se observa una correlación negativa y fuerte entre la CFS-España y la escala de Barthel (a mayor fragilidad, menor independencia) y con las escalas de calidad de vida, la física (PCS) al ingreso y a los 3, 6,9 y 12 meses y la mental (MCS) a los 9 meses (a mayor fragilidad, peor calidad de vida). Hay una correlación negativa moderada con la escala de Lawton y Brody y una correlación también moderada pero positiva con la edad y con el índice de Charlson. Observamos una correlación débil con los días previos de hospitalización y con la gravedad al ingreso estimada por el SAPS3 (tabla 3; y tablas S2, S3 y S4 del Anexo B).
Validez de la CFS-España. Correlaciones
| Validez convergente y divergente de la CFS-España. Correlaciones de Spearman | |||
|---|---|---|---|
| Variables correlacionadas | r | Correlación | p |
| CFS-Es vs. edad | 0,306 | Moderada | <0,001 |
| CFS-Es vs. Lawton y Brody | −0,499 | Moderada | <0,001 |
| CFS-Es vs. Barthel | −0,569 | Fuerte | <0,001 |
| CFS-Es vs. días de hospitalización previa Σ | 0,288 | Débil | 0,001 |
| CFS-Es vs. días de UCI previa Σ | 0,300 | No hay correlación | 0,242 |
| CFS-Es vs. Charlson | 0,418 | Moderada | <0,001 |
| CFS-Es vs. SAPS 3 | 0,209 | Débil | 0,014 |
| CFS-Es ingreso vs. PCS ingreso | −0,604 | Fuerte | <0,001 |
| CFS-Es ingreso vs. MCS ingreso | −0,194 | Débil | <0,001 |
| CFS-Es 3 meses vs. PCS 3 meses | −0,644 | Fuerte | <0,001 |
| CFS-Es 3 meses vs. MCS 3 meses | −0,408 | Moderada | <0,001 |
| CFS-Es 6 meses vs. PCS 6 meses | −0,741 | Fuerte | <0,001 |
| CFS-Es 6 meses vs. MCS 6 meses | −0,472 | Moderada | <0,001 |
| CFS-Es 9 meses vs. PCS 9 meses | −0,735 | Fuerte | <0,001 |
| CFS-Es 9 meses vs. MCS 9 meses | −0,510 | Fuerte | <0,001 |
| CFS-Es 12 meses vs. PCS 12 meses | −0,750 | Fuerte | <0,001 |
| CFS-Es 12 meses vs. MCS 12 meses | −0,422 | Moderada | <0,001 |
| CFS-Es vs. IMC | 0,048 | No hay correlación | 0,289 |
| Validez predictiva de la CFS-España. Correlaciones de Spearman | |||
|---|---|---|---|
| Variables correlacionadas | r | Correlación | p |
| CFS-Es vs. SOFA día 1 | 0,113 | Débil | 0,015 |
| CFS-Es vs. SOFA estancia en UCI | 0,133 | Débil | 0,003 |
| CFS-Es vs. días movilización pasiva | 0,090 | Nula | 0,046 |
| CFS-Es vs. días movilización activa | −0,009 | No hay correlación | 0,841 |
| CFS-Es vs. días de depuración extrarrenal | 0,169 | Débil | <0,001 |
| CFS-Es vs. estancia en UCI | 0,108 | Débil | 0,017 |
| CFS-Es vs. estancia en el hospital | 0,036 | No hay correlación | 0,430 |
| CFS-Es ingreso vs. PCS 3 meses | −0,369 | Moderada | <0,001 |
| CFS-Es ingreso vs. MCS 3 meses | −0,104 | No hay correlación | 0,051 |
| CFS-Es ingreso vs. PCS 6 meses | −0,386 | Moderada | <0,001 |
| CFS-Es ingreso vs. MCS 6 meses | −0,125 | Débil | 0,020 |
| CFS-Es ingreso vs. PCS 9 meses | −0,379 | Moderada | <0,001 |
| CFS-Es ingreso vs. MCS 9 meses | −0,138 | Débil | 0,011 |
| CFS-Es ingreso vs. PCS 12 meses | −0,367 | Moderada | <0,001 |
| CFS-Es ingreso vs. MCS 12 meses | −0,081 | No hay correlación | 0,140 |
| CFE-Es vs. días desde ingreso en UCI hasta DAUCI | −0,105 | No hay correlación | 0,132 |
| CFS-Es vs. días con delirio | 0,050 | No hay correlación | 0,268 |
| CFS-Es vs. días con Contenciones Mecánicas | 0,079 | No hay correlación | 0,081 |
CFS-Es: ClinicalFrailtyScale-España; DAUCI: debilidad adquirida en la UCI; MCS: componente mental del cuestionario de calidad de vida percibida SF-12; PCS: componente físico del cuestionario de calidad de vida percibida SF-12; SAPS: Simplified Acute Physiologic Score; SF-12: 12-item Short Form Survey; SOFA: Sequential Organ Failure Assessment; UCI: unidad de cuidados intensivos.
Con respecto a la validez predictiva de la escala CFS-España, es decir, la capacidad de predecir episodios futuros, se observa que la fragilidad (CFS-España: 5-9) es un factor de riesgo para desenlaces negativos relevantes (tablas 3 y 4).
Validez predictiva de la Clinical Frailty Scale-España
| Pacientesn=493 | CFS-ES 1-4N=407 | CFS-ES 5-9N=86 | OR (IC95%) | p | |
|---|---|---|---|---|---|
| DAUCI (MRC<48), pacientes, n (%) | 207 (42,0) | 163 (40,0) | 44 (51,2) | 2,622 (1,499-4,587) | 0,001 |
| Movilización solo pasiva (IMS-Es 0-3)a, n (%) | 343 (69,6) | 275 (67,6) | 68 (79,1) | 1,749 (1,046-2,925) | 0,033 |
| Fisioterapia en UCI, pacientes, n (%) | 189 (38,3) | 156 (38,3) | 33 (38,4) | 1,002 (0,621-1,616) | 0,994 |
| Pacientes con glucemiasb | |||||
| <80 mg/dL, n (%) | 151 (30,6) | 116 (28,5) | 35 (40,7) | 1,722 (1,064-2,785) | 0,027 |
| De 80 a 180 mg/dL, n (%) | 492 (99,8) | 406 (99,8) | 86 (100) | n.a. | n.a |
| De 181 a 215 mg/dL, n (%) | 282 (57,2) | 223 (54,8) | 59 (68,6) | 1,803 (1,099-2,959) | 0,022 |
| >215 mg/dL, n (%) | 203 (41,2) | 161 (39,6) | 42 (48,8) | 1,458 (0,914-2,327) | 0,118 |
| Pacientes con EVN / ESCIDb, n (%) | |||||
| De 0 a 3 | 490 (99,4) | 405 (99,5) | 86 (98,8) | 0,420 (0,038-4,682) | 0,481 |
| De 4 a 10 | 294 (59,6) | 236 (58,0) | 58 (67,4) | 1,501 (0,918-2,455) | 0,106 |
| Pacientes con RASSb, n (%) | |||||
| De +4 a+1 | 234 (47,5) | 186 (45,7) | 48 (55,8) | 1,501 (0,940-2,397) | 0,089 |
| 0 | 437 (88,6) | 365 (89,7) | 72 (83,7) | 0,592 (0,307-1,140) | 0,117 |
| De −1 a −2 | 292 (59,2) | 238 (58,5) | 54 (62,8) | 1,198 (0,742-1,936) | 0,460 |
| −3 | 205 (41,6) | 161 (39,6) | 44 (51,2) | 1,601 (1,003-2,554) | 0,048 |
| De −4 a −5 | 245 (49,7) | 190 (46,7) | 55 (64,0) | 2,026 (1,252-3,279) | 0,004 |
| Pacientes con diagnóstico de delirio, n (%) | 71 (14,4) | 58 (14,3) | 13 (15,1) | 1,072 (0,558-2,057) | 0,853 |
| Pacientes con contenciones mecánicas, n (%) | 270 (54,8) | 222 (54,5) | 48 (55,8) | 1,053 (0,659-1,681) | 0,830 |
| Transfusiones, pacientes, n (%) | |||||
| Sangre completa | 59 (12,0) | 47 (11,5) | 12 (14,0) | 1,242 (0,628-2,455) | 0,533 |
| Glóbulos rojos | 102 (20,7) | 73 (17,9) | 29 (33,7) | 2,328 (1,393-3,891) | 0,001 |
| Plasma | 37 (7,5) | 29 (7,1) | 8 (9,3) | 1,337 (0,589-3,035) | 0,488 |
| Plaquetas | 41 (8,3) | 35 (8,6) | 6 (7,0) | 0,797 (0,324-1,959) | 0,621 |
| Técnicas de depuración extrarrenal, pacientes, n (%) | 57 (11,6) | 38 (9,3) | 19 (22,1) | 2,754 (1,498-5,064) | 0,001 |
| Pacientes conb, n (%) | |||||
| VM invasiva | 332 (67,3) | 264 (64,9) | 68 (79,1) | 2,046 (1,171-3,575) | 0,012 |
| VM no invasiva | 48 (9,7) | 42 (10,3) | 6 (7,0) | 0,652 (0,268-1,586) | 0,345 |
| Alto flujo | 147 (29,8) | 117 (28,7) | 30 (34,9) | 1,328 (0,811-2,173) | 0,259 |
| Fármacos vasoactivos, pacientes, n (%) | 284 (57,6) | 215 (52,8) | 69 (80,2) | 3,625 (2,060-6,379) | <0,001 |
| Eventos adversos en UCIb, pacientes, n (%) | 102 (20,7) | 84 (20,6) | 18 (20,9) | 1,018 (0,574-1,804) | 0,952 |
| Eventos adversosb, n (%) | |||||
| Extubación no programada | 8 (1,6) | 6 (1,5) | 2 (2,3) | 1,591 (0,316-8,021) | 0,574 |
| Reintubación por extubación fallida | 29 (5,9) | 21 (5,2) | 8 (9,3) | 1,885 (0,806-4,410) | 0,144 |
| Bacteriemia relacionada con CVC | 28 (5,7) | 23 (5,7) | 5 (5,8) | 1,031 (0,381-2,791) | 0,953 |
| Neumonía asociada a VM | 47 (9,5) | 42 (10,3) | 5 (5,8) | 0,536 (0,206-1,398) | 0,203 |
| Infección urinaria por SV | 28 (5,7) | 25 (6,1) | 3 (3,5) | 0,552 (0,163-1,872) | 0,341 |
| Maniobras de RCPb, pacientes, n (%) | 19 (3,9) | 8 (2,0) | 11 (12,8) | 7,315 (2,847-18,793) | <0,001 |
| LTSVb, pacientes, n (%) | 45 (9,1) | 28 (6,9) | 17 (19,8) | 3,335 (1,732-6,420) | <0,001 |
| Destino al alta del hospital, n (%) | |||||
| Domicilio | 331 (67,1) | 291 (71,5) | 40 (46,5) | 0,405 (0,195-0,844) | 0,016 |
| Centro de larga estancia | 49 (10,0) | 37 (9,1) | 12 (14,0) | 2,467 (1,184-5,137) | 0,016 |
| Mortalidad, pacientes, n (%) | |||||
| En UCI | 53 (10,8) | 33 (8,1) | 20 (23,3) | 3,434 (1,859-6,346) | <0,001 |
| En hospital | 87 (17,6) | 54 (13,3) | 33 (38,4) | 4,070 (2,419-6,850) | <0,001 |
| Antes de los 3 meses | 104 (21,1) | 63 (15,5) | 41 (47,7) | 4,975 (3,014-8,212) | <0,001 |
| Antes de los 6 meses | 114 (23,1) | 71 (17,4) | 43 (50,0) | 4,732 (2,887-7,757) | <0,001 |
| Antes de los 9 meses | 124 (25,2) | 79 (19,4) | 45 (52,3) | 4,557 (2,794-7,433) | <0,001 |
| Antes de los 12 meses | 133 (27,0) | 87 (21,4) | 46 (53,5) | 4,230 (2,603-6,873) | <0,001 |
| PCS ≥ 50 a los 3 meses, n (%)c | 79 (22,2) | 79 (24,8) | 0 (0,0) | n.a. | n.a |
| MCS ≥ 50 a los 3 meses, n (%)c | 134 (37,6) | 125 (39,3) | 9 (23,7) | 0,479 (0,219-1,046) | 0,065 |
| PCS ≥ 50 a los 6 meses, n (%)c | 102 (29,3) | 99 (31,8) | 3 (8,1) | 0,189 (0,057-0,630) | 0,007 |
| MCS ≥ 50 a los 6 meses, n (%)c | 143 (41,1) | 129 (41,5) | 14 (37,8) | 0,859 (0,426-1,732) | 0,671 |
| PCS ≥ 50 a los 9 meses, n (%)c | 109 (32,2) | 106 (34,8) | 3 (8,8) | 0,182 (0,054-0,608) | 0,006 |
| MCS ≥ 50 a los 9 meses, n (%)c | 141 (41,6) | 128 (42,0) | 13 (38,2) | 0,856 (0,413-1,773) | 0,676 |
| PCS ≥ 50 a los 12 meses, n (%)c | 115 (34,4) | 112 (37,5) | 3 (8,6) | 0,157 (0,047-0,523) | 0,003 |
| MCS ≥ 50 a los 12 meses, n (%)c | 144 (43,1) | 133 (44,5) | 11 (31,4) | 0,572 (0,270-1,210) | 0,144 |
CFS-Es 1-4: pacientes no frágiles; CFS-Es 5-9: pacientes frágiles; CFS-Es: ClinicalFrailtyScale-España; CVC: catéter venoso central; DAUCI: debilidad adquirida en la UCI; ESCID: escala de conductas indicadoras de dolor; EVN: escala verbal numérica; IC: intervalo de confianza; LTSV: limitación del tratamiento de soporte vital; MCS: componente mental del cuestionario de calidad de vida percibida SF-12; MRC: MedicalResearchCouncil; n.a: no aplicable; OR: oddsratio; PCS: componente físico del cuestionario de calidad de vida percibida SF-12; RCP: reanimación cardiopulmonar; SF-12: 12-item Short Form Survey; SV: sonda vesical; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
Los pacientes con movilización solo pasiva nunca fueron movilizados activamente durante la estancia en UCI.
Pacientes que en algún momento del ingreso en UCI hayan tenido glucemias en cada uno de los rangos considerados; que en algún momento durante la estancia en la UCI hayan tenido valoraciones de dolor o agitación/sedación situados en los estratos contemplados; que en algún momento del ingreso en UCI hayan tenido tratamiento con ventilación mecánica invasiva, ventilación mecánica no invasiva o alto flujo o hayan sufrido algún episodio adverso contemplado.
Los resultados de la PCS y la MCS a los 3 meses del alta hospitalaria son con 356 pacientes (318 no frágiles y 38 frágiles), a los 6 meses del alta hospitalaria con 348 pacientes (311 no frágiles y 37 frágiles), a los 9 meses con 339 pacientes (305 no frágiles y 34 frágiles) y a los 12 meses del alta hospitalaria con 334 pacientes (299 no frágiles y 35 frágiles).
Tener niveles de CFS-España de fragilidad al ingreso es un factor de riesgo para que, durante la estancia en UCI, los pacientes sean movilizados solo pasivamente (IMS-España<4) (OR 1,749; IC95%: 1,046-2,925), desarrollen debilidad muscular (DAUCI) (OR 2,622; IC95%: 1,499-4,587), tengan episodios de hipoglucemia (<80mg/dL) (OR 1,722; IC95%: 1,064-2,785) o hiperglucemia moderada (181-215mg/dL) (OR 1,803; IC95%: 1,099-2,959), precisen técnicas de depuración extrarrenal (OR 2,754; IC95%: 1,498-5,064), ventilación mecánica invasiva (OR 2,406; IC95%: 1,171-3,575), fármacos vasoactivos (OR 3,625; IC95%: 2,060-6,379), técnicas de reanimación cardiopulmonar (OR 7,315; IC95%: 2,847-18,793) o de ver limitado el tratamiento de soporte vital (OR 3,335; IC95%: 1,732-6,420). Se han observado diferencias en los niveles de sedación de los pacientes frágiles, aquellos con CFS-España> 4 tienen sedaciones más profundas, pero no se han observado diferencias ni en dolor ni en el diagnóstico de delirio.
La correlación entre la valoración de CFS-Es y el SOFA es débil, tanto si correlacionamos con el SOFA del día 1 de ingreso (r=0,113) como con la mediana de los valores de SOFA de toda la estancia en UCI (r=0,133). No se han observado diferencias en la estancia en UCI o en hospital; la CFS-España al ingreso tiene una correlación débil con la estancia en UCI (r=0,108) y no hay correlación (p=0,430) con la estancia en el hospital. Los pacientes frágiles tienen 2,467 veces mayor riesgo de ser dados de alta a un centro de larga estancia que los no frágiles (OR 2,467; IC95%: 1,184-5,137).
La fragilidad al ingreso (CFS-España: 5-9) se asocia a una mayor mortalidad en UCI (OR 3,434; IC95%: 1,859-6,346]), en el hospital (OR 4,070; IC95%: 2,419-6,850) e incluso hasta el año de alta del hospital (OR 4,230; IC95%: 2,603-6,873).
Entre los supervivientes del hospital, el porcentaje de pacientes con buena calidad de vida mental (MCS ≥ 50) fue mayor entre los no frágiles que entre los frágiles a los 3, 6, 9 y 12 meses, aunque las diferencias no llegaron a ser significativas. La buena calidad de vida física (PCS ≥ 50) fue significativamente superior en los pacientes no frágiles. La correlación entre la CFS-España antes del ingreso y la calidad de vida física percibida (PCS) en cada momento de evaluación resultó moderada, mientras que no hubo correlación o fue débil entre la CFS-España al ingreso y la calidad de vida mental (MCS) en cada momento de evaluación.
Sensibilidad al cambio y efecto suelo y techoEl tamaño del efecto de los cambios de la CFS-España entre el momento de la inclusión, los puntos intermedios y el alta fue elevada, tanto considerando solo a los supervivientes a 12 meses del alta (d=0,832), como considerando a los fallecidos con CFS-España de 9 (d=0,894) o considerando a los fallecidos con la última valoración realizada (d=0,874). El mayor cambio observado ha sido entre el ingreso y los 3 meses del alta (aumenta la CFS-España el 55,7% de los pacientes y disminuye el 9,3%) o entre el ingreso y los 12 meses del alta (aumentan la fragilidad el 50,3% y la disminuyen el 14,5%). En el momento de la inclusión el porcentaje de pacientes con la puntuación más baja de fragilidad (CFS-España=0) fue del 6,7% y con la puntuación más alta (CFS-España=9) fue del 0,0%. En el resto de los momentos de valoración, los porcentajes fueron similares, siempre presentó valores aceptables (<15%) (tablas S5 y S6 del Anexo B).
DiscusiónValidez convergente y divergenteEn nuestro estudio se observa que la CFS-España tiene buena validez convergente con la edad, el sexo, la dependencia, tanto para las actividades instrumentales como para las de la vida diaria, con escalas de comorbilidad y con factores socioeconómicos previos al ingreso.
La relación entre la CFS y la edad (a mayor edad, más probabilidad de fragilidad) se ha reportado previamente en estudios que han aplicado la CFS en pacientes mayores de 1631,32 o 18 años33-44. Sin embargo, otros autores no encuentran diferencias de edad entre pacientes no frágiles y frágiles cuando han empleado la CFS en pacientes mayores de 16 años45, de entre 50 y 65 años46 o en mayores de 7047 o de 80 años48. Esta discrepancia se podría explicar porque la correlación de la CFS-Es con la edad es moderada. Por otra parte, la controversia señala que no toda la fragilidad es explicada por la edad avanzada de los pacientes. La fragilidad también puede observarse en pacientes jóvenes al ingreso en la UCI. Por otro lado, debemos diferenciar entre la edad cronológica y la fisiológica49: personas jóvenes pueden tener acumulación de déficits o enfermedades que conlleve una edad fisiológica superior a la cronológica.
Asimismo, se ha reportado previamente una mayor incidencia de fragilidad en las mujeres32,35,38,41,42,45,47,50, aunque el riesgo de fragilidad de las mujeres reportado por Remelli et al.42 (OR 3,31; IC95%: 1,04-10,50) fue superior al obtenido en nuestro estudio.
La relación, que hemos observado, entre la fragilidad y la dependencia para actividades instrumentales y de la vida diaria y la fragilidad, también reportada por otros autores46,50,51, tiene una correlación ligeramente inferior a la de descrita por Vrettos et al.51 (r=−0,725) entre la CFS y el índice de Barthel.
En los estudios que han evaluado la CFS y el índice de comorbilidad de Charlson en pacientes de diferentes grupos de edad (mayores de 8048 años, de 6551 años, de 50 años52,53 o de 16 años31) han encontrado diferencias significativas entre el índice de comorbilidad de Charlson en los pacientes frágiles y los no frágiles. En nuestro estudio, además de encontrar correlación con esa escala, hemos observado diferencias significativas entre pacientes no frágiles y frágiles en otras comorbilidades que previamente no habían sido descritas.
En lo que se refiere a los factores socioeconómicos, observamos, al igual que Hewitt y Booth45 y Bagshaw et al.46, un mayor porcentaje de pacientes frágiles en el grupo con niveles básicos de educación. Además, se observa una menor probabilidad de fragilidad en pacientes con una estabilidad familiar y económica. Estos hallazgos no se han descrito hasta ahora.
La fuerte correlación con el componente físico (PCS) del cuestionario de calidad de vida percibida SF-12 permite concluir que cuanto mayor es la fragilidad, menor es la calidad de vida física. La correlación con el componente mental es menor, por lo que la asociación con la fragilidad no es tan fuerte. No se han hallado estudios que evalúen la validez convergente de la escala CFS con la calidad de vida, aunque sí se ha evaluado la validez predictiva.
Validez predictivaLas diferencias significativas de gravedad al ingreso en UCI (SAPS3), entre pacientes no frágiles y frágiles, también han sido informadas por De Geer et al.37, en una cohorte de pacientes de 18 años o más (mediana [Q1-Q3]: 49 [39-62] vs. 62 [54-72]; p <0,001) si bien la gravedad de los pacientes no frágiles en la cohorte de De Geer et al.37 era inferior a la actual cohorte, cuyas diferencias resultan clínicamente irrelevantes y la correlación entre CFS-España y SAPS3 es débil.
Se ha relacionado la fragilidad (CFS> 4) con el nivel de soporte vital en términos de necesidad de terapias extrarrenales durante el ingreso en intensivos35,43,53,54, necesidad de ventilación mecánica35,36,42,55, de fármacos vasoactivos35,43 o con la mayor probabilidad de tener órdenes de limitación del tratamiento12,36,37,56. En nuestra cohorte también se ha observado que la CFS-España predice la necesidad de esas terapias.
Aunque se ha relacionado la fragilidad con el delirio57, en esta cohorte no se ha encontrado esta asociación. Sahle et al.58, en un estudio en el que analizan la relación entre la fragilidad (medida con CFS) y el delirio (evaluado con la escala CAM-ICU) reportan que los pacientes frágiles tuvieron mayor probabilidad de un episodio de delirio (OR 1,86; IC95%: 1,77-1,95). Tanto en este estudio como en las revisiones59,60 que analizan la relación entre estas 2afecciones, los pacientes tenían 65 años o más, o estaban en el posoperatorio de diferentes cirugías. Por otro parte, hay una gran heterogeneidad en los instrumentos utilizados para medir tanto la fragilidad como el delirio. Puesto que las diferentes escalas de fragilidad no discriminan por igual a pacientes frágiles y no frágiles, las conclusiones de estas revisiones deben tomarse con precaución. Así, la fragilidad medida con la escala FRAIL, escala menos implementada hasta el momento en pacientes críticos, parece ser un buen predictor de delirio en pacientes ancianos ingresados en UCI57. Nuestros hallazgos, opuestos a los de estudios previos, pueden ser debidos a que solo se pudo evaluar el delirio en el 49,1% del tiempo registrado. Son necesarios, por lo tanto, más estudios que delimiten la relación entre estas 2variables en pacientes críticos adultos.
La relación entre los niveles de fragilidad y la duración de la estancia en la UCI y en el hospital es controvertida. Mientras que hay estudios que encuentran diferencias significativas, con una estancia más prolongada de los pacientes frágiles en UCI34,35,37,38,52,54,55,61,62 o en el hospital35,43,52,54,61,62, hay revisiones que no detectan relación3,5,12. En nuestro caso tampoco se ha observado esa diferencia. Una posible explicación puede deberse a la diferencia en las necesidades de soporte vital y de limitación, así como a las diferencias de mortalidad. Los pacientes frágiles con elevada demanda es probable que fallezcan antes.
Sí que hay coincidencia en el valor predictivo de la fragilidad, evaluada con la CFS, con respecto a la mortalidad, a corto y largo plazo. Se ha reportado mayor mortalidad en la UCI de los pacientes frágiles, tanto al implementar la CFS en pacientes jóvenes3,32,36-38,40,41,63 como en pacientes mayores de 50 años52,53,64, de 60 años55, de 6526 años o de 80 años65-67. También se ha reportado mayor mortalidad hospitalaria3,32,34-36,38,40,43,47,52-54,56,61,63,64,68,69, a los 3 meses del alta hospitalaria37,40,47,70, a los 63,5,32,37,40,42,44,47,53,71-74 y hasta a los 12 meses del alta hospitalaria32,38,40,45,47,48,69,70,74. En nuestro análisis también encontramos una relación entre fragilidad y mortalidad.
En el caso de los enfermos que no fallecen en el hospital, se observa una relación entre la fragilidad y que el destino tras el alta no sea el domicilio habitual. Este hallazgo ya ha sido reportado en estudios que incluyen población no anciana31,32,35,45,53.
De la misma manera, hay una relación significativa entre la fragilidad al ingreso y la calidad de vida física percibida tras el alta hospitalaria3,61,70,71,75. Brummel et al.70 reportan una relación significativa de la CFS con peor calidad de vida física a los 3 y 12 meses del alta. Bagshaw et al.61 reportan puntuaciones más bajas de PCS entre los pacientes frágiles a los 6 y 12 meses y la correlación reportada por McNelly et al.75 es moderada (r=0,56). En la validación de la CFS-España se ha observado una correlación negativa y moderada entre la fragilidad al ingreso y cada una de las valoraciones de la PCS durante el seguimiento. Por otro lado, Brummel et al.70 reportaron asociaciones no significativas entre la CFS al ingreso y el componente mental de la SF-36 en las evaluaciones (3 y 12 meses del alta) y, aunque Bagshaw et al.61 también reportan niveles de MCS más bajos en los pacientes frágiles a los 6 y 12 meses, McNelly et al.75 informan de una correlación débil entre la fragilidad y la MCS (r=0,21). Estos resultados son similares a los obtenidos en la validación de la CFS-España, con puntuaciones más bajas de MCS entre los pacientes frágiles, pero sin llegar a la significación estadística. Las correlaciones de la CFS-España al ingreso con la MCS en cada momento de evaluación son débiles o inexistentes.
Sensibilidad al cambio y efecto suelo y techoNo hemos encontrado autores que hayan evaluado la sensibilidad al cambio de la CFS, aunque sí ha sido evaluado el efecto suelo y techo. La escala CFS-España presenta mejor efecto suelo (6,7%) que el reportado por Tipping et al.64 (36%), con el mismo efecto techo (0%).
Relevancia prácticaLos resultados obtenidos ponen de manifiesto que la escala CFS-España tiene buena validez para evaluar la fragilidad de pacientes críticos adultos, tanto por enfermeras como por intensivistas13, y sirven para ajustar los planes de cuidados y tratamientos médicos con el fin de mitigar las consecuencias negativas del ingreso en UCI. Aplicar la escala precisa poco tiempo9 y debería formar parte de la valoración integral que se le hace al paciente al ingresar. Aunque la fragilidad no es todavía muy conocida en el ámbito de intensivos y, por lo tanto, su valoración no está muy extendida, la difusión de los hallazgos de este estudio podrá contribuir al empleo de la escala.
Fortalezas y limitacionesUna de las limitaciones de este estudio ha sido la imposibilidad de valorar todas las variables diarias a todos los pacientes. Esto ha sido debido a diversas causas, fundamentalmente al nivel de consciencia de los pacientes, bien por su enfermedad (el 35,7% ingresaron por enfermedad neurológica o neuroquirúrgica), bien por el nivel de sedación (en el 28% de las valoraciones diarias de la escala RASS, los pacientes tenían valores inferiores a −2). Una de estas variables que no pudo ser evaluada a diario, por los motivos mencionados, fue el delirio. Esto puede contribuir a que no encontremos relación entre la fragilidad y el delirio, cuando sí ha sido reportado por otros autores.
Otras limitaciones fueron las derivadas de la pandemia de la covid-19. Durante más de un año se impusieron limitaciones a las visitas en las unidades que impidieron la interlocución con los familiares y, por lo tanto, retrasó la captación de los pacientes. Este fue el motivo por el que no se incluyeron en el estudio los pacientes con covid-19: al no poder incluirlos desde un principio, fueron excluidos cuando se reanudó el reclutamiento.
La escasa muestra de algunas variables, como la obesidad mórbida, la necesidad de maniobras de reanimación cardiopulmonar o niveles educativos de posgrado, nos obliga a ser cautos con su interpretación. Además, la relación entre la fragilidad y la obesidad mórbida tiene una limitación añadida, puesto que el peso corporal, utilizado para el cálculo del IMC, no diferencia entre masa corporal magra y grasa, lo que podría confundir la relación observada.
Los investigadores no tuvieron entrenamiento previo que les capacitase para implementar adecuadamente la escala. Si bien es cierto que cada nivel de la escala contiene una descripción de las características de los pacientes y el evaluador puede orientar la valoración del paciente según esta descripción, la falta de experiencia y la curva de aprendizaje de los evaluadores han podido sesgar los resultados. No obstante, consideramos que son las mismas condiciones en las que se encuentra el clínico al aplicar la escala en su práctica clínica habitual y, por otro lado, todos los evaluadores tenían experiencia en la valoración de los pacientes críticos.
GeneralizabilidadAunque las unidades participantes son limitadas, creemos que la dispersión geográfica y sus características hacen que la población sea muy representativa de la población de pacientes que ingresan en una UCI.
Cambios en el instrumentoLa CFS-España ha demostrado ser una buena herramienta para evaluar la fragilidad de pacientes críticos adultos y no consideramos que sea necesario hacer ajustes ni cambios en el instrumento. A pesar de ello, el nivel 9 nos parece poco operativo en intensivos9, puesto que es poco probable su ingreso en la UCI. De hecho, en esta cohorte no había ningún paciente en este nivel al ingreso en UCI.
Investigaciones futurasAunque existen numerosas herramientas que evalúan la fragilidad de los pacientes, ninguna de ellas ha sido desarrollada para pacientes adultos no ancianos ni tampoco para pacientes críticos. Cabe preguntarse si resultaría adecuado desarrollar una herramienta específica para esta población adulta crítica, en lugar de adaptar las ya existentes. Quizá esta podría ser una línea de investigación interesante.
Por otro lado, en España no se disponía de la escala Clinical Frailty Scale adaptada a nuestro idioma. Este es el primer estudio con población española adulta de cuidados intensivos desarrollado con la versión española (CFS-España). Serán necesarios más estudios, en las unidades de críticos españolas, para consolidar los hallazgos.
Como ya se ha comentado, existe controversia en la relación de la fragilidad con la edad. Una línea interesante de investigación futura puede ser analizar la relación de la fragilidad con la edad biológica, y no con la edad cronológica.
ConclusionesLa CFS-España muestra una buena validez convergente con la edad, con las mujeres, con la dependencia para las actividades instrumentales y básicas de la vida diaria, con peor calidad de vida física, con los días de hospitalización en el año anterior, el nivel académico y las rentas anuales bajas. La fragilidad no ha mostrado relación con la calidad de vida mental, con la gravedad al ingreso en UCI, con el SOFA ni con la estancia en UCI u hospitalaria. Además, tiene validez predictiva para el nivel de soporte vital durante la estancia en la UCI, para la mortalidad en todos los momentos evaluados y para el destino al alta hospitalaria.
FinanciaciónEste estudio ha sido financiado con una beca de la Acción estratégica en Salud del Instituto de Salud Carlos III, PI20/01231.
Consideraciones éticas y consentimiento informadoEl estudio ha sido evaluado y considerado apto por el Comité de Ética de Investigación con Medicamentos del Hospital Universitario de Getafe con fecha de 4 de octubre de 2019 y número de expediente CEIm19/42.
Los pacientes fueron informados y aceptaron participar voluntariamente firmando el consentimiento informado. Si el nivel de consciencia no permitía la autorización del paciente, la información se dio a los familiares más directos, quienes firmaron el consentimiento. En este último caso se requirió ratificación del paciente en cuanto el nivel de consciencia lo permitió.
Conflicto de interesesSusana Arias-Rivera y Marta Raurell-Torredà son editoras de la revista EnfermeríaIntensiva, por lo que, para la evaluación del presente trabajo, se ha utilizado el procedimiento descrito en las normas de publicación en estos casos. El resto de los autores declaran no tener ningún conflicto de interés.
Hospital Universitario de Getafe (Madrid): M. del Mar Sánchez-Sánchez, Raquel Jareño-Collado, Raquel Sánchez-Izquierdo, Eva I. Sánchez-Muñoz, Virginia López-López, Pedro Vadillo-Obesso, Sonia López-Cuenca, Lorena Oteiza-López, María Nogueira-López, Marta Suero-Domínguez, M. Carmen Martín-Guzmán, Olga Rodríguez-Estevez, Juan Enrique Mahía-Cures. Hospital Universitario Central de Asturias (Oviedo): Emilia Romero-de San Pío, Julieta Alonso-Soto, Esther González-Alonso, Lara María Rodríguez-Villanueva, Montserrat Fernández-Menéndez, Roberto Riaño-Suárez, María González-Pisano, Adrián González-Fernández, Helena Fernández-Alonso, José Antonio Gonzalo-Guerra. Complejo Hospitalario Universitario Insular Materno-Infantil (Las Palmas de Gran Canaria): Yeray Gabriel Santana-Padilla, Zaida Alamo-Rodríguez, Famara Díaz-Marrero, Benjamín Guedes-Santana, Aridane Méndez-Santana, José Rodríguez-Alemán, Lorea Ugalde-Jauregui. Hospital General Universitario Gregorio Marañón (Madrid): Mónica Juncos Gozalo, Ángeles Ponce-Figuereo, Ana Muñoz-Martínez, Iñaki Erquicia-Peralt. Hospital Universitario de Bellvitge (Hospitalet de Llobregat, Barcelona): Gemma Via-Clavero, Laia Martínez-Bosch, Jordi Torreblanca-Parra, Vicente Corral-Vélez. Hospital Clínico Universitario de Santiago, (Santiago de Compostela, La Coruña): M. del Rosario Villar-Redondo, Leticia Esmoris López, Natalia Vázquez Rodríguez, Gloria Güeto Rial, Isabel Lara Granja Gómez. Hospital Universitario Vall d’Hebron (Barcelona): Elisabet Gallart Vivé, Montserrat Aran Esteve, Bernat Planas Pascual. Hospital Universitario del Sureste, Arganda del Rey (Madrid): Mónica Juncos Gozalo. Hospital Universitario 12 de Octubre (Madrid): M. Jesus Frade-Mera, María Teresa Pulido Martos, Candelas López López, Laura Martín Velázquez, Isabel Martínez Yegles, Amanda Lesmes González de Aledo, Francisco Javier Zarza Bejarano, Marta Sánchez Cortés, M. del Ara Murillo Pérez, Clara Cornejo Bauer, Laura Hernández López, Francisco de Paula Delgado Moya, Miguel Angel Bejerano Casillas.