La seguridad de los pacientes críticos en situaciones de crisis: pandemia y proyectos Zero
Más datosLa pandemia por el SARS-Cov-2 ha impactado negativamente en la aplicación de las recomendaciones de Neumonía Zero y se ha acompañado de un incremento de las tasas de Neumonía asociada a ventilación mecánica (NAVM) en las unidades de cuidados intensivos de España. Con el objetivo de disminuir las tasas actuales a 7 episodios por 1000 días de VM, se han actualizado las recomendaciones del proyecto inicial.
Se identificaron, 27 medidas que se clasificaron en 12 medidas funcionales (posición semisentada, higiene estricta de manos, entrenamiento para manipular la vía aérea, valoración diaria de posible extubación, protocolización del destete, traqueostomía precoz, ventilación no invasiva, vigilancia microbiológica, cambio de tubuladuras, humidificación, fisioterapia respiratoria, nutrición enteral postpilórica), 7 mecánicas (control de la presión del neumotaponamiento, tubos con aspiración subglótica, nutrición con sondas de bajo calibre/en intestino delgado, aspiración de secreciones con circuitos cerrados/abiertos, filtros respiratorios, cepillado de dientes, técnicas de presión negativa en la aspiración de secreciones) y 8 farmacológicas (descontaminación selectiva digestiva, descontaminación orofaríngea, ciclo corto de antibióticos, higiene de boca con clorhexidina, antibióticos inhalados, rotación de antibióticos, probióticos, anticuerpos monoclonales).
Cada medida se analizó de forma independiente, por al menos dos miembros del grupo de trabajo, mediante una revisión sistemática de la literatura y una revisión iterativa de las recomendaciones de las sociedades científicas y/o grupos de expertos.
Para la clasificación de la calidad de la evidencia y fuerza de las recomendaciones se siguió la propuesta del grupo GRADE. Para determinar el grado de recomendación, cada medida fue puntuada por todos los miembros del grupo de trabajo en relación con su efectividad, tolerabilidad y aplicabilidad en las UCI españolas a corto plazo de tiempo. Se solicitó el apoyo de expertos externos en alguna de las medidas que se revisaron. Se seleccionaron aquellas medidas que alcanzaron la máxima puntuación.
The SARS-Cov-2 pandemic has had a negative impact on the implementation of the Zero Pneumonia recommendations and has been accompanied by an increase in rates of ventilator- associated pneumonia (VAP) in intensive care units in Spain. With the aim of reducing the current rates to 7 episodes per 1000 days of MV, the recommendations of the initial project have been updated.
Twenty-seven measures were identified and classified into 12 functional measures (semi- sitting position, strict hand hygiene, airway manipulation training, daily assessment of possible extubation, protocolisation of weaning, early tracheostomy, non-invasive ventilation, microbiological surveillance, tubing change, humidification, respiratory physiotherapy, post- pyloric enteral nutrition), 7 mechanical measures (pneumotap pressure control, subglottic suction tubes, subglottic suctioning of tubes, subglottic suctioning of tubes, post-pyloric enteral nutrition, subglottic suction tubes, small-bore/small-bowel tube nutrition, closed/open circuit secretion suctioning, respiratory filters, tooth brushing, negative pressure techniques for secretion suctioning) and 8 pharmacological (selective digestive decontamination, oropharyngeal decontamination, short course of antibiotics, chlorhexidine mouth hygiene, inhaled antibiotics, antibiotic rotation, probiotics, monoclonal antibodies).
Each measure was analysed independently, by at least two members of the working group, through a systematic review of the literature and an iterative review of recommendations from scientific societies and/or expert groups.
For the classification of the quality of the evidence and strength of the recommendations, the GRADE group proposal was followed. To determine the level of recommendation, each measure was scored by all members of the working group in relation to its effectiveness, tolerability and applicability in Spanish ICUs in the short term. The support of external experts was requested for some of the measures reviewed. Those measures that achieved the highest score were selected.
En 1994 el Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (GTEI-SEMICYUC) desarrolló el Estudio Nacional de Vigilancia de Infección Nosocomial (ENVIN) (https://semicyuc.org/envin/) como registro informatizado de la incidencia de infección nosocomial para los Servicios o Unidades de Cuidados Intensivos (UCI). Las tasas registradas en el ENVIN de neumonía asociada a ventilación mecánica (NAVM), desde 1994 hasta 2008, oscilaron entre 14 y 17 episodios por 1.000 días de ventilación mecánica (VM). En 2009-2010, con la implementación de las medidas introducidas dentro del proyecto Bacteriemia Zero (BZ) descendieron de 12 episodios por 1.000 días de VM, y desde la instauración de las medidas incluidas en el proyecto Neumonía Zero (NZ), en los años 2011 a 2012 se redujeron a menos de siete episodios por 1.000 días de VM1, llegando en el año 2019 a 5,41 episodios por 1.000 días de VM2.
Lamentablemente la pandemia del nuevo coronavirus SARS-CoV-2 ha supuesto un importante cambio en el modelo del paciente ingresado en UCI (más fragilidad y comorbilidades) así como cambios estructurales, funcionales y organizativos en las UCI, lo que ha impactado negativamente en la aplicación de las recomendaciones y se ha acompañado de un incremento de las tasas de NAVM a de 19,99 episodios por 1.000 días de VM, valores superiores al inicio de los proyectos Zero.
Con el objetivo de disminuir las tasas actuales a menos de siete episodios por 1.000 días de VM, para recuperar las tasas previas a la pandemia, se han actualizado las recomendaciones del proyecto inicial y se han adaptado a las condiciones actuales de la pandemia.
MetodologíaPara actualizar las recomendaciones del proyecto NZ y adaptarlas a la situación de pandemia se constituyó un grupo de trabajo formado por miembros de la SEMICYUC, de la Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC), Asociación Española de Enfermería de Prevención y Control de Infecciones (AEEPyCI) y Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH).
Se identificaron, a partir de las recomendaciones y revisiones realizadas por sociedades científicas y/o grupos de expertos, 27 medidas relacionadas con la prevención de NAVM. Se clasificaron en 12 medidas funcionales, siete mecánicas y ocho farmacológicas. Cada una de estas medidas se analizaron de forma independiente, por al menos dos miembros del grupo de trabajo, con base en datos extraídos de ensayos clínicos y/u otros artículos. Para ello, se llevó a cabo una revisión sistemática de la literatura en las principales bases de datos electrónicas y una revisión iterativa de las recomendaciones de las sociedades científicas y/o grupos de expertos relacionados con cada medida.
Para la clasificación de la calidad de la evidencia y fuerza de las recomendaciones se siguió la propuesta del grupo Grading of Recommendations Assessment, Development and Evaluation Working Group (GRADE)3 (disponible en: http://www.gradeworkinggroup.org/], que tiene en cuenta no solo el número y diseño de los estudios realizados sino también la calidad de la evidencia (tabla 1).
Clasificación de la evidencia y el grado de recomendación según el sistema GRADE
| Clasificación de la evidencia | |
| Alta | Alta confianza en la coincidencia entre el efecto real y el estimado |
| Moderada | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efecto estimado |
| Baja | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado |
| Muy baja | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado |
| Grado de recomendación | |
| Fuerte | Se refiere a la decisión que tomaría la mayoría de las personas bien informadas |
| Débil | Se refiere a la decisión que tomaría la mayoría de las personas bien informadas, aunque una minoría considerable no lo haría |
Para determinar el grado de recomendación, cada medida fue puntuada por todos los miembros del grupo de trabajo en relación con su efectividad, tolerabilidad y aplicabilidad en las UCI españolas a corto plazo de tiempo. Se solicitó el apoyo de expertos externos en alguna de las medidas que se revisaron. Se seleccionaron aquellas medidas que alcanzaron la máxima puntuación.
ResultadosA continuación, se presenta la actualización de cada una de las medidas identificadas. La clasificación de la evidencia y el grado de recomendación se presentan en las tablas 2, 3 y 4.
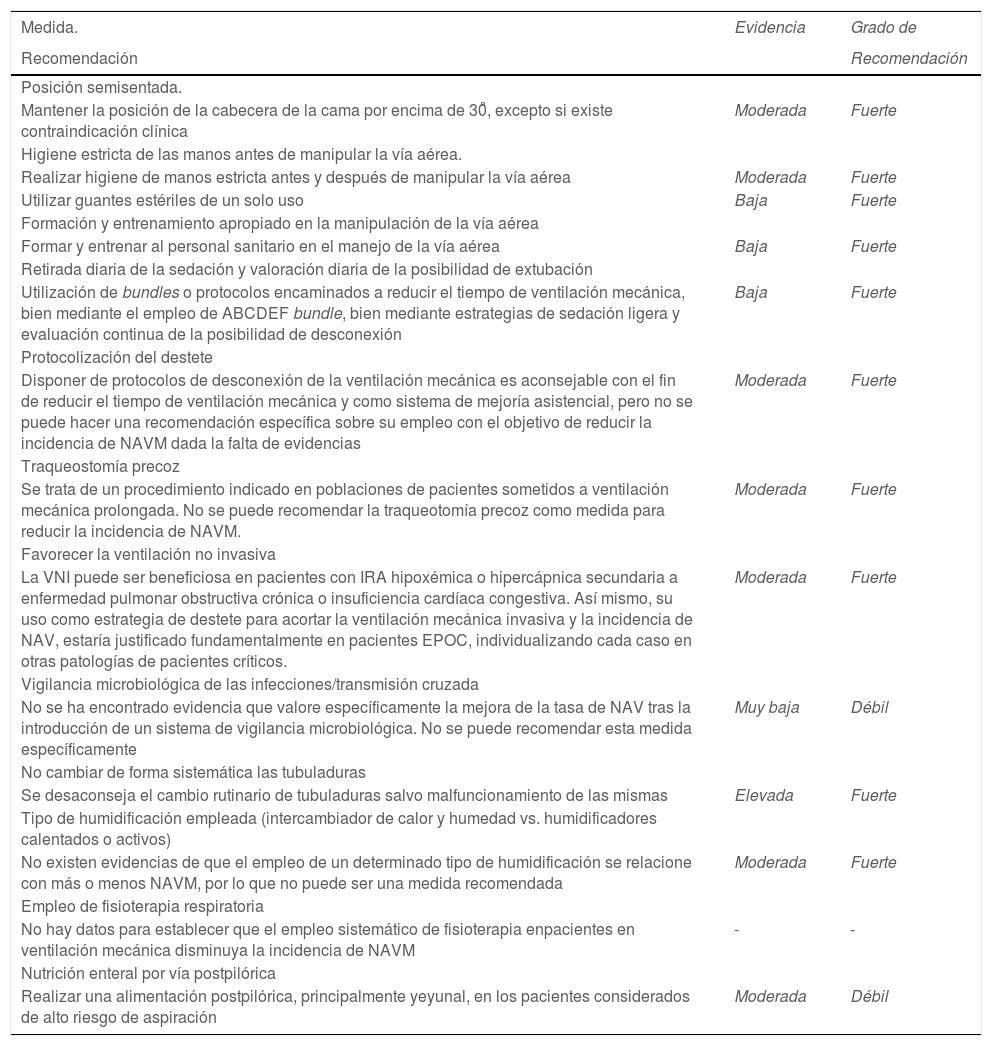
Evidencia y grado de recomendación de las medidas funcionales revisadas
| Medida. | Evidencia | Grado de |
|---|---|---|
| Recomendación | Recomendación | |
| Posición semisentada. | ||
| Mantener la posición de la cabecera de la cama por encima de 30̊, excepto si existe contraindicación clínica | Moderada | Fuerte |
| Higiene estricta de las manos antes de manipular la vía aérea. | ||
| Realizar higiene de manos estricta antes y después de manipular la vía aérea | Moderada | Fuerte |
| Utilizar guantes estériles de un solo uso | Baja | Fuerte |
| Formación y entrenamiento apropiado en la manipulación de la vía aérea | ||
| Formar y entrenar al personal sanitario en el manejo de la vía aérea | Baja | Fuerte |
| Retirada diaria de la sedación y valoración diaria de la posibilidad de extubación | ||
| Utilización de bundles o protocolos encaminados a reducir el tiempo de ventilación mecánica, bien mediante el empleo de ABCDEF bundle, bien mediante estrategias de sedación ligera y evaluación continua de la posibilidad de desconexión | Baja | Fuerte |
| Protocolización del destete | ||
| Disponer de protocolos de desconexión de la ventilación mecánica es aconsejable con el fin de reducir el tiempo de ventilación mecánica y como sistema de mejoría asistencial, pero no se puede hacer una recomendación específica sobre su empleo con el objetivo de reducir la incidencia de NAVM dada la falta de evidencias | Moderada | Fuerte |
| Traqueostomía precoz | ||
| Se trata de un procedimiento indicado en poblaciones de pacientes sometidos a ventilación mecánica prolongada. No se puede recomendar la traqueotomía precoz como medida para reducir la incidencia de NAVM. | Moderada | Fuerte |
| Favorecer la ventilación no invasiva | ||
| La VNI puede ser beneficiosa en pacientes con IRA hipoxémica o hipercápnica secundaria a enfermedad pulmonar obstructiva crónica o insuficiencia cardíaca congestiva. Así mismo, su uso como estrategia de destete para acortar la ventilación mecánica invasiva y la incidencia de NAV, estaría justificado fundamentalmente en pacientes EPOC, individualizando cada caso en otras patologías de pacientes críticos. | Moderada | Fuerte |
| Vigilancia microbiológica de las infecciones/transmisión cruzada | ||
| No se ha encontrado evidencia que valore específicamente la mejora de la tasa de NAV tras la introducción de un sistema de vigilancia microbiológica. No se puede recomendar esta medida específicamente | Muy baja | Débil |
| No cambiar de forma sistemática las tubuladuras | ||
| Se desaconseja el cambio rutinario de tubuladuras salvo malfuncionamiento de las mismas | Elevada | Fuerte |
| Tipo de humidificación empleada (intercambiador de calor y humedad vs. humidificadores calentados o activos) | ||
| No existen evidencias de que el empleo de un determinado tipo de humidificación se relacione con más o menos NAVM, por lo que no puede ser una medida recomendada | Moderada | Fuerte |
| Empleo de fisioterapia respiratoria | ||
| No hay datos para establecer que el empleo sistemático de fisioterapia enpacientes en ventilación mecánica disminuya la incidencia de NAVM | - | - |
| Nutrición enteral por vía postpilórica | ||
| Realizar una alimentación postpilórica, principalmente yeyunal, en los pacientes considerados de alto riesgo de aspiración | Moderada | Débil |
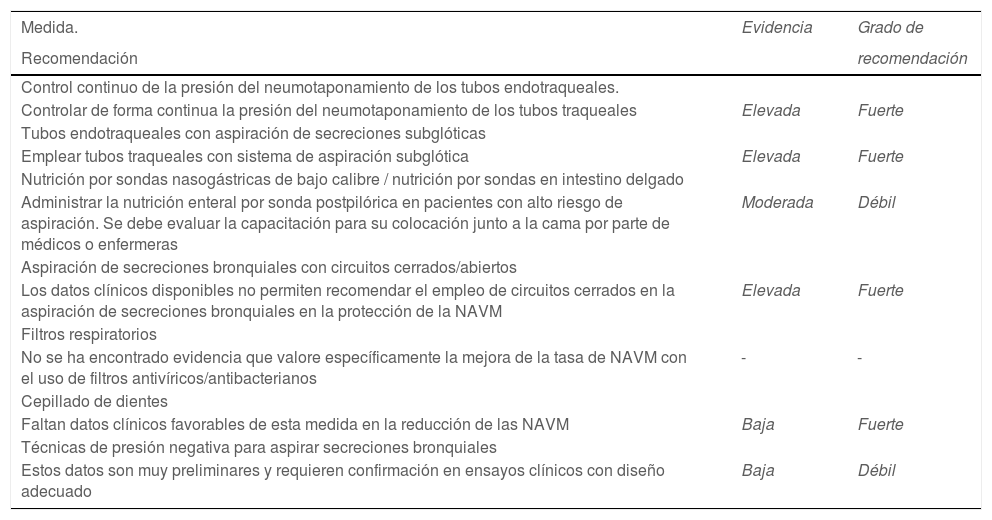
Evidencia y grado de recomendación de las medidas mecánicas revisadas
| Medida. | Evidencia | Grado de |
|---|---|---|
| Recomendación | recomendación | |
| Control continuo de la presión del neumotaponamiento de los tubos endotraqueales. | ||
| Controlar de forma continua la presión del neumotaponamiento de los tubos traqueales | Elevada | Fuerte |
| Tubos endotraqueales con aspiración de secreciones subglóticas | ||
| Emplear tubos traqueales con sistema de aspiración subglótica | Elevada | Fuerte |
| Nutrición por sondas nasogástricas de bajo calibre / nutrición por sondas en intestino delgado | ||
| Administrar la nutrición enteral por sonda postpilórica en pacientes con alto riesgo de aspiración. Se debe evaluar la capacitación para su colocación junto a la cama por parte de médicos o enfermeras | Moderada | Débil |
| Aspiración de secreciones bronquiales con circuitos cerrados/abiertos | ||
| Los datos clínicos disponibles no permiten recomendar el empleo de circuitos cerrados en la aspiración de secreciones bronquiales en la protección de la NAVM | Elevada | Fuerte |
| Filtros respiratorios | ||
| No se ha encontrado evidencia que valore específicamente la mejora de la tasa de NAVM con el uso de filtros antivíricos/antibacterianos | - | - |
| Cepillado de dientes | ||
| Faltan datos clínicos favorables de esta medida en la reducción de las NAVM | Baja | Fuerte |
| Técnicas de presión negativa para aspirar secreciones bronquiales | ||
| Estos datos son muy preliminares y requieren confirmación en ensayos clínicos con diseño adecuado | Baja | Débil |
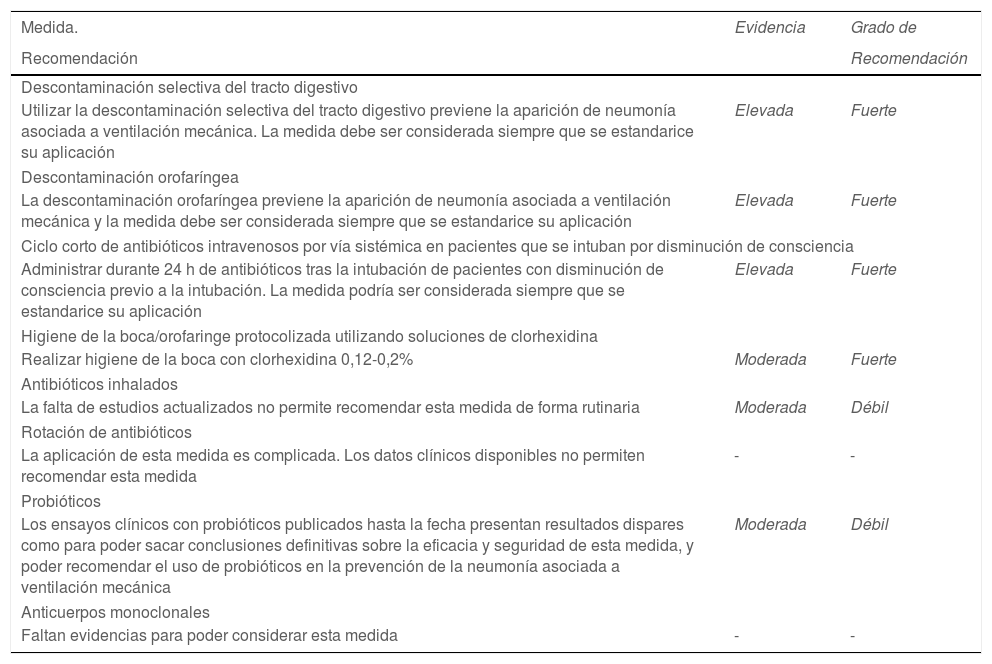
Evidencia y grado de recomendación de las medidas farmacológicas revisadas
| Medida. | Evidencia | Grado de |
|---|---|---|
| Recomendación | Recomendación | |
| Descontaminación selectiva del tracto digestivo | ||
| Utilizar la descontaminación selectiva del tracto digestivo previene la aparición de neumonía asociada a ventilación mecánica. La medida debe ser considerada siempre que se estandarice su aplicación | Elevada | Fuerte |
| Descontaminación orofaríngea | ||
| La descontaminación orofaríngea previene la aparición de neumonía asociada a ventilación mecánica y la medida debe ser considerada siempre que se estandarice su aplicación | Elevada | Fuerte |
| Ciclo corto de antibióticos intravenosos por vía sistémica en pacientes que se intuban por disminución de consciencia | ||
| Administrar durante 24 h de antibióticos tras la intubación de pacientes con disminución de consciencia previo a la intubación. La medida podría ser considerada siempre que se estandarice su aplicación | Elevada | Fuerte |
| Higiene de la boca/orofaringe protocolizada utilizando soluciones de clorhexidina | ||
| Realizar higiene de la boca con clorhexidina 0,12-0,2% | Moderada | Fuerte |
| Antibióticos inhalados | ||
| La falta de estudios actualizados no permite recomendar esta medida de forma rutinaria | Moderada | Débil |
| Rotación de antibióticos | ||
| La aplicación de esta medida es complicada. Los datos clínicos disponibles no permiten recomendar esta medida | - | - |
| Probióticos | ||
| Los ensayos clínicos con probióticos publicados hasta la fecha presentan resultados dispares como para poder sacar conclusiones definitivas sobre la eficacia y seguridad de esta medida, y poder recomendar el uso de probióticos en la prevención de la neumonía asociada a ventilación mecánica | Moderada | Débil |
| Anticuerpos monoclonales | ||
| Faltan evidencias para poder considerar esta medida | - | - |
En 2016 la Cochrane Library publica una revisión sistemática4 donde se muestra que la posición semisentada (30-60°) puede reducir significativamente la sospecha de NAVM al compararla con la posición supina (0-10°) (RR [IC 95%]: 0,36 [0,25-0,50]), aunque no se encontraron diferencias en las NAVM diagnósticas por microbiología en los tres estudios incluidos (RR [IC 95%]: 0,44 [0,11-1,77]). Tampoco se encontraron diferencias entre los pacientes en 45° vs. 25-30°. Los resultados no pudieron ser concluyentes.
En 2021 Güner et al.5 publicaron un ensayo clínico unicéntrico de 60 pacientes en tres brazos (elevación < 30°, elevación de 30° y elevación de 45°), donde reportan que la frecuencia de la NAVM fue significativamente menor en el brazo de 45° vs. < 30° (p = 0,022), no se encontraron diferencias entre el resto de los grupos.
Esta medida es de fácil aplicación, económica y no asociada a efectos secundarios. El cociente riesgo-beneficio favorece su aplicación. Se recomienda en todas las guías de práctica clínica6–9 y se incluye en 95% de los bundles dirigidos a la prevención de la NAVM10.
Higiene estricta de las manos antes de manipular la vía aéreaLas principales guías internacionales6,11,12 dan un alto grado de recomendación a esta medida. De los cinco momentos en los que es obligatoria la higiene estricta de manos del personal sanitario, propuestos por la Organización Mundial de la Salud (OMS)13, se identifican dos relacionados con el manejo de la vía aérea, antes de realizar una tarea aséptica y después de la exposición a fluidos corporales. Tanto los Centers for Disease Control and Prevention (CDC)6 como la OMS14, recomiendan el uso de guantes limpios en la aspiración de secreciones bronquiales, además de la correcta higiene de manos y la American Association for Respiratory Care15 propone el uso de guantes estériles en la aspiración con sistemas de circuito abierto y guantes limpios en la aspiración con circuito cerrado.
Formación y entrenamiento apropiado en la manipulación de la vía aéreaNo se ha encontrado evidencia específica sobre la relación entre la capacitación en la aspiración de secreciones bronquiales en pacientes intubados y las tasas de NAVM. No obstante, la falta de conocimiento es una barrera en la implementación de las recomendaciones16, la literatura muestra que la mejora en la educación y formación de los profesionales en atención directa a pacientes en VM, consigue aumentar significativamente el cumplimiento de los bundles, asociándose a una reducción en la incidencia de la NAVM17–22.
Retirada diaria de la sedación y valoración diaria de la posibilidad de extubaciónEntre 62 a 73% de las NAVM aparecen a partir del cuarto día de intubación, con mayor riesgo entre los días seis y ocho23, de ahí las recomendaciones dirigidas a intentar reducir el tiempo de intubación a través de la interrupción diaria de la sedación o la sedación ligera, para poder valorar diariamente la posibilidad de extubación. Shehabi et al.24 reportan que la sedación profunda predice menor probabilidad de extubación temprana (HR [IC 95%]: 0,80 [0,73- 0,87]; p < 0,001) y mayor riesgo de muerte (HR [IC 95%]: 1,29 [1,15-1,46]; p < 0,001). Las directrices de la práctica clínica publicadas recientemente sobre la prevención y manejo del dolor, la agitación y la sedación en pacientes adultos de UCI25, recomiendan en pacientes con VM mantener una sedación ligera, interrupciones diarias de la sedación, así como empoderar a las enfermeras para el cumplimiento de los protocolos.
La interrupción diaria de la sedación y el nivel de sedación ligero han demostrado que pueden reducir la duración de la VM26 pero no necesariamente la NAVM27. A pesar de ello, esta medida se ha incluido en los bundles encaminados a reducir el tiempo de VM, como mecanismo para reducir las NAVM. La implementación de estos bundles sí han demostrado reducción en la mortalidad (OR [IC 95%]: 0,90 [0,84-0,97]), con mayor impacto en pacientes con NAVM (OR [IC 95%]: 0,71 [0,52-0,97])28.
Protocolización del desteteEstudios observacionales han puesto de manifiesto que prolongar de manera innecesaria los días de VM supone un aumento de la mortalidad y de la morbilidad de los pacientes, incluyendo un aumento del riesgo de NAVM y del daño pulmonar asociado, por lo que una de las recomendaciones promovidas para reducir esos efectos adversos incluye disponer de un protocolo de destete29.
Blackwood et al.30, en su revisión sistemática publicada en 2014 demostraron que la duración de la VM se ve reducida en un 26% cuando existe un protocolo de destete. Más recientemente, Yeung et al.31, en una revisión sistemática donde se analizan los protocolos de destete con aplicación de ventilación no invasiva (VNI), describen una reducción significativa en el tiempo de VM, de estancia en UCI y de mortalidad y también una reducción en la incidencia de NAVM. En esta misma línea se han publicado otros dos estudios posteriores a la revisión sistemática32,33.
Traqueostomía precozDiversos estudios no han encontrado diferencias en las NAVM cuando se han comparado traqueostomía precoz vs. tardía34–38. Chorath et al.39, en un metaanálisis de 17 estudios, describen una reducción en la incidencia de NAVM con la traqueostomía precoz, aunque los mismos autores manifiestan la posibilidad de sesgo en los resultados, llegando incluso a considerar la traqueostomía como un factor de riesgo de desarrollar NAVM en pacientes neurológicos. En un metaanálisis publicado en 202040, donde se analizan siete estudios de pacientes con edema cerebral traumático, la traqueostomía precoz se asoció con un menor riesgo de la NAVM (diferencia de riesgo [IC 95%]: 0,78 [0,70-0,88]), sin diferencias en la mortalidad. En la guía de traqueostomía en el paciente crítico41 no se encuentra suficiente evidencia que apoye la realización de traqueostomía precoz con el objetivo de disminuir la incidencia de NAVM.
Favorecer la ventilación no invasivaEn 2010, los autores de un metaanálisis42 donde se analizan estudios de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) o edema agudo de pulmón, en su mayoría demuestran los beneficios de la VNI en la reducción de la NAVM. Estos mismos autores, en un metaanálisis del 201443 sobre 16 estudios encontraron que el destete de pacientes con VNI reduce la NAVM (RR [IC 95%]: 0,25 [0,15-0,43]), fundamentalmente en pacientes con EPOC. También Yeung et al.31, en un metaanálisis del 2017 con 25 estudios, comprobaron que la VNI como estrategia de destete disminuye la NAVM, la estancia en UCI y la mortalidad hospitalaria. Un nuevo metaanálisis del 2021 con seis estudios, relacionan la VNI con menos días de VM, de NAVM (OR [IC 95%]: 0,24 [0,08-0,71]; p = 0,014) y de estancia en UCI y en el hospital.
Vigilancia microbiológica de las infecciones/transmisión cruzadaNo existen estudios que valoren específicamente la introducción de un sistema de vigilancia microbiológica y su impacto en la disminución de las tasas de NAVM. En un estudio del 200344 se introduce la vigilancia de la NAVM en un paquete de medidas para reducir esta infección, con resultados favorables. En la búsqueda bibliográfica específica en los últimos 10 años, no se ha encontrado ninguna nueva evidencia, aunque son bastantes los artículos que incluyen la vigilancia para mejorar el manejo de los antibióticos.
No cambiar de forma sistemática las tubuladurasEn un metaanálisis publicado en 201045, con 10 ensayos clínicos aleatorizados (ECA) incluidos, se demuestra un aumento del riesgo de desarrollar NAVM en aquellos pacientes en los que el cambio de tubuladuras de los respiradores se realizaba de forma rutinaria cada 48 horas frente al cambio cada siete días (OR [IC 95%]: 1,93 [1,08- 3,44]). Ese mismo año, Choi et al.46 no encontraron diferencias en las tasas de NAVM cambiando las tubuladuras cada siete o 14 días.
Tipo de humidificación empleada (intercambiador de calor y humedad vs. humidificadores calentados o activos)Gillies et al.47 publicaron, en 2017, un metaanálisis de 34 estudios donde no encuentran diferencias significativas, entre los intercambiadores de calor y humedad (ICH) y los humidificadores calentados, en el riesgo de obstrucción de la vía aérea, en la mortalidad ni en la incidencia de NAVM (RR [IC 95%]: 0,93 [0,73-1,19]). En este metaanálisis se comenta la posibilidad de una menor incidencia de neumonía con el empleo de ICH hidrofóbicos, aunque los datos son heterogéneos entre los diferentes estudios. Tampoco Picazo et al.48, más recientemente, encontraron asociación entre el tipo de humidificación y las infecciones respiratorias.
Los ICH son fáciles de usar, mientras que los humidificadores calentados confieren mayor humedad. La selección de uno u otro debe realizarse siempre de acuerdo con el contexto clínico. El comité de cuidados respiratorios de la Sociedad Torácica China en el consenso de expertos49 sobre la prevención de la transmisión nosocomial, durante la atención respiratoria para pacientes críticamente enfermos con neumonía por COVID-19, recomienda los intercambiadores de calor (con doble tubo calentado para evitar la condensación) que deberían cambiarse cuando estén visiblemente sucios.
Empleo de fisioterapia respiratoriaDos revisiones sistemáticas50,51 identifican una reducción de la mortalidad relacionada con la fisioterapia respiratoria, pero no encuentran una reducción significativa en las NAVM.
- 1.
Nutrición enteral (NE) por vía postpilórica:
- a)
Vía de administración. En la guía de la European Society of Clinical Nutrition and Metabolism (ESPEN) para pacientes críticos52 se recomienda el acceso gástrico como método estándar para iniciar la NE y la alimentación postpilórica en pacientes con intolerancia no resuelta con procinéticos, pacientes con alto riesgo de aspiración. En dos metaanálisis53,54 y un ECA55 reciente se han encontrado reducciones en las tasas de NAVM con la alimentación postpilórica vs. gástrica. A pesar de ello, la colocación de la sonda postpilórica requiere experiencia y se considera menos fisiológica, por lo que su uso rutinario no parece justificado.
- b)
Medición del volumen residual gástrico (VRG). La guía ESPEN52 sugiere retrasar la alimentación enteral cuando el VRG es > 500 mL/6 h, considerando en esta situación la administración de procinéticos. Tanto Montejo et al.56, en 2010, como Reignier et al.57, en 2013, no han encontrado diferencias significativas en las tasas de NAVM cuando no se ha monitorizado el VRG frente a la monitorización rutinaria.
- c)
Fármacos procinéticos. Las últimas recomendaciones de la guía ESPEN52, indican que debe utilizarse eritromicina intravenosa en los pacientes críticos con intolerancia gástrica. Tanto la eritromicina como otros procinéticos ven disminuida su eficacia a un tercio después de 72 h, por lo que deben suspenderse tras tres días de tratamiento. La incidencia de NAVM no se ha visto afectada por el uso de eritromicina intravenosa.
En un metaanálisis con siete ECA publicado en 201958, se observa que la medición continua de la presión de neumotaponamiento redujo significativamente la incidencia de presión < 20 cm H2O (OR [IC 95%]: 0,03 [00,001–00,7]) y de presión > 30 cm H2O (OR [IC 95%]: 0,06 [00,003–00,15]), al compararlo con el control intermitente, disminuyendo de forma significativa la incidencia de NAVM (OR [IC 95%]: 0,39 [0,28-0,55]).
Tubos traqueales con aspiración de secreciones subglóticasPozuelo-Carrascosa et al.59 en el año 2020, analizaron nueve metaanálisis que incluían 20 diferentes ECA. Todos los metaanálisis demuestran una reducción estadísticamente significativa de la NAVM con el uso de tubos traqueales con aspiración subglótica y en el análisis conjunto de todos ellos describen una reducción del riesgo de neumonía (RR [IC 95%]: 0,56 [0,48-0,63]) y de la mortalidad (RR [IC 95%]: 0,88 [0,80-0,97]), aunque no se encontraron diferencias en otros 49 desenlaces secundarios como el tiempo de VM o el tiempo de estancia en UCI.
Nutrición por sondas nasogástricas de bajo calibre/nutrición por sondas en intestino delgadoEn dos estudios aleatorizados60,61 no se objetivó reducción del riesgo de aspiración utilizando sondas nasogástricas (SNG) de bajo calibre respecto a las SNG de calibre estándar. En un estudio retrospectivo en 202162, realizado en Japón, se encontró que los pacientes del grupo de la sonda de alimentación de bajo calibre tenían significativamente mayor mortalidad intrahospitalaria a los 28 días (17,0 vs. 15,6%; CR [IC 95%]: 1,08 [1,03 a 1,14]) y una prevalencia significativamente mayor de neumonía adquirida en el hospital (9,3 vs. 8,5%; OR [IC 95%]: 1,11 [1,02 a 1,21]). En un metaanálisis de 14 ensayos de la Cochrane en 201553 se sugiere que la alimentación postpilórica se asocia con bajas tasas de neumonía en comparación con la alimentación con SNG (RR [IC 95%]: 0,65 [0,51-0,84]).
La inserción de una sonda en intestino delgado es un procedimiento técnicamente complicado que requiere experiencia y asistencia endoscópica.
Aspiración de secreciones bronquiales con circuitos cerrados/abiertosJongerden et al.63, en un metaanálisis de ocho estudios aleatorizados publicados en 2007, no encontraron diferencias en la incidencia de NAVM utilizando un sistema cerrado o uno abierto (RR [IC 95%]: 0,96 [0,76-1,21]), al igual que Aryani64, en una revisión de 2018, o Ardehali et al.65, en un ECA de 2020.
En cuanto a la frecuencia de cambio de los circuitos, tampoco se han encontrado diferencias significativas en las tasas de NAVM cuando se ha comparado no cambiarlo rutinariamente vs. cambiarlo cada 24 horas66, ni al comparar el cambio cada 48 horas vs. 24 horas67.
Filtros respiratoriosSe ha realizado un estudio en cuidados intensivos68 que incluyó 230 pacientes aleatorizados a ser ventilados con o sin filtro bacteriano, donde no se han encontrado diferencias significativas en el porcentaje de pacientes que desarrollaron NAVM (24,56 vs. 21,55%) o en la incidencia por 1.000 días de VM (17,41 vs. 16,26).
Los filtros pueden utilizarse en pacientes con VM con sospecha o confirmación de infecciones respiratorias muy transmisibles (TBC bacilífera). En estos casos se debería colocar un filtro en la rama espiratoria de las tubuladuras o entre el tubo endotraqueal y la pieza en «Y», para evitar la contaminación del aire ambiental y prevenir la infección de los trabajadores y familiares.
Cepillado de dientesEn una revisión sistemática con 12 ECA publicada en 201969, en la que se evalúa el impacto del cepillado de dientes en la NAVM, ninguno de los procedimientos evaluados en los artículos demostró su capacidad para disminuir las NAVM. Zhao et al.70, en una actualización de una revisión sistemática Cochrane, sobre los cuidados de la higiene oral en pacientes críticos y su impacto en la NAVM, concluyen que existe evidencia de certeza baja de que el cepillado de dientes sea beneficioso en la reducción de la NAVM.
Técnicas de presión negativa para aspirar secreciones bronquialesLa tecnología de la insuflación-exsuflación mecánica (IEM) se desarrolló hace cerca de 70 años y existe amplia experiencia en pacientes no críticos, principalmente aquellos con enfermedades neuromusculares crónicas degenerativas. Consiste en la generación de un flujo espiratorio acelerado que simula la tos natural, reforzando y aumentando así el mecanismo de arrastre de secreciones hacia el exterior. En pacientes críticos intubados la experiencia publicada es aún escasa, Los resultados de un ECA71 sugieren que la IEM es segura y mejor tolerada que la aspiración con sonda. Además, se ha comprobado en otro ECA72, que el volumen de secreciones aspirado es significativamente superior al que se consigue con la sonda estéril de aspiración convencional. Asimismo, un estudio retrospectivo73 sugiere que la aplicación de la IEM en pacientes intubados reduce la incidencia de la NAVM.
Medidas farmacológicas (tabla 4)Descontaminación selectiva del tracto digestivoLa descontaminación selectiva del tracto digestivo (DDS) incluye la administración de antibióticos tópicos en orofaringe y por SNG y un ciclo corto de un antibiótico de amplio espectro por vía intravenosa. La DDS pretende prevenir el desarrollo de infecciones endógenas, es decir precedidas por un estado de portador del tracto digestivo (desde orofaringe hasta recto), mediante la aplicación tópica en orofaringe y tubo digestivo de una mezcla de antimicrobianos no absorbibles. Desde que Stoutenbeek et al.74 publicaron el primer trabajo sobre la eficacia de la DDS, en 1983, se han publicado más de 65 estudios aleatorizados y 11 metaanálisis o revisiones sistemáticas75–84, que han demostrado la eficacia, efectividad y eficiencia de esta estrategia para reducir el desarrollo de nuevas infecciones en UCI (predominantemente infecciones respiratorias y bacteriemias) e incluso, en alguno de ellos, para disminuir la mortalidad. El último metaanálisis85, publicado en 2020, con ensayos clínicos en paciente quirúrgicos, ratifica la reducción de la NAVM con la DDS.
Descontaminación orofaríngeaLa descontaminación orofaríngea (DOF) ha sido analizada en nueve ensayos controlados86, que muestran una reducción de la incidencia de NAVM (OR [IC 95%]: 0,17 [0,17-0,43]), aunque sin reducción asociada de la mortalidad, ni reducción de la colonización intestinal por microorganismos potencialmente patógenos, incluidos multirresistentes.
Apenas se han publicados nuevos ensayos clínicos, en un estudio pre-post, Landelle et al.87 observaron un descenso significativo de la incidencia de NAVM tras añadir la DOF a un paquete de medidas de prevención también eficaces. En la revisión sistemática y metaanálisis Cochrane publicada en 202188 concluye que la DOF reduce significativamente la incidencia de la NAVM, aunque sin efecto sobre la mortalidad.
Ciclo corto de antibióticos intravenosos por vía sistémica en pacientes que se intuban por disminución de conscienciaUna revisión del 201789 demuestra que la administración sistémica de antibióticos en pacientes en coma disminuye la incidencia de NAVM precoz (RR [IC 95%]: 0,32 [0,19-0,54]) y estancia en UCI, pero no afecta a la mortalidad ni la duración de la VM. Un estudio posterior90, de cohortes retrospectivo en pacientes con lesión neurológica, observó el efecto de la aplicación de 2 g de ceftriaxona en el momento de la intubación, confirmando una disminución de las NAVM precoces tras la implementación de este protocolo (7,4 vs. 19,8%; p = 0,026).
Higiene de boca/orofaringe protocolizada utilizando soluciones de clorhexidinaEn los últimos años se ha producido cierta controversia en torno a esta recomendación, por sus posibles eventos adversos de lesiones en la mucosa oral y su asociación con la mortalidad. Se presentan cinco revisiones sistemáticas recientes.
En 2014 Klompas et al.91 analizaron 16 ECA, publicados antes de 2013, comparando clorhexidina vs. placebo en adultos con VM. En el conjunto de los 16 ECA la utilización de clorhexidina se asoció con una disminución de las NAVM (RR [IC 95%]: 0,73 [0,58-0,92]; p = 0,008). No obstante, aunque se observó una reducción significativa en los tres estudios con pacientes de cirugía cardiaca (RR [IC 95%]: 0,56 [0,15-0,77]; p < 0,001), no se observó diferencia en los 13 estudios con pacientes sin cirugía cardiaca (RR [IC 95%]: 0,78 [0,60-1,02]; p:NS). No hubo ninguna diferencia en la mortalidad (RR [IC 95%]: 1,13 [0,99-1,28]).
En 2016 Hua et al.92 analizaron 38 ECA en los que se realizan cuatro comparaciones de higiene bucal. Los datos de 18 ECA que aportaron datos de NAVM mostraron que el enjuague bucal o el gel de clorhexidina, como parte de la higiene bucal, reduce el riesgo de NAVM en comparación con placebo o la atención habitual (RR [IC 95%]: 0,74 [0,61-0,89]; p = 0,002). No hay evidencia de diferencias en la mortalidad entre clorhexidina vs. placebo/atención habitual (CR [IC 95%]: 1,09 [0,96-1,23]; p = 0,18). Solo dos estudios informaron de eventos adversos, y estos fueron leves con una frecuencia similar en los grupos clorhexidina y control.
También en 2016 Zuckerman et al.93 publicaron el análisis de cuatro estudios que evaluaban el efecto de la clorhexidina en la prevención de NAVM en pacientes adultos ingresados en UCI. Concluyen que existe evidencia suficiente para apoyar el uso de clorhexidina oral en la práctica para la prevención de NAVM.
Otra revisión sistemática del 201994 incluyó 10 ECA y analizaron el efecto de la clorhexidina a diferentes concentraciones (0,2-2%) y la frecuencia de la higiene bucal en la aparición de NAVM y colonización bacteriana de la vía aérea. Se encontró que la clorhexidina 0,2% era más eficaz que el grupo de control (gel dental placebo y solución salina normal) en la prevención de NAVM y que la aplicación de dos veces al día fue eficaz para reducir la tasa de NAVM, la colonización microbiana fue menor en el grupo de clorhexidina al 2%. Concluyen que la clorhexidina es una intervención eficaz en el cuidado bucal para prevenir la NAVM y la colonización microbiana.
La última revisión sistemática de Cochrane70 publicada en el 2020, incluye 40 ECA y analiza el impacto de la clorhexidina en la prevención de la NAVM. El metaanálisis de 13 ECA que utilizaron soluciones o gel de clorhexidina mostró que la clorhexidina redujo la incidencia de NAVM (RR [IC 95%]: 0,67 [0,47-0,97]; p = 0,05). El resultado de mortalidad se informó en nueve estudios y, en general, el metaanálisis mostró que no hay diferencias en la mortalidad entre los pacientes que emplearon clorhexidina o placebo/atención habitual (RR [IC 95%]: 1,02 [0,84-1,23]; p = 0,86). Se concluye que la higiene bucal con clorhexidina 0,12% como parte del cuidado bucal reduce la NAVM. No se ha encontrado evidencia sobre la reducción de mortalidad.
Antibióticos inhaladosPóvoa et al.95 en un metaanálisis del 2018 con solo seis estudios comparativos en los que evaluaron el efecto de los antibióticos inhalados en la prevención de la NAVM, demostraron que la administración de los antibióticos con nebulización reduce la aparición de NAVM al compararlo con placebo o ningún tratamiento (OR [IC 95%]: 0,46 [0,22-0,97]), pero este efecto no se observa cuando el antibiótico es instilado en vía traqueal.
Rotación de antibióticosRainieri et al.96 en 2010 publicaron un estudio en el que evalúan el efecto de un programa de rotación trimestral de antibióticos sobre la incidencia de la NAVM causadas por bacterias gramnegativas resistentes a antibióticos. Se observó una reducción no significativa de las NAVM polimicrobianas y de NAVM por bacterias gramnegativas resistentes a antibióticos, y significativa de las NAVM por Pseudomonas aeruginosa.
ProbióticosLa administración oral de probióticos (bacterias viables) podría tener un efecto beneficioso relacionado con su efecto sobre la flora intestinal. El concepto es análogo al de la DDS, ya que en ambos casos se pretende prevenir la sustitución de la flora normal por colonización secundaria del tracto digestivo proximal y distal (flora nosocomial potencialmente patógena). En algunos casos se han administrado con «prebióticos» (azúcares no digeribles). A la combinación de ambos se la denomina «synbiotics».
Es una medida controvertida sobre su efecto en la incidencia de NAVM y mortalidad. Los últimos metaanálisis publicados en 2020 no permiten sacar conclusiones definitivas. Batra et al.97 analizan nueve estudios aleatorizados en pacientes de UCI con VM, a los que se administró probióticos/synbiotics vs. placebo. La incidencia de NAVM fue menor en el grupo de los probióticos (RR [IC 95%]: 0,70 [0,56-0,88]; p = 0,002), así como la estancia en UCI y la mortalidad hospitalaria. Su et al.98 analizaron 14 estudios. La administración de probióticos se asoció con una reducción de NAVM (OR [IC 95%]: 0,62 [0,45-0,85]; p = 0,003), pero no cuando se analizan los seis estudios doble ciego (OR [IC 95%]: 0,72 [0,44-1,19]; p = 0,20). No hubo diferencias en la mortalidad en UCI.
Anticuerpos monoclonales (MoAb)El empleo de MoAb frente a antígenos específicos de bacterias individuales tiene varias potenciales ventajas, entre las que destaca su efecto altamente selectivo, exclusivo del microorganismo diana y, por lo tanto, dejando indemne el resto de la flora bacteriana del huésped. Existen pruebas de su eficacia preventiva y terapéutica en modelos experimentales con MoAb específicos frente a la alfa exotoxina de Staphylococcus aureus y frente antígenos de superficie de Pseudomonas aeruginosa que se han evaluado en ECA, doble ciego y multinacionales99. El ensayo que emplea el MoAb frente a alfa exotoxina de Staphylococcus aureus en la prevención de la NAVM por esta bacteria en pacientes colonizados acaba de publicarse100 y el efecto preventivo no alcanza significación estadística, salvo en determinados subgrupos. El ensayo clínico en el que se evalúa la prevención de la NAVM por Pseudomonas aeruginosa con un MoAb bi-específico ha resultado negativo y está pendiente de publicarse.
ConclusionesDe acuerdo con la revisión bibliográfica y la ponderación de eficacia, tolerancia y aplicabilidad de las medidas revisadas, se han identificado 10 recomendaciones que deben emplearse de forma obligatoria en todas las unidades adheridas al proyecto NZ. El paquete de medidas recoge y matiza las medidas originales del proyecto NZ (2011), sin establecer diferencias entre ellas.
- 1.
Mantener la posición de la cabecera de la cama por encima de 30°, excepto si existe contraindicación clínica.
- 2.
Realizar higiene de manos estricta antes y después de manipular la vía aérea, y utilizar guantes estériles de un solo uso.
- 3.
Formar y entrenar al personal sanitario en el manejo de la vía aérea.
- 4.
Favorecer el proceso de extubación de forma segura para reducir el tiempo de ventilación.
- 5.
Controlar de forma continua la presión del neumotaponamiento de los tubos traqueales.
- 6.
Emplear tubos traqueales con sistema de aspiración continuo de secreciones subglóticas.
- 7.
No cambiar de forma programada las tubuladuras del respirador.
- 8.
Administrar antibióticos durante las 24 horas siguientes a la intubación de pacientes con disminución de consciencia previo a la intubación.
- 9.
Realizar higiene de la boca con clorhexidina 0,12-0,2%.
- 10.
Utilizar la descontaminación selectiva digestiva completa.
Financiado, en parte, por la Agencia Española de Medicamentos y Productos Sanitarios (AEMyPS) del Ministerio de Sanidad (MS) a través de un contrato nominativo (Expediente n.∘: 2021/48603/001).
Francisco Álvarez Lerma. Hospital del Mar, Barcelona, España
Miguel Sánchez García. Hospital Clínico Universitario San Carlos, Madrid, España
José Garnacho Montero. Hospital Virgen de la Macarena, Sevilla, España
Manuel Álvarez González. Hospital Clínico Universitario San Carlos, Madrid, España
Joaquín Álvarez Rodríguez. Hospital de Fuenlabrada, Madrid, España
Federico Gordo Vidal. Hospital del Henares. Coslada, Madrid, España
Leonardo Lorente Ramos. Hospital Universitario de Canarias, Tenerife, España
Rosa García Díez. Organización Sanitaria Integrada Bilbao Basurto, Osakidetza, España
Rosa Jam Gatell. Hospital Parc Tauli, Sabadell, Barcelona, España
Susana Arias Rivera. Hospital Universitario de Getafe, Madrid, España
Mónica Vázquez Calatayud. Clínica Universidad de Navarra, Pamplona, España
Mónica Delicado Domingo. Organización Sanitaria Integrada Bilbao Basurto, Osakidetza, España
Inmaculada Fernández, Hospital Par Tauli, Sabadell, Barcelona, España