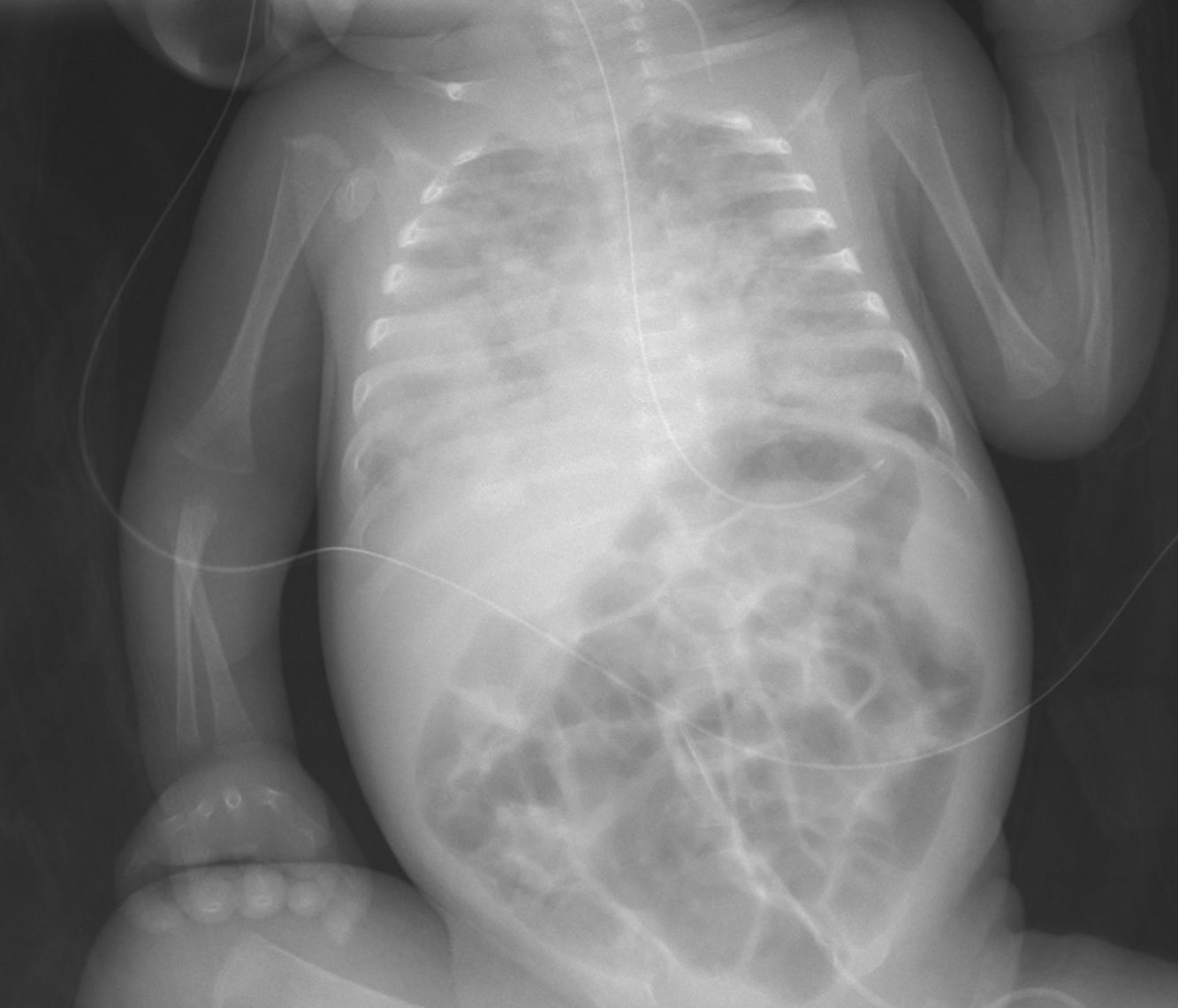
La baja frecuencia de algunas enfermedades infecciosas en neonatos ocasiona un retraso diagnóstico, acarreando una alta morbimortalidad. Presentamos el caso de un prematuro de 28 semanas gestacionales, padres sanos y etnia gitana, que ingresa en la unidad neonatal por prematuridad con evolución favorable. A los 57 días de vida, próximo al alta hospitalaria, inicia distrés respiratorio grave junto con fiebre, hepatoesplenomegalia y coagulopatía. Se diagnostica de sepsis-neumonía nosocomial, con mala evolución clínica y radiológica (fig. 1) con la antibioterapia habitual, mostrando en la tomografía axial computarizada una extensa neumonía necrosante bilateral. Se sospecha síndrome hemofagocítico secundario al cumplir 6 de los 8 criterios clínico-analíticos1. Tras 15 días del inicio del cuadro, ante la mala evolución clínica y la negatividad de las pruebas microbiológicas para virus, hongos y bacterias habituales, se realiza despistaje de infección tuberculosa. Se extraen muestras de jugo gástrico durante 3 días consecutivos para las pruebas de reacción en cadena de la polimerasa (PCR), baciloscopia y cultivo, y se realiza una prueba de la tuberculina (PT). Ante la lectura negativa de la PT a las 48h, se solicita una prueba de interferon-gamma release assay (IGRA). Se reciben los resultados de la baciloscopia y de la PCR en jugo gástrico, que son positivos para Mycobacterium tuberculosis, siendo el IGRA también positivo. Se diagnostica de tuberculosis (TB) perinatal, obteniéndose posteriormente un cultivo positivo para M. tuberculosis. El estudio de contactos de familiares y del personal sanitario revela enfermedad tuberculosa pulmonar bacilífera tanto en la madre como en la abuela. Ambas referían encontrarse asintomáticas y negaban viajes al extranjero.
La TB perinatal es aquella que aparece en menores de 3 meses, con una baja incidencia en nuestro medio2. En una serie de casos del Hospital La Paz, su frecuencia supone el 1,4% de las TB en edad pediátrica3. Su origen puede ser congénito o adquirido de forma posnatal, siendo esta última la más frecuente. El diagnóstico de la TB en el período de lactante es difícil debido al menor rendimiento de las pruebas microbiológicas. Del mismo modo, la PT tiene más falsos negativos debido a la peor inmunidad celular y también en las formas de TB diseminadas, frecuentes en esta población. El IGRA tiene mayor especificidad que la PT, pero una sensibilidad también baja en lactantes. Por ello, si existe alta sospecha, se debe realizar PT o IGRA, y si el resultado es negativo para una de ellas, se recomienda realizar la otra, alcanzando una sensibilidad mayor del 90% con la combinación de ambas4.
Respecto a la recogida de muestras para el diagnóstico microbiológico, la TB congénita tiene cargas bacilares altas en jugo gástrico y en muestras respiratorias (lavado broncoalveolar o aspirado bronquial), siendo positivas hasta en el 80% de los casos5, no así la TB posnatal, que es escasamente bacilífera. Es necesaria también la extracción de LCR para descartar meningitis, solicitando PCR, baciloscopia, cultivo y adenosina desaminasa. Otras muestras posibles si existe alta sospecha serían líquido ascítico o pleural, material fecal, u orina. El cultivo es la prueba diagnóstica de referencia; permite identificar la especie y determinar la sensibilidad a antituberculosos, aunque tiene como inconvenientes la baja sensibilidad (30-50%) y la demora de hasta 4 semanas para un resultado definitivo. La PCR destaca por su mayor rapidez, alta especificidad en niños y también permite detectar resistencias a fármacos. Su sensibilidad es del 65-70% respecto al cultivo. La baciloscopia es rápida, pero con una sensibilidad baja en niños, siendo más elevada en la TB congénita.
Los hallazgos radiológicos son muy frecuentes en lactantes, destacando las adenopatías hiliares y el patrón miliar. Los signos clínicos son variables, desde pacientes con buen aspecto y leve distrés respiratorio hasta distrés respiratorio grave, neumonía sin respuesta al tratamiento, tos pertusoide, fiebre, hepatoesplenomegalia, linfadenopatías, distensión abdominal, ascitis, diarrea persistente o ictericia6. El fondo de ojo debe ser examinado en busca de coriorretinitis y granulomas. Existen manifestaciones infrecuentes de la TB congénita, como lesiones cutáneas o del oído medio7. Sin tratamiento, un 10-20% desarrollará formas diseminadas (meningitis o diseminación miliar). También es más habitual desarrollar otras complicaciones como shock séptico, coagulación intravascular diseminada, fallo multiorgánico o síndrome hemofagocítico.
El tratamiento en la fase intensiva (primeros 2 meses) ha de combinar 4 tuberculostáticos: isoniacida, rifampicina, pirazinamida y, como cuarto fármaco, un aminoglucósido o etambutol8, debiéndose retirar este último cuando se compruebe la sensibilidad a los otros 3 fármacos de primera línea. Se continuará en la fase de mantenimiento con isoniacida y rifampicina durante al menos 9 meses, pudiéndose asociar corticoides en las formas graves9. En conclusión, se debe sospechar TB perinatal en infecciones que no responden a la antibioterapia habitual y con cultivos negativos. El diagnóstico precoz mejora el pronóstico.
FinanciaciónLa presente publicación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.