El término RIME (erupción mucocutánea infecciosa reactiva) fue acuñado en 2019 para hacer referencia a un grupo infrecuente de erupciones mucocutáneas parainfecciosas, englobando tanto etiologías víricas (SARS-CoV-2, influenza, herpesvirus) como bacterianas1. Dentro de estas últimas se encuentra Mycoplasma pneumoniae, cuya infección puede asociar de forma infrecuente dicha manifestación, anteriormente denominada MIRM (rash y mucositis inducidos por Mycoplasma), en el 6,8% de los infectados2. Existe una variante sin afectación cutánea, denominada RIME sine rash3, como el caso que se describe a continuación.
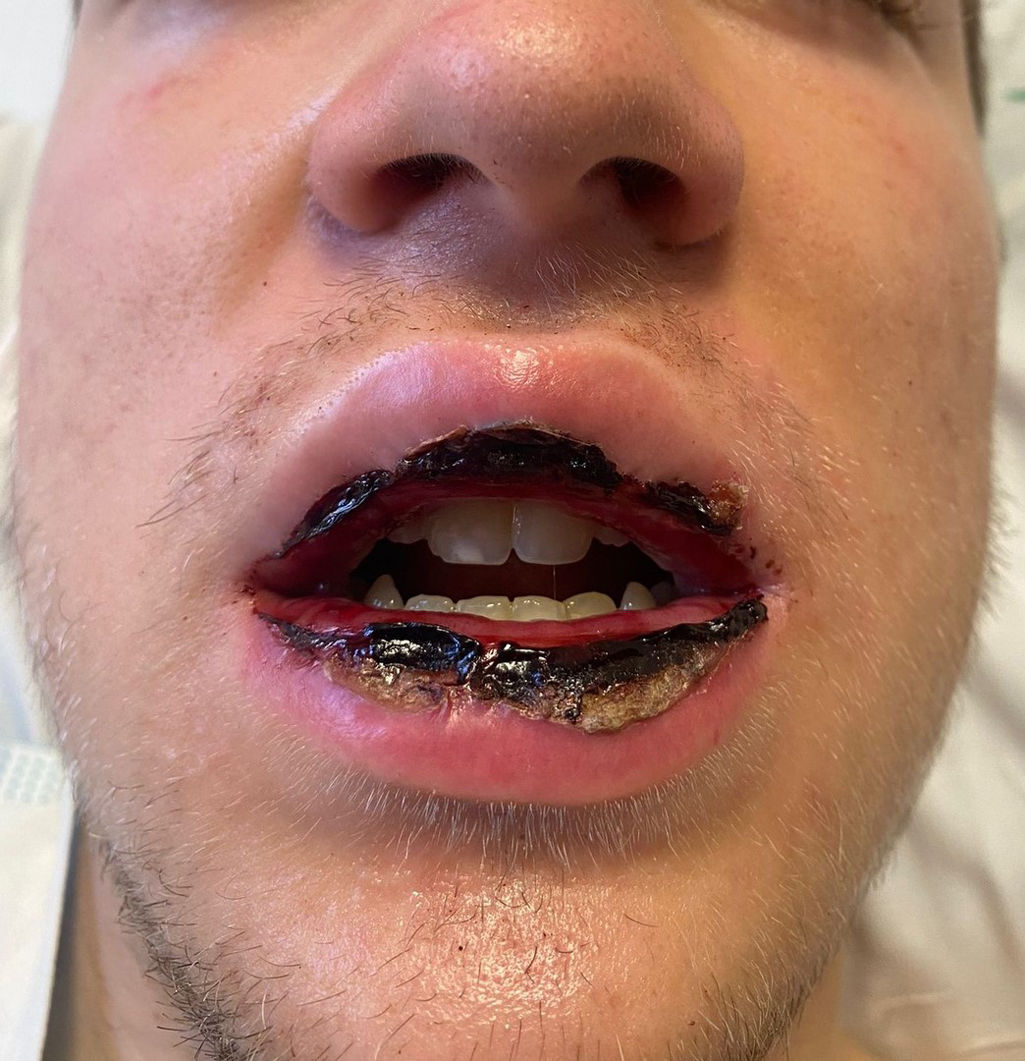
Presentamos el caso de un varón de 19 años sin antecedentes relevantes que acudió por cuadro febril de 5 días de evolución seguido de la aparición 48 horas después de lesiones necróticas en el labio inferior, y posterior extensión a toda la mucosa oral, condicionando imposibilidad para la deglución por odinofagia severa y dificultad en la apertura bucal. No presentaba antecedentes epidemiológicos relevantes ni consumo de fármacos. A la exploración se objetivaron lesiones necróticas costrosas de fondo eritematoso en la porción interna del labio superior e inferior (fig. 1) y, en paladar blando, lesiones puntiformes, eritematosas planas que se extendían a orofaringe. No se objetivaron otras lesiones cutáneas salvo una lesión macular eritematosa subcentimétrica en el glande. Las pruebas complementarias realizadas inicialmente mostraron una elevación de proteína C reactiva (PCR; 142mg/L) y leucocitosis con neutrofilia (11.900/mm3 con 79% neutrófilos), siendo la radiografía de tórax normal. Se ingresó para tratamiento de soporte nutricional y estudio, completando el mismo con las siguientes determinaciones analíticas: autoinmunidad (antimembrana basal epidérmica, antisustancia intercelular epidérmica, anticuerpos antinucleares, antígeno nuclear extraíble; todos negativos), serologías víricas (virus de Epstein-Barr, citomegalovirus, virus de hepatitis B y C, inmunodeficiencia humana; negativas) y estudio de exudado mediante reacción en cadena de la polimerasa (PCR) para gripe A, virus respiratorio sincitial y SARS-CoV-2, negativos. Los hemocultivos fueron negativos y se realizó biopsia punch de las lesiones. Finalmente, las serologías bacterianas mostraron negatividad para Chlamydophila pneumoniae pero IgM positiva para M. pneumoniae. Se instauró tratamiento antibiótico de amplio espectro inicialmente y posteriormente dirigido, y glucocorticoides sistémicos con mejoría clínica y analítica, siendo alta hospitalaria tras el reinicio de la tolerancia por vía oral. Posteriormente, la biopsia de mucosa yugal realizada mostró datos de espongiosis y exocitosis inflamatoria asociada a cambios epiteliales reactivos, infiltrado inflamatorio crónico perivascular y tejido de granulación, con inmunofluorescencia directa negativa. Tras el alta, se confirmó la recuperación clínica completa y la serología mostró la aparición de IgG con persistencia de IgM para M. pneumoniae. El diagnóstico final fue de RIME sine rash asociada a infección por M. pneumoniae.
Esta entidad afecta predominantemente a varones con una media de edad de 12 años4. Si bien su fisiopatología no está clara, se postula un mecanismo inmune multifactorial: mimetismo entre la adhesina MP P1 y los antígenos queratinocitarios, pudiendo desarrollar una reacción cruzada y autoanticuerpos frente a los antígenos presentes en las mucosas; la formación y depósito de inmunocomplejos; la activación policlonal de células plasmáticas y la susceptibilidad genética1. El diagnóstico es clínico, comenzando generalmente con un cuadro prodrómico (fiebre, tos, malestar general) seguido a la semana de la aparición de lesiones mucocutáneas, generalmente polimorfas con predominio de vesículas y ampollas. Se han propuesto criterios diagnósticos4 para la forma clásica, severa y RIME sine rash, siendo los de esta última variante: erupción mucocutánea que afecte <10% de la superficie corporal; afectación de al menos dos membranas mucosas; afectación cutánea leve en forma de lesiones vesiculobullosas, en diana o exantema y hallazgos clínicos y analíticos compatibles con neumonía atípica. Si bien se desconoce la causa de las diferentes presentaciones clínicas, se cree que la presencia de múltiples subtipos genéticos de M. pneumoniae podrían mostrar diferentes patrones de tropismo tisular y, por tanto, la diversidad de presentación clínica4.
Ante la sospecha clínica, es imprescindible descartar la introducción reciente de algún fármaco que pudiera inducir cuadros como el síndrome de Stevens-Johnson/necrólisis epidérmica tóxica (SJS/NET), recomendándose asimismo la determinación de proteína C reactiva y velocidad de sedimentación globular, radiografía de tórax, exudado nasofaríngeo para virus respiratorios y serología de M. pneumoniae, C. pneumoniae y herpesvirus. A menudo, los anticuerpos frente a M. pneumoniae están presentes en el momento de la sintomatología clínica, debido al largo periodo de incubación. La demostración de un incremento en 4 veces el título entre una muestra de la fase aguda y una de la fase de convalecencia, o bien títulos superiores o iguales a 1/32, proporciona una sensibilidad del 90% y una especificidad del 88%5. Por otra parte, las técnicas moleculares presentan también alta sensibilidad y especificidad, no obstante, presentan la limitación de no poder diferenciar colonización de infección. La biopsia cutánea, si bien no muestra hallazgos específicos, es útil para la exclusión de enfermedades ampollosas autoinmunes. El diagnóstico diferencial debe incluir la necrólisis epidérmica inducida por fármacos (SSJ y NET), enfermedad de Kawasaki, pénfigo vulgar, enfermedad de Behçet y enfermedad mano-pie-boca6.
El curso de la enfermedad es generalmente benigno con recuperación completa, aunque no es infrecuente que asocie comorbilidad relacionada con la dificultad para la deglución (deshidratación, pérdida de peso) y alteraciones neuropsiquiátricas7. En hasta el 10% de los casos pueden aparecer secuelas mucosas, fundamentalmente oculares4. Las recurrencias son infrecuentes, aunque existe variabilidad entre las distintas series tanto en prevalencia (8-38% de los casos)5,8 como en características clínicas predisponentes8,9. Los episodios recurrentes se asocian con tiempos de recuperación más cortos y un menor o igual grado de afectación mucosa en comparación con los episodios iniciales10.
Con respecto al tratamiento, no existen actualmente directrices claras, siendo fundamentalmente de soporte, priorizando asegurar la nutrición e hidratación, la protección de mucosas y el control del dolor. Si la afectación de mucosas es extensa se pueden administrar corticoides sistémicos (prednisona/metilprednisolona 1mg/kg/día durante 5-7 días)7. Aunque se recomienda el uso de antibióticos, no hay evidencia a este respecto, ya que, si bien reducen las complicaciones infecciosas, su papel en la evolución de las lesiones mucocutáneas es desconocido5. También se han empleado inmunoglobulinas por vía intravenosa, ciclosporina o inhibidores TNF-α, aunque no hay evidencia que los avale2.
FinanciaciónNo financiación.