El cribado de cáncer de pulmón (CP) detecta tumores precozmente. El estudio prospectivo GESIDA 8815 se diseñó para valorar la utilidad de esta estrategia en personas VIH+ (PVVIH) mediante la realización de una tomografía computarizada (TC) de baja radiación.
Pacientes y métodosSe incluyeron 371 pacientes grandes fumadores (>20 paquetes-año), >45años y con nadir de CD4+ <200mm3. Se realizó una visita y TC basal y 4 de seguimiento anualmente.
ResultadosRealizaron la visita y TC basal (TC0) 329 pacientes y completaron el estudio 206 (TC1=285; TC2=259; TC3=232; TC4=206). Todos recibían TAR. Se detectaron 35 nódulos pulmonares > 8mm y se diagnosticaron 9CP en estadio precoz (4 en TC1, 2 en TC2, 1 en TC3 y 2 en TC4). No existieron diferencias entre los que desarrollaron CP y los que no en sexo, edad, nadir CD4+, patología pulmonar previa, antecedentes familiares ni número de paquetes/año. En cada visita se diagnosticaron otras patologías, fundamentalmente EPOC, coronarias calcificadas y lesiones residuales de tuberculosis. Al finalizar el estudio, 38 pacientes dejaron de fumar y 75 redujeron el consumo. Fallecieron 2 pacientes por CP y 16 por otras causas (p=0,025).
ConclusionesEl diseño del presente estudio no permitió definir la utilidad real de la estrategia. La adherencia a la prueba disminuyó progresivamente a lo largo del tiempo. Es muy frecuente el diagnóstico de otras patologías torácicas. Incluir a pacientes fumadores en un protocolo de diagnóstico precoz de CP podría ayudar a dejar de fumar.
Lung cancer (LC) screening detects tumors early. The prospective GESIDA 8815 study was designed to assess the usefulness of this strategy in HIV+ people (PLHIV) by performing a low-radiation computed tomography (CT) scan.
Patients and methods371 heavy smokers patients were included (>20 packs/year), >45years old and with a CD4+ <200mm3 nadir. One visit and CT scan were performed at baseline and 4 for follow-up time annually.
Results329 patients underwent the baseline visit and CT (CT0) and 206 completed the study (CT1=285; CT2=259; CT3=232; CT4=206). All were receiving ART. A total >8mm lung nodules were detected, and 9 early-stage PCs were diagnosed (4 on CT1, 2 on CT2, 1 on CT3 and 2 on CT4). There were no differences between those who developed LC and those who did not in sex, age, CD4+ nadir, previous lung disease, family history, or amount of packets/year. At each visit, other pathologies were diagnosed, mainly COPD, calcified coronary artery and residual tuberculosis lesions. At the end of the study, 38 patients quit smoking and 75 reduced their consumption. Two patients died from LC and 16 from other causes (P=.025).
ConclusionsThe design of the present study did not allow us to define the real usefulness of the strategy. Adherence to the test progressively decreased over time. The diagnosis of other thoracic pathologies is very frequent. Including smokers in an early diagnosis protocol for LC could help to quit smoking.
En los últimos años han cobrado especial interés en las personas que viven con VIH (PVVIH) los eventos no definitorios de sida (ENOS), y, dentro de ellos, los tumores no definitorios de sida (TNDS)1-5. En España, según datos presentados en 2023 en el XIVCongreso Nacional de GeSIDA6, se encontró una tasa de incidencia de 3,82×1.000 personas-año en varones (IC95%: 3,46-4,22) y de 4,21×1.000 en mujeres (IC95%: 3,4-5,21), siendo el cáncer de pulmón (CP) el más frecuente, con una tasa de incidencia de 0,69×1.000 (IC95%: 0,56-0,86). El tabaquismo, muy frecuente en las PVVIH, es uno de los principales agentes implicados en su desarrollo; el riesgo de desarrollarlo aumenta con la edad, y algunos estudios epidemiológicos han encontrado mayor incidencia a edades más precoces en las PVVIH7. Además, Sigel et al.8, independientemente del hábito tabáquico, encontraron una incidencia en PVVIH (2,04×1.000 personas-año) mayor que en población VIH− (1,19×1.000 personas-año).
Aunque el CP es una de las principales causas de muerte, hasta hace poco tiempo no ha habido un método de cribado que permitiera realizar su diagnóstico precoz. En la actualidad se propone el uso de la tomografía computarizada (TC) de baja radiación, existiendo una disminución de la mortalidad gracias a su aplicación9,10. Los United States Preventive Services Task Force (USPSTF)11 y las guías clínicas de la European AIDS Clinical Society (EACS)12 recomiendan realizarla a aquellos pacientes con edades entre 50 y 80años, con un consumo acumulado de tabaco ≥20 paquetes/año o que hayan sido fumadores hasta hace 15años.
Hulbert el al.13 publicaron en 2014 el primer estudio en PVVIH con resultados no concluyentes, lo que nos animó a realizar el presente estudio, cuyo objetivo fue intentar definir la utilidad del uso de la TC de baja radiación como sistema de detección precoz del CP en esta población.
MétodosObjetivos- 1.
El objetivo principal fue evaluar la utilidad de la realización de una TC torácica seriada de baja radiación para la detección precoz del CP en un grupo de PVVIH y alto riesgo de desarrollarlo.
- 2.
Los objetivos secundarios fueron describir los hallazgos radiológicos, diferentes del CP, encontrados en cada TC y las actitudes diagnósticas y terapéuticas que de ellos se derivaron.
Se diseñó un estudio prospectivo con un seguimiento por paciente de 4años llevado a cabo en los Servicios de Medicina Interna-Unidad VIH, Neumología y Radiodiagnóstico de 6 hospitales españoles. La población se seleccionó entre las PVVIH atendidas en la consulta que cumplían los criterios de inclusión.
Se analizó la información relativa a cada paciente en la visita de inicio, en la que se recogieron datos clínico-epidemiológicos, características y estadio de la infección por el VIH, conductas de riesgo y antecedentes familiares que pudieran condicionar el desarrollo de un CP.
El cronograma del estudio aparece reflejado en la tabla 1.
Cronograma de las visitas y TC realizados en el estudio
| Visita inicial | 1 año | 2 años | 3 años | 4 años | |
|---|---|---|---|---|---|
| Edad | |||||
| Sexo | |||||
| Nacionalidad | |||||
| Riesgo VIH | |||||
| Años de infección | |||||
| Grupo CDC | |||||
| Recibe TAR | |||||
| Años en TAR | |||||
| CD4+/mm3 nadir | |||||
| CD4+/mm3 actual | |||||
| CD8+/mm3 actual | |||||
| Ratio CD4+/CD8+ | |||||
| Carga viral <50 copias/ml | |||||
| Antecedentes familiares | |||||
| Patología pulmonar | |||||
| Historia tabáquica | |||||
| TC torácico | CT0 | CT1 | CT2 | CT3 | CT4 |
Se realizó una TC al inicio y posteriormente cada año, hasta completar cuatro años (5TC).
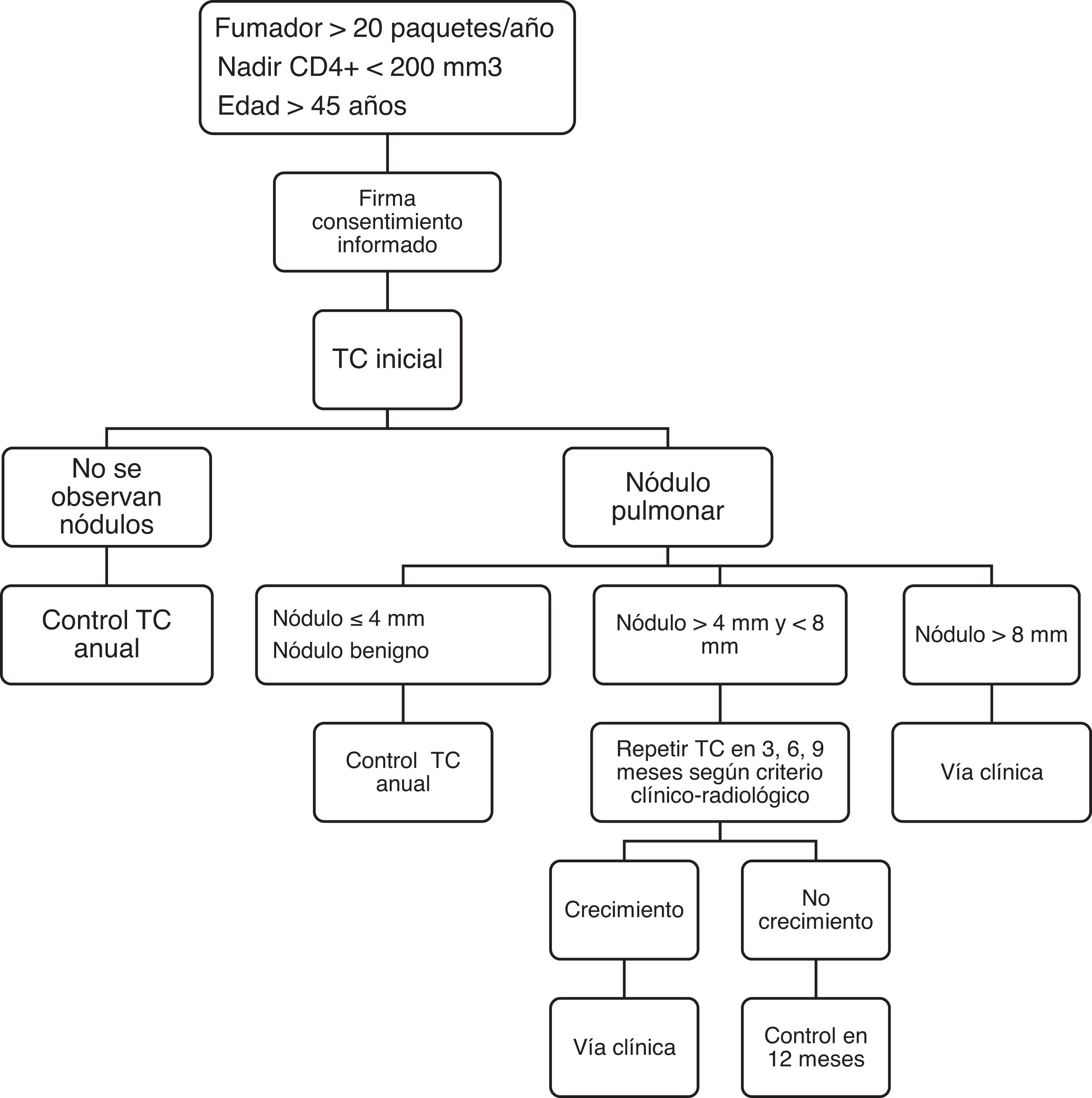
Los estudios radiológicos se llevaron a cabo tras acudir el paciente a consulta y firmar el consentimiento informado, y a todos se les aplicó el mismo algoritmo diagnóstico (fig. 1). El análisis se realizó por el radiólogo en la estación de trabajo habitual con un protocolo de TC de tórax de baja radiación sin contraste endovenoso, e inspiración de dosis baja (120kV, 100mA) con reconstrucción axial de 3mm, pitcho1 y 0,6mm de colimación. Se utilizó un algoritmo estándar de reconstrucción de pulmón (ancho de ventana, 1.500UH; nivel de ventana, −600UH) y mediastino (anchura de ventana, 400UH; nivel de ventana, 40UH) y un posproceso de máxima intensidad de proyección en plano axial. Los resultados se registraron en un formulario estandarizado y se clasificaron como:
- •
Resultados negativos: sin nódulos pulmonares. La TC se repitió a los 12 meses.
- •
Resultados positivos: existían nódulos pulmonares. Se consideró positivo cualquier nódulo parenquimatoso, excluyendo los densamente calcificados.
Se evaluó el tamaño midiendo el diámetro más grande en el plano transversal. Se clasificaron en 3 categorías: ≤4mm, 5-8mm y >8mm. La actitud en relación al tamaño fue:
- 1.
Los nódulos ≤4mm se consideraron de baja sospecha y se realizó el control en 12 meses.
- 2.
A los nódulos indeterminados (5-8mm) se les aplicó un algoritmo de seguimiento según criterio médico y se realizó una TC intermedia entre los 3 y los 9 meses.
- 3.
Los nódulos >8mm se dirigieron a vía clínica, realizando estudio de PET-TC y/o estudio de TC dinámica, según criterio radiológico. En caso de resultado positivo, se realizaron las pruebas complementarias que el facultativo responsable del paciente consideró necesarias.
Se realizó, además, un estudio descriptivo del resto de los hallazgos encontrados.
La TC de baja radiación fue la única intervención que se realizó fuera de la rutina de la visita de cada paciente. Cuando tras su realización se objetivó patología pulmonar subsidiaria de alguna actitud diagnóstico-terapéutica añadida, se informó al paciente y se tomaron las medidas oportunas.
Criterios de inclusiónCumplir todos los siguientes:
- 1.
Infección confirmada por VIH con nadir de linfocitos CD4+ <200/mm3.
- 2.
Ser fumadores importantes con un consumo ≥20 paquetes-año en el momento de inclusión o haber fumado hasta los 15años anteriores.
- 3.
Tener >45años.
- 4.
Firmar el consentimiento informado
Cumplir alguno de los siguientes:
- 1.
Realización de una TC torácica en los 18 meses anteriores.
- 2.
Gestación.
- 3.
Historia previa de CP.
- 4.
Infección respiratoria aguda que una vez resuelta permitía una nueva evaluación del paciente como candidato a entrar en el estudio.
Todos los datos se recogieron en CRD electrónico RedCAp (Copyright 2006-2013 Vanderbilt University). Se realizó el análisis descriptivo de los datos sociodemográficos y relacionados con VIH, hábito tabáquico, CP y resultados de la TC en la visita de inicio y visitas de seguimiento mediante tablas de frecuencias para las variables categóricas y media desviación típica o mediana y rango intercuartílico para las variables cuantitativas con distribución normal o no normal, respectivamente. Se evaluaron las diferencias en las características de los individuos en la visita de inicio en función del diagnóstico de CP en el seguimiento mediante el test chi cuadrado de asociación para las variables categóricas y el test t de Student o el test no paramétrico U de Mann-Whitney para las variables cuantitativas con distribución normal o no normal, respectivamente.
El análisis estadístico se realizó con el programa Stata (versión 17.0; Stata Corporation, College Station, TX, EE.UU.).
Aspectos éticosEl estudio se realizó de acuerdo con el protocolo, los principios establecidos en la versión revisada actual de la Declaración de Helsinki (Seúl, octubre de 2008) y de acuerdo con los requisitos reguladores aplicables, en particular las Normas armonizadas tripartitas ICH para las Buenas Prácticas Clínicas 1996 y el Real Decreto de Ensayos Clínicos 223/2004, que incorpora en su totalidad el ordenamiento de la Directiva Europea 2001/20/CE14. Todos los pacientes firmaron el consentimiento informado y el protocolo fue aprobado por el Comité Ético del Hospital Universitario La Paz
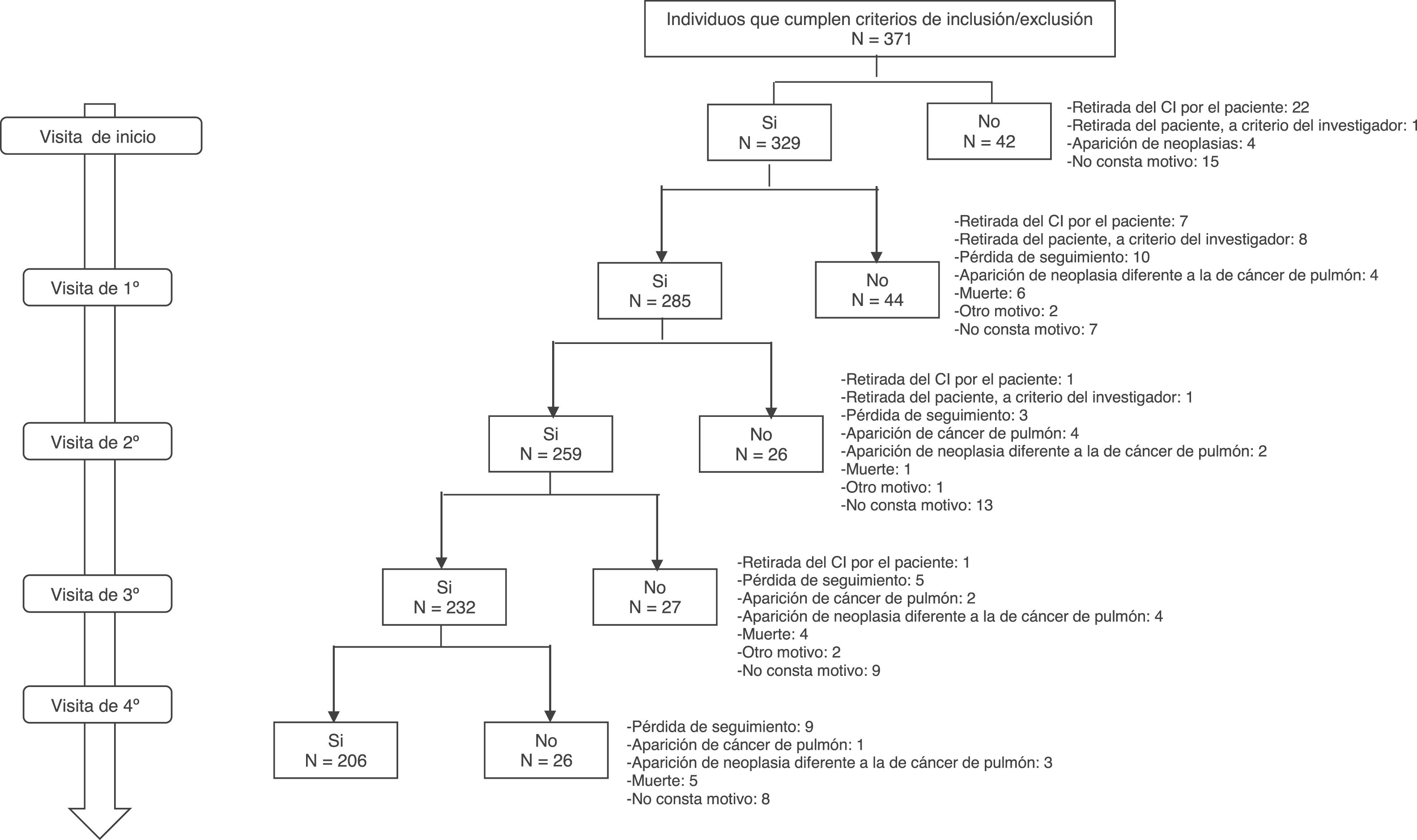
ResultadosSe incluyeron en el estudio 371 pacientes, de los que realizaron la visita y TC de inicio (TC0) 329 y completaron el seguimiento 206 (TC1=285; TC2=259; TC3=232; TC4=206). En la figura 2 se refleja el diagrama de flujo de la población en estudio. El 76,9% eran varones nacidos en España (93,6%), con una edad media (DE) de 54,7 (6,7) años. Las principales vías de adquisición del VIH fueron drogadicción parenteral (52%) y relaciones sexuales (21,3% homosexuales; 20,1% heterosexuales). La mediana del nadir de linfocitos CD4+/mm3 fue de 98 (RI=42-150) y cumplían criterios de sida 147 pacientes (44,7%). Todos recibían tratamiento antirretroviral (TAR) con una mediana de años en tratamiento de 18,6 (RI=14,3-21,2). El TAR era un régimen de terapia triple basado en inhibidores de la integrasa en 111 pacientes (33,8%), en inhibidores de la transcriptasa inversa no análogos de nucleótidos en 84 (25,6%) y en inhibidores de la proteasa en 33 (10,1%). En el momento de iniciar el estudio la carga viral era indetectable en 307 pacientes (93,3%), la mediana de los linfocitos CD4+/mm3 era de 571 (RI=660-847) y la de los CD8+, de 890 (RI=660-1.144). Solo 28 (8,5%) tenían antecedentes familiares de CP y 116 (35,3%) tenían alguna patología pulmonar previa. La mediana de tiempo transcurrido desde el inicio del hábito tabáquico hasta entrar en el estudio fue de 37,4años (RI=33,3-41,8), la mediana de paquetes/año, de 35 (RI=27-42), y 271 (82,4%) continuaban fumando. En la tabla 2 se reflejan todas las características de la población en estudio.
Datos sociodemográficos, relacionados con el VIH, el hábito tabáquico y el cáncer de pulmón en la visita de inicio
| Visita de inicio | |
|---|---|
| n=329 | |
| Sexo, n (%) | Hombre 253 (76,9); Mujer 76 (23,1) |
| Edad media en años (DE) | 54,7 (6,7) |
| Mediana edad en años (RI) | 54,3 (50,7-58,0) |
| Nacido en España, n (%) | 308 (93,6) |
| Mediana años de infección (RI) | 22,9 (17,0-27,3) |
| Vía de adquisición del VIH, n (%) | |
| UDVP | 171 (52,0) |
| HSH | 70 (21,3) |
| HSM | 66 (20,1) |
| Transfusión | 1 (0,3) |
| Otros | 12 (3,6) |
| Desconocido | 9 (0,03) |
| Estadio CDC, n (%) | |
| A | 97 (29,5) |
| B | 85 (25,8) |
| C | 147 (44,7) |
| Mediana nadir CD4+, mm3(RI) | 98 (42-150) |
| Recibían TAR, n (%) | 329 (100) |
| Mediana años en TAR (RI) | 18,6 (14,3-21,2) |
| Pauta TAR, n (%) | |
| Basada en inhibidores de la integrasa | 111 (33,8) |
| Basada en no análogos | 84 (25,6) |
| Basada en inhibidores de la proteasa | 33 (10,1) |
| Monoterapia | 27 (8,2) |
| Biterapia | 61 (18,6) |
| Otras | 12 (3,7) |
| Mediana CD4+/mm3(RI) | 571 (419-847) |
| Mediana CD8+/mm3(RI) | 890 (660-1144) |
| CV ≤ 50 copias/ml, n (%) | 307 (93,3) |
| Antecedentes familiares cáncer pulmón, n (%) | 28 (8,5) |
| Patología o radioterapia pulmonar previa, n (%) | 116 (35,3) |
| Fuma actualmente, n (%) | 271 (82,4) |
| Mediana años fumando (RI) | 37,4 (33,3-41,8) |
| Mediana número de paquetes-año (RI) | 35 (27-42) |
CV: carga viral; DE: desviación estándar; HSH: hombres que tienen sexo con hombres; HSM: hombres que tienen sexo con mujeres (trasmisión heterosexual); RI: rango intercuartílico; TAR: tratamiento antirretroviral; UDVP: usuarios de drogas por vía parenteral.
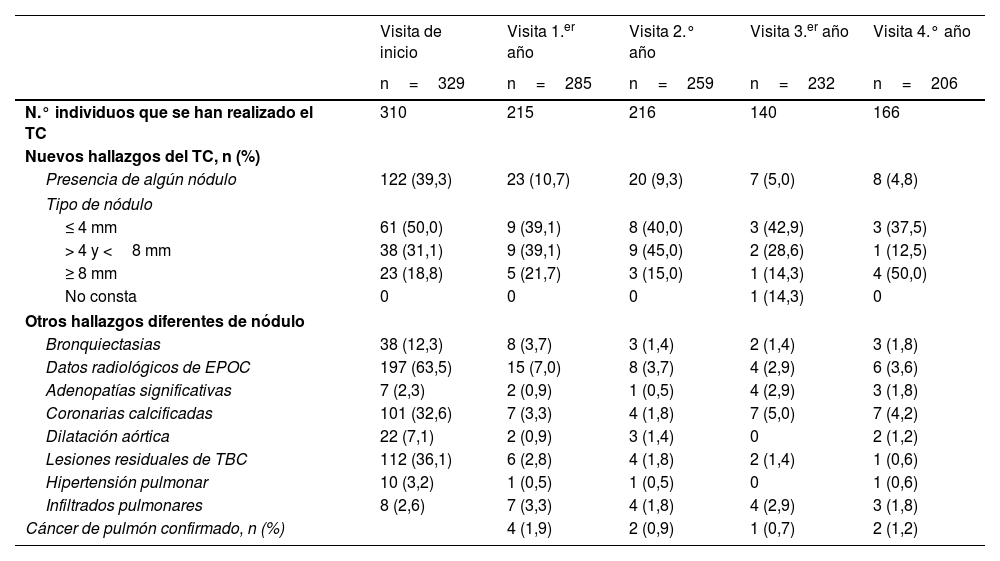
En cada visita se diagnosticaron otras patologías torácicas diferentes de los nódulos pulmonares, siendo los hallazgos más frecuentes datos radiológicos de EPOC (230 pacientes), coronarias calcificadas (126 pacientes) y lesiones residuales de tuberculosis (125 pacientes). En la tabla 3 se describen los hallazgos radiológicos encontrados en cada visita. Los pacientes en los que se detectó patología pulmonar fueron enviados a neumología, y aquellos que tenían dilatación aórtica fueron derivados a cirugía vascular. Si bien la TC de baja radiación no es específica para la cuantificación del calcio en las arterias coronarias, en los 126 (38,2%) en los que se encontraron calcificadas se intensificaron las medidas destinadas a controlar el riesgo cardiovascular.
Información sobre el resultado del TC en la visita de inicio y en las visitas de seguimiento
| Visita de inicio | Visita 1.er año | Visita 2.° año | Visita 3.er año | Visita 4.° año | |
|---|---|---|---|---|---|
| n=329 | n=285 | n=259 | n=232 | n=206 | |
| N.° individuos que se han realizado el TC | 310 | 215 | 216 | 140 | 166 |
| Nuevos hallazgos del TC, n (%) | |||||
| Presencia de algún nódulo | 122 (39,3) | 23 (10,7) | 20 (9,3) | 7 (5,0) | 8 (4,8) |
| Tipo de nódulo | |||||
| ≤ 4 mm | 61 (50,0) | 9 (39,1) | 8 (40,0) | 3 (42,9) | 3 (37,5) |
| > 4 y <8 mm | 38 (31,1) | 9 (39,1) | 9 (45,0) | 2 (28,6) | 1 (12,5) |
| ≥ 8 mm | 23 (18,8) | 5 (21,7) | 3 (15,0) | 1 (14,3) | 4 (50,0) |
| No consta | 0 | 0 | 0 | 1 (14,3) | 0 |
| Otros hallazgos diferentes de nódulo | |||||
| Bronquiectasias | 38 (12,3) | 8 (3,7) | 3 (1,4) | 2 (1,4) | 3 (1,8) |
| Datos radiológicos de EPOC | 197 (63,5) | 15 (7,0) | 8 (3,7) | 4 (2,9) | 6 (3,6) |
| Adenopatías significativas | 7 (2,3) | 2 (0,9) | 1 (0,5) | 4 (2,9) | 3 (1,8) |
| Coronarias calcificadas | 101 (32,6) | 7 (3,3) | 4 (1,8) | 7 (5,0) | 7 (4,2) |
| Dilatación aórtica | 22 (7,1) | 2 (0,9) | 3 (1,4) | 0 | 2 (1,2) |
| Lesiones residuales de TBC | 112 (36,1) | 6 (2,8) | 4 (1,8) | 2 (1,4) | 1 (0,6) |
| Hipertensión pulmonar | 10 (3,2) | 1 (0,5) | 1 (0,5) | 0 | 1 (0,6) |
| Infiltrados pulmonares | 8 (2,6) | 7 (3,3) | 4 (1,8) | 4 (2,9) | 3 (1,8) |
| Cáncer de pulmón confirmado, n (%) | 4 (1,9) | 2 (0,9) | 1 (0,7) | 2 (1,2) | |
EPOC: enfermedad pulmonar obstructiva crónica; TBC: tuberculosis; TC: tomografía computarizada.
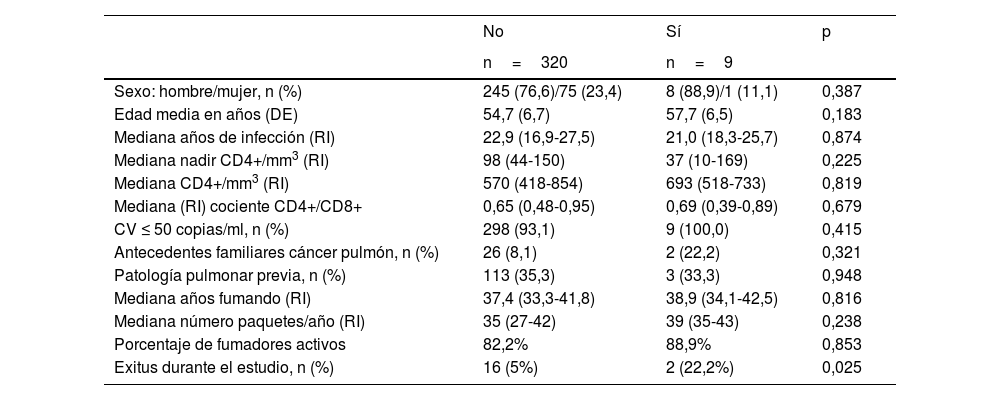
Se detectaron 180 nódulos pulmonares, pero solo 35 eran >8mm (23 en T0, 5 en T1, 3 en T2, 1 en T3 y 4 en T4). Todos fueron incluidos en la vía clínica del Servicio de Neumología correspondiente, diagnosticándose mediante fibrobroncoscopia en 7 pacientes y Endo Bronchial Ultra Sound (EBUS) en 2, un total de 9CP (2,7% del total de pacientes incluidos; 9,16×1.000 personas-año) en estadio precoz (4 en TC1, 2 en TC2, 1 en TC3 y 2 en TC4). No existieron diferencias significativas entre los que desarrollaron CP y los que no en relación al sexo, la edad, los años de infección VIH, el nadir de linfocitos CD4+, linfocitos CD4+ en el momento de iniciar el estudio, la ratio CD4+/CD8+, la patología pulmonar previa, los antecedentes familiares, el tiempo desde el inicio del hábito tabáquico ni el número de paquetes/año (tabla 4). La mortalidad fue significativamente mayor en el grupo en el que se diagnosticó CP (p=0,025), y al finalizar el estudio habían fallecido 18 pacientes (5,5%): 2 por CP y 16 por otras causas (p=0,025), siendo la más frecuente la presencia de una neoplasia diferente a la de pulmón (6 pacientes, 33,3%) y la patología hepática no neoplásica (3 pacientes, 16,7%)
Características sociodemográficas relacionadas con el VIH, el hábito tabáquico y el cáncer de pulmón en la visita de inicio en función del diagnóstico de cáncer de pulmón en el seguimiento
| No | Sí | p | |
|---|---|---|---|
| n=320 | n=9 | ||
| Sexo: hombre/mujer, n (%) | 245 (76,6)/75 (23,4) | 8 (88,9)/1 (11,1) | 0,387 |
| Edad media en años (DE) | 54,7 (6,7) | 57,7 (6,5) | 0,183 |
| Mediana años de infección (RI) | 22,9 (16,9-27,5) | 21,0 (18,3-25,7) | 0,874 |
| Mediana nadir CD4+/mm3 (RI) | 98 (44-150) | 37 (10-169) | 0,225 |
| Mediana CD4+/mm3 (RI) | 570 (418-854) | 693 (518-733) | 0,819 |
| Mediana (RI) cociente CD4+/CD8+ | 0,65 (0,48-0,95) | 0,69 (0,39-0,89) | 0,679 |
| CV ≤ 50 copias/ml, n (%) | 298 (93,1) | 9 (100,0) | 0,415 |
| Antecedentes familiares cáncer pulmón, n (%) | 26 (8,1) | 2 (22,2) | 0,321 |
| Patología pulmonar previa, n (%) | 113 (35,3) | 3 (33,3) | 0,948 |
| Mediana años fumando (RI) | 37,4 (33,3-41,8) | 38,9 (34,1-42,5) | 0,816 |
| Mediana número paquetes/año (RI) | 35 (27-42) | 39 (35-43) | 0,238 |
| Porcentaje de fumadores activos | 82,2% | 88,9% | 0,853 |
| Exitus durante el estudio, n (%) | 16 (5%) | 2 (22,2%) | 0,025 |
CV: carga viral; DE: desviación estándar; RI: rango intercuartílico.
A todos los pacientes se les informó de los beneficios de abandono del tabaco y se les facilitó el contacto con las unidades de deshabituación tabáquica de cada centro. Al finalizar el estudio, 38 habían dejado de fumar y 75 habían reducido significativamente el consumo de tabaco.
DiscusiónEl CP es el más letal de los cánceres, y causó 1,80 millones de muertes en el mundo en 2020, según la OMS. En España, anualmente se diagnostican 30.000 casos y mueren por su causa 23.000 personas. El número de nuevos casos-año ha ido en aumento, y probablemente se incremente15,16. Su cribado detecta tumores de forma precoz, cuando aún son incipientes y, por lo tanto, curables, y se reduce su mortalidad entre el 18 y el 39%. Su detección precoz es posible mediante la realización periódica de una TC con dosis bajas de radiación10-12. En Estados Unidos está indicada su realización en personas entre 50 y 80años, que fumen >20 paquetes/año o que hayan fumado durante los últimos 15años10,11. En España, el cribado de CP no está incluido en la cartera de servicios del sistema nacional de salud de forma universal, y mucho menos está establecida su utilidad en las PVVIH. Afortunadamente, en noviembre de 2023 la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) notificó el inicio del proyecto piloto Cancer Screening, Smoking Cessation and Respiratory Assessment (CASSANDRA), que tiene como objetivo demostrar la viabilidad, la factibilidad y el coste-efectividad de los programas de cribado en CP en nuestro país17. Además, en las PVVIH se está llevando a cabo un ensayo clínico multicéntrico sobre el cribado integral de los TNDS, y en él se incluye también la estrategia de realizar cribado de CP18.
Se ha postulado que el CP es más frecuente en las PVVIH, independientemente del tabaco, y que hace su aparición antes posiblemente por la existencia de alteraciones inmunitarias4,8,19. Por ello, en los criterios de inclusión, además de ser grandes fumadores (≥20 paquetes/año), se estableció la edad de 45años (aunque en España la edad media de diagnóstico es 64años) y que los pacientes hubieran tenido un nadir <200 linfocitos CD4/mm3. Si bien en los 4años de seguimiento la incidencia fue más elevada que en otras series8 (9,16×1.000 personas-año), en números absolutos solo se diagnosticaron 9 cánceres en los sucesivos TC realizados, sin encontrarse diferencias en la edad ni en los linfocitos CD4 entre los pacientes que desarrollaron CP y los que no, por lo que probablemente se deba considerar el consumo de tabaco el factor fundamental para desarrollar el programa de cribado, teniendo menos importancia los factores derivados de la infección por VIH, como el nadir de linfocitos CD4+7,19,20. Sin embargo, la mediana del nadir de CD4+ en los que tuvieron CP fue claramente inferior, aunque sin diferencias significativas (probablemente por el número reducido de casos) a la de los pacientes sin CP (37 vs 98, respectivamente). A pesar de este dato no concluyente, creemos que haber establecido el nadir inferior a 200 linfocitos CD4+/mm3 como criterio de inclusión fue un factor limitante de nuestro estudio. Habernos centrado solo en los criterios establecidos por los USPSTF11 o la EACS12 para realizar el cribado nos hubiera permitido definir mejor la utilidad real de la estrategia. Kong et al.21 realizaron un estudio similar al nuestro con pacientes que tenían >500 linfocitos CD4+/mm3 y observaron que se producía una reducción de la mortalidad similar a la de la población general, por lo que debe considerarse como una estrategia útil a implementar en el seguimiento de las PVVIH.
Aunque Díaz-Álvarez et al.22 ya publicaron en 2021 un estudio piloto demostrando las ventajas de realizar una TC de baja radiación para el diagnóstico precoz del CP, con el presente trabajo se pretendía confirmar la validez de la estrategia con la realización de TC seriadas. Si bien a nivel individual las ventajas de los 9 diagnósticos precoces fueron importantes, al no existir un grupo comparador es difícil valorar sus ventajas globales. Uno de los inconvenientes fundamentales que nos encontramos fue la irrupción de la pandemia del SARS-CoV-223, lo que hizo que se perdiera la oportunidad de realizar muchas exploraciones, ya que empezaron 329 pacientes y acabaron 206. Sin embargo, no es solo esa circunstancia la que complicó el seguimiento, ya que en todo estudio prolongado en el tiempo hay un gran número de pérdidas de seguimiento. De hecho, Islam et al.24 encontraron que solo el 12% de 73 PVVIH que tenían hecha una TC de baja radiación acudió a realizarse una segunda TC, demostrando así una adherencia a la prueba notablemente inferior a lo observado en la población general.
El hecho de que al realizar una TC pulmonar en personas asintomáticas se detecten también otras patologías condiciona un seguimiento más estrecho y permite que se adopten medidas terapéuticas o preventivas que de otra forma no se tomarían. A pesar de todas estas ventajas, no hay que olvidar la posibilidad de que existan falsos positivos que pueden condicionar la realización de procedimientos diagnósticos invasivos innecesarios25. En todo programa de cribado de cáncer (ya sea en pulmón, mama, próstata o colon) el beneficio obtenido debe considerarse superior al riesgo que pueda entrañar su realización en personas sanas26,27. En nuestro estudio, tanto en las visitas de inicio como en las sucesivas se encontraron múltiples hallazgos que condicionaron actitudes diagnósticas y terapéuticas que de otra forma no se hubieran realizado, lo que aporta también una ventaja adicional en el seguimiento de los pacientes.
El principal factor de riesgo del CP es el tabaquismo, por lo que en todo paciente que se incluya en un programa de detección precoz del mismo debería plantearse también el abandono del tabaco28,29. En nuestro estudio se ha observado una disminución del consumo de cigarrillos en el 27% de los sujetos y un abandono total en el 14%. Aunque esto puede ser un hecho circunstancial, enfrentar a los pacientes a un posible diagnóstico de CP podría considerarse un aliciente para dejar de fumar. El uso conjunto de ambas estrategias podría en un futuro disminuir la incidencia de dicha neoplasia en PVVIH.
En resumen, creemos que el diseño del presente estudio no permite definir la utilidad real de la estrategia, teniendo en cuenta, además, que la adherencia a la prueba disminuye progresivamente a lo largo del tiempo. Por otro lado, consideramos que la cifra elegida como nadir de linfocitos CD4+ ha sido un factor limitante para seleccionar la población en estudio, ya que probablemente se han dejado fuera pacientes que se podían haber beneficiado del cribado, tal y como realizaron Makinson et al.30, que establecieron el dintel del nadir en 350 linfocitos CD4+/mm3. Sin embargo, en nuestro estudio se observó un nadir de CD4+ menor entre los sujetos que desarrollaron CP, por lo que no se puede descartar que en un estudio con un número mayor de pacientes se hubieran observado diferencias significativas entre los pacientes que desarrollaron CP y los que no según el nadir de linfocitos CD4+. Al igual que sucede con otras neoplasias, los criterios de inclusión de las PVVIH en un programa de cribado de CP deberían ser, como mínimo, iguales a los que existen en la población general en los lugares en los que está cubierto por el Sistema Nacional de Salud, teniendo en cuenta que el consumo de tabaco es más acusado en esta población, la edad de aparición del CP es más temprana y los tumores pueden comportarse de forma más agresiva, sobre todo en pacientes muy inmunodeprimidos. Es muy frecuente el diagnóstico de otras patologías, lo que podría condicionar un seguimiento más estrecho de estas PVVIH. Por último, incluir a pacientes fumadores en un protocolo de diagnóstico precoz de CP podría ayudar a dejar de fumar.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.