El sarampión ha mostrado en los últimos años una reemergencia en Europa1. En España este aumento no se ha producido, pero la seroprevalencia en adultos jóvenes es inferior a la ideal2 pese a la elevada cobertura con vacuna triple vírica (VTV), debido a su disminución con el tiempo tras la vacunación. Por ello, actualmente la enfermedad suele aparecer en adultos, frecuentemente vinculada con casos importados y, a veces, relacionada con la asistencia sanitaria3,4. El diagnóstico microbiológico se basa en el uso combinado de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) y serología5.
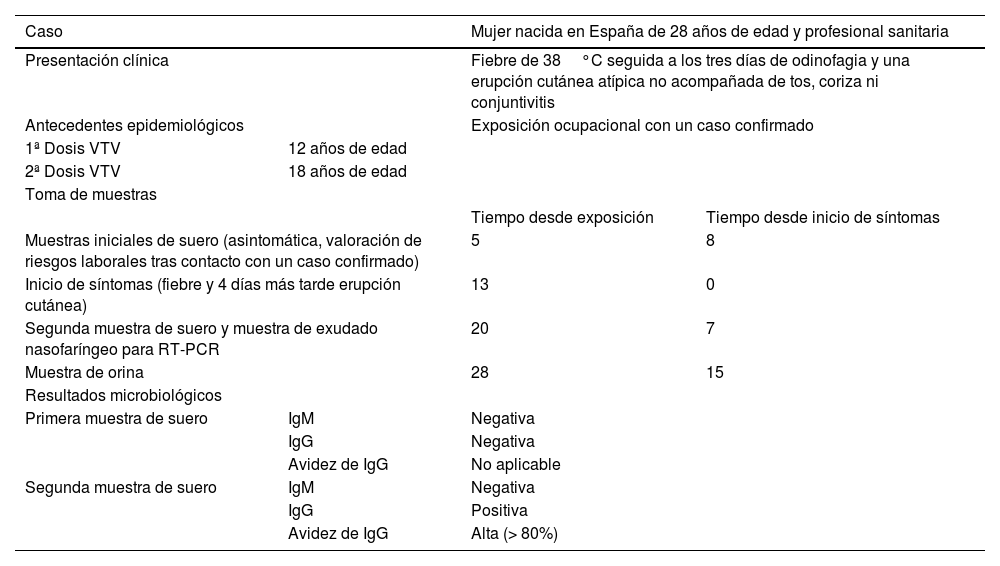
El objetivo de esta carta es informar sobre un caso de sarampión en una paciente correctamente vacunada, en la que el diagnóstico microbiológico mostró ciertas particularidades (tabla 1). Mujer de 28 años, auxiliar de clínica en urgencias hospitalarias, vacunada con dos dosis de VTV, que estuvo en contacto con un paciente atendido en su centro por cuadro sospechoso de mononucleosis que tras valoración en la urgencia se traslada e ingresa en otro centro sanitario, de otra Comunidad Autónoma, donde se confirma posteriormente como un caso de sarampión. Tras la notificación de este caso previo, se realizó estudio serológico a la paciente expuesta y aquí comentada (todavía asintomática), en muestra de suero extraída a los cinco días del contacto para valorar y confirmar su estado inmunitario, resultando negativas tanto IgM como IgG frente a sarampión mediante CLIA (DiaSorin S.p.A, Saluggia, Italia), indicándole cuarentena domiciliaria. Trece días después del contacto presentó fiebre (38°C), que remitió en cuatro días, proseguida de un enantema y de un exantema atípico (brazos y piernas). Ante esta situación se recomendó la toma de muestra de exudado faríngeo para su estudio por RT-PCR del gen de la nucleoproteína (RealCycler®, progenie molecular, Valencia, España) y la extracción de una segunda muestra de suero que finalmente se obtienen a los 20 días de la exposición y tres días del inicio del exantema. El resultado de RT-PCR en el exudado faríngeo fue negativo. En este segundo suero (reprocesado en paralelo con el primero) la IgM continuó negativa, pero se apreció un resultado positivo de IgG, que además presentó un índice de avidez alto (> 80%), determinado por ELISA (Euroimmun, Lübeck, Alemania).
Características clínico-epidemiológicas del caso
| Caso | Mujer nacida en España de 28 años de edad y profesional sanitaria | ||
|---|---|---|---|
| Presentación clínica | Fiebre de 38°C seguida a los tres días de odinofagia y una erupción cutánea atípica no acompañada de tos, coriza ni conjuntivitis | ||
| Antecedentes epidemiológicos | Exposición ocupacional con un caso confirmado | ||
| 1ª Dosis VTV | 12 años de edad | ||
| 2ª Dosis VTV | 18 años de edad | ||
| Toma de muestras | |||
| Tiempo desde exposición | Tiempo desde inicio de síntomas | ||
| Muestras iniciales de suero (asintomática, valoración de riesgos laborales tras contacto con un caso confirmado) | 5 | 8 | |
| Inicio de síntomas (fiebre y 4 días más tarde erupción cutánea) | 13 | 0 | |
| Segunda muestra de suero y muestra de exudado nasofaríngeo para RT-PCR | 20 | 7 | |
| Muestra de orina | 28 | 15 | |
| Resultados microbiológicos | |||
| Primera muestra de suero | IgM | Negativa | |
| IgG | Negativa | ||
| Avidez de IgG | No aplicable | ||
| Segunda muestra de suero | IgM | Negativa | |
| IgG | Positiva | ||
| Avidez de IgG | Alta (> 80%) | ||
Aunque la VTV es altamente efectiva frente a sarampión, la protección puede decaer con el tiempo (waning immunity) y una pequeña proporción de vacunados expuestos al virus salvaje pueden infectarse6,7. El incremento en las coberturas vacunales hace que el número de personas inmunizadas sea elevado, por lo que es esperable que, aun siendo raro, la frecuencia absoluta de casos en vacunados aumente en el futuro.6,7. Los fallos de la VTV pueden ser primarios (ausencia inicial de respuesta) o secundarios (respuesta inicial, pero con una pérdida de protección posterior)8. En regiones con buenas coberturas de vacunación estos últimos son más comunes. El diagnóstico de los fallos vacunales de sarampión es complicado debido a la presentación clínica atípica y los resultados de laboratorio, que aparentemente pueden ser confusos7,9: la IgM suele ser negativa (dado que no es el primer contacto con el virus [vivo, pero atenuado en la vacuna]) y la RT-PCR puede no llegar a detectar el virus por una menor carga viral probablemente debido a una respuesta inmune más rápida y eficaz que limita la capacidad de multiplicarse este en el hospedador previamente vacunado. Para la caracterización del fallo vacunal es crucial el ensayo de avidez de IgG7, que diferencia entre el primer contacto con el virus (baja avidez, que en vacunados indicaría fallo primario) de un nuevo contacto (alta avidez, indicativo en vacunados de fallo secundario)7,9. En ocasiones, como ocurrió con esta paciente, a pesar de la vacunación completa, la IgG puede ser negativa en la fase aguda (probablemente debido al descenso a niveles indetectables y no protectores). La seroconversión con IgG específica de alta avidez sería la consecuencia del efecto refuerzo (booster) propiciado por la infección natural. Así, en este caso, que cumplía criterios de confirmación, tanto epidemiológicos (vínculo con un caso de sarampión) como microbiológicos (seroconversión de IgG)10, pero que presentaba resultados que pudieran apreciarse como discrepantes (IgM y RT-PCR negativas), la determinación de alta avidez de IgG en la segunda muestra indicó que el fallo vacunal era de tipo secundario.
Conflicto de interesesLos autores declaran la ausencia de cualquier conflicto de interés con relación a este estudio. Este trabajo es consecuencia de la actividad de vigilancia desarrollada en el marco del Plan de eliminación del sarampión, rubéola y síndrome de rubéola congénita en la Comunidad de Madrid.
A Belén Ramos, Teresa Gómez y Rebeca Sánchez por su excelente labor en las técnicas de serología efectuadas en este estudio.