Introducción
Aunque el tratamiento antirretroviral (TARV) ha conseguido disminuir la morbilidad y la mortalidad asociada a la infección por el virus de la inmunodeficiencia humana (VIH), en las consultas especializadas existe un número creciente de pacientes en multifracaso en los que es difícil conseguir una supresión virológica mantenida, requiriendo un tratamiento individualizado.
Los documentos de Consenso de la International Aids Society y GESIDA (Grupo de Estudio del sida) recomiendan la utilización de estudios de resistencia genotípica a antirretrovirales, en pacientes con fracaso virológico, mientras puedan existir pautas antirretrovirales alternativas 1,2. La mayoría de los estudios sobre los que se basan las recomendaciones han demostrado un beneficio de estos tests a corto plazo (4-6 meses) 3-8.
En la práctica clínica las pruebas de resistencia se solicitan mayoritariamente a pacientes con fracasos múltiples. Los tratamientos de rescate en estos pacientes son especialmente complejos debiendo tener en cuenta la cumplimentación y disposición del paciente, los antirretrovirales previamente utilizados, la presencia de mutaciones asociadas a resistencias, las posibles interacciones farmacológicas y la adecuada potencia de la combinación de rescate. Existen pocos ensayos clínicos que evalúen la eficacia de los TARV en estos pacientes, esto puede ser debido a que las causas por las que un TARV puede fracasar son muy heterogéneas siendo difícil el diseño e interpretación de ensayos clínicos de rescate 9.
En este contexto creemos que cobran especial relevancia los estudios observacionales a largo plazo de pacientes en fracaso virológico.
Los objetivos del presente estudio son describir la utilización de los estudios de resistencias genotípicas por fracaso virológico en la práctica clínica, la evolución a largo plazo de los pacientes en los que se solicitó y conocer los factores predictivos de mala evolución virológica.
Métodos
Estudio retrospectivo observacional que incluyó a todos los pacientes con infección por VIH tipo 1 (VIH-1) en TARV con cargas virales superior a 2.000 cop./ml a los que se solicitó estudio de resistencia genotípica entre octubre de 1999 y diciembre de 2001. Se excluyeron del estudio los pacientes que no habían recibido TARV los últimos 3 meses antes de la solicitud del test de resistencias genotípicas (TRG), cuando se solicitó por primoinfección VIH o embarazo y cuando no se pudo secuenciar por presentar cargas virales bajas.
El estudio se realizó en el Hospital Son Dureta, un centro que atendió en consultas especializadas durante este período de tiempo a 1.507 pacientes con infección por el VIH y que dispone de una base de datos específica.
Las variables estudiadas fueron la edad, el factor de riesgo para adquirir la infección por el VIH, cifra de linfocitos CD4 nadir, carga viral (CV) cénit, tiempo en TARV y con cada uno de los fármacos antirretrovirales, número de combinaciones TARV utilizadas, linfocitos CD4 y CV en el momento de la solicitud del estudio de resistencias, mutaciones en el gen de la transcriptasa inversa (TI) y de la proteasa, cambios en el tratamiento tras la recepción del estudio de resistencias y evolución clínica, virológica e inmunológica.
Los tests de resistencias genotípicas fueron realizados en el Instituto Carlos III (Centro Nacional de Majadahonda). La secuenciación del virus se realizó mediante el kit comercial HIV-1 Genotypic System Assay según las directrices del fabricante. La interpretación de las secuencias se efectuó con la base de datos de la Universidad de Stanford (Stanford HIV RT and Protease Sequence Database; http://hivdb. standford.edu/hiv/). Las mutaciones en el gen de la TI para análogos nucleósidos (ANTI) consideradas fueron la M41L, E44DA/D, A62V, K65R, D67N, T69i, K70R, L74V, V75I/T/M/A, Q151M, M184VI, L210W, T215Y/F, K219G/E, considerándose mutaciones asociadas a análogos de la timidina (TAM) según la nomenclatura utilizada por dicha Universidad la serie de mutaciones M41L, D67N, K70R, L210W, T215Y/F y K219 G/E. Entre las mutaciones asociadas a resistencias a los análogos no nucleósidos (ANNTI) se consideraron la A98G, L100I, K101E, K103N, V106A, Y181C/I/V, Y188L, G190A, P225 H y la M230L. En el gen de la proteasa se consideraron mutaciones mayores, la D30N, V32I, G48V, I50V, V82 A/T/F/S, I84V y L90M.
Los tratamientos de rescate, durante el período de estudio, fueron decididos por el médico responsable apoyándose en los resultados del genotipado.
Análisis estadístico
Las variables continuas se describen como media y desviación estándar (DE) o como mediana y percentil 25 y 75 y las variables categóricas como porcentajes.
Para comparar la evolución virológica e inmunológica según número de combinaciones TARV previas se utilizó la t de Student.
Para valorar los factores predictivos de buen control virológico se evaluaron todos los pacientes de la cohorte a los que se había solicitado estudio de resistencias si disponíamos de los resultados de las variables dependientes (análisis por pacientes en tratamiento OT). Las variables para evaluar el control virológico que se utilizaron fueron: presentar un descenso en la carga viral plasmática (CVP) > 1 log a los 6 meses de iniciar el tratamiento de rescate y presentar CV < 400 cop./ml por bDNA de Chiron a los 12 meses de seguimiento. Los pacientes que alcanzaban CV < 50 cop./ml, se consideró que tenían 50 copias para calcular la magnitud del descenso de la carga viral. Se relacionaron estas variables dependientes con las otras variables independientes del estudio utilizando el test de la chi cuadrado (χ 2) para las variables categóricas o la t de Student para las variables continuas que seguían una distribución normal. La fuerza de la asociación entre la variable dependiente y el resto de variables independientes categóricas se obtuvo mediante la odds ratio (OR) calculada a partir de las tablas de contingencia y se expresa mediante el intervalo de confianza del 95%. Las variables que obtuvieron una significación estadística y/o que presentaban plausibilidad biológica fueron introducidas en un modelo de regresión logística (Forward Conditional) respecto a la variable dependiente. La fuerza de la asociación de estas variables respecto a la variable dependiente se ajustaron eliminando los factores de confusión y calculando una nueva OR ajustada al modelo. Todos los análisis estadísticos se han realizado mediante el paquete estadístico SPSS 10.0 (SPSS Inc 2000) versión para Windows.
Resultados
Durante el período de estudio se siguieron activamente 1.507 pacientes con infección por el VIH y se solicitaron estudios de resistencias genotípicas en 236 (15,6%), siendo valorables 196. Las características de los pacientes y los TARV previos se expresan en la tabla 1. La media de edad fue de 39,4 ± 8,3 años. Los pacientes habían recibido TARV durante un promedio de 5 años, con una mediana de 7 fármacos y con múltiples combinaciones de ellos. Sólo 15 pacientes (7,7%) habían seguido una única pauta de TARV, 22 (11,2%) dos, mientras que 99 (50,5%) habían recibido cinco o más combinaciones. El 34,7% de los pacientes no habían recibido previamente ANNTI y el 7,7% inhibidores de proteasa (IP).
El estudio genotípico del gen de la TI demostró tres o más TAM: en 96 pacientes (49%) y cuatro o más en 49 (25%) (tabla 2). De los pacientes con tres o más TAM 57 presentaban el patrón de mutaciones TAM-1 (M41L, L210W y T215Y) frente a 21 pacientes que presentaban el patrón TAM-2 (D67N, K70R, T215F y K219Q). Únicamente 55 (28%) no presentaban ninguna mutación en el gen de la TI. La mutación M184V se observó en 103 (57%) de los 181 pacientes que habían recibido más de un mes de tratamiento con lamivudina. La mutación L74V se observó en 16 pacientes (8,2%) y la mutación K65R sólo en uno. Diecinueve pacientes (13,5%) presentaban más de tres TAM y la mutación M184V, y nueve (6,4%) más tres de TAM y la L74V. Entre los patrones admitidos de multirresistencia a ANTI se observó la Q151M en 7 pacientes (3,6%), el patrón M41 L, D67N, K70R, L210W, T215Y/F y K219Q/E en un paciente y la T69SS en ninguno.
Entre las mutaciones relacionadas con resistencias a los ANNTI 88 pacientes (45%) presentaban la mutación K103N (82 de los 123 pacientes con tratamientos previos con ANNTI) y 24 la Y181C (12,2%).
La media de mutaciones mayores en el gen de la proteasa fue de 1,75 (DE: 0,8). Ochenta y cinco pacientes (49%) presentaban cinco o más mutaciones en este gen y 66 (33%) más de cinco (tabla 2).
Después de recibir los resultados de las resistencias genotípicas se modificó el tratamiento en 145 pacientes (74%). En los que no se modificó, las principales razones fueron: la ausencia de mutaciones relacionadas con resistencias en 6 pacientes (3%), el haberse realizado un cambio de tratamiento coincidiendo con la solicitud de la prueba que no necesitó modificación por ser el mismo que se habría hecho en base al patrón de resistencias en 25 (13%) y presentar viremias bajas inferiores a 5.000 cop./ml de forma persistente en 20 (10%).
Los tratamientos de rescate realizados tras recibir los estudios de resistencias fueron muy diversos, 59 combinaciones en total. La combinación de ANTI más utilizada fue la d4T + ddI que se empleó en 76 casos (52,7%). Como tercer fármaco se utilizó un ANNTI en 36 (24,7%), abacavir en 21 (14,4%) e IP no potenciados en 29 (20%). Se utilizaron IP potenciados con ritonavir o dos IP en 51 pacientes (35%), y pautas con cuatro o más fármacos que incluían IP y ANNTI en nueve (6,2%). Las pautas con 4 fármacos más frecuentes fueron: d4T + ddI + EFV + NFV + HU y la de d4T + ddI + EFV o NVP + LPV. Se utilizó hidroxiurea en 13 pacientes (9%).
Durante el seguimiento de los 196 pacientes incluidos en la cohorte, 11 fallecieron (nueve por progresión a sida, uno por acidosis láctica y otro por causa no conocida), y 16 (8%) se perdieron seis de ellos por cambio de residencia. Requirieron un nuevo cambio de tratamiento 83 pacientes (42%), 33 por efectos adversos, 40 por nuevo fracaso virológico y 10 por simplificación.
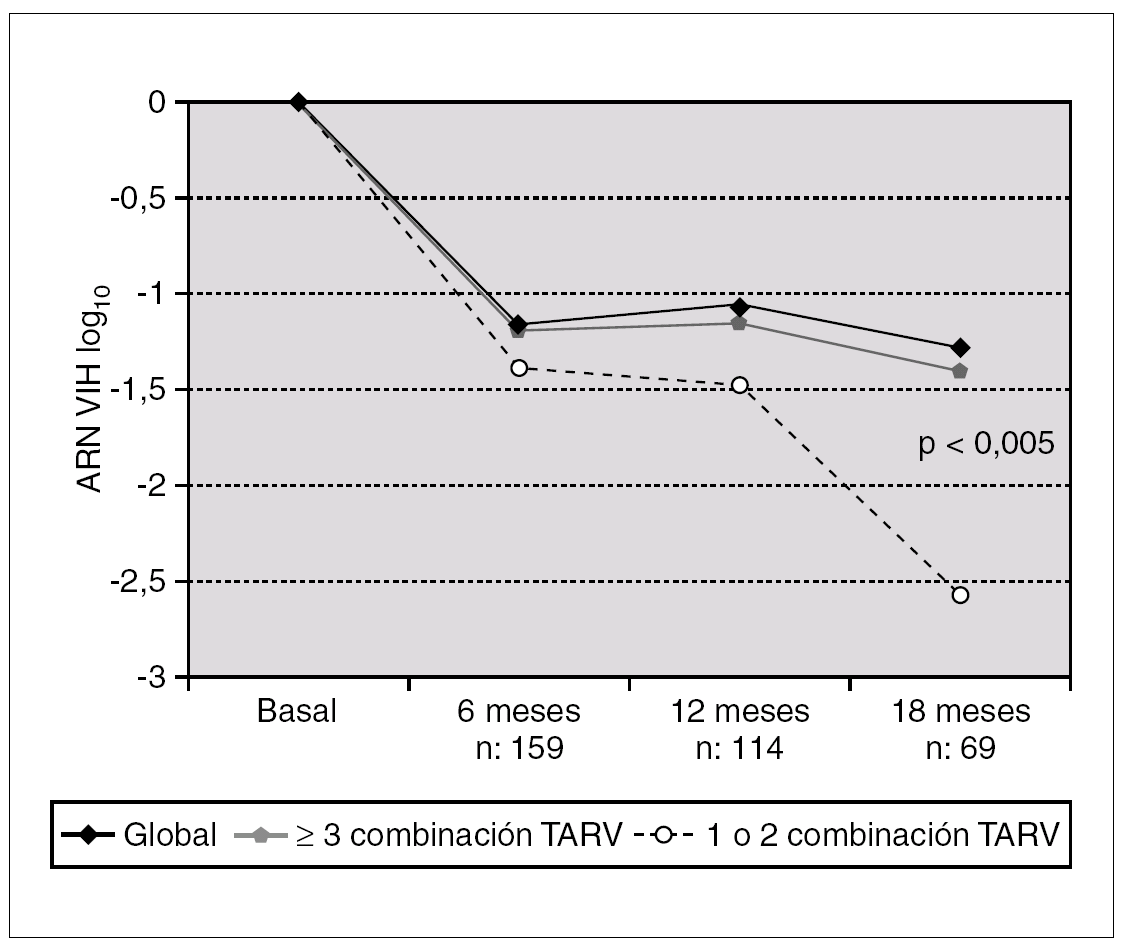
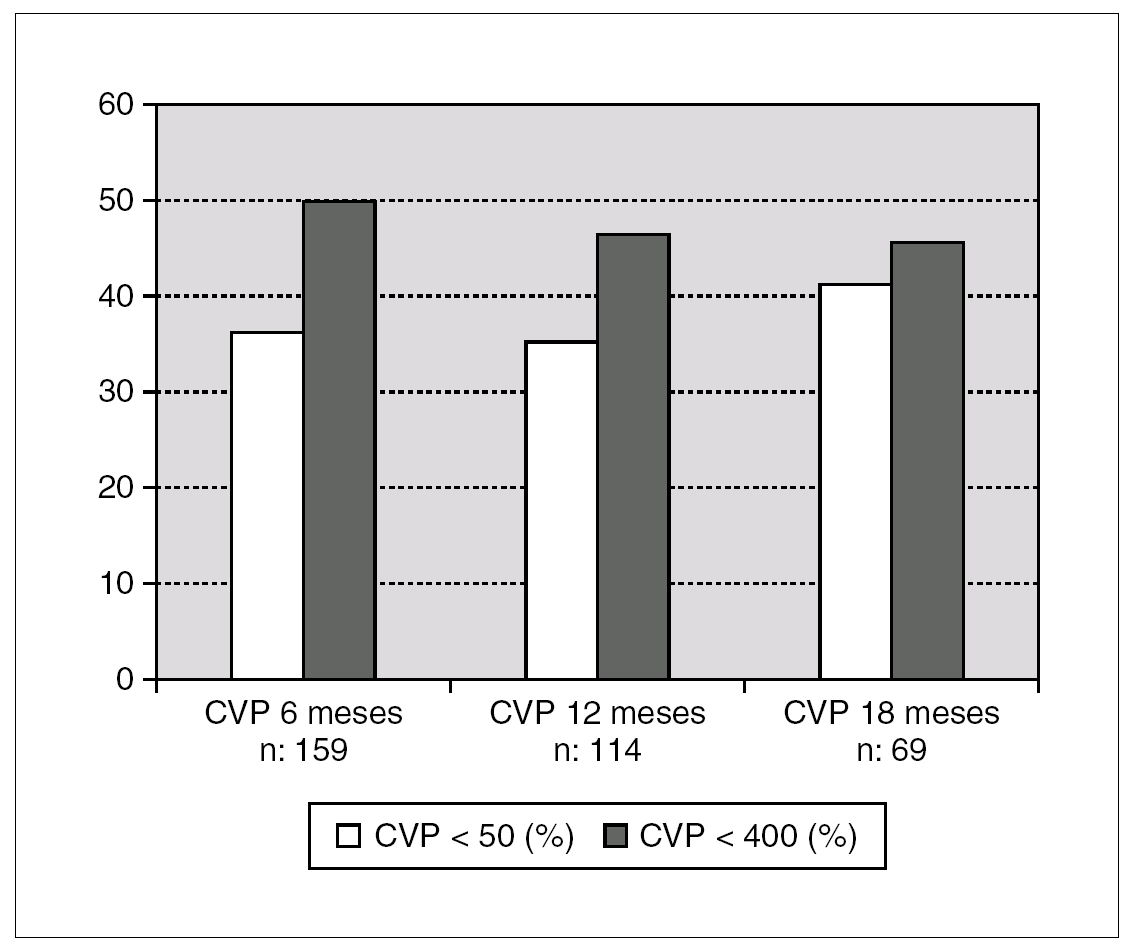
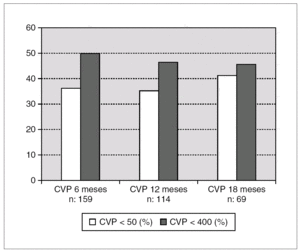
La disminución media de la CV a los 6 meses de los pacientes seguidos en tratamiento fue de 1,2 log10, a los 12 meses de 1,12 log10 y a los 18 meses de 1,36 (fig. 1). A los 6 meses 68 pacientes (43%) presentaban un descenso en la viremia de más de un logaritmo. El porcentaje de pacientes que en el análisis en tratamiento presentaban CV < 50 cop./ml y < 400 cop./ml se expresa en la figura 2. Consiguen una CV < 400 el 49,7% de los pacientes a los 6 meses, 48% a los 12 y 45,8% a los 18 meses. Por intención de tratar estos porcentajes disminuirían al 40,8% a los 6 meses, 29% a los 12 meses y 17% a los 18 meses. Al comparar la respuesta virológica según el número de pautas de TARV previos no apreciamos diferencias entre los grupos tratados con 3-4 combinaciones frente a los que habían recibido cinco o más. Al comparar los grupos (1 o 2 combinaciones de TARV previas frente a tres o más), únicamente observamos diferencias significativas a los 18 meses (p < 0,005) (fig. 1). La media de los linfocitos CD4 aumentó en 59, 74 y 94 céls./μl a los 6, 12 y 18 meses. No se observaron diferencias en el incremento de los linfocitos CD4 según número de combinaciones de TARV previas.
Figura 1. Evolución de la carga viral según el número de combinaciones TARV previas utilizadas.
Figura 2. Evolución del porcentaje de pacientes en tratamiento recibido con buen control virológico (CVP < 50 o < 400 cop./ml).
Al realizar un análisis univariante los factores que se relacionaron con presentar una disminución de la carga viral mayor de 1 log a los 6 meses fueron, la pauta antirretroviral de rescate utilizada, y ser naive a ANNTI (p = 0,016). Así, los pacientes en los que se utilizaron pautas de rescate con abacavir como tercer fármaco o IP no potenciados tuvieron una OR de 2,6 (1,17-5,2) de presentar un descenso menor de 1 log a los 6 meses y la disminución media de la CVP fue de 0,97 log10 frente a 1,44 log en los pacientes tratados con IP potenciados o ANNTI solos o en combinación. Variables como la CVP o la cifra de linfocitos CD4 al iniciar el tratamiento de rescate, las mutaciones presentes en el TRG o los factores de riesgo de adquirir la infección VIH, no fueron predictivas de la evolución virológica a los 6 meses. En el análisis multivariante la única variable predictora fue la pauta de rescate utilizada OR 2,4 1,2-5.
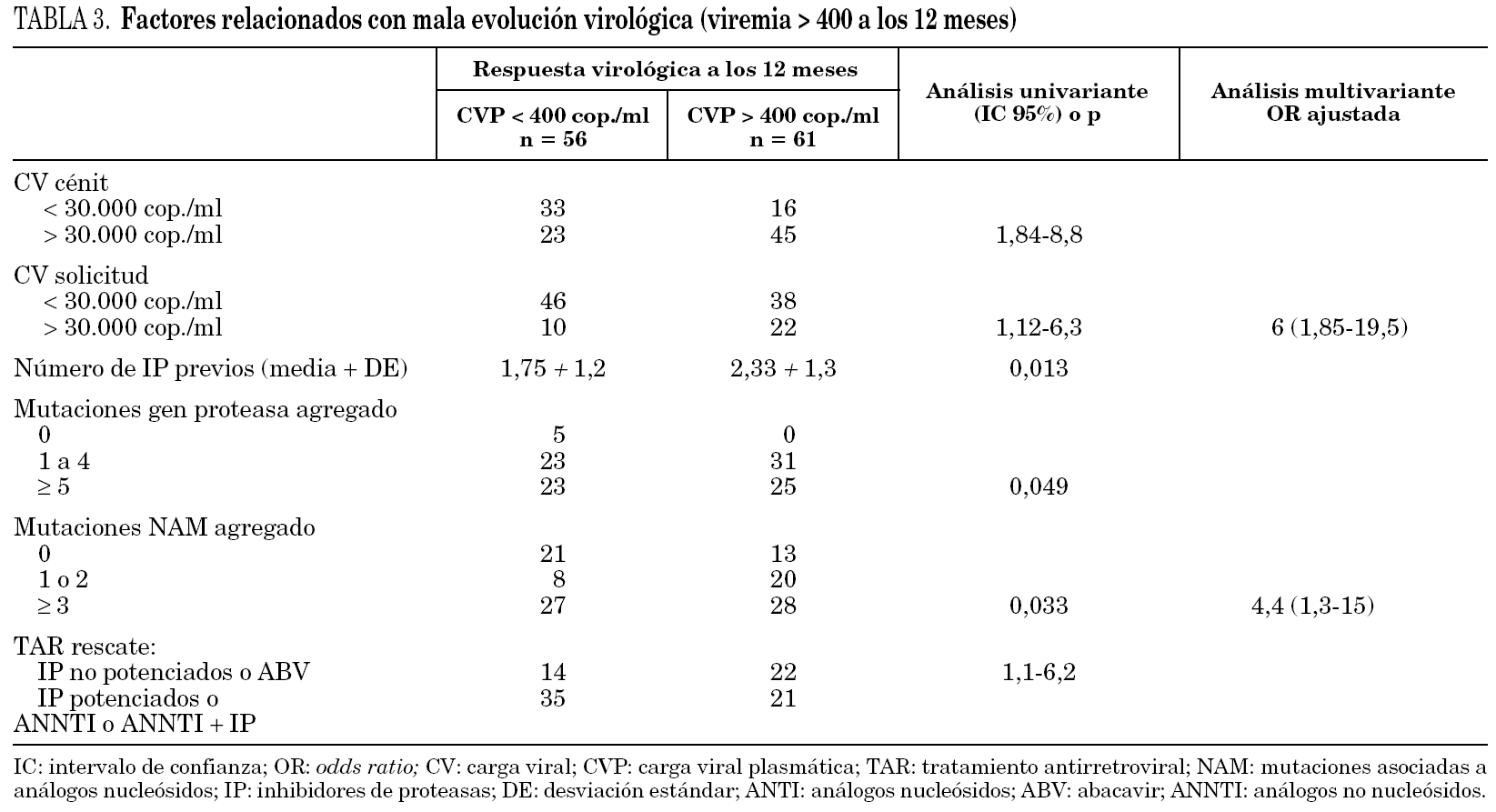
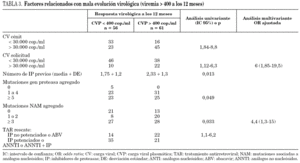
Los factores que en el análisis univariante se relacionaron con presentar fracaso virológico, CV > 400 cop./ml a los 12 meses se expresan en la tabla 3. En el análisis multivariante tener una CV > 30.000 cop./ml en el momento de la solicitud del estudio de resistencias OR 6 (1,85-19,5) y tener más de 3 TAM OR 4,4 1,3-15 fueron las variables que mejor predijeron el fracaso virológico. Si del análisis excluimos a los 19 pacientes que habían recibido sólo 1 o 2 combinaciones de TARV y realizamos un nuevo análisis multivariante de los pacientes en multifracaso, los resultados obtenidos son similares, entrando únicamente estas dos variables en el modelo. En el análisis univariante no resultaron predictivas variables como el factor de riesgo para la adquisición del VIH, presentar infección concomitante por el virus de la hepatitis C, número de combinaciones de TARV previas, los linfocitos CD4 nadir o en el momento de la solicitud.
Discusión
En el período de estudio el 15% de los pacientes seguidos en unas consultas externas específicas por infección VIH precisaron estudios de resistencia genotípica por fracaso virológico. Los TRG se solicitaron mayoritariamente a pacientes con tratamientos previos extensos, media de 5 años y cinco combinaciones de TARV previas. En el 74% de los pacientes se realizó un cambio de TARV sobre la base del TRG recibido y en el 13% no se cambió por haberse realizado previamente, en el momento de la solicitud. En nuestros pacientes el fracaso virológico se relacionó en especial con la aparición de resistencias, sólo en 6 pacientes la ausencia de mutaciones permitió detectar una mala adherencia al TARV. No se realizó ningún cuestionario o recuento que permitiera cuantificar la adherencia en estos pacientes.
Las mutaciones detectadas con más frecuencia en el gen de la transcriptasa inversa se hallaron en los codones 41, 215 y 184 que se relacionan con resistencias a zidovudina y a lamivudina. Estos resultados son muy similares a los de los pacientes pretratados del estudio ERASE-3 realizado en España. En nuestra población el 50% de pacientes tenían tres o más TAM. A diferencia del estudio ERASE-3 observamos un porcentaje elevado de pacientes con mutaciones asociadas a resistencias a ANNTI en los codones 103 y 190. Prácticamente el 50% de los pacientes presentaban cinco o más mutaciones en el gen de la proteasa, siendo las más frecuentes las localizadas en los codones 90, 82 y 46, igual que ocurría en el estudio ERASE-3 10. Comparado con el estudio multicéntrico español presentado recientemente por B. Rodes en 146 pacientes en fracaso virológico con una media de 8,5 años de TARV observamos unos porcentajes inferiores de pacientes con la asociación de tres o más TAM con la mutación 184 (13,5% frente a 29,4%), en la mutación K65R y los complejos de multirresistencia Q151M y de la T69S. El porcentaje de pacientes con más de cinco mutaciones frente a IP (33%) fue también algo menor al 45,7% descrito por estos autores 11. Estas diferencias pueden explicarse porque este estudio transversal se realizó en 2003, mientras que el nuestro, engloba un período anterior y pacientes con menor tiempo de tratamiento.
La evolución virológica de esta cohorte observacional de pacientes, mayoritariamente en multifracaso, es bastante buena. Así en el análisis en tratamiento el 50% de los pacientes presenta viremias inferiores a 400 cop./ml a los seis y por TI el 40,8%. Los resultados son similares a los obtenidos en los estudios aleatorizados en las ramas que disponen de estudio de resistencias con opinión de expertos 3,5,6,8 y en algunos de los escasos ensayos clínicos de rescate publicados 12-14. Las terapias de rescate tipo mega-HAART (que combinan cinco o más fármacos), obtienen resultados algo mejores con el 40-57% de pacientes con viremias indetectables al año de seguimiento 15-17. Inmunológicamente se observa un aumento progresivo en la cifra de linfocitos CD4 que fue independiente del número de pautas de TARV previas realizadas. Estudios recientes han demostrado un beneficio inmunológico, con recuentos de linfocitos CD4 superiores a los basales, en un porcentaje importante de pacientes con tratamiento antirretroviral de gran actividad (TARGA) en fracaso virológico por mecanismos no bien dilucidados, pero probablemente relacionados con la disminución de la capacidad replicativa de las cepas mutantes o actividad residual persistente de algunos de los fármacos 18.
Desde el punto de vista clínico 11 de los pacientes en multifracaso (5,6%) fallecieron a los 18 meses de seguimiento, mayoritariamente por progresión de la enfermedad. Estas cifras de mortalidad son similares a las descritas por Zaccarelli et al 19 en Italia aunque inferiores a1 10 y 14,2% observadas a los 18 y 36 meses por Lee et al 20 en Canadá. El estudio de Zacarelli observó que la probabilidad de muerte en estos pacientes a los 36 meses se relacionaba con las multirresistencias de clase, siendo del 8% en los pacientes sin multirresistencia, 12% con una resistencia de clase, 14% con dos y 57% con tres 19. El estudio PLATO, que reúne varias cohortes de pacientes con fracaso a las tres clases de fármacos de Europa y EE.UU., ha observado una mortalidad de 5,5 x 100 personas/año, siendo los principales predictores de mortalidad la CVP y los linfocitos CD4 21.
Entre las pautas de rescate seleccionadas, únicamente los IP no potenciados y el abacavir utilizados como tercer fármaco mostraron una peor respuesta virológica. A consecuencia de estos malos resultados virológicos requirieron un cambio de tratamiento posterior el 35% de los pacientes con IP no potenciados o abacavir frente al 14% de los pacientes tratados con IP potenciados o ANNTI con o sin IP. La pauta con IP potenciados fue la que mantuvo una mejor respuesta virológica a largo plazo con disminuciones de la carga viral a los 18 meses superiores a los 2 log. Las pautas con ANNTI solos o en combinación presentaron una buena respuesta inicial, con aumentos posteriores en la media de la CVP a partir de los 12 meses (datos no presentados). La buena respuesta inicial con ANNTI puede explicarse porque la mayoría de pacientes no habían recibido previamente fármacos de esta familia y porque la presencia de mutaciones relacionadas con la zidovudina (M41L, D67N, L210W, T215Y) se han asociado in vitro a una hipersensibilidad al efavirenz 22,23. A largo plazo, los pacientes previamente tratados con ANTI que se rescatan con ANNTI asociados a ANTI presentan rebrote virológico con frecuencia, principalmente si presentan mutaciones asociadas a ANTI e IP 24,25. A pesar de las limitaciones inherentes a un estudio retrospectivo para la valoración de tratamientos, nuestra experiencia parece refrendar la de otros autores 11,26,27 de que pueden conseguirse resultados virológicos aceptables en pacientes en multifracaso y con múltiples resistencias si se utilizan pautas con una potencia suficiente, principalmente con IP potenciados que permiten obtener unos niveles séricos que exceden las concentraciones inhibitorias de muchos virus resistentes. Una limitación importante de estos tratamientos de rescate es el elevado porcentaje de pacientes que requieren cambio de tratamiento por efectos adversos, 17% en nuestra serie.
Uno de los hallazgos que creemos de más interés en nuestro estudio y que refrenda estudios previos es que en los pacientes en multifracaso las variables que mejor predicen la evolución virológica son presentar CV < 30.000 cop./ml y menos de tres TAM al iniciar el TARV de rescate. Diversas publicaciones han demostrado la importancia de la viremia basal en pacientes que inician un tratamiento de rescate 12,28 sugiriendo que en los que presentan cifras de CV-VIH-1 elevada es especialmente importante diseñar combinaciones de fármacos de potencia elevada y alta barrera genética.
En resumen a pesar de que los TRG se solicitan en la práctica clínica en pacientes en multifracaso, las pautas TARV de rescate consiguen al año mantener CVP < 400 copias en casi el 50% de pacientes en tratamiento y con una respuesta inmunológica mantenida. Como en otros estudios recientes 17,29 el número de mutaciones en el gen de la TI son variables predictoras de la evolución virológica en estos pacientes en multifracaso, lo que apoya de forma indirecta la utilidad de los estudios de resistencia genotípica incluso en estos pacientes.
Correspondencia: Dr. Melcior Riera-Jaume.
Unidad de Enfermedades Infecciosas. Servicio de Medicina Interna.
Hospital Universitario Son Dureta.
Andrea Doria, 54. 07014 Palma de Mallorca. España.
Correo electrónico: mriera@hsd.es
Manuscrito recibido el 28-6-2004; aceptado el 15-7-2004.