La meningoencefalitis criptocócica (MC) es una enfermedad grave que ocasiona 181.100 muertes anuales en el mundo1. Las principales especies causantes son Cryptococcus neoformans y Cryptococcus gattii. Frecuentemente se asocia a infección por el VIH en situación de inmunodepresión avanzada o a otro tipo de inmunodeficiencias (trasplante de órgano sólido, neoplasias y pacientes en quimioterapia o con fármacos inmunosupresores); sin embargo, hasta el 20% de los casos ocurren en pacientes inmunocompetentes donde predominan las variedades C. neoformans grubii y C. gattii2. Presentamos un caso autóctono de MC por C. gattii resistente a fluconazol con respuesta favorable a isavuconazol.
Varón de 59 años con antecedente de politoxicomanía, ictus isquémico con hemiparesia derecha y cirrosis Child-Pugh B por virus C con respuesta viral sostenida. Acudió al servicio de Urgencias por inestabilidad en la marcha, sensación de giro de objetos y fiebre de 3 semanas de evolución. En la exploración destacó supraversión de la mirada, con fondo de ojo sin edema papilar, no presentando alteraciones en el resto de la exploración física y neurológica.
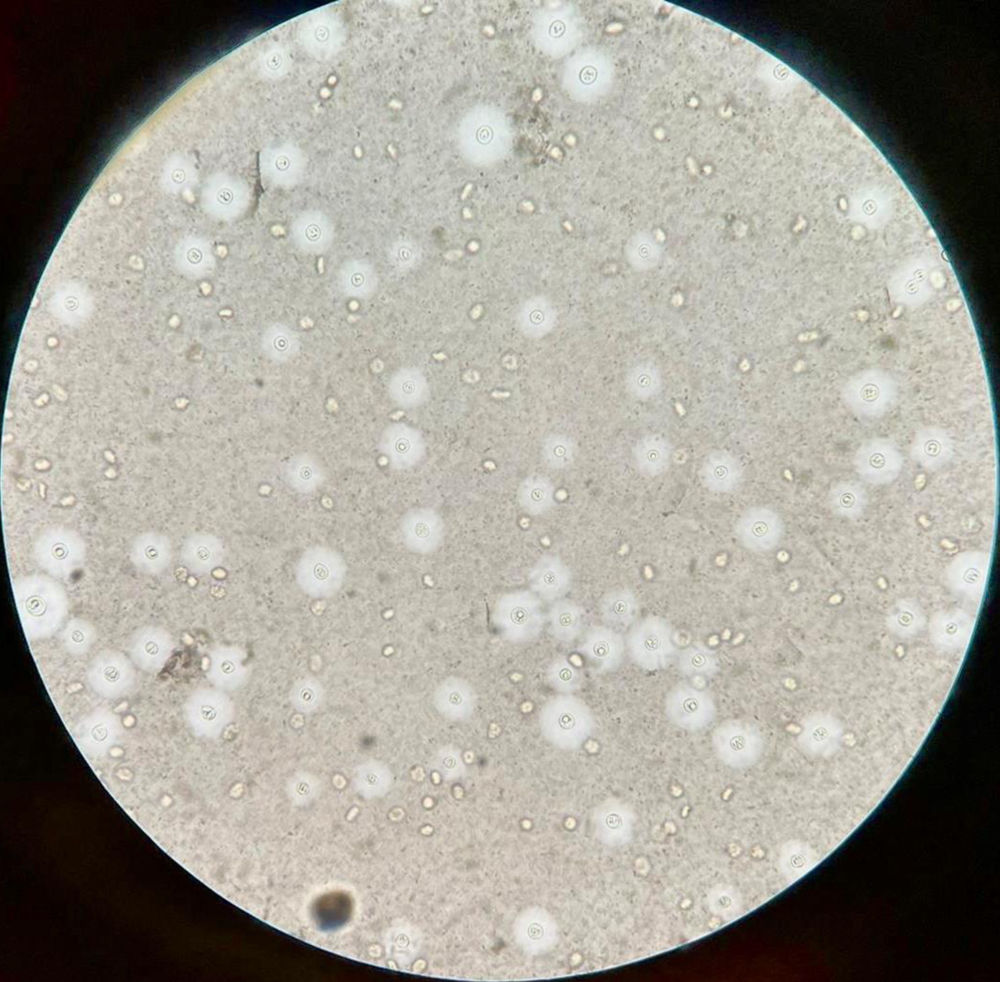
Se realizó una TC craneal sin hallazgos y una punción lumbar (PL) con líquido cefalorraquídeo (LCR) turbio con presión normal y bioquímica sugestiva de meningitis bacteriana (glucosa 8mg/dl, proteínas totales 383,7mg/dl, leucocitos 8.297 células, 92% polimorfonucleares); en la tinción de Gram y en la tinta china se observaron levaduras compatibles con Cryptococcus spp. (fig. 1), confirmándose la detección de ADN para C. gattii/ neoformans mediante una técnica molecular basada en ácidos nucleicos de PCR múltiple (Biomérieux, FilmArrayTM). En el cultivo se identificó C. gattii. Los hemocultivos fueron negativos y el título basal del antígeno criptocócico en LCR (látex) fue >1/10.000.
La resonancia magnética craneal mostró criptococomas cerebelosos. Se determinaron subclases de inmunoglobulinas, complemento, poblaciones linfocitarias, serología VIH y se descartaron neoplasias ocultas. En la TC se detectó esplenomegalia sin signos de hipertensión portal.
Para el tratamiento de la infección del sistema nervioso central (SNC) por C. gattii se extrapolaron datos sobre C. neoformans2, y se optó por iniciar tratamiento, según las recomendaciones de la OMS3, con anfotericina B liposomal (AmB-L) 10mg/kg en dosis única endovenosa+flucitosina (5-FC) 100mg/kg/día oral en 4 dosis seguidas de fluconazol 1.200mg vía oral cada 24h durante 2 semanas.
Pese a este tratamiento, el paciente continuó con disminución del nivel de consciencia y persistió el crecimiento del hongo en los sucesivos cultivos del LCR. Finalmente, se cambió al esquema de la IDSA4 con AmB-L 3-4mg/kg/día y 5-FC. Tras 6 semanas de tratamiento, la levadura continuó aislándose en el LCR con títulos de antígeno >1/10.000, por lo que decidimos asociar un azol al régimen anterior.
En el Centro Nacional de Microbiología, utilizando el método de microdilución en caldo, las CMI de los diferentes azoles fueron: fluconazol >4μg/ml; voriconazol 2μg/ml; isavuconazol 1μg/ml.
La hepatopatía limitaba el uso de voriconazol, por su mejor perfil hepático y, basándonos en los datos de la literatura5, optamos por isavuconazol i.v. (IVZ) a 200mg/8h durante 48h y 200mg cada 24h como mantenimiento.
Se determinaron, por cromatografía líquida con espectrometría de masas, niveles valle de isavuconazol tras 6 dosis, tanto en plasma como en LCR, siendo de 5μg/ml y 0,66μg/ml, respectivamente.
Tras 2 semanas con este régimen (AmB-L/5-FC/IVZ) se negativizaron los cultivos del LCR y el título del antígeno criptocócico descendió a 1/4.000 la primera semana y a 1/2.000 la segunda, lo que se asoció con una mejoría neurológica. Completó 6 semanas con este último esquema.
En España C. gattii se ha aislado como colonizador en árboles del litoral mediterráneo6 y se han descrito casos autóctonos en pacientes sin infección por el VIH7.
En la MC, tanto en pacientes inmunodeprimidos como en inmunocompetentes, el LCR muestra un recuento de glóbulos blancos inferior a 50 células/μL con predominio mononuclear, proteinorraquia leve y glucosa baja o normal. Por ello, nuestro caso tuvo una presentación atípica que obligó a considerar otras etiologías.
El tratamiento de la infección por Cryptococcus spp. se basa en el uso de polienos, azoles y análogos de nucleósidos (pirimidinas)1. La experiencia clínica con otros azoles distintos al fluconazol es limitada. Se debe considerar una posible resistencia a los antifúngicos cuando no se consigue negativizar los cultivos de LCR. Para los aislados no identificados como C. neoformans, el CLSI define como punto de corte para fluconazol 16μg/ml, clasificando como fenotipo no salvaje o con posibles mecanismos de resistencia las cepas con CMI >16μg/ml. Para C. gattii el EUCAST no ha propuesto puntos de corte para fluconazol, pero sí que los establece para anfotericina B (0,5μg/ml) y posaconazol (1μg/ml)8. En nuestro caso optamos por isavuconazol, frente a voriconazol o posaconazol, por su menor perfil de interacciones, menor toxicidad hepatorrenal y buena difusión al SNC9. Existen ensayos que apoyan la eficacia de isavuconazol con una dosis de carga de 200mg/8h durante 2 días, seguido de 200mg diarios como mantenimiento para la enfermedad pulmonar y meníngea10. Kohno et al. obtuvieron una tasa de respuesta con isavuconazol de hasta el 90%5. En nuestro caso, si bien la concentración plasmática de isavuconazol supera la CMI, en LCR fue inferior a la esperada y a la CMI de la levadura, lo que sugiere que la respuesta se debió a la combinación de antifúngicos.
Isavuconazol podría ser un azol seguro y eficaz como parte del esquema de tratamiento para la criptococosis cuando no fuera posible utilizar fluconazol o voriconazol.
FinanciaciónNo se ha recibido financiación.
AutoríaTodos los autores han contribuido sustancialmente en cada uno de los siguientes aspectos: 1) la adquisición de datos, 2) la revisión crítica del contenido intelectual, 3) la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores no tienen conflicto de intereses que declarar.
Dr. Vicente Merino (Servicio de Farmacia Hospitalaria, Hospital Universitario Virgen Macarena, Sevilla).
Dra. Maite Ruiz Pérez Pipaón (Unidad de Enfermedades Infecciosas, Microbiología y Parasitología, Hospital Universitario Virgen del Rocío, Sevilla, España).