La presencia de insuficiencia renal y/o de alteración de la función hepática supone el necesario ajuste de la dosis de los antibióticos que se eliminan de forma activa por la orina o por metabolismo hepático, respectivamente. En el primer caso, puede señalarse la conveniencia de reducir la dosis un 30% para cada uno de los niveles de alteración de la función renal (moderada y grave). En la disfunción hepática no puede señalarse una regla global por lo que ha de recurrirse a utilizar la información específica de cada uno de los antibióticos. El uso de hemodiálisis elimina antibióticos con peso molecular y/o fijación a proteínas y/o volumen de distribución reducidos, lo que implica la administración de la dosis inmediatamente después de la sesión, e incluso la administración de dosis supletoria. En el caso de las técnicas de depuración externa más extremas, sólo la presencia de un volumen de distribución elevado garantiza que el antibiótico no será eliminado.
Renal or hepatic failure implies the need adjust the dosage of antibiotics that are eliminated in active form through the kidneys or metabolized through the liver. In the first case, the dose should be reduced by 30% for each level of renal impairment (moderate and severe). In hepatic failure, there is no general rule, and the specific information provided for each antibiotic should be used. Hemodialysis clears antibiotics with a low molecular weight, and a reduced protein binding and distribution volume. Thus, the dose should be administered immediately after the session or a supplementary dose should be provided. When the most intensive extrarenal clearance techniques are used, the presence of a high volume of distribution is the only guarantee that the antibiotic will not be eliminated
La elección de la posología de un fármaco exige la contemplación meticulosa de las circunstancias especiales que pueden concurrir en el paciente y, dentro de ellas, de las que pueden afectar a cualquiera de los 3 procesos farmacocinéticos: absorción, distribución y eliminación. Si bien todas ellas pueden tener su relevancia, son las que afectan de forma preferente a la eliminación de los fármacos, las que adquieren especial importancia por 2 razones: son muy frecuentes en los pacientes que precisan antibioticoterapia y la repercusión sobre los fármacos es especialmente notable. De ahí que, en la actualidad, se realice un esfuerzo en la investigación clínica de los fármacos, procediendo a verificar el grado de alteración de la farmacocinética en pacientes que presentan diferentes grados de insuficiencia renal y, en algunos casos, incluso cuando el paciente es sometido a técnicas de hemodiálisis convencional. Del mismo modo, es habitual que se investigue el impacto de alguno de los tipos de insuficiencia hepática, como es el caso de la cirrosis.
La información obtenida es, sin duda, muy valiosa pero su extrapolación no es posible cuando en el paciente concurren otras circunstancias, como la presencia de alteraciones de la función hepática distintas a la cirrosis o, lo que resulta sin duda más frecuente, es sometido a las modernas técnicas de depuración externa (DE) del tipo de la hemofiltración continua, en las que hay numerosas variables independientes; entre otras el tipo de filtro y los flujos utilizados, cuyo impacto real sobre la farmacocinética es difícil de precisar e imposible de presumir.
En este artículo se intentará explicar el tipo de impacto que generan estas técnicas y de qué forma se puede precisar, desde el conocimiento de algunos datos de cada fármaco, cuál será la magnitud de éste. Además, se ha considerado de utilidad incluir tablas en las que se describen algunas pautas posológicas recomendadas de los fármacos de interés del grupo de los antiinfecciosos. La bibliografía no puede ser exhaustiva, serían cientos de citas y, por ello, se ha preferido situar en cada apartado las citas más relevantes, remitiendo al lector interesado a los medios habituales para que identifique en ellos las citas más específicas de cada fármaco.
¿Cómo detectar el impacto de las alteraciones de la función renal y/o hepática sobre los fármacos?1–4Aunque resulte excesivamente simplificado, es posible realizar una predicción acerca del impacto que la alteración de la función renal y, con más dificultades, la de la función hepática, van a tener sobre la farmacocinética de un fármaco. Estas alteraciones producen una reducción de la capacidad del organismo para eliminar los fármacos cuyo impacto final dependerá, lógicamente, del tipo y de la gravedad de la alteración y de la vía preferente de eliminación del fármaco. Expresado en términos farmacocinéticos, puede señalarse que ambas situaciones cursan con una reducción del aclaramiento del fármaco y que, si no se produce al mismo tiempo una alteración paralela de la distribución del fármaco, tendrá una repercusión directa sobre la semivida de eliminación que aumentará. Este dato no es sino la expresión de la mayor lentitud de eliminación del fármaco. Esto conlleva que a la hora de medir las concentraciones plasmáticas verifiquemos que se mantienen elevadas durante más tiempo, es decir, que el tiempo que tarda en reducirse a la mitad la concentración plasmática, semivida de eliminación, es superior.
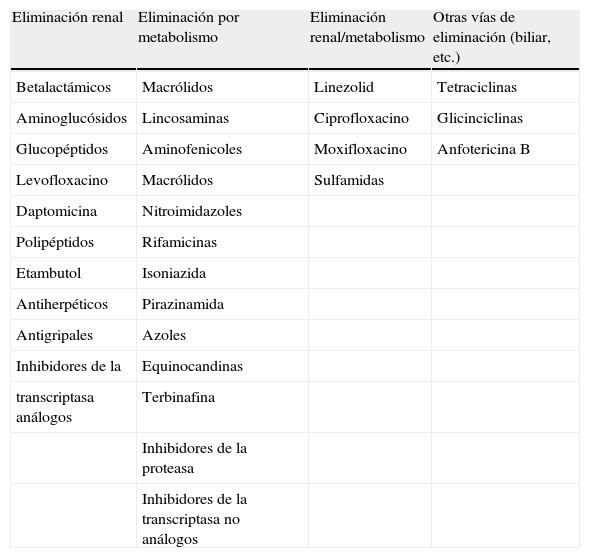
Tal y como se ha señalado, reconocer a los fármacos que precisan el ajuste del intervalo resulta sencillo. Bastará, por una parte, con comprobar el grado de participación del riñón y del metabolismo hepático en la excreción del fármaco activo y, a veces, la de sus metabolitos. Para ello debe estudiarse el valor relativo de cada uno de los aclaramientos renal y extrarrenal, utilizando como referencia el aclaramiento total. Esta relativización, cuantifica directamente el papel de las vías comentadas en la eliminación del fármaco y con él se expresa el previsible impacto y la necesidad de ajuste de las alteraciones específicas de cada una de ellas. Dicho de otro modo más sencillo, cuando se clasifica a los fármacos de acuerdo a su eliminación (tabla 1) se están cualificando los valores de sus aclaramientos parciales respecto al total e identificando a los que sufrirán modificaciones farmacocinéticas cuando haya insuficiencia renal, hepática o ambas. Este tipo de tablas tiene un valor relativo, pero sólo a la hora de ajustar inicialmente, ya que no siempre en ese momento está disponible la información específica de cada uno de los fármacos, que es en definitiva la que interesa.
Vías preferentes de eliminación de los fármacos
| Eliminación renal | Eliminación por metabolismo | Eliminación renal/metabolismo | Otras vías de eliminación (biliar, etc.) |
| Betalactámicos | Macrólidos | Linezolid | Tetraciclinas |
| Aminoglucósidos | Lincosaminas | Ciprofloxacino | Glicinciclinas |
| Glucopéptidos | Aminofenicoles | Moxifloxacino | Anfotericina B |
| Levofloxacino | Macrólidos | Sulfamidas | |
| Daptomicina | Nitroimidazoles | ||
| Polipéptidos | Rifamicinas | ||
| Etambutol | Isoniazida | ||
| Antiherpéticos | Pirazinamida | ||
| Antigripales | Azoles | ||
| Inhibidores de la | Equinocandinas | ||
| transcriptasa análogos | Terbinafina | ||
| Inhibidores de la proteasa | |||
| Inhibidores de la transcriptasa no análogos |
Identificado el fármaco de acuerdo con la necesidad de adecuar la dosis en relación con las enfermedades asociadas, llegará el momento de prescribir la dosis. Para ello debe considerarse que la posología incluye 2 cuestiones: la dosis que hay que administrar y el intervalo de tiempo que ha de transcurrir entre cada dosis y, por ello, es preciso conocer si la alteración de la función excretora exige adaptar cualquiera de ellos, o incluso ambos. Este problema es sencillo de explicar. La dosis de un fármaco es la responsable directa de producir una concentración plasmática concreta, mientras que del intervalo dependerá que se mantenga la concentración en el tiempo, y puesto que la función excretora alterada afecta más a la secuencia de concentraciones en el tiempo que a su magnitud, lo más acertado será ajustar el intervalo. En ocasiones la alteración de la función del órgano excretor se asocia con una expansión del contenido del agua corporal y esta circunstancia condiciona que al mismo tiempo resulte necesario ajustar la dosis, habitualmente elevándola, para conseguir alcanzar la misma concentración inicial que en condiciones de normalidad.
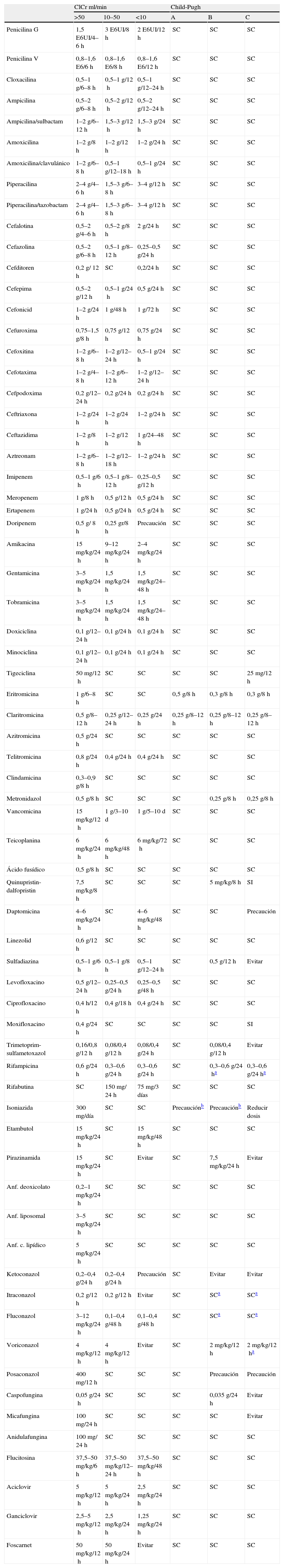
La presencia de insuficiencia renal plantea un ajuste sencillo de la posología, ya que el retraso de la velocidad de eliminación acostumbra a relacionarse con la reducción del aclaramiento de creatinina (ClCr). De ahí que resulte sencillo establecer pautas posológicas específicas (tabla 2).
Pautas posológicas y alteración de la función renal y hepática
| ClCr ml/min | Child-Pugh | |||||
| >50 | 10–50 | <10 | A | B | C | |
| Penicilina G | 1,5 E6UI/4–6h | 3 E6UI/8h | 2 E6UI/12h | SC | SC | SC |
| Penicilina V | 0,8–1,6 E6/6h | 0,8–1,6 E6/8h | 0,8–1,6 E6/12h | SC | SC | SC |
| Cloxacilina | 0,5–1g/6–8h | 0,5–1g/12h | 0,5–1g/12–24h | SC | SC | SC |
| Ampicilina | 0,5–2g/6–8h | 0,5–2g/12h | 0,5–2g/12–24h | SC | SC | SC |
| Ampicilina/sulbactam | 1–2g/6–12h | 1,5–3g/12h | 1,5–3g/24h | SC | SC | SC |
| Amoxicilina | 1–2g/8h | 1–2g/12h | 1–2g/24h | SC | SC | SC |
| Amoxicilina/clavulánico | 1–2g/6–8h | 0,5–1g/12–18h | 0,5–1g/24h | SC | SC | SC |
| Piperacilina | 2–4g/4–6h | 1,5–3g/6–8h | 3–4g/12h | SC | SC | SC |
| Piperacilina/tazobactam | 2–4g/4–6h | 1,5–3g/6–8h | 3–4g/12h | SC | SC | SC |
| Cefalotina | 0,5–2g/4–6h | 0,5–2g/8h | 2g/24h | SC | SC | SC |
| Cefazolina | 0,5–2g/6–8h | 0,5–1g/8–12h | 0,25–0,5g/24h | SC | SC | SC |
| Cefditoren | 0,2g/ 12h | SC | 0,2/24h | SC | SC | SC |
| Cefepima | 0,5–2g/12h | 0,5–1g/24h | 0,5g/24h | SC | SC | SC |
| Cefonicid | 1–2g/24h | 1g/48h | 1g/72h | SC | SC | SC |
| Cefuroxima | 0,75–1,5g/8h | 0,75g/12h | 0,75g/24h | SC | SC | SC |
| Cefoxitina | 1–2g/6–8h | 1–2g/12–24h | 0,5–1g/24h | SC | SC | SC |
| Cefotaxima | 1–2g/4–8h | 1–2g/6–12h | 1–2g/12–24h | SC | SC | SC |
| Cefpodoxima | 0,2g/12–24h | 0,2g/24h | 0,2g/24h | SC | SC | SC |
| Ceftriaxona | 1–2g/24h | 1–2g/24h | 1–2g/24h | SC | SC | SC |
| Ceftazidima | 1–2g/8h | 1–2g/12h | 1g/24–48h | SC | SC | SC |
| Aztreonam | 1–2g/6–8h | 1–2g/12–18h | 1–2g/24h | SC | SC | SC |
| Imipenem | 0,5–1g/6h | 0,5–1g/8–12h | 0,25–0,5g/12h | SC | SC | SC |
| Meropenem | 1g/8h | 0,5g/12h | 0,5g/24h | SC | SC | SC |
| Ertapenem | 1g/24h | 0,5g/24h | 0,5g/24h | SC | SC | SC |
| Doripenem | 0,5g/ 8h | 0,25gr/8h | Precaución | SC | SC | SC |
| Amikacina | 15mg/kg/24h | 9–12mg/kg/24h | 2–4mg/kg/24h | SC | SC | SC |
| Gentamicina | 3–5mg/kg/24h | 1,5mg/kg/24h | 1,5mg/kg/24–48h | SC | SC | SC |
| Tobramicina | 3–5mg/kg/24h | 1,5mg/kg/24h | 1,5mg/kg/24–48h | SC | SC | SC |
| Doxiciclina | 0,1g/12–24h | 0,1g/24h | 0,1g/24h | SC | SC | SC |
| Minociclina | 0,1g/12–24h | 0,1g/24h | 0,1g/24h | SC | SC | SC |
| Tigeciclina | 50mg/12h | SC | SC | SC | SC | 25mg/12h |
| Eritromicina | 1g/6–8h | SC | SC | 0,5g/8h | 0,3g/8h | 0,3g/8h |
| Claritromicina | 0,5g/8–12h | 0,25g/12–24h | 0,25g/24h | 0,25g/8–12h | 0,25g/8–12h | 0,25g/8–12h |
| Azitromicina | 0,5g/24h | SC | SC | SC | SC | SC |
| Telitromicina | 0,8g/24h | 0,4g/24h | 0,4g/24h | SC | SC | SC |
| Clindamicina | 0,3–0,9g/8h | SC | SC | SC | SC | SC |
| Metronidazol | 0,5g/8h | SC | SC | SC | 0,25g/8h | 0,25g/8h |
| Vancomicina | 15mg/kg/12h | 1g/3–10 d | 1g/5–10 d | SC | SC | SC |
| Teicoplanina | 6mg/kg/24h | 6mg/kg/48h | 6mg/kg/72h | SC | SC | SC |
| Ácido fusídico | 0,5g/8h | SC | SC | SC | SC | SC |
| Quinupristin-dalfopristin | 7,5mg/kg/8h | SC | SC | SC | 5mg/kg/8h | SI |
| Daptomicina | 4–6mg/kg/24h | SC | 4–6mg/kg/48h | SC | SC | Precaución |
| Linezolid | 0,6g/12h | SC | SC | SC | SC | SC |
| Sulfadiazina | 0,5–1g/6h | 0,5–1g/8h | 0,5–1g/12–24h | SC | 0,5g/12h | Evitar |
| Levofloxacino | 0,5g/12–24h | 0,25–0,5g/24h | 0,25–0,5g/48h | SC | SC | SC |
| Ciprofloxacino | 0,4h/12h | 0,4g/18h | 0,4g/24h | SC | SC | SC |
| Moxifloxacino | 0,4g/24h | SC | SC | SC | SC | SI |
| Trimetoprim-sulfametoxazol | 0,16/0,8g/12h | 0,08/0,4g/12h | 0,08/0,4g/24h | SC | 0,08/0,4g/12h | Evitar |
| Rifampicina | 0,6g/24h | 0,3–0,6g/24h | 0,3–0,6g/24h | SC | 0,3–0,6g/24ha | 0,3–0,6g/24ha |
| Rifabutina | SC | 150mg/ 24h | 75mg/3 días | SC | SC | SC |
| Isoniazida | 300mg/día | SC | SC | Precauciónb | Precauciónb | Reducir dosis |
| Etambutol | 15mg/kg/24h | SC | 15mg/kg/48h | SC | SC | SC |
| Pirazinamida | 15mg/kg/24h | SC | Evitar | SC | 7,5mg/kg/24h | Evitar |
| Anf. deoxicolato | 0,2–1mg/kg/24h | SC | SC | SC | SC | SC |
| Anf. liposomal | 3–5mg/kg/24h | SC | SC | SC | SC | SC |
| Anf. c. lipídico | 5mg/kg/24h | SC | SC | SC | SC | SC |
| Ketoconazol | 0,2–0,4g/24h | 0,2–0,4g/24h | Precaución | SC | Evitar | Evitar |
| Itraconazol | 0,2g/12h | 0,2g/12h | Evitar | SC | SCa | SCa |
| Fluconazol | 3–12mg/kg/24h | 0,1–0,4g/48h | 0,1–0,4g/48h | SC | SCa | SCa |
| Voriconazol | 4mg/kg/12h | 4mg/kg/12h | Evitar | SC | 2mg/kg/12h | 2mg/kg/12ha |
| Posaconazol | 400mg/12h | SC | SC | SC | Precaución | Precaución |
| Caspofungina | 0,05g/24h | SC | SC | SC | 0,035g/24h | Evitar |
| Micafungina | 100mg/24h | SC | SC | SC | SC | Evitar |
| Anidulafungina | 100mg/ 24h | SC | SC | SC | SC | SC |
| Flucitosina | 37,5–50mg/kg/6h | 37,5–50mg/kg/12–24h | 37,5–50mg/kg/48h | SC | SC | SC |
| Aciclovir | 5mg/kg/12h | 5mg/kg/24h | 2,5mg/kg/24h | SC | SC | SC |
| Ganciclovir | 2,5–5mg/kg/12h | 2,5mg/kg/24h | 1,25mg/kg/24h | SC | SC | SC |
| Foscarnet | 50mg/kg/12h | 50mg/kg/24h | Evitar | SC | SC | SC |
ClCr: aclaramiento de creatinina; SC: sin cambios; SI: sin información.
La insuficiencia hepática es mucho más problemática; por las diferencias existentes en la repercusión de cada tipo de enfermedad sobre la función de este órgano, y por la ausencia de relación entre las alteraciones de las pruebas funcionales hepáticas y los parámetros de eliminación de los fármacos. En este sentido, debe recordarse que el hígado participa en la eliminación de los fármacos a través de metabolismo microsomal y no microsomal, y de la excreción biliar, que pueden acontecer o no, en mayor o menor grado, simultáneamente en un mismo fármaco. Además, las consecuencias del metabolismo pueden ser distintas: inactivación del fármaco con transformación en un derivado inofensivo, activación del fármaco y/o transformación en metabolitos más tóxicos. Para complicar más si cabe este cuadro, hay que considerar que la insuficiencia hepática puede conllevar alteraciones asociadas de función renal e hipoalbuminemia que incidirán en provocar alteraciones específicas y sobreañadidas a las de la propia función hepática.
La cirrosis hepática probablemente es la entidad que produce, al menos en sus estadios más avanzados, mayor grado de alteración de la farmacocinética de los fármacos. Conviene recordar que en esta enfermedad hay una alteración global de la estructura del hígado que cursa con reducción del flujo sanguíneo hepático, presencia de derivación intra y extrahepática, capilarización de los sinusoides y reducción del número de hepatocitos. Todas estas circunstancias conllevan que, en general, se trate de una enfermedad que puede llegar a modificar de forma muy importante la farmacocinética de algunos antibióticos, mucho más que las modificaciones producidas por otro tipo de enfermedades hepáticas como la hepatitis aguda, la crónica o el hígado metastásico. Las modificaciones propias de la cirrosis generan, habitualmente, un aumento de la biodisponibilidad de los fármacos que se eliminan a través de cualquiera de los mecanismos en los que interviene el hígado y que está justificado por diversos motivos. Por una parte, se produce una reducción del efecto de primer paso, por déficit de la actividad enzimática y/o presencia de derivación y/o reducción del flujo sanguíneo hepático que conllevará un aumento, a veces notable, de la fracción biodisponible y con ello de las concentraciones. Por otra parte, la probable hipoalbuminemia producirá un aumento de la fracción libre con repercusiones especialmente relevantes para los fármacos que circulan fijados en alta proporción a esta proteína. Este hecho producirá un aumento de la distribución del fármaco y, con ello, de su semivida de eliminación, lo que de nuevo será causa de aumento de la biodisponibilidad. Por último, debe recordarse que la reducción del número de hepatocitos puede asociarse a una reducción de la actividad enzimática, que parece especialmente importante para el sistema microsomal ligado al CYP450. De ahí que se produzca una reducción del aclaramiento del fármaco cuyo metabolismo está ligado a la actividad de estas enzimas y, como consecuencia, un aumento de la semivida de eliminación que acarreará un aumento de la biodisponibilidad. Afortunadamente, en caso de la cirrosis se dispone de una clasificación de gravedad, que facilita la estratificación sistemática de los pacientes. Esta circunstancia permite que haya información sistemática del impacto de la cirrosis sobre los diferentes fármacos, especialmente en el caso de los más modernos (tabla 2).
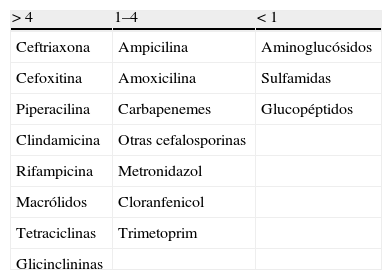
Para finalizar, merece la pena comentar un último aspecto de importancia en el caso de los antibióticos con relación a la obstrucción de la vía biliar. Considerando que la presencia de antibiótico en la bilis parece deberse a su excreción formando parte activa de la bilis, la presencia de obstrucción puede conducir a una reducción muy importante de la concentración del antibiótico a este nivel, con independencia de la magnitud de las concentraciones que alcanza el fármaco en situaciones de normalidad de la vía biliar. Conviene recordar este hecho, ya que a menudo se destaca la importancia de utilizar antibióticos que se eliminan de forma importante a través de la vía biliar cuando es preciso tratar infecciones asociadas a obstrucciones o cuando se precisa la administración profiláctica previa a la cirugía biliar y hay obstrucción de ésta (tabla 3). Evidentemente, esta recomendación no considera que la obstrucción biliar pueda dificultar de tal modo la excreción biliar de estos fármacos que las concentraciones alcanzadas no lleguen a ser eficaces.
Antibióticos y eliminación biliar. Relación entre concentración biliar y la plasmática
| > 4 | 1–4 | < 1 |
| Ceftriaxona | Ampicilina | Aminoglucósidos |
| Cefoxitina | Amoxicilina | Sulfamidas |
| Piperacilina | Carbapenemes | Glucopéptidos |
| Clindamicina | Otras cefalosporinas | |
| Rifampicina | Metronidazol | |
| Macrólidos | Cloranfenicol | |
| Tetraciclinas | Trimetoprim | |
| Glicinclininas |
Es evidente que disponer de la información específica extraída de estudios realizados con cada uno de los fármacos es al final el mejor de los recursos, pero también es evidente que esto no siempre es posible bien porque no existen tales estudios, bien porque no están disponibles en el momento de la prescripción inicial. Por ello, de una forma global y, al menos, para iniciar el tratamiento, pueden considerarse las siguientes recomendaciones:
- •
Es muy probable que se precise aumentar el intervalo de administración de los fármacos que se eliminan por vía renal cuando haya insuficiencia renal y esto será especialmente relevante cuando se trate de fármacos que pueden tener un índice terapéutico más reducido, como aminoglucósidos y glucopéptidos. El ajuste acostumbra a incluir diferentes dosis/intervalos de acuerdo al grado de insuficiencia renal medido por el ClCr y, aunque hay recomendaciones específicas como las que figuran en la tabla 2, para iniciar el tratamiento puede considerarse la reducción de un 30% de la dosis habitual por cada escalón de alteración de la función renal a partir de un ClCr <50ml/min. Es decir, reducir un 30% de la dosis diaria cuando ClCr está comprendido entre 30–50ml/min y al menos el 60% de la dosis diaria cuando el ClCr <30ml/min. Lógicamente, y siempre con la máxima celeridad, se localizará la información específica para realizar el ajuste más fino que en algunas ocasiones, como con aminoglucósidos y glucopéptidos, requerirá incluso la monitorización de los valores plasmáticos.
- •
No hay ninguna regla general para el ajuste de dosis cuando es preciso utilizar un fármaco que se elimina a través de metabolismo y hay alteración de la función hepática. Por ello se recomienda precaución ya en el momento de la prescripción, priorizando, en lo posible, la elección de los que se eliminan por otras vías.
- •
Los fármacos que se eliminan de forma mixta, renal y metabolismo, acostumbran a ser de manejo sencillo cuando hay alteraciones singulares de cualquiera de las vías excretoras ya que la otra, mientras esté indemne, tenderá a compensar la eliminación del fármaco. Por ello, no suelen requerir ajuste de dosis salvo cuando hay alteración concurrente de ambas vías, circunstancia que complicará el uso de este tipo de fármacos al no disponer de información acerca del tipo de ajuste a realizar.
- •
Algunos fármacos, entre ellos algunos antibióticos, se eliminan de forma preferente por otras vías, y entre ellas la vía biliar. Lógicamente, el impacto de la alteración de la función renal será mínimo, mientras que el de la insuficiencia hepática dependerá del grado de afección de la función biliar. La presencia de obstrucción grave puede implicar concentraciones infraterapéuticas, incluso de los fármacos que son eliminados a través de la bilis.
La presencia de insuficiencia de los órganos excretores exige la utilización de técnicas de DE para intentar mantener el equilibrio homeostásico. Estas técnicas son de uso cada vez más frecuente y eficiente, ya que hay equipos muy diversos y sofisticados que plantean múltiples posibilidades de flujos y de filtros. Esta circunstancia no facilita la obtención de resultados sistemáticos habida cuenta que las condiciones utilizadas en cada paciente son distintas, hasta el punto de generarse impactos muy diferentes sobre la eliminación de los fármacos, lo que impide realizar extrapolaciones sin riesgos evidentes. La complejidad de este tema es tan importante que puede asegurarse que resultaría preciso monitorizar en el tiempo las concentraciones de cada uno de los fármacos que recibe cualquier paciente cuando es sometido a este tipo de técnicas, sobre todo cuando son continuas y extremas. Cuando la técnica es más convencional, la hemodiálisis crónica de 4h de duración, se dispone de abundante información acerca de su impacto en la eliminación de muchos de los fármacos y especialmente de los más modernos.
En cualquier caso, son 2 los principios generales que rigen la depuración de un fármaco: la relación del tamaño del fármaco con el del poro del filtro y la cantidad en la que el fármaco está presente en el material que es filtrado, el plasma.
La primera de las cuestiones parece evidente, ya que para que el fármaco sea eliminado ha de ser capaz de atravesar el espacio físico del poro. El tamaño de un fármaco se mide a través de su peso molecular y, por ello, las moléculas grandes (peso molecular elevado) tienen, habitualmente, muy pocas probabilidades de ser dializadas por la técnica convencional. Del mismo modo, las moléculas pequeñas que circulan en plasma unidas a proteínas en una proporción elevada tienen, de hecho, un tamaño muy elevado (el peso molecular de la albúmina es de 65.000 D unido al su propio peso molecular), lo que impide que el fármaco unido a la proteína atraviese el filtro.
La segunda cuestión también es de compresión sencilla. La hemodiálisis depura los solutos que están presentes en la sangre y, por ello, otra condición relevante es que el fármaco esté presente en la sangre en el momento de la diálisis, si no es así no será dializado, con independencia de su tamaño. Hay un parámetro farmacocinético que describe la capacidad de un fármaco para estar presente en la sangre y/o para difundir a los diferentes tejidos: el volumen de distribución. Se define como el volumen de agua corporal en el que el fármaco se encuentra disuelto. En el modelo más sencillo, este parámetro se calcula dividiendo el valor de la cantidad de fármaco que ha penetrado en el organismo entre el de la concentración máxima alcanzada (Cmax), fórmula que no es sino la conclusión de un silogismo o regla de tres directa y sencilla: si en 1ml del volumen corporal del paciente hay x mg del fármaco, ¿en qué cantidad estará disuelta la totalidad de fármaco que ha penetrado en el organismo?
Para tener una idea de la capacidad de distribución del fármaco desde el valor de su volumen de distribución, debe recordarse que el volumen de agua vascular es de unos 3l y que éste con otros 12–15l del líquido intersticial, configuran el llamado compartimiento central. Por consiguiente, los fármacos que tienen un volumen de distribución inferior a 20l (0,25l/kg) están presentes en el territorio vascular y en el líquido intersticial y, por ello, en condiciones de ser dializados si su tamaño lo facilita. Lógicamente, cuanto mayor es el valor del volumen de distribución menor es la presencia del fármaco en el compartimiento central, y mayor en el intracelular y en depósitos tisulares específicos, y por ello menor la probabilidad de ser dializado incluso por las técnicas más extremas que incluyen el uso de filtros para moléculas de tamaños elevados, de flujos elevados y mantenidos en el tiempo.
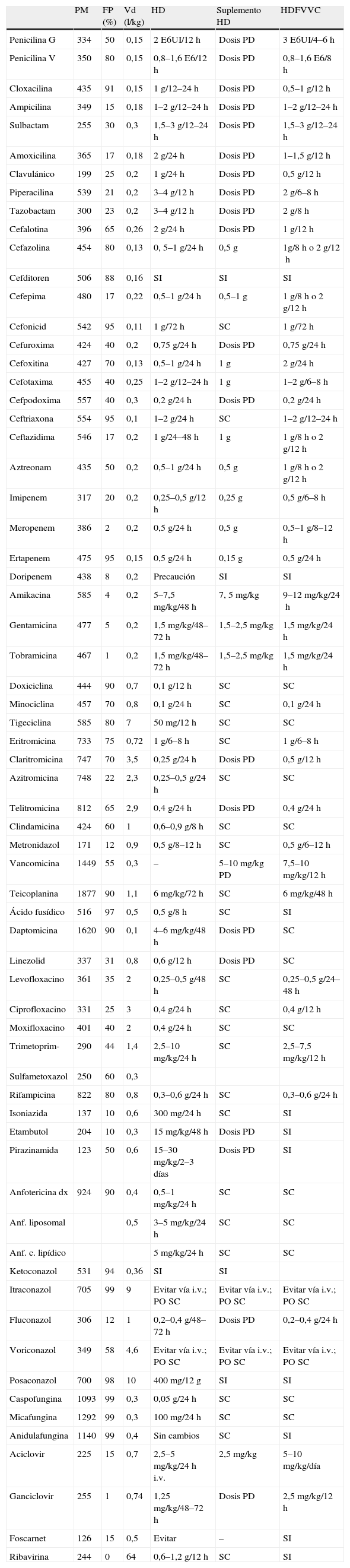
En la tabla 4 se describen los valores del peso molecular, de la fijación a proteínas y del volumen de distribución de los antibióticos, y en las siguientes columnas se resume la posología recomendada cuando se realiza hemodiálisis, diálisis peritoneal y hemofiltración. En general, y como una recomendación de interés, pueden destacarse los siguientes extremos:
- •
La hemodiálisis convencional afecta de forma especial a los fármacos con volumen de distribución reducido (<0,3–0,4l/kg). Cuanto menor es este valor, mayor es el grado de eliminación, siempre que al mismo tiempo el peso molecular del fármaco sea reducido (<500D). En estos casos, es habitual que se precise administrar una dosis suplementaria del fármaco al terminar la sesión de diálisis. En muchos casos es suficiente con administrar la dosis prevista para la presencia de insuficiencia renal severa (ClCr <15ml/min), el día que corresponda de acuerdo al intervalo de administración, pero en los instantes siguientes a la finalización de la sesión de hemodiálisis.
- •
En el caso de las técnicas de hemofiltración y hemodiafiltración, la información disponible es escasa, poco sistematizada o se ha obtenido en condiciones no siempre extrapolables, de aquí que la información deba utilizarse con gran precaución. Este tipo de técnicas, cuando se utilizan filtros de gran capacidad y flujos muy elevados, pueden llegar a eliminar moléculas de gran tamaño (hasta 20.000 D). De aquí que el peso molecular de los fármacos, sobre todo el de los diferentes antibióticos, no suponga ningún problema para la eliminación. La distribución del fármaco sí que continúa representando una barrera a la eliminación, ya que cuanto menor sea su presencia en el compartimiento central, menor resultará el impacto de la técnica sobre el fármaco. En este sentido, debe recordarse que algunos fármacos con peso molecular reducido que se fijan poco a proteínas y cuya distribución se realiza en el compartimiento central, por ejemplo, la gran mayoría de los betalactámicos, pueden ser eliminados en tal cantidad que se precisen dosis incluso superiores a las máximas utilizadas en pacientes con función renal normal.
Depuración externa
| PM | FP (%) | Vd (l/kg) | HD | Suplemento HD | HDFVVC | |
| Penicilina G | 334 | 50 | 0,15 | 2 E6UI/12h | Dosis PD | 3 E6UI/4–6h |
| Penicilina V | 350 | 80 | 0,15 | 0,8–1,6 E6/12h | Dosis PD | 0,8–1,6 E6/8h |
| Cloxacilina | 435 | 91 | 0,15 | 1g/12–24h | Dosis PD | 0,5–1g/12h |
| Ampicilina | 349 | 15 | 0,18 | 1–2g/12–24h | Dosis PD | 1–2g/12–24h |
| Sulbactam | 255 | 30 | 0,3 | 1,5–3g/12–24h | Dosis PD | 1,5–3g/12–24h |
| Amoxicilina | 365 | 17 | 0,18 | 2g/24h | Dosis PD | 1–1,5g/12h |
| Clavulánico | 199 | 25 | 0,2 | 1g/24h | Dosis PD | 0,5g/12h |
| Piperacilina | 539 | 21 | 0,2 | 3–4g/12h | Dosis PD | 2g/6–8h |
| Tazobactam | 300 | 23 | 0,2 | 3–4g/12h | Dosis PD | 2g/8h |
| Cefalotina | 396 | 65 | 0,26 | 2g/24h | Dosis PD | 1g/12h |
| Cefazolina | 454 | 80 | 0,13 | 0, 5–1g/24h | 0,5g | 1g/8h o 2g/12h |
| Cefditoren | 506 | 88 | 0,16 | SI | SI | SI |
| Cefepima | 480 | 17 | 0,22 | 0,5–1g/24h | 0,5–1g | 1g/8h o 2g/12h |
| Cefonicid | 542 | 95 | 0,11 | 1g/72h | SC | 1g/72h |
| Cefuroxima | 424 | 40 | 0,2 | 0,75g/24h | Dosis PD | 0,75g/24h |
| Cefoxitina | 427 | 70 | 0,13 | 0,5–1g/24h | 1g | 2g/24h |
| Cefotaxima | 455 | 40 | 0,25 | 1–2g/12–24h | 1g | 1–2g/6–8h |
| Cefpodoxima | 557 | 40 | 0,3 | 0,2g/24h | Dosis PD | 0,2g/24h |
| Ceftriaxona | 554 | 95 | 0,1 | 1–2g/24h | SC | 1–2g/12–24h |
| Ceftazidima | 546 | 17 | 0,2 | 1g/24–48h | 1g | 1g/8h o 2g/12h |
| Aztreonam | 435 | 50 | 0,2 | 0,5–1g/24h | 0,5g | 1g/8h o 2g/12h |
| Imipenem | 317 | 20 | 0,2 | 0,25–0,5g/12h | 0,25g | 0,5g/6–8h |
| Meropenem | 386 | 2 | 0,2 | 0,5g/24h | 0,5g | 0,5–1g/8–12h |
| Ertapenem | 475 | 95 | 0,15 | 0,5g/24h | 0,15g | 0,5g/24h |
| Doripenem | 438 | 8 | 0,2 | Precaución | SI | SI |
| Amikacina | 585 | 4 | 0,2 | 5–7,5mg/kg/48h | 7, 5mg/kg | 9–12mg/kg/24h |
| Gentamicina | 477 | 5 | 0,2 | 1,5mg/kg/48–72h | 1,5–2,5mg/kg | 1,5mg/kg/24h |
| Tobramicina | 467 | 1 | 0,2 | 1,5mg/kg/48–72h | 1,5–2,5mg/kg | 1,5mg/kg/24h |
| Doxiciclina | 444 | 90 | 0,7 | 0,1g/12h | SC | SC |
| Minociclina | 457 | 70 | 0,8 | 0,1g/24h | SC | 0,1g/24h |
| Tigeciclina | 585 | 80 | 7 | 50mg/12h | SC | SC |
| Eritromicina | 733 | 75 | 0,72 | 1g/6–8h | SC | 1g/6–8h |
| Claritromicina | 747 | 70 | 3,5 | 0,25g/24h | Dosis PD | 0,5g/12h |
| Azitromicina | 748 | 22 | 2,3 | 0,25–0,5g/24h | SC | SC |
| Telitromicina | 812 | 65 | 2,9 | 0,4g/24h | Dosis PD | 0,4g/24h |
| Clindamicina | 424 | 60 | 1 | 0,6–0,9g/8h | SC | SC |
| Metronidazol | 171 | 12 | 0,9 | 0,5g/8–12h | SC | 0,5g/6–12h |
| Vancomicina | 1449 | 55 | 0,3 | – | 5–10mg/kg PD | 7,5–10mg/kg/12h |
| Teicoplanina | 1877 | 90 | 1,1 | 6mg/kg/72h | SC | 6mg/kg/48h |
| Ácido fusídico | 516 | 97 | 0,5 | 0,5g/8h | SC | SI |
| Daptomicina | 1620 | 90 | 0,1 | 4–6mg/kg/48h | Dosis PD | SC |
| Linezolid | 337 | 31 | 0,8 | 0,6g/12h | Dosis PD | SC |
| Levofloxacino | 361 | 35 | 2 | 0,25–0,5g/48h | SC | 0,25–0,5g/24–48h |
| Ciprofloxacino | 331 | 25 | 3 | 0,4g/24h | SC | 0,4g/12h |
| Moxifloxacino | 401 | 40 | 2 | 0,4g/24h | SC | SC |
| Trimetoprim- | 290 | 44 | 1,4 | 2,5–10mg/kg/24h | SC | 2,5–7,5mg/kg/12h |
| Sulfametoxazol | 250 | 60 | 0,3 | |||
| Rifampicina | 822 | 80 | 0,8 | 0,3–0,6g/24h | SC | 0,3–0,6g/24h |
| Isoniazida | 137 | 10 | 0,6 | 300mg/24h | SC | SI |
| Etambutol | 204 | 10 | 0,3 | 15mg/kg/48h | Dosis PD | SI |
| Pirazinamida | 123 | 50 | 0,6 | 15–30mg/kg/2–3 días | Dosis PD | SI |
| Anfotericina dx | 924 | 90 | 0,4 | 0,5–1mg/kg/24h | SC | SC |
| Anf. liposomal | 0,5 | 3–5mg/kg/24h | SC | SC | ||
| Anf. c. lipídico | 5mg/kg/24h | SC | SC | |||
| Ketoconazol | 531 | 94 | 0,36 | SI | SI | |
| Itraconazol | 705 | 99 | 9 | Evitar vía i.v.; PO SC | Evitar vía i.v.; PO SC | Evitar vía i.v.; PO SC |
| Fluconazol | 306 | 12 | 1 | 0,2–0,4g/48–72h | Dosis PD | 0,2–0,4g/24h |
| Voriconazol | 349 | 58 | 4,6 | Evitar vía i.v.; PO SC | Evitar vía i.v.; PO SC | Evitar vía i.v.; PO SC |
| Posaconazol | 700 | 98 | 10 | 400mg/12g | SI | SI |
| Caspofungina | 1093 | 99 | 0,3 | 0,05g/24h | SC | SC |
| Micafungina | 1292 | 99 | 0,3 | 100mg/24h | SC | SC |
| Anidulafungina | 1140 | 99 | 0,4 | Sin cambios | SC | SI |
| Aciclovir | 225 | 15 | 0,7 | 2,5–5mg/kg/24h i.v. | 2,5mg/kg | 5–10mg/kg/día |
| Ganciclovir | 255 | 1 | 0,74 | 1,25mg/kg/48–72h | Dosis PD | 2,5mg/kg/12h |
| Foscarnet | 126 | 15 | 0,5 | Evitar | – | SI |
| Ribavirina | 244 | 0 | 64 | 0,6–1,2g/12h | SC | SI |
Dosis PD: administrar la dosis correspondiente al finalizar la sesión de hemodiálisis; FP: porcentaje de fármaco fijado a proteínas; HD: dosis que hay que administrar en pacientes con hemodiálisis; HDFVVC: hemodiafiltración venovenosa continua; i.v.: intravenoso; PM: peso molecular; SC: sin cambios; SI: sin información; suplemento HD: dosis que hay que administrar cuando finaliza la diálisis como suplemento a la que recibe pautada; Vd: volumen de distribución.
En definitiva en estas situaciones y mientras no se disponga de información específica puede ser conveniente recordar:
- •
El uso de antibióticos que presentan un volumen de distribución <0,5l/kg, con independencia de su peso molecular en técnicas de depuración externa continua, puede conllevar la eliminación de cantidades importantes. Por ello, y con el fin de facilitar el uso de dosis muy elevadas, mayores incluso que las convencionales, puede resultar importante utilizar fármacos dotados de índice terapéutico amplio.
- •
Este problema parece no afectar a los fármacos que presentan un volumen de distribución elevado, que pueden utilizarse a la dosis recomendada con independencia de la técnica de depuración utilizada.