Aspectos epidemiológicos
La Organización Mundial de la Salud (OMS) considera la infección por el virus de la hepatitis B (VHB) una de las 10 primeras causas de muerte en el mundo. Se estima que un tercio de la población mundial ha sido infectada por este virus y que alrededor de 400 millones de personas padecen una infección crónica por él 1. En el mundo, la infección por este virus es responsable de más de 500.000 muertes por cirrosis y/o hepatocarcinoma cada año. De hecho, el VHB es considerado después del tabaco como el agente carcinogénico más importante en todo el mundo.
En Asia, África Subsahariana y Oriente Medio, donde viven el 75% de los infectados, la infección se adquiere mayoritariamente por vía materno-filial. La mayoría de los niños así infectados son incapaces de aclarar la infección, por lo que la tasa de infección en los adultos de estas áreas geográficas es muy alta, y llega a afectar a entre el 7 y el 20% de la población 2. De ellos, del 15 al 30% desarrollarán cirrosis hepática y hepatocarcinoma, complicaciones que limitarán significativamente sus expectativas de vida. En países occidentales, donde esta enfermedad se adquiere mayoritariamente en la adolescencia y en la edad adulta, la tasa de infección oscila entre el 0,2 y el 1% en la población. En estos países, la infección por el VHB ocasiona menos del 10% de las cirrosis hepáticas, si bien origina todavía un número nada despreciable de hepatocarcinomas. Se calcula, por ejemplo que en EE.UU. la infección por el VHB produce entre 4.000 y 5.500 muertes al año, y es responsable de un gasto económico-sanitario que puede alcanzar los 400-500 millones de dólares al año. Estas cifras justifican el enorme esfuerzo realizado en los últimos 25 años para intentar lograr que la infección crónica por el VHB sea una enfermedad prevenible y tratable. En esta revisión nos centraremos en el tratamiento de la infección por el VHB en nuestra área.
Terminología en la infección por el VHB
La Asociación Americana para el Estudio de las Enfermedades Hepáticas (AASLD) elaboró, a partir de las conclusiones obtenidas en una conferencia de consenso promovida por el National Institutes of Health (NIH) unas guías de actuación en las que se fijaron las definiciones y criterios diagnósticos que deben utilizarse en la hepatitis crónica por el VHB 3,4. Esta terminología (tabla 1) de la que se eliminaron términos antiguos que podían dar lugar a equívocos como el de "portador sano" del VHB, fue también la utilizada en la Conferencia Consenso de la Asociación Europea para el Estudio del Hígado (EASL) 5 y será la que utilicemos en adelante.
Historia natural de la infección en países occidentales
En la historia natural de la infección por el VHB se han identificado 3 fases: fase inicial de inmunotolerancia, fase de aclaramiento o fase inmunoactiva y fase final inactiva. La de inmunotolerancia se caracteriza por la existencia de alta replicación viral (ADN del VHB habitualmente por encima de 10 5 copias/ml) acompañada de escasa o nula hepatólisis (concentraciones normales de alanino aminotransferasa [ALT]). Esta situación se observa principalmente en niños infectados al nacer o en los primeros años de vida, y en ellos persiste durante bastantes años. Por el contrario, es infrecuente o de muy breve duración en las infecciones adquiridas en la adolescencia y en la edad adulta. Por esta razón, en nuestro medio casi todos los pacientes diagnosticados se encuentran en fase de aclaramiento (en la que concentraciones elevadas del ADN del VHB coexisten con elevación de las cifras de ALT y con mayor o menor grado de daño hepático) o en fase de infección inactiva. En esta última fase de la infección, tras frenarse la replicación viral descienden los valores del ADN viral, hasta hacerse en muchos casos indetectable, se normalizan los valores de ALT y, generalmente, todo ello se acompaña de seroconversión de antígeno e del virus de la hepatitis B (HBeAg) a anti-HBe. La seroconversión a anti-HBe es frecuente (del 5 al 20% al año) y en ocasiones viene precedida de la elevación brusca de las transaminasas séricas, incluso por encima de 1.000 U/l, lo que puede erróneamente llevar a pensar al clínico en la existencia de una hepatitis aguda por VHB si desconocía la situación previa de infección crónica por VHB en el paciente. El pronóstico de los pacientes que logran alcanzar la fase de infección crónica inactiva suele ser bueno aunque en gran parte va a depender de la intensidad de las lesiones hepáticas existentes en el momento de alcanzarse esta situación, que a veces se logra con mínimas lesiones hepáticas y en otras ocasiones cuando se ha establecido ya una cirrosis. La existencia de reactivaciones de la hepatitis B cuando se ha alcanzado esta situación de inactividad es posible, tanto de forma espontánea como asociadas a la instauración de tratamientos que condicionan inmunosupresión 6,7.
Algunos pacientes no consiguen pasar de la fase de inmunoaclaramiento y persisten con replicación viral activa y elevación de transaminasas de forma sostenida u oscilante, sufriendo un daño hepático progresivo. Esta situación puede darse tanto con positividad del HBeAg (hepatitis crónicas HBeAg positivo) como con negatividad de este marcador (hepatitis crónicas HBeAg negativo). El diferenciar entre estas formas de hepatitis tiene implicaciones clínicas y terapéuticas.
Globalmente, los pacientes con hepatitis crónica por VHB tienen una tasa anual de evolución a cirrosis del 2 al 5%. En los pacientes con HBeAg negativo la tasa puede ser mayor, del 8 al 10% al año. En su gran mayoría los pacientes que se mantienen en situación de inmunoaclaramiento, o sufren una reactivación, con elevación de las concentraciones del ADN y de la ALT, permaneciendo con HBeAg negativo, presentan una mutación en la región precore del genoma del VHB que impide la síntesis de este antígeno, pero no impide la replicación viral. Esta combinación de parámetros analíticos debe hacer sospechar su existencia. Son muchos los factores que pueden influir en la velocidad de progresión a la cirrosis y al hepatocarcinoma (tabla 2). De todos ellos, el mantenimiento de valores elevados de ADN viral parece ser el más importante, y es un potente factor con valor predictivo para el desarrollo de hepatocarcinoma, independientemente de la positividad del HBeAg, de las concentraciones de transaminasas e incluso de la existencia o no de cirrosis 8,9.
Tratamiento terapéutico de los pacientes infectados por el VHB
Evaluación inicial
La evaluación inicial de los pacientes infectados por el VHB debe ir encaminada a investigar la fase en que se encuentra la infección y la coexistencia de otras posibles enfermedades víricas (virus de la hepatitis C [VHC], virus de la hepatitis D [VHD], virus de la inmunodeficiencia humana [VIH]), metabólicas, por consumo de tóxicos (principalmente etanol) o de naturaleza autoinmune, que pueden coexistir y estar contribuyendo al desarrollo de la enfermedad hepática. Debe también aprovecharse esta toma de contacto inicial para ofrecer al paciente información que le ayude a disminuir la transmisión de la infección, y debe aconsejarse el estudio de su entorno familiar más cercano. La determinación de los marcadores séricos del VHB, incluyendo concentraciones de ADN viral, de alfa-fetoproteína y la realización de una ecografía abdominal deben también realizarse de forma cotidiana. El paciente debe ser vacunado frente al virus de la hepatitis A (VHA) si no presenta anticuerpos que indiquen exposición previa a este virus, ya que se ha descrito un mayor número de complicaciones y mayor frecuencia de hepatitis aguda por VHA de curso fulminante en pacientes con enfermedad hepática crónica subyacente 10.
La decisión de realizar o no una biopsia hepática como parte del estudio de estos pacientes depende de numerosos factores. La biopsia hepática sigue siendo el método más fiable para conocer el grado de actividad necroinflamatoria y el de fibrosis hepática, aunque es una técnica molesta y no exenta de complicaciones. Para obviar su realización se viene investigando en los últimos años la fiabilidad de diversos métodos de imagen y distintos marcadores séricos desarrollados cómo posibles alternativas para medir el grado de fibrosis 11. Adicionalmente, la disponibilidad de técnicas que con sensibilidad y reproducibilidad altas permiten medir la replicación del VHB y el desarrollo de fármacos cada vez más eficaces en el control de esta infección han ido condicionando que en la práctica cada vez sea menor el número de biopsias hepáticas realizadas en estos pacientes.
Selección de pacientes candidatos a recibir tratamiento
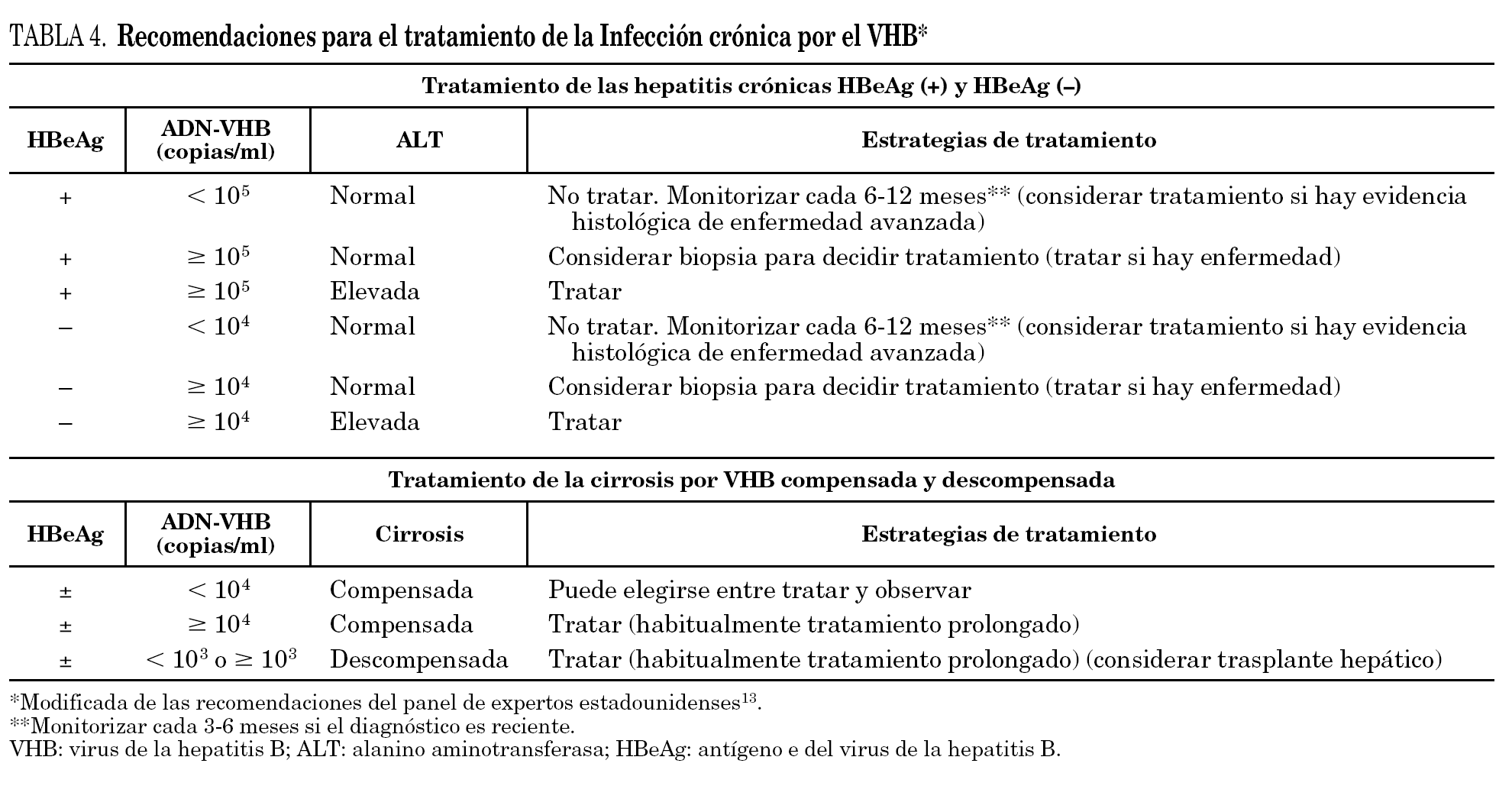
En el momento actual no hay un criterio uniforme acerca de qué pacientes deben recibir tratamiento. Las guías de tratamiento de la infección crónica por el VHB, emitidas por la AASLD 3,4, por la EASL 5 y por la Asian Pacific Association for the Study of the Liver (APASL) 12, con algunas diferencias entre ellas, basan la elección de los pacientes candidatos en la existencia de actividad de la enfermedad hepática, medida por: a) concentraciones elevadas de transaminasas, al menos dos veces por encima del límite superior de la normalidad, y b) positividad de los marcadores séricos que indican replicación viral activa del VHB (concentraciones elevadas de ADN y positividad del HBeAg). En la tabla 3 se recoge un resumen de estas recomendaciones que han sido recientemente cuestionadas por algunos grupos de expertos 13 basándose principalmente en 2 puntos: a) la observación de que muchos pacientes con concentraciones de ALT, que no alcanzan el valor de dos veces el límite superior de la normalidad, o que incluso muestran valores normales de ALT, pueden presentar enfermedad hepática significativa 14, y b) considerar que una concentración de ADN del VHB de 10 5 copias/ml, señalado en las guías como punto con el que tomar decisiones para tratar o no tratar, podría ser excesivamente alto, especialmente en los pacientes HBeAg negativo con mutación en la región precore. De hecho, muchos pacientes que se encuentran en esta situación y con concentraciones de ADN < 10 5 copias/ml tienen transaminasas elevadas y lesiones histológicas significativas en la biopsia hepática 15. Un resumen de estas propuestas alternativas de indicación de tratamiento elaboradas por el panel de expertos de EE.UU. se muestra en la tabla 4. Adicionalmente, en los últimos años se ha sugerido en amplios estudios, realizados mayoritariamente en Asia, donde la infección por VHB es muy prevalente, que el reducir de forma sostenida la replicación viral se traduce no sólo en una mejoría de la actividad necroinflamatoria hepática y en una reducción de la fibrosis, sino también en una mejoría de la supervivencia y en una reducción del riesgo de evolución a hepatocarcinoma 8,12. Estos resultados han llevado a muchos a promulgar la necesidad de ampliar la liberalización de las indicaciones del tratamiento recogidas en las guías oficiales de la AASLD, EASL y APASL. En esta línea de opinión se ha sugerido que con los datos disponibles actualmente estaría justificado tratar a todo paciente con HBsAg sin anti-HBs y con ADN del VHB detectable en suero 16. No obstante, y en espera de la confirmación de muchos de los datos recientemente comunicados, estas opiniones deben de ser interpretadas con cautela y, en todo caso, sin olvidar que la decisión de tratar o no a un paciente es un acto que debe ser tomado por el clínico en función no sólo de los datos disponibles, sino también atendiendo a las circunstancias personales de cada paciente 17.
Los pacientes que han logrado seroconvertir a anti-HBe y los que permaneciendo anti-HBe positivos mantienen bajas concentraciones de ADN viral, también deben ser monitorizados. En estos pacientes, la existencia de datos bioquímicos de inflamación (p. ej., elevación de ALT $ 2 el límite superior de la normalidad) podría justificar la realización de una biopsia para evaluar mejor el daño hepático que podríamos estar infravalorando, de cara a sopesar la conveniencia o no de instaurar tratamiento antiviral.
Objetivos del tratamiento
En último término el objetivo del tratamiento va encaminado a reducir de la tasa de progresión a la cirrosis y a reducir el desarrollo de sus complicaciones (insuficiencia hepatocelular, hipertensión portal y aparición de carcinoma hepatocelular). En la clínica diaria, sin embargo, nos vemos obligados a utilizar otros objetivos terapéuticos cuantificables a más corto plazo. Diversos estudios de seguimiento realizados en paciente que habían sido tratados han demostrado que la reducción de la replicación viral correlaciona con mejoría de la evolución clínica, bioquímica e histológica de la enfermedad 9,18-23. Por ello, los parámetros indicativos de replicación viral son los más utilizados como indicadores de respuesta satisfactoria al tratamiento. En los pacientes con HBeAg positivo la respuesta viene indicada por la seroconversión de HBeAg a anti-HBe y por la disminución o negativización de las concentraciones de ADN del VHB. En los pacientes con HBeAg negativo el mejor objetivo terapéutico lo constituye el lograr la indetectabilidad del ADN sérico del VHB 23. La normalización de las transaminasas, como marcador indirecto de la actividad necroinflamatoria hepática, suele lograrse paralelamente a la reducción del ADN viral y correlaciona, si se logra de forma sostenida, con mejoría en la biopsia hepática. La indetectabilidad del ADN no siempre se consigue y no está definido con precisión cuál es el dintel a partir del cual podemos considerar que la replicación viral está satisfactoriamente controlada. Algunos estudios han sugerido que mantener el ADN por debajo de 10 4 copias/ml podría ser el objetivo por cuanto este nivel se asocia a reducción en las concentraciones de transaminasas, mayor tendencia a seroconversión a anti-HBe y a un menor riesgo de desarrollo de resistencias 24. La pérdida del HBsAg con seroconversión a anti-HBs ocurre en pacientes sin tratamiento en menos del 0,5% de los pacientes al año, y cuando sucede suele verse con más frecuencia en mujeres que llevan muchos años de infección. En pacientes bajo tratamiento este cambio es más frecuente 25. Su observación no indica una erradicación auténtica de la infección: en hepatocitos puede seguir detectándose ADN circular cerrado covalente (ADNccc) del VHB, y se ha descrito la transmisión de la infección por VHB a partir de órganos procedentes de estos sujetos, así como también la existencia de reactivaciones tras recibir tratamiento quimioterápico o inmunosupresor 26,27. En el momento actual no hay evidencia de que pueda lograrse una auténtica erradicación de la infección por el VHB 28.
Fármacos disponibles actualmente
Hasta el presente la Food and Drug Administration (FDA) ha aprobado 5 fármacos para el tratamiento de la infección crónica por el VHB: interferón alfa-2b (1992), lamivudina (1998), adefovir dipovixil (2002), peginterferón alfa-2a (2005), y entecavir (2005), si bien el uso de interferón convencional ha ido siendo sustituido progresivamente por el de interferón pegilado. Otros fármacos aprobados para su utilización en la infección por el VIH-1, como el tenofovir y emtricitabina, tienen también actividad frente al VHB 29-32. Tanto el interferón como el resto, análogos de nucleósidos/nucleótidos, han sido propuestos como candidatos para ser utilizados en primera línea de tratamiento. Ambos tipos de fármacos han demostrado su eficacia pero tienen también limitaciones 25,32-35 (véanse las tablas 5 y 6).
El interferón pegilado se ha usado habitualmente en tratamientos de 48 semanas de duración, aunque es posible que en las hepatitis crónicas HBeAg positivo pudieran obtenerse similares resultados con tan sólo 24 semanas de tratamiento 35,37,38. En los tratamientos con este fármaco la existencia de altas concentraciones de ALT y tener una baja carga viral basal se han señalado como factores que predicen mayor tasa de respuesta. Otros factores de menor importancia son ser joven, de sexo femenino y que la infección sea debida a un genotipo viral A o B.
La duración óptima del tratamiento con análogos de nucleósidos/nucleótidos no ha sido bien establecida todavía, pero a menudo se necesitan tratamientos prolongados, de años de duración, para alcanzar una respuesta virológica sostenida, si es que ésta se consigue. Algunos estudios sugieren que para reducir el número de recidivas, el tratamiento debería mantenerse un mínimo de 6 meses tras lograr la seroconversión a anti-HBe 4,13,14. En los pacientes con hepatitis crónica HBeAg negativo el mantenimiento de la respuesta virológica es aún más problemático, y muestra una alta incidencia de recidivas incluso tras llevar varios años con ADN del VHB indetectable en suero 36,39. El poseer una concentración basal elevada de ALT es el factor que más potentemente se asocia para estos fármacos con la predicción de seroconversión a anti-HBe. La relación con las concentraciones de ADN es menos consistente, aunque en algún estudio se ha señalado que la respuesta podía ser peor en los más virémicos, como también podría ser más elevada en ellos la probabilidad del desarrollo de resistencias. No se ha demostrado que el genotipo del VHB sea un factor con valor predictivo de respuesta para el tratamiento con estos fármacos.
El desarrollo de resistencias durante el tratamiento con análogos de nucleósidos/nucleótidos es bastante frecuente. Aunque las mutaciones asociadas a mayor o menor grado de resistencia pueden ser estudiadas analizando el genoma viral, en la práctica clínica se admite que han aparecido al comprobarse una elevación de al menos una unidad log10 del ADN viral tras haberse conseguido el nadir durante el tratamiento. El desarrollo de resistencia se acompaña de pérdida de la acción antiviral, y se asocia con mayor frecuencia de brotes de actividad hepatolítica y en ocasiones de descompensación de la enfermedad hepática 40,41.
Con lamivudina, fármaco bien tolerado en la dosis de 100 mg al día, la mutación más frecuente y de mayor relevancia clínica (mutación YMDD), aparece en un 14-32% de los pacientes al año y la presenta hasta el 69% de los pacientes a los 5 años. Cuando esta mutación aparece puede utilizarse adefovir, que es activo en presencia de la mutación YMDD, o bien entecavir. El adefovir dipovixil es un análogo de nucleótido, profármaco del adefovir. Es bien tolerado y aunque se ha descrito riesgo de nefrotoxicidad, especialmente en pacientes cirróticos y trasplantados, esta es mínima con la dosis habitual de 10 mg/día. El 2% de pacientes desarrollan resistencia a los 2 años, el 8,5% de resistencia a los 3 años y hasta el 15-20% a los cuatro 36,38. Las mutaciones más frecuentes son la N236T y la A181V, y ambas son sensibles a la lamivudina, aunque a medida que discurre el tiempo se van describiendo otras nuevas como la M204A. Entecavir es un análogo del nucleósido desoxiguanidina que actúa inhibiendo la ADN-polimerasa del VHB. Este fármaco tiene una marcada acción antiviral frente al VHB (tabla 5), un buen perfil de seguridad, al menos en estudios realizados a medio plazo, y una alta barrera genética para el desarrollo de resistencias, aunque estos dos últimos aspectos deberán ser confirmados en estudios con mantenimiento de esta terapia a más largo plazo. En dos extensos estudios, recientemente publicados, en los que se evaluó el tratamiento con entecavir frente a lamivudina en pacientes con hepatitis crónica con HBeAg positivo 33 y negativo 34, los pacientes que recibieron entecavir mostraron una mayor tasa de mejoría histológica, mayor descenso en la concentración del ADN del VHB basal y mayor tendencia a la normalización de las transaminasas (tabla 7). Un punto interesante en relación con este fármaco es que las resistencias a entecavir han sido descritas, hasta la fecha, solamente en pacientes con resistencias previas a lamivudina 42, situación en la que además sigue siendo eficaz en parte. Recientemente se ha comunicado también (Estudio ETV-022) que el tratamiento prolongado a 96 semanas con entecavir continúa incrementando el número de sujetos que logran la indetectabilidad del ADN del VHB y la normalización de las transaminasas.
¿Qué fármacos y en qué orden debemos utilizarlos?
Hasta el presente no pueden hacerse recomendaciones globales en este sentido para el tratamiento de la hepatitis crónica por VHB. Probablemente la mejor aproximación a esta pregunta sea que para cada paciente debe realizarse una selección individual del fármaco o combinaciones de ellos, atendiendo a las peculiaridades de cada caso y a la disponibilidad y coste de cada uno de estos recursos. En líneas generales, debería intentarse conseguir una mayor duración de la respuesta virológica con una menor duración del tratamiento minimizando a la vez los efectos indeseados y el coste económico del mismo. Adicionalmente, debería elegirse un fármaco con el que si se desarrollaran resistencias pudiéramos tener cubierta la posibilidad de utilizar otro fármaco como terapia de rescate. Así, se ha especulado que el uso de interferón pegilado podría ser una buena alternativa en pacientes con HBeAg positivo, con concentraciones de ADN medias-bajas, y con transaminasas moderadamente elevadas, más aún si esta situación se da en pacientes jóvenes, y si el genotipo viral, de estar disponible es el A o el B 28. Este fármaco, por su mayor tendencia a lograr una respuesta virológica, a una mayor seroconversión a anti-HBs y por no producir resistencia al tratamiento podría ser el más indicado en pacientes jóvenes con unas largas expectativas de vida y de duración de la infección. El fracaso de un tratamiento con interferón pegilado en estas circunstancias en nada limita el uso posterior de los otros fármacos. Los pacientes con concentraciones elevadas de ADN circulante, en función al menos de los estudios realizados con lamivudina y entecavir, en los que se sugiere que la eficacia parece depender poco de las concentraciones elevadas del ADN, probablemente serían candidatos más adecuados, en términos de tolerancia y coste/beneficio, para recibir tratamiento con análogos de nucleósidos/nucleótidos 43,44. También, estos fármacos son los de elección en los pacientes con cirrosis hepática descompensada, particularmente en aquellos candidatos a recibir, o que ya han recibido, un trasplante hepático 45 y también en los pacientes en los que está previsto iniciar un tratamiento quimioterápico 6. Quizás el problema del desarrollo de resistencias al tratamiento, como ha ocurrido con el VIH, pueda mejorar con el uso de varios fármacos a la vez, especialmente si van dirigidos a distintas dianas terapéuticas 25,35,46.
Hepatitis crónica por VHB en situaciones especiales
Existen una serie de situaciones en las que la historia natural y el tratamiento de la infección crónica por el VHB merecen una consideración especial. Estas situaciones se dan fundamentalmente en la coinfección con otros virus (VHC, VHD y VIH), en el paciente con trasplante hepático y en las reactivaciones que la hepatitis o la infección oculta por el VHB pueden sufrir en el paciente oncológico que recibe quimioterapia.
Coinfección por VHB y VIH
La coinfección con el VIH es particularmente frecuente, puesto que ambos virus comparten similares vías de transmisión. Más del 80% de los pacientes infectados por el VIH tienen positividad de marcadores serológicos del VHB que expresan infección pasada por este virus y alrededor del 8 al 10% están coinfectados por ambos 47,48. Los pacientes infectados por el VIH que se infectan por VHB tienen mayor tendencia a cronificar esta infección, mantienen concentraciones más elevadas de ADN viral y menor tasa de seroconversión a anti-HBe. No hay evidencias de que la infección por el VHB acelere el curso de la infección por el VIH ni de que el VHB altere la respuesta a los tratamientos antirretrovirales de alta potencia (HAART). Sin embargo, estos tratamientos pueden inducir mayor número de episodios de hepatotoxicidad y con cierta frecuencia pueden observarse tras su inicio reactivaciones de la infección B dentro del llamado síndrome de reconstitución inmune. Por el contrario, la infección por el VIH influye sobre la historia natural de la infección por el VHB, produciendo un mayor desarrollo de fibrosis y una más rápida evolución a cirrosis y a la aparición de sus complicaciones 49. Esta peor evolución podría ser la responsable de la mayor mortalidad de causa hepática que se ha observado en algunas series que han analizado cuál es la evolución de los pacientes coinfectados por ambos virus 50.
En el momento actual, aunque se hayan elaborado algunas guías terapéuticas 47 no está bien establecido cuál es el tratamiento ideal de estos pacientes, y una vez más éste deberá individualizarse en función de varios factores como que el paciente reciba HAART o no lo precise todavía. En sujetos con menos de 500 CD4+ cél./ml, la mejor opción es iniciar HAART, si es que no lo venía recibiendo, y jugar con el hecho de que varios fármacos (lamivudina, emtricitabina y tenofovir disoproxil) ejercen acción antiviral frente a ambos virus. Esto, que en principio es un dato positivo, puede ser responsable, sin embargo, de exacerbaciones bruscas de la replicación del VHB cuando alguno de ellos es retirado del HAART y se ha descrito resistencias cruzadas para ambos virus. En consecuencia, estos fármacos de acción dual no deberían ser utilizados de forma aislada en monoterapia para tratar la infección por el VHB, porque pueden seleccionar resistencia que dificulte el tratamiento de la infección por el VIH, sino que deben utilizarse formando parte de un régimen de HAART 48. De entre ellos, el adefovir en dosis de 10 mg al día, parece no ejercer presión importante sobre la transcriptasa inversa del VIH, lo que lo convierte en un fármaco relativamente seguro si se usa como monoterapia en estos pacientes, y esta posibilidad está de hecho recogida en algunas guías terapéuticas 47. Aunque lamivudina y emtricitabina seleccionan con facilidad resistencias para el VHB, su asociación, aprobada para el tratamiento de la infección por VIH, consigue una potente y sostenida actividad frente al VHB. Esta combinación, dentro de un régimen de HAART, es probablemente una de las terapias de elección en la actualidad para el tratamiento de la coinfección por VHB y VIH 47. De forma similar, el uso de tenofovir, dentro de un régimen que contenga otro fármaco que actúe frente al VHB, como lamivudina o la entricitabina, es también una posibilidad que hay que considerar. El tenofovir tiene acción frente a ambos virus, incluso en presencia de mutaciones que confieren resistencia a la lamivudina y parece tener una elevada barrera genética para el desarrollo de resistencias frente al VHB 29,32. Otras posibilidades que hay que tener en cuenta se basan en el uso de fármacos con actividad exclusivamente frente al VHB para ser administrados paralelamente al HAART, como son el entecavir y en un futuro otros como la telbivudina, que se encuentra en avanzado estado de desarrollo. Datos preliminares sugieren que con la administración de este último asociado a lamivudina puede conseguirse una potente inhibición de la replicación del VHB.
En pacientes con más de 500 CD4+ cél./ml, que no estén recibiendo HAART, pueden usarse cualquiera de los fármacos que poseen actividad exclusivamente frente al VHB, incluyendo el interferón pegilado, siempre que no haya contraindicaciones para su uso (p. ej., cirrosis muy evolucionada). La información disponible sobre el uso de interferón pegilado en pacientes coinfectados por el VHB es muy escasa, pero extrapolaciones de su uso en pacientes coinfectados por el VHC permiten suponer que la tolerancia sea aceptable. En relación con la delimitación de los pacientes que puedan beneficiarse de su uso, podrían utilizarse los mismos criterios que en los monoinfectados por el VHB a la espera de más información.
Algo que no debiera olvidarse es que la infección por el VHB es una enfermedad prevenible. La mejor y más rentable manera de reducir el impacto de la infección por el VHB en los pacientes con infección por VIH sería evitarla. Por ello, las diferentes guías de actuación y conferencias de consenso recogen la indicación de investigar en todo paciente infectado por el VIH la existencia de marcadores de exposición previa al VHB, con el fin de identificar a los que sean susceptibles de vacunación. La vacuna de la hepatitis B es segura en estos pacientes pero su eficacia es menor a medida que aumenta la inmunosupresión, por lo que debería administrarse lo más precozmente posible.
Coinfección por VHB y VHC
Por la misma razón, el compartir algunas de sus vías de transmisión, la coinfección por estos virus no es infrecuente, y puede alcanzar en países occidentales al 10-30% de los pacientes infectados por el VHB. Ambos virus interactúan entre sí de modo que el VHC disminuye al replicación del VHB (los pacientes coinfectados presentan menor concentración de ADN circulante del VHB y tienen mayor tendencia a la seroconversión a anti-HBe) y también lo contrario (las concentraciones de ARN del VHC son más bajas y la frecuencia de aclaramiento de la infección por VHC es más alta que en los monoinfectados). Pese a ello, la coinfección por ambos virus se asocia con un mayor riesgo de hepatitis aguda fulminante, una más rápida progresión de la enfermedad hepática y a un mayor riesgo de carcinoma hepatocelular. Aunque existen guías de tratamiento para las infecciones crónicas por virus B y C de la hepatitis, no se han establecido unas normas claras de actuación en el caso de la coinfección, y las series publicadas de tratamiento en esta circunstancia incluyen a un número muy escaso de pacientes. Debe tenerse presente que un tratamiento con éxito sobre uno de los dos virus puede producir reactivación del otro como consecuencia de la desaparición del efecto inhibidor de la coinfección. Un tratamiento estándar con interferón pegilado y ribavirina podría, por el primero de los fármacos, cubrir ambos virus 25, y la adición de lamivudina podría ayudar a frenar la replicación del VHB si ésta se mantiene activa. No hay datos publicados con el uso de otros antivirales como el entecavir de más reciente aprobación.
Reactivación de la infección por el VHB durante tratamientos oncológicos
La reactivación de la infección por el VHB al recibir tratamiento quimioterápico fue inicialmente descrita en el tratamiento de linfomas y otras enfermedades hematológicas y posteriormente se ha descrito también en pacientes que reciben tratamiento para tumores sólidos. La frecuencia con la que ocurre ese suceso depende, por un lado, de la prevalencia de la infección por el VHB en esa zona y, por otro, de la intensidad de la quimioterapia utilizada.
Inicialmente fue comunicada en pacientes con HBsAg positivo. Estudios posteriores han extendido la posibilidad de observar este fenómeno a pacientes con infección oculta por el VHB, generalmente con positividad aislada del anti-HBc como único marcador de contacto previo con este virus, e incluso en individuos con positividad de anti-HBs. La reactivación de la infección por el VHB debe ser diagnosticada en el paciente que recibiendo quimioterapia o poco después de ella, presenta elevación de las concentraciones de ADN viral 10 veces por encima de los basales o alcanza 9 log10. Habitualmente esta elevación se acompaña de aumento de la concentración de transaminasas y clínicamente puede expresarse como una hepatitis aguda con una tasa de mortalidad no despreciable (5-40%). Además, su aparición puede suponer el cese precoz de la quimioterapia, lo que puede traducirse en una menor eficacia de ésta, particularmente en los cánceres de mama y en los linfomas no hodgkinianos. El pronóstico de las reactivaciones es peor en los sujetos con enfermedad hepática avanzada, por lo que la vigilancia y las medidas preventivas deben extremarse en el caso de que el paciente padezca una cirrosis documentada mediante biopsia o sospechada por datos clínicos y analíticos. La aparición de una reactivación de la infección por el VHB es más frecuente cuando el paciente parte de concentraciones basales de ADN del VHB elevadas y con el uso de algunos quimioterápicos como corticoides, antraciclinas y los anticuerpos monoclonales B o T 6. Este daño hepático, que aparece después de que se reactive la replicación viral B, puede ser evitado si se monitoriza la replicación viral y se administra al paciente terapia frente al VHB. La mayoría de los estudios realizados al respecto se basan, por razones históricas, en la utilización de lamivudina aunque el abanico de fármacos que podríamos utilizar actualmente es más amplio, incluyendo adefovir y entacavir. Esta forma de actuación se ha mostrado eficaz en pacientes de alto riesgo de recidiva definidos.
Nuevos fármacos y dianas terapéuticas para el VHB
Pese a los avances conseguidos en los últimos años con el desarrollo de nuevos antivirales para tratar la infección por el VHB está claro que queda aún mucho camino que recorrer en el control de esta infección. Diversas estrategias y dianas terapéuticas están siendo exploradas para intentar conseguir fármacos más eficaces y seguros para el control de esta enfermedad. La telbivudina (Idenix), clevudina (Gilead Sciences), pradefovir (Valeant Pharm.), elbucitavitabina (Achillo Pharm.), valtorcitabina (Idenix), MCC 478 (Eli Lily), MIV 210 (Medivir), hepavir B (Ribaphar), andoxovir (Triangle Pharm.) y racivir (Pharmasset) son nuevos análogos de nucleósidos que se encuentran en distintas fases de desarrollo. El zadaxin (SciClone), teradigm (Epimmune), HE2000 (Hollis-Eden), y vacunas terapéuticas (PowderJect) son fármacos inmunoestimulantes que también se están evaluando como posibles alternativas o complementos en el tratamiento de la infección crónica por el VHB. Es de esperar que el desarrollo de éstos y otros nuevos fármacos y la investigación de terapias de combinación, deparen en el futuro cambios sustanciales en la potencia del tratamiento antiviral B, en un mejor control de la replicación viral y en último término en la disminución de las complicaciones últimas de la enfermedad como son la cirrosis hepática y el carcinoma hepatocelular.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
Correspondencia: Dr. A. Sánchez-Quijano.
Departamento de Medicina Interna.
Hospital Universitario Virgen del Rocío.
Avda. Manuel Siurot, s/n. 41013 Sevilla. España.
Correo electrónico: aquijano@cica.es
Manuscrito recibido el 21-4-2006; aceptado el 22-5-2006.