Las determinaciones microbiológicas de la carga viral de los virus de la inmunodeficiencia humana tipo 1 (VIH-1), de la hepatitis C (VHC) y de la hepatitis B (VHB) son fundamentales para el seguimiento y control de los pacientes infectados por estos virus. Los laboratorios de microbiología disponen de herramientas que garantizan la fiabilidad de sus resultados, entre ellas se encuentran los programas de intercomparación externos, como el Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). En el presente artículo se muestra el análisis de resultados del Programa de Control de Calidad SEIMC de carga viral de estos virus y el genotipado del VHC realizado durante el año 2018.
Métodos y resultadosEn el control de VIH-1 se remitieron 5 estándares, de los que uno (plasma humano seronegativo) no contenía el virus, y los otros 4 consistían en plasma de 3 pacientes virémicos distintos en un intervalo de concentraciones entre 2-5 log10 copias/ml. Una parte significativa de los laboratorios participantes obtuvo de uno a varios resultados fuera de los límites aceptables (media±0,25 log10 copias/ml), dependiendo del estándar y del método empleado, en promedio el 26% de los centros. La repetibilidad fue buena, y la mayoría de los laboratorios obtuvieron resultados aceptables (D<0,5 log10 copias/ml). En los controles de VHC y VHB se remitieron 2 estándares con diferente contenido del virus. La mayor parte de los participantes, un 87% en el caso del VHC y un 88% en el del VHB, obtuvo ambos resultados dentro de los límites de la media±1,96 DE log10 UI/ml.
ConclusionesLos resultados obtenidos ponen de manifiesto la utilidad de los controles externos para asegurar la calidad de los resultados analíticos. Debido a la variabilidad interlaboratorio, es aconsejable utilizar un mismo método y el mismo laboratorio en el seguimiento de los pacientes.
Human immunodeficiency virus type 1 (HIV-1) and hepatitis B (HBV) and C virus (HCV) viral load determinations are among the most relevant markers for the follow-up of patients infected with these viruses. External quality control tools are crucial to ensure the accuracy of the results obtained by microbiology laboratories. This article summarised the results obtained from the 2018 SEIMC External Quality Control Programme for HIV-1, HCV, and HBV viral loads and HCV genotyping.
Methods and resultsIn the HIV-1 program, a total of five standards were sent. One standard consisted of seronegative human plasma, while the remaining four contained plasma from three different viremic patients, in the range of 2-5 log10 copies/mL; two of these standards were identical, with the aim of determining repeatability. A significant proportion of the laboratories (28% on average) obtained values outside the accepted range (mean±0.25 log10 copies/mL), depending on the standard and on the method used for quantification. Repeatability was good, with most laboratories reporting results within the limits (D<0.5 log10 copies/mL). The HBV and HCV programme consisted of two standards with different viral load contents. Most of the participants, 87% in the case of HCV and 88% in the HBV, obtained all the results within the accepted range (mean±1.96 SD log10 UI/mL).
ConclusionsData from this analysis reinforce the utility of proficiency programmes to ensure the quality of the results obtained by a particular laboratory. Due to the marked interlaboratory variability, it is advisable to use the same method and the same laboratory for patient follow-up.
La determinación de carga viral del virus de la inmunodeficiencia humana tipo 1 (VIH-1), del virus de la hepatitis B (VHB) y del virus de la hepatitis C (VHC) constituye una de las funciones primordiales del laboratorio de microbiología molecular. Para su realización, los laboratorios suelen emplear sistemas comerciales, pero su eficacia diagnóstica es difícil de evaluar con la sola experiencia de cada centro. El Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) dispone de controles externos de carga viral de los virus VIH-1, VHC (incluye genotipado) y VHB. Estos son de participación anónima y voluntaria, y están a disposición de los profesionales que desarrollan su actividad en el laboratorio e, indirectamente, a los clínicos que atienden a los pacientes infectados por esos virus.
En este artículo se resumen las principales conclusiones y enseñanzas derivadas del análisis conjunto de los resultados remitidos por los participantes en la edición del año 2018.
2Control de calidad del VIH-12.1Características del material remitidoEn el envío correspondiente al año 2018 se remitieron 5 estándares de plasma congelado denominados VIH-1/18, VIH-2/18, VIH-3/18, VIH-4/18 y VIH-5/18. Estos se habían analizado y valorado para el contenido en ARN del VIH-1. Cuatro de ellos contenían cantidades conocidas de ARN y se obtuvieron de plasma procedente de distintos pacientes virémicos (VIH-1/18 al VIH-4/18), buscando contenidos teóricos dentro de un intervalo de 2 a 4 unidades logarítmicas. Los estándares VIH-3/18 y VIH-4/18 eran idénticos, lo que permitió analizar la repetibilidad de los resultados intralaboratorio (repetitividad de resultados en un mismo momento y bajo las mismas condiciones). El estándar VIH-5/18 se preparó con plasma de un paciente seronegativo. Las muestras se analizaron antes de emplearse mediante diferentes técnicas, confirmando así los valores teóricos.
Una vez preparados los estándares, se mantuvieron congelados a –80°C hasta su envío a los participantes, que se realizó con nieve carbónica y asegurando entregas en menos de 24 horas.
2.2Criterios de evaluaciónPara demostrar la especificidad de las determinaciones se contaba con el estándar VIH-5/18 como control negativo. En este caso, se consideraron válidos los resultados que se informaron por debajo del límite de detección de la técnica utilizada, por lo que cualquier cuantificación se correspondería con un resultado falso positivo. En todos los casos, se eliminaron los valores extremos y aberrantes para el cálculo de la media1. El criterio de aceptación se fijó en la media de resultados informados en cada estándar mediante cada uno de los métodos±0,25 log102–8. Para los estándares VIH-3/18 y VIH-4/18 (plasmas idénticos), se tomó como medida central la media de los valores obtenidos en ambos por todos los participantes que utilizaban un mismo método, además, también se emplearon para evaluar la repetibilidad de los resultados. En este caso se calculó el diferencial (D) entre ambos valores expresados en unidades logarítmicas. Se consideró aceptable cuando D<0,5 log10 copias/ml, valor que tiene en cuenta tanto la variabilidad técnica2–8 como la biológica y que, en la práctica, es el que se utiliza en el seguimiento de los pacientes para considerar que se ha producido un cambio significativo de la carga viral con fines pronósticos, o para el control de la eficacia del tratamiento.
2.3Resultados del control del VIH-1Se envió el material de control a 106 participantes, de los que 102 remitieron respuesta (96,2%). El método informado por la mayoría de los participantes (52%) fue la reacción en cadena de la polimerasa en tiempo real (PCR-RT) realizada con los equipos y reactivos TaqManÒ de Roche (sin contabilizar plataforma Cobas 6800), la PCR-RT mediante la plataforma Cobas 6800 de Roche se informó por el 28,4%, le siguieron en frecuencia la PCR-RT de Abbott que la empleó el 6,9% y la k-PCR de Versant (Siemens) por el 4,9%. Del resto de los participantes 3 de ellos (2,9%) informaron la PCR-RT de Veris (Beckman Coulter), 2 la PCR-RT de GeneXpert de Cepheid (2,0%), 1 la PCR-RT de Qiagen Diagnostics (0,9%), 1 la Nuclisens (bioMerieux) y 1 una PCR-RT de desarrollo propio (in house).
En la tabla 1 se resumen los resultados obtenidos con los 4 métodos comerciales más empleados. Desde el punto de vista de la especificidad, los resultados fueron muy buenos, y no se detectaron valores cuantificables en el estándar negativo (VIH-5/18). En cuanto a la variabilidad de los resultados, no hay mucha diferencia entre los diferentes estándares remitidos, por lo que no se comenta el número de valores fuera de intervalo por estándar. Asimismo, de la tabla 1 se puede deducir la existencia de una variabilidad intermétodo, que se confirma cuando se analizan los resultados individuales de los participantes (no se muestran), de modo que los valores obtenidos con el mismo estándar utilizando 2 métodos distintos no son siempre comparables. Estos resultados, en su conjunto, son similares a los obtenidos en el Programa de Control de Calidad SEIMC de otros años3–8.
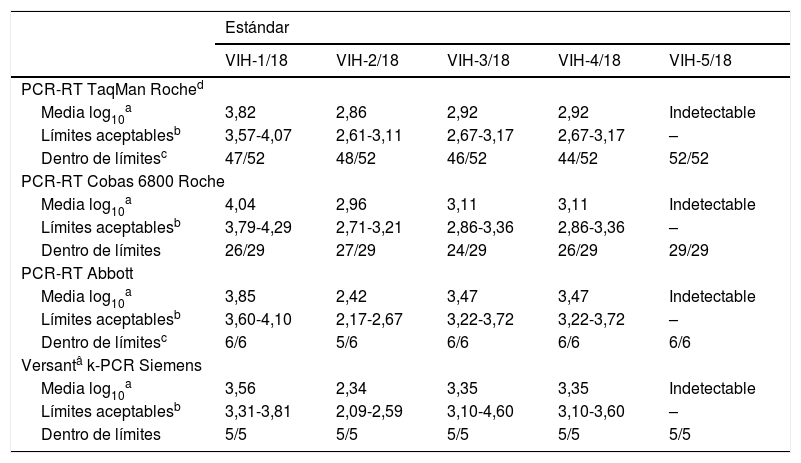
Control del virus de la inmunodeficiencia humana 1 (VIH-1): análisis de los resultados dentro de límites según el método comercial utilizado
| Estándar | |||||
|---|---|---|---|---|---|
| VIH-1/18 | VIH-2/18 | VIH-3/18 | VIH-4/18 | VIH-5/18 | |
| PCR-RT TaqMan Roched | |||||
| Media log10a | 3,82 | 2,86 | 2,92 | 2,92 | Indetectable |
| Límites aceptablesb | 3,57-4,07 | 2,61-3,11 | 2,67-3,17 | 2,67-3,17 | – |
| Dentro de límitesc | 47/52 | 48/52 | 46/52 | 44/52 | 52/52 |
| PCR-RT Cobas 6800 Roche | |||||
| Media log10a | 4,04 | 2,96 | 3,11 | 3,11 | Indetectable |
| Límites aceptablesb | 3,79-4,29 | 2,71-3,21 | 2,86-3,36 | 2,86-3,36 | – |
| Dentro de límites | 26/29 | 27/29 | 24/29 | 26/29 | 29/29 |
| PCR-RT Abbott | |||||
| Media log10a | 3,85 | 2,42 | 3,47 | 3,47 | Indetectable |
| Límites aceptablesb | 3,60-4,10 | 2,17-2,67 | 3,22-3,72 | 3,22-3,72 | – |
| Dentro de límitesc | 6/6 | 5/6 | 6/6 | 6/6 | 6/6 |
| Versantâ k-PCR Siemens | |||||
| Media log10a | 3,56 | 2,34 | 3,35 | 3,35 | Indetectable |
| Límites aceptablesb | 3,31-3,81 | 2,09-2,59 | 3,10-4,60 | 3,10-3,60 | – |
| Dentro de límites | 5/5 | 5/5 | 5/5 | 5/5 | 5/5 |
PCR-RT: reacción en cadena de la polimerasa en tiempo real.
En cuanto a los métodos de PCR-RT, los comercializados por Roche se desglosan en 2 grupos, por un lado, los que emplean la plataforma Cobas 6800 (n=29) y, por otro, el resto de equipos y reactivos TaqMan Roche (n=53, aunque un centro no realizó ninguna de las determinaciones). Con la plataforma Cobas 6800 se obtiene un 8,9% de resultados fuera del límite de aceptación, con el resto de reactivos y equipos TaqMan (Roche) el 8,8%, con los de Abbott el 3,3% y con Siemens ninguno; aunque hay que tomar estos 2 últimos datos con mucha cautela, pues el número de participantes que utilizaron estos métodos es muy bajo (6 y 5, dependiendo de la técnica).
Respecto a todos los centros que informan, Veris (Beckman Coulter), GeneXpert (Cepheid) y Qiagen (6 en total), cabe destacar que con ninguno de ellos se detecta carga viral en los estándares VIH-3/18 y 4/18 (mismo estándar), aportando así resultados falsamente negativos.
En cuanto a los resultados del estudio de repetibilidad, la mayoría de los centros superaron esta prueba sin problema. En 2 de las ocasiones no se pudo valorar porque no se realizó la determinación de carga viral en los estándares implicados, y en 6 por informarse carga viral indetectable. Por lo que respecta al resto de centros, todos superan el ensayo de repetibilidad (100%), obteniendo resultados reproducibles (D<0,5 log10).
2.4Comentarios y conclusiones al control del VIH-1En términos generales, los resultados que aquí se presentan dan una idea de la variabilidad que se puede obtener en el laboratorio en la práctica diaria y con una prueba de importante trascendencia como es la carga viral del VIH-1. Cuando se observa la variabilidad intermétodo (incluso eliminando los resultados extremos y aberrantes), esta se aproxima, y en ocasiones supera, a las 0,5 unidades logarítmicas; valor límite que se usa en clínica para establecer un cambio significativo de carga viral, lo que refuerza la conveniencia de no cambiar de laboratorio en el seguimiento habitual de los pacientes.
Es importante señalar que el método más usado por los participantes es la PCR-RT comercializada por Roche, y que el número de participantes que emplea la plataforma de PCR-RT Cobas 6800 (Roche) es suficiente para poder extraer conclusiones de forma independiente. Debido a un mayor empleo de los equipos y reactivos de Roche, los datos analizados tienen una mayor significación estadística respecto al resto de técnicas empleadas.
El porcentaje de valores que se sitúa fuera del intervalo de aceptación de±0,25 log10 copias/ml alrededor de la media para cada técnica no fue especialmente alto, como máximo del 9% en el caso de los reactivos más empleados (Roche).
Cuando se analiza la especificidad, los datos son buenos, ya que no se detectaron resultados falsamente positivos.
Se detectan resultados falsamente negativos, agrupados en 3 técnicas que son informadas por muy pocos participantes, situación que impide valorar la prueba de repetibilidad.
Como es habitual en este tipo de control, se introdujeron 2 muestras idénticas para evaluar la repetibilidad de los resultados de un determinado laboratorio. Los datos obtenidos son muy buenos, ya que, tras eliminar los que no responden y los que obtienen resultados falsamente negativos, se alcanzó en el 100% de los centros.
A modo de resumen, estos resultados pueden considerarse aceptables y coherentes con lo esperado, aunque se detectan desviaciones que muestran la posibilidad de obtener resultados erróneos en cualquier laboratorio. De ahí la necesidad de introducir acciones de control interno y externo que minimicen la aparición de dichos errores; entre ellas la participación en ejercicios de intercomparación externos2–11 como los representados por el Programa de Control de Calidad Externo SEIMC.
3Control de calidad del VHC3.1Características del material remitidoEn el control de carga viral de VHC se remitieron 2 estándares de plasma congelado (VHC-1/18 y VHC-2/18) que se obtuvieron de 2 pacientes virémicos para el VHC, buscando unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron congeladas a una temperatura de –80°C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24h. Ambos estándares, previamente a su envío, se habían analizado por dos laboratorios expertos diferentes, confirmándose los valores teóricos aproximados. También se solicitó la realización del genotipado del VHC en el estándar VHC-1/18 a todos los participantes que dispusieran de dicha técnica en su cartera de servicios. En esta ocasión, el valor asignado de esta última determinación fue genotipo 1a, y se obtuvo mediante PCR-RT de Abbott. De este modo, se consideraron respuestas válidas todas las coincidentes con el genotipo 1a.
3.2Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml) y los resultados individuales obtenidos por cada participante se compararon respecto al intervalo de confianza (IC) del 95% (media±1,96 DE —desviación estándar—) de todos los que utilizaron su mismo método comercial12,13. Al igual que en el resto de controles de carga viral, para el cálculo de la media y de la DE se excluyeron los valores extremos y aberrantes1.
3.3Resultados del control del VHCEn este control se remitieron muestras a 105 laboratorios, de los que respondieron 100, por lo que el porcentaje de participación en la determinación de la carga viral fue del 95,2%. De ellos, 75 realizaron también el genotipado del VHC, lo que supuso el 71,4% del total de participantes que contestaron al control.
La técnica utilizada mayoritariamente para la realización de la carga viral fue la amplificación por PCR-RT, especialmente con el sistema comercial TaqManÒ de Roche, y los centros que emplean la plataforma Cobas 6800 son 30 (30,0%), y 50 (50,0%) el resto de equipos y reactivos TaqMan de Roche. Diez participantes (10%) utilizaron la PCR-RT de Abbott, 3 la PCR-RT Veris de Beckman Coulter (3%), 3 la k-PCR Versant de Siemens (3%), 2 la PCR-RT GeneXpert de Cepheid (2%), 1 la PCR-RT de Qiagen Diagnostics (1%), 1 una PCR-RT de desarrollo propio (1%).
La tabla 2 resume los datos para el total de participantes. La variabilidad fue similar en ambos estándares, aunque ligeramente superior con el estándar de baja carga viral (VHC-2/18). Cuando se comparan todos los resultados informados, independientemente de la técnica empleada, el 93% se encuentra dentro del intervalo de aceptación. De forma general, una vez eliminados los valores aberrantes, los resultados obtenidos se consideraron buenos, aunque se informó 1 resultado falsamente negativo con el estándar de baja carga.
La tabla 3 resume los resultados de cada una de las técnicas comparados con la media de los que usan su mismo método; no se muestran los resultados de las técnicas empleadas por un bajo número de participantes, ya que deben tomarse con prudencia. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (IC del 95% de la media de los participantes por cada técnica), destacando que, debido a que la técnica de PCR-RT TaqMan® de Roche fue la más que más ampliamente se utilizó, las conclusiones que de ella se derivan son las más consistentes. Con los equipos de Roche (excluida la plataforma Cobas 6800), se obtuvieron 96 resultados (2 participantes no informan ningún resultado), de ellos 8 (8,3%) quedaron fuera del intervalo de aceptación (5 se corresponden con el estándar VHC-1/18 y 3 con el VHC-2/18). Los centros que presentaron ambos estándares fuera de los límites de aceptación fueron 2. Cabe destacar que, en la gran mayoría de las ocasiones, se obtienen resultados dentro del intervalo aceptable.
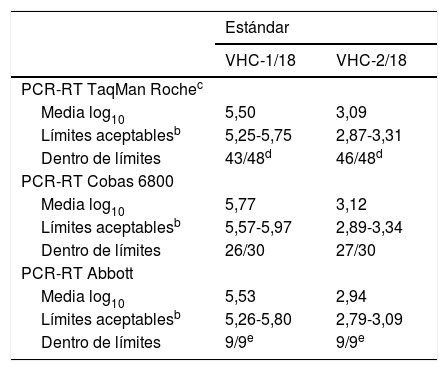
Control del virus de la hepatitis C (VHC): análisis de los resultados dentro de límites según el método comercial utilizadoa
| Estándar | ||
|---|---|---|
| VHC-1/18 | VHC-2/18 | |
| PCR-RT TaqMan Rochec | ||
| Media log10 | 5,50 | 3,09 |
| Límites aceptablesb | 5,25-5,75 | 2,87-3,31 |
| Dentro de límites | 43/48d | 46/48d |
| PCR-RT Cobas 6800 | ||
| Media log10 | 5,77 | 3,12 |
| Límites aceptablesb | 5,57-5,97 | 2,89-3,34 |
| Dentro de límites | 26/30 | 27/30 |
| PCR-RT Abbott | ||
| Media log10 | 5,53 | 2,94 |
| Límites aceptablesb | 5,26-5,80 | 2,79-3,09 |
| Dentro de límites | 9/9e | 9/9e |
PCR-RT: reacción en cadena de la polimerasa en tiempo real.
Respecto a la plataforma de PCR-RT Cobas 6800, que emplearon 30 centros, hay que destacar que 7 de los 60 valores informados se encontraban fuera del intervalo de aceptación, de ellos 4 se correspondían con el estándar VHC-1/18 y los 3 restantes con el VHC-2/18. Por último, 2 centros presentaron ambos estándares fuera de intervalo de aceptación.
En cuanto al sistema PCR-RT de Abbott, se informó por 9 centros, ya que 1 no realizó las determinaciones solicitadas. De los 18 valores informados, todos estaban dentro del intervalo de aceptación (100,0%).
No se comentan los datos del resto de métodos empleados porque fueron usados por muy pocos centros.
Aunque no es posible hacer un análisis estadístico de correlación de valores, las medias obtenidas con las PCR-RT TaqMan de Roche y la de Abbott fueron bastante homogéneas y, en conjunto, se podría decir que los métodos son razonablemente comparables entre sí.
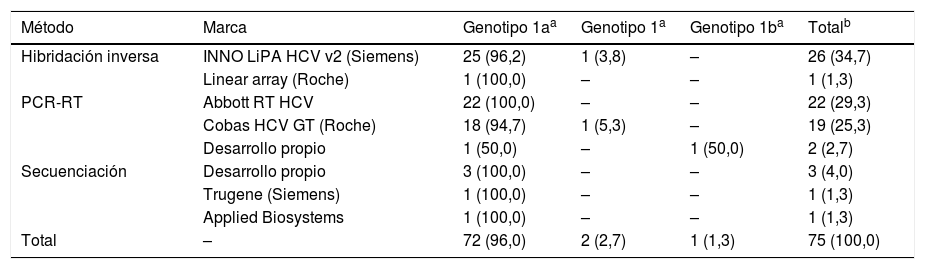
De los 105 participantes inscritos al control, 75 realizaron el genotipado del VHC (71,4%). De este modo informaron genotipo 1a el 96%, genotipo 1 el 2,7% y genotipo 1b el 1,3%.
El método que se utilizó de forma mayoritaria por los participantes fue la PCR-RT (57,3%), seguido de la hibridación inversa (36,0%) y la secuenciación (6,7%). Todos los participantes que emplearon el sistema de INNO LiPA HCV (Versant, Siemens) emplearon la versión 2.
La marca comercial más empleada fue INNO LiPA HCV de Siemens (34,7%), con ella la mayoría de los genotipos informados se correspondieron con 1b (96,2%). Respecto a los equipos basados en una PCR-RT, en todas las ocasiones excepto 2 se informó genotipo 1a (95,1%); mientras que mediante secuenciación, el único genotipo informado fue el 1a (100,0%). Los datos se muestran en la tabla 4.
Análisis de los resultados del genotipado del virus de la hepatitis B (VHC) (estándar VHC-1/18)
| Método | Marca | Genotipo 1aa | Genotipo 1a | Genotipo 1ba | Totalb |
|---|---|---|---|---|---|
| Hibridación inversa | INNO LiPA HCV v2 (Siemens) | 25 (96,2) | 1 (3,8) | – | 26 (34,7) |
| Linear array (Roche) | 1 (100,0) | – | – | 1 (1,3) | |
| PCR-RT | Abbott RT HCV | 22 (100,0) | – | – | 22 (29,3) |
| Cobas HCV GT (Roche) | 18 (94,7) | 1 (5,3) | – | 19 (25,3) | |
| Desarrollo propio | 1 (50,0) | – | 1 (50,0) | 2 (2,7) | |
| Secuenciación | Desarrollo propio | 3 (100,0) | – | – | 3 (4,0) |
| Trugene (Siemens) | 1 (100,0) | – | – | 1 (1,3) | |
| Applied Biosystems | 1 (100,0) | – | – | 1 (1,3) | |
| Total | – | 72 (96,0) | 2 (2,7) | 1 (1,3) | 75 (100,0) |
Desde el punto de vista de valoración general de los resultados, los que aquí se presentan se deben considerar como buenos y coherentes con lo esperado. La mayor parte de los participantes incluye sus resultados individuales dentro del intervalo de aceptación (IC del 95%). En total, solo un participante obtuvo un resultado falsamente negativo con el estándar de baja carga.
Respecto a la detección del genotipo, los resultados se consideran muy buenos dado que la práctica totalidad de los centros coincidió con el valor asignado.
4Control de calidad del VHB4.1Características del material remitidoEn el control de carga viral de VHB se remitieron 2 estándares de plasma congelado (VHB-1/18 y VHB-2/18) que se obtuvieron de 2 pacientes distintos con viremia por el VHB, buscando unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron a una temperatura de –80°C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24h. Ambos estándares se habían analizado previamente a su envío por laboratorios expertos, y se confirmaron los valores teóricos.
4.2Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml) comparando los resultados individuales obtenidos por cada participante respecto al IC del 95% (media±1,96 DE) de todos los que utilizaron su mismo método comercial12,13. Al igual que con el control del VIH-1 y del VHC, para el cálculo de la media y de la DE se excluyeron los valores extremos y aberrantes1.
4.3Resultados del control del VHBEn este control se remitieron muestras a 96 laboratorios, de los que 91 respondieron, lo que supone un porcentaje de participación del 94,8%. Como sucede con los otros controles de carga viral (VIH-1 y VHC), los métodos informados por la gran mayoría de los participantes fueron la PCR-RT con reactivos Cobas TaqMan® de Roche (47,2%, 43 centros) y la plataforma Cobas 6800 de Roche (29,7%, 27 centros), seguidos a distancia por la PCR-RT de Abbott (12,1%, 11 centros), la PCR-RT de Veris Beckman-Coulter (3,3%, 3 centros), la k-PCR de Versant de Siemens (3,3%, 3 centros), la PCR-RT de Qiagen (2,2%, 2 centros), la PCR-RT de GeneXpert de Cepheid (1,1%, 1 centro) y la PCR-RT de desarrollo propio (1,1%, 1 centro).
La tabla 5 resume los datos para el total de participantes. Del conjunto de resultados informados, se encontraban dentro del intervalo de aceptación alrededor del 91%. Cabe destacar que 3 participantes obtuvieron ambos valores fuera del intervalo aceptable. En todas las ocasiones que se informa resultado se detecta carga viral, por lo que no hubo resultados falsamente negativos. En general, una vez eliminados los resultados aberrantes, estos fueron buenos.
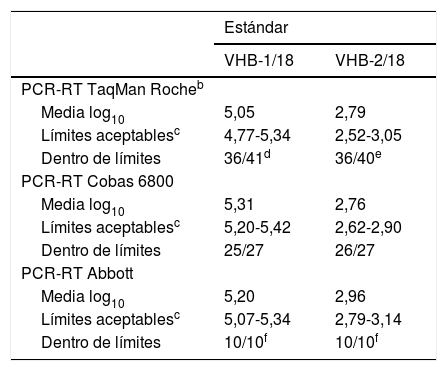
La tabla 6 resume los resultados de los laboratorios obtenidos mediante las técnicas que se emplearon más, y se comparan entre sí con la media de cada técnica. No se muestran los datos correspondientes a los sistemas Versant (Siemens), Qiagen, Veris (Beckman Coulter), geneXpert (Cepheid), ni PCR-RT de desarrollo propio, porque los emplearon muy pocos centros. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (IC del 95% de la media de los participantes por cada técnica). Debido a que la técnica de PCR-RT TaqMan® Roche fue la que se utilizó más ampliamente, las conclusiones que de ella se derivan son las más consistentes. Los resultados informados mediante esta técnica se desglosan en 2 grupos, ya que los correspondientes a la plataforma Cobas 6800 de Roche se analizan de forma independiente. Así, de los 27 participantes que especificaron emplear la plataforma Cobas 6800 (Roche), solo 3 aportaron 1 de los 2 valores fuera del intervalo de aceptación. Mediante el resto de equipos de Roche (n=43) se obtuvo un total de 81 resultados, y 9 de ellos quedaron fuera del intervalo de aceptación, de los cuales 5 se correspondían al estándar VHB-1/18 y los otros 4 al VHB-2/18; se detectó carga viral en todas las ocasiones. Por otro lado, 2 de los centros participantes no presentan ninguno de sus valores dentro del intervalo de aceptación.
Control del virus de la hepatitis B (VHB): análisis de los resultados dentro de límites según el método comercial utilizadoa
| Estándar | ||
|---|---|---|
| VHB-1/18 | VHB-2/18 | |
| PCR-RT TaqMan Rocheb | ||
| Media log10 | 5,05 | 2,79 |
| Límites aceptablesc | 4,77-5,34 | 2,52-3,05 |
| Dentro de límites | 36/41d | 36/40e |
| PCR-RT Cobas 6800 | ||
| Media log10 | 5,31 | 2,76 |
| Límites aceptablesc | 5,20-5,42 | 2,62-2,90 |
| Dentro de límites | 25/27 | 26/27 |
| PCR-RT Abbott | ||
| Media log10 | 5,20 | 2,96 |
| Límites aceptablesc | 5,07-5,34 | 2,79-3,14 |
| Dentro de límites | 10/10f | 10/10f |
En cuanto al sistema de PCR-RT de Abbott, todos los participantes que informan algún valor mediante esta técnica (n=10) presentan todos sus valores dentro del intervalo de aceptación (100,0%).
4.4Comentarios y conclusiones al control del VHBDesde el punto de vista de valoración general de los resultados, los que aquí se presentan se deben considerar como aceptables y coherentes con lo esperado. En todas las ocasiones se detecta carga viral, y no se observaron resultados falsamente negativos.
La mayor parte de los participantes incluyen sus resultados individuales dentro del intervalo de aceptación (IC del 95%). No obstante, es importante que los laboratorios, de forma individual, mantengan un alto grado de vigilancia sobre la calidad de sus resultados en el día a día y, en caso necesario, introduzcan las medidas correctoras oportunas. Por lo que se refiere al análisis por técnicas comerciales, no es posible obtener datos concluyentes, debido a la utilización mayoritaria de un determinado método.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.