Paciente de 55 años con diabetes mellitus tipo 2 y microangiopatía en tratamiento con metformina (850mg dos veces al día). También presentaba glaucoma de ángulo abierto, una retinopatía diabética asociada a edema macular por la que había recibido 14 inyecciones intravítreas en el ojo derecho (OD) y 8 inyecciones en el ojo izquierdo (OI) con aflibercept (40mg/ml), así como desprendimiento de retina en OI que requirió vitrectomía pars plana (23g y endoláser por pequeños desgarros paravasculares). Además, refería uso frecuente de lentes de contacto diarias. El paciente sufrió empeoramiento progresivo de la agudeza visual en OD con hiperemia conjuntival y fotofobia. A la exploración del OD, se observó la córnea deslustrada, así como 2 úlceras corneales laterales (3×2mm) y otra en región medial con forma de semiluna. Se tomaron muestras de raspado corneal para estudio microbiológico.
Se sembró la muestra de raspado corneal en agar tripticasa soja con 5% de sangre de cordero (Becton Dickinson, Franklin Lakes, NJ, EE.UU.), agar Saboraud con cloranfenicol (BDTM) y agar chocolate, además de cultivo específico para detección de Acanthamoeba spp. Para el cultivo de Acanthamoeba spp. se emulsionaron 1-2 colonias de Escherichia coli o Enterobacter aerogenes en una solución Page hasta conseguir una turbidez homogénea y posteriormente inocular 0,2ml de esta solución en una placa de Petri. Posteriormente se inoculó la muestra en este medio y se visualizó cada 24-48h, observándose crecimiento a los 4 días (fig. 1b, ejemplo de crecimiento en medio de Page). Una PCR positiva de Acanthamoeba spp. confirmó el resultado. El paciente empezó a ser tratado de forma alterna con gotas oftálmicas de propamidina (0,1%/10ml cada 2h) y de clorhexidina (0,02%/10ml cada 2h).
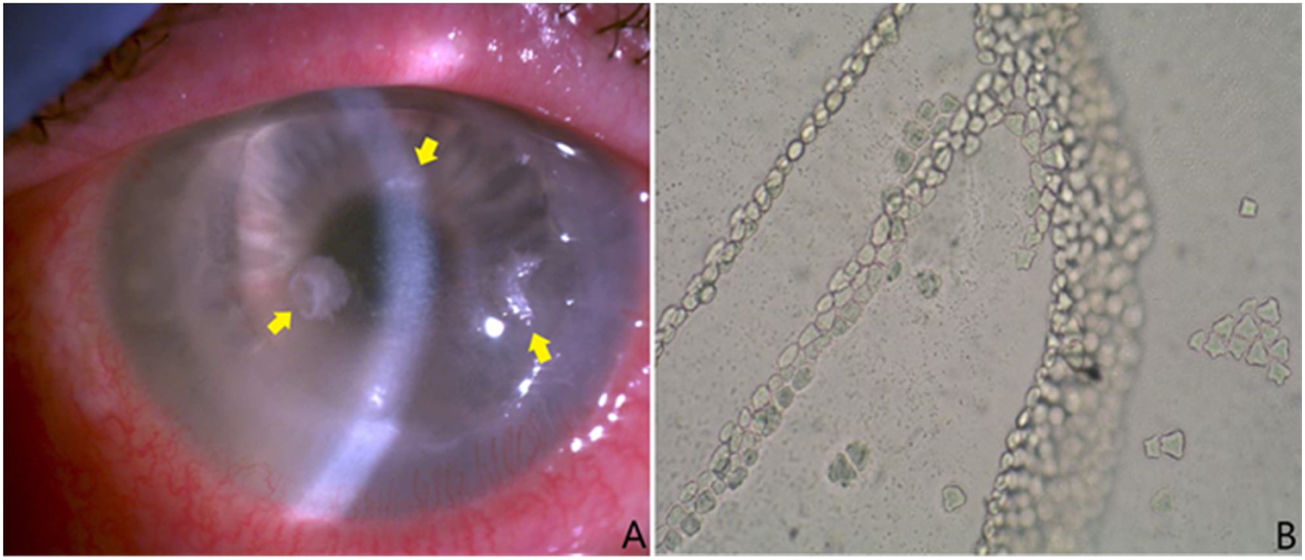
A) Tres lesiones adelgazadas con halo endotelial sublesional de aspecto cristalino (flechas amarillas). Se tomaron muestras de las mismas y se enviaron al laboratorio de microbiología para cultivo y a anatomía patológica para estudio. Esas lesiones se colonizaron por S. oralis. B) Crecimiento típico de los quistes de Acanthamoeba spp. en medio de Page cubierto con Escherichia coli. Presencia de láminas contiguas de quistes. Sin tinción y con aumento ×100.
La evolución clínica fue buena al principio, pero posteriormente comenzó con empeoramiento progresivo, persistiendo úlcera corneal e infiltrado anular. Además, aparecieron 3 lesiones adelgazadas con halo endotelial sublesional de aspecto cristalino (fig. 1a) y se decidió realizar otro raspado corneal para cultivo. Se volvió a cultivar la muestra de raspado en los mismos medios de cultivo citados anteriormente. En este caso se observó crecimiento de Streptococcus oralis sensible a penicilina, vancomicina y tetraciclinas, comenzándose en ese momento tratamiento mediante gotas oftálmicas con moxifloxacino (5mg/ml cada 6h), que posteriormente fue reemplazado por colirio reforzado con vancomicina y colirio de penicilina (50mg/ml y 330.000U/ml, respectivamente cada 2h de forma alterna). En anatomía patológica se observaron colonias de microorganismos de apariencia bacteriana compactados en el tercio más superficial, así como quistes compatibles con infestación por Acanthamoeba spp.
Ante la nula mejoría se decidió realizar queratoplastia penetrante tras mes y medio de tratamiento, precisando una sutura corneal una semana después por Seidel (comunicación entre la cámara anterior y el exterior). La muestra corneal obtenida quirúrgicamente fue procesada mediante cultivos microbiológicos, así como PCR de Acanthamoeba spp. y secuenciación del ADNr del gen 16S, siendo negativo para todas las pruebas. Tras la queratoplastia penetrante, el paciente mejoró progresivamente desde el punto de vista clínico y en el seguimiento estrecho realizado por oftalmología se mostró aclaramiento de la córnea.
DiscusiónLa queratopatía cristalina infecciosa es una forma de queratitis infecciosa indolente y caracterizada por presentar opacidades características en forma de aguja asociada a una mínima o nula reacción inflamatoria. Algunos autores la denominan «colonización bacteriana intraestromal no inflamatoria» y evitan el término «infección» debido a la ausencia de inflamación. Fue descrita por primera vez por Gorovoy et al.1 cuando descubrieron cocos grampositivos que colonizaban la córnea de un paciente tras queratoplastia penetrante. Parece que los microorganismos entran en el estroma corneal a través de un defecto epitelial, que puede ser aprovechado por patógenos virulentos u oportunistas y proliferan. Cuando la respuesta inmune habitual se ve atenuada por inmunosupresión localizada, permite que los microorganismos se acaben rodeando, en ocasiones, por un biofilm2.
Característicamente, los agentes causales más frecuentes de este síndrome son Streptococcus alfa hemolíticos del grupo viridans, sobre todo, Streptococcus mitis2–4. Esta asociación entre Streptococcus spp. y queratopatía cristalina podría estar relacionada con la posible abundante producción de un biofilm de mucopolisacárido, aunque se necesitan más estudios que comprueben esta asociación4. Otros patógenos que pueden ser causa de esta patología son otros cocos grampositivos (Staphylococcus coagulasa-negativos, Enterococcus faecalis…), y en menor medida, bacilos gramnegativos, y hongos como Candida albicans, entre otros2,3,5,6.
En la mayoría de ocasiones, el defecto epitelial necesario aparece tras cirugía asociado al uso de corticoides tópicos (frecuente tras cirugías de córnea)1. La utilización de campo estéril o la correcta limpieza y esterilización del instrumental, detectar factores de riesgo (como blefaritis u obstrucción de la vía lacrimal) y el uso de povidona yodada podrían reducir la colonización y participación de patógenos oportunistas como S. oralis. El uso de anestésicos locales, así como queratitis previas por Achantamoeba spp. (normalmente tras uso de lentes de contacto), también se asocian con queratopatía cristalina2–4. Otra hipótesis indica que los microorganismos podrían establecer una relación de endosimbiosis con Acanthamoeba spp. y cuando las amebas empiezan a morir tras el uso de antisépticos, estos son liberados de su interior y se adhieren a la córnea7.
Para la identificación del microorganismo causal se debe llevar a cabo un raspado corneal, aunque en ocasiones no se llegará a la profundidad de las lesiones, y puede ser necesaria una biopsia de córnea para confirmar el diagnóstico8. Otra opción diagnóstica es realizar una punción aspiración con aguja fina y realización de PCR, que además evitaría el uso de técnicas invasivas.
La primera opción terapéutica son antibióticos de amplio espectro tópicos, que deberán ser reforzados para intentar atravesar los biofilms formados por algunos microorganismos2,9. Cuando no hay mejoría, se optaría por la vía intraestromal10. La utilización de láser (láser excimer o Nd:Yag) como terapia adyuvante al tratamiento tópico puede ser útil para evitar la formación de biofilm6. En caso de haber progresión de la enfermedad parece necesaria la escisión quirúrgica del tejido infiltrado. La disección lamelar anterior se reservaría para lesiones más superficiales, mientras que la queratoplastia penetrante se realizaría para lesiones más profundas (se reemplaza la totalidad de la córnea frente a queratoplastia lamelar o selectiva, si se sustituyen exclusivamente aquellas capas que están afectadas)9.
La queratopatía cristalina requiere de una actuación diagnóstica y terapéutica rápida y, en ocasiones, precisará de otras actuaciones complementarias como el uso del láser o cirugía para eliminar totalmente las bacterias acantonadas. Limitar el uso de corticoides y/o anestésicos locales junto con un seguimiento clínico estrecho después de este tipo de cirugías se antoja fundamental.
FinanciaciónLa presente carta no ha recibido ayudas económicas.
AutoríaDomingo Fernández Vecilla: escribió la carta científica, revisó bibliografía.
Silvia López-Plandolit Antolin: ayudó a redactar el caso clínico, revisó bibliografía y proporcionó las imágenes.
Miren Josebe Unzaga Barañano: ayudó con la concepción del caso, revisó el caso y ayudó a modificarlo.
José Luis Díaz de Tuesta del Arco: revisó el caso, ayudó a modificarlo y revisó la bibliografía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.