Las enfermedades causadas por micobacterias atípicas o no tuberculosas, y especialmente por micobacterias de crecimiento rápido (MCR), son un fenómeno cada vez más extendido en todo el mundo1,2.De entre los muchos factores que inciden en el aumento de casos comunicados se incluyen la ubicuidad de dichos microorganismos en el medio ambiente y la capacidad de los mismos para formar biopelículas3,4. Dicha característica les hace ser especialmente resistentes a antibióticos comúnmente utilizados para tratar infecciones micobacterianas en la práctica clínica actual (como son, por ejemplo, amikacina, ciprofloxacino o claritromicina)5. Algunos estudios estiman que la resistencia a antibióticos de las bacterias que se encuentran formando parte de una biopelícula es unas 1.000-1.500 veces mayor en comparación con las células planctónicas6, aunque hay pocos estudios relacionados con dicha resistencia en biopelículas formadas por MCR5,7,8.
El objetivo de este estudio es determinar la influencia de la formación de biopelículas por MCR en la sensibilidad frente a distintos antimicrobianos mediante un sistema estandarizado. Para ello, se estudiaron las cepas tipo Mycobacterium abscessus DSM 44196, Mycobacterium chelonae ATCC 19235, Mycobacterium fortuitum ATCC 6841, Mycobacterium mageritense ATCC 700351, Mycobacterium mucogenicum DSM 44124, Mycobacterium peregrinum ATCC 14467 y Mycobacterium smegmatis ATCC 607. Los antibióticos estudiados fueron amikacina (AN), claritromicina (CLR) y ciprofloxacino (CIP) (Sigma, Alemania). Se estableció la concentración mínima inhibitoria (CMI) de las cepas estudiadas mediante la técnica de microdilución en caldo para MCR de acuerdo con el protocolo recomendado por el Clinical and Laboratoy Standards Institute (CLSI)9. Para determinar la concentración mínima de erradicación de la biopelícula (CMEB), la biopelícula se desarrolló siguiendo el protocolo basado en el sistema de Calgary usando las placas MBECTM Biofilm Inoculator (Innovotech, Canadá)10. Dichas placas se inocularon con una suspensión de densidad óptica 0,5 MacFarland obtenida a partir de las cepas incubadas en Middlebrook 7H9 (7H9). Las placas inoculadas se incubaron a 37°C en agitación (80rpm) durante 96h. A continuación las proyecciones de material plástico sobre las que se desarrolló la biopelícula se lavaron con PBS estéril y se introdujeron en placas de 96 pocillos que contenían diluciones seriadas de los 3 antibióticos, y se incubaron a 37°C durante 48h. Trascurrido dicho tiempo, las tapas con las proyecciones se lavaron de nuevo con PBS y se sonicaron durante 5min introduciéndolas en placas con 7H9 sin antibióticos. Estas placas se incubaron a 37°C en atmósfera normal durante 7días, tras lo cual se realizó la lectura visual de la CMEB. Se decidió utilizar la temperatura de 37°C (en lugar de 30°C, temperatura recomendada para el estudio de sensibilidad convencional) con el objetivo de utilizar unas condiciones más similares a las existentes en las biopelículas asociadas a infecciones en humanos (que habitualmente se desarrollan a temperaturas más próximas a los 37 que a los 30°C). Por otra parte, se trata de la temperatura recomendada por el fabricante. En cualquier caso, y previamente a la realización de los estudios, se comprobó la capacidad de las cepas estudiadas de crecer a 37°C.
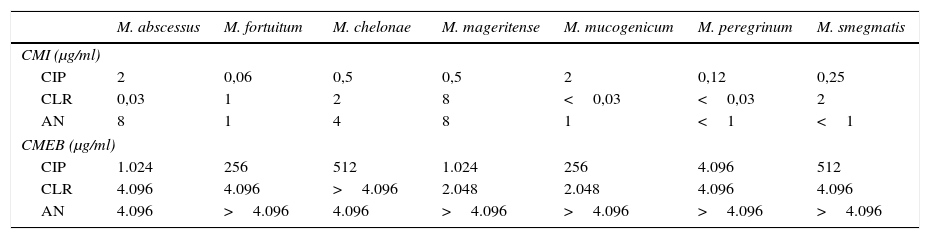
Los resultados obtenidos de CMI y CMEB se muestran en la tabla 1. De acuerdo con ellos, se puede concluir que las MCR, cuando se encuentran formando parte de una biopelícula, presentan una resistencia a antimicrobianos muy superior respecto a las micobacterias en estado planctónico, variando desde <100 veces en el caso de M.mucogenicum cuando se expone a ciprofloxacino, hasta >100.000 veces en el caso de M.abscessus y M.peregrinum cuando se exponen a claritromicina.
Concentración mínima inhibitoria (CMI) y concentración mínima de erradicación de la biopelícula (CMEB) de las diferentes cepas frente a ciprofloxacino (CIP), claritromicina (CLR) y amikacina (AN)
| M. abscessus | M. fortuitum | M. chelonae | M. mageritense | M. mucogenicum | M. peregrinum | M. smegmatis | |
|---|---|---|---|---|---|---|---|
| CMI (μg/ml) | |||||||
| CIP | 2 | 0,06 | 0,5 | 0,5 | 2 | 0,12 | 0,25 |
| CLR | 0,03 | 1 | 2 | 8 | <0,03 | <0,03 | 2 |
| AN | 8 | 1 | 4 | 8 | 1 | <1 | <1 |
| CMEB (μg/ml) | |||||||
| CIP | 1.024 | 256 | 512 | 1.024 | 256 | 4.096 | 512 |
| CLR | 4.096 | 4.096 | >4.096 | 2.048 | 2.048 | 4.096 | 4.096 |
| AN | 4.096 | >4.096 | 4.096 | >4.096 | >4.096 | >4.096 | >4.096 |
De entre los antimicrobianos estudiados, ciprofloxacino resultó ser el más activo frente a biopelículas de micobacterias de crecimiento rápido, mientras que claritromicina y amikacina no mostraron prácticamente actividad frente a las mismas. Este dato debería tenerse en cuenta a la hora de plantear las opciones terapéuticas en infecciones causadas por MCR asociadas a la formación de biopelículas.