Introducción
Algunas amebas de vida libre (AVL) de los géneros Naegleria, Acanthamoeba y Balamuthia, pertenecientes a la familia Acanthamoebidae 1,2, se han identificado como agentes infecciosos en humanos y animales. Sólo una especie de Naegleria, N. fowleri, algunas de Acanthamoeba (A. castellani, A. culbertsoni, A. hatchetti, A. healyi, A. polyphaga, A. rhysodes, A. astronyxis, A. divionensis) y la única especie conocida de Balamuthia, B. mandrillaris, se sabe que causan enfermedades 3-16. Estas amebas se encuentran ampliamente distribuidas en el agua y el suelo de los 5 continentes. La tierra húmeda y las aguas con abundante sustrato son un buen caldo de cultivo para su persistencia y su multiplicación. Se han aislado tanto en aguas dulces como saladas, y contaminan sistemas y dispositivos (conducciones de agua, de calefacción, aire acondicionado, etc.) y, secundariamente, objetos y enseres comunes de nuestro entorno, por lo que son múltiples las ocasiones de entrar en contacto con estos pequeños protozoarios, que pueden ser causa de diversas afecciones 4,5,8,10,13,17-25.
Naegleria fowleri es el agente etiológico de la grave, y a menudo fatal, meningoencefalitis amebiana primaria de evolución sobreaguda (< 10 días) 4,6,7,10,16,18, Acanthamoeba y Balamuthia, de la meningoencefalitis granulomatosa amebiana de curso subagudo o crónico, así como de granulomas en la piel y en otros órganos y tejidos, y de queratitis 4,5,8,10,14,15,19 (recientemente se ha descrito un nuevo caso de meningoencefalitis amebiana originado por Sappinia diploidea) 11. Muchas de estas infecciones son oportunistas y ocurren sólo en huéspedes inmunodeprimidos (meningoencefalitis por Acanthamoeba y Balamuthia, acantamebiasis cutánea), pero en otros casos no es así, puesto que la queratitis por Acanthamoeba, la meningoencefalitis por Naegleria y algún caso de meningoencefalitis por Balamuthia pueden producirse en personas sanas (inmunocompetentes) 5-17.
Por otro lado, se ha comprobado que las AVL interactúan con distintas especies bacterianas en el medio. Acanthamoeba ha sido identificada como predadora de bacterias: enterobacterias, pseudomonas, vibrios, etc. En otros casos, las bacterias utilizan a la ameba como hospedador y también como "refugio" en presencia de factores hostiles; igualmente, en condiciones favorables de temperatura, osmolaridad y pH, pueden multiplicarse e inducir la lisis de aquéllas, caso de Legionella pneumophila, Listeria monocytogenes, Vibrio cholerae, Chlamydia pneumoniae, Escherichia coli O-157, etc., con las consecuencias que este hecho puede tener para la propagación de estos patógenos al hombre 26-29.
El ciclo biológico de Naegleria consta de 3 estadios: quiste, trofozoíto y forma flagelada. Los otros 2 géneros carecen de forma flagelada 10,30-32. Los trofozoítos de Naegleria atraviesan el epitelio neuroolfatorio, con lo que alcanzan el sistema nervioso central (SNC), y pueden encontrarse en el líquido cefalorraquídeo (LCR) 5,10,33. Los de Acanthamoeba pasan a través de pequeñas escoriaciones de la piel o de úlceras mucosas del tracto respiratorio y, posteriormente, por vía hematógena llegan a diversos órganos y tejidos del cuerpo, con un claro tropismo por la piel y el SNC, donde pueden multiplicarse activamente y originar una meningoencefalitis muy grave, por la frecuente demora en el diagnóstico (es muy infrecuente el hallazgo de trofozoítos en el LCR) 5,10,12,18,19,32,33.
El diagnóstico de estas infecciones del SNC es complicado y se sustenta, fundamentalmente, en el examen directo y en los cultivos del LCR y de biopsia cerebral. Las técnicas de detección antigénica por hibridación con sondas o PCR y la inmunofluorescencia directa (IFD) con anticuerpos monoespecíficos o genoespecíficos marcados están al alcance de muy pocos laboratorios (en centros de investigación o muy especializados). El tratamiento también es problemático, puesto que no está estandarizado y, además, algunos de los antiamebianos de primera elección no se han comercializado en España 18,19,32,33.
Biología y epidemiología
El género Acanthamoeba comprende protozoos ubicuos de vida libre que se encuentran en el aire, el suelo, las aguas, dulces o saladas, residuales, e incluso en el agua del grifo o embotellada, las unidades de diálisis, el material odontológico, etc.19-25. También se encuentran como contaminantes de cultivos bacterianos o celulares y se han aislado de las vías respiratorias altas de humanos sanos, de lesiones de la piel en inmunodeprimidos y de tejido corneal en pacientes con queratitis amebiana 21-25,32-36. Su ciclo biológico consta de 2 estadios: una forma activa, con capacidad infecciosa y reproductora, que es el trofozoíto, y la forma latente, que es el quiste. El trofozoíto se alimenta de bacterias, algas, levaduras y partículas orgánicas ambientales por medio de la emisión de seudópodos y su posterior fagocitosis (en la córnea se piensa que se alimentan de queratocitos). La locomoción la realizan gracias a los acantopodios y se reproducen por fisión binaria. La formación del quiste ocurre en condiciones ambientales adversas, como la falta de alimento, desecación o cambios en la temperatura y pH. En estas condiciones, el microorganismo reduce drásticamente su actividad metabólica y así es capaz de sobrevivir a la acción de desinfectantes, antibióticos, cloración y bajas temperaturas, incluso de congelación, y puede permanecer viable varios años a 20 °C. En condiciones ambientales apropiadas, los quistes se transforman en trofozoítos, que sintetizan enzimas que favorecen la penetración y destrucción tisular 10,18-20,30,31,37-39.
Aunque el uso de lentes de contacto es el factor predisponente con más frecuencia asociado a la queratitis por Acanthamoeba, la incidencia de esta enfermedad entre los portadores de estas lentes sigue siendo muy baja (1 caso por cada 30.000 portadores y año) 14 lo que indica que este microorganismo es, relativamente, poco virulento, que existe inmunidad innata en el huésped y que el epitelio corneal ofrece una barrera frente a la penetración de las amebas en el estroma y el desarrollo consiguiente de queratitis 30,31,37-39. En los pacientes con antecedentes de traumatismo, las amebas pueden llegar directamente al estroma y, en portadores de lentes de contacto, dicho acceso se facilita por microtraumatismos repetidos, aunque se ha visto que A. castellanii atraviesa el epitelio intacto de la córnea 40. No están bien caracterizados los mecanismos del sistema inmunitario que operan contra Acanthamoeba. En estudios experimentales con animales se ha visto que los neutrófilos y macrófagos suponen la mayor respuesta inflamatoria celular en el área de la infección. Parece que los macrófagos conjuntivales tienen un papel muy importante en la eliminación de los trofozoítos, ya que su desaparición aumenta la incidencia de la infección, agrava la enfermedad y determina que la queratitis se inicie más temprano y tenga un curso más prolongado. El primer caso de queratitis por Acanthamoeba se describió en 1974 41, y hasta 1984 se mantuvo como una enfermedad muy poco frecuente, en la mayoría de casos asociada a traumatismos de la córnea y a la exposición a aguas contaminadas. A mediados de los ochenta, aumentó de forma espectacular el número de casos y se atribuyó al incremento del uso de lentes de contacto y a su incorrecta desinfección 42-47.
Entre los factores predisponentes destacan los traumatismos corneales, el contacto con cuerpos extraños o la exposición al agua templada (p. ej., de una bañera o piscina), pero el factor de riesgo más importante es el uso de lentes de contacto, no desinfectarlas apropiadamente o con la frecuencia recomendada y su utilización durante la práctica de la natación 44-51.
Manifestaciones clínicas
La queratitis amebiana es la manifestación clínica más habitual de la infestación por el género Acanthamoeba. Se caracteriza por ser dolorosa e invalidante. La infección progresa originando una ulceración de la córnea y puede dar como resultado ceguera en casos muy graves. Es una enfermedad difícil de diagnosticar y tratar, ya que las manifestaciones clínicas se confunden a menudo con las de las queratitis herpética, fúngica o micobacteriana, lo que provoca que el diagnóstico correcto y el comienzo del tratamiento se retrasen semanas o meses 42-45,52-54.
El cuadro clínico varía según el momento de la primera consulta. Al principio, las amebas se encuentran en el epitelio corneal, pero si la enfermedad progresa se produce la invasión del estroma. En sus inicios, se caracteriza por limbitis, queratopatía punteada, infiltrados epiteliales, subepiteliales o perineurales (queratoneuritis radial). En este momento el paciente presenta enrojecimiento, lagrimeo, fotofobia y dolor de diversa intensidad, pero desproporcionado respecto a los signos oculares, así como visión borrosa 48-51. Si la enfermedad progresa, puede observarse ulceración, infiltrados anulares, placas endoteliales y uveítis anterior, con o sin hipopión (presencia de pus en la cámara anterior del ojo), y con menos frecuencia, edema corneal. Si el proceso se agrava, se pueden producir abscesos, escleritis, glaucoma, catarata e infección microbiana secundaria. Lo más característico es la presencia de un infiltrado anular compuesto por células inflamatorias (neutrófilos). Los pacientes que sufren esta infección son generalmente inmunocompetentes; no obstante, no desarrollan inmunidad protectora apreciable, por lo que es posible la reinfección 50-58.
Diagnóstico
Obtención de la muestra y envío al laboratorio
Ante una sospecha de queratitis por Acanthamoeba, o simplemente para descartarla en presencia de datos oftalmológicos y epidemiología sugestiva (tratamientos convencionales fallidos, antecedente de traumatismo ocular o portador de lentes de contacto), el oftalmólogo solicitará, al laboratorio de Microbiología, el envío de un recipiente idóneo para el transporte y la conservación de la muestra. Un tubo o frasco estéril de boca ancha (los contenedores de orina de 50-100 ml son apropiados) con 1 ml de solución de Page (anexo 1), previamente atemperada en estufa de cultivos durante 20 min, es válido para depositar las pequeñas virutas corneales recogidas asépticamente mediante microespátula oftálmica o similar, y también es adecuado para descartar queratitis de otra etiología, bacteriana o viral, puesto que el fin primordial es evitar la desecación de la muestra. El recipiente se mantendrá a temperatura ambiente hasta su transporte al laboratorio, aunque también es posible hacerlo sin solución conservante si se asegura un rápido procesamiento (aviso de su envío al laboratorio y de qué muestra se trata).
Cultivo de la muestra
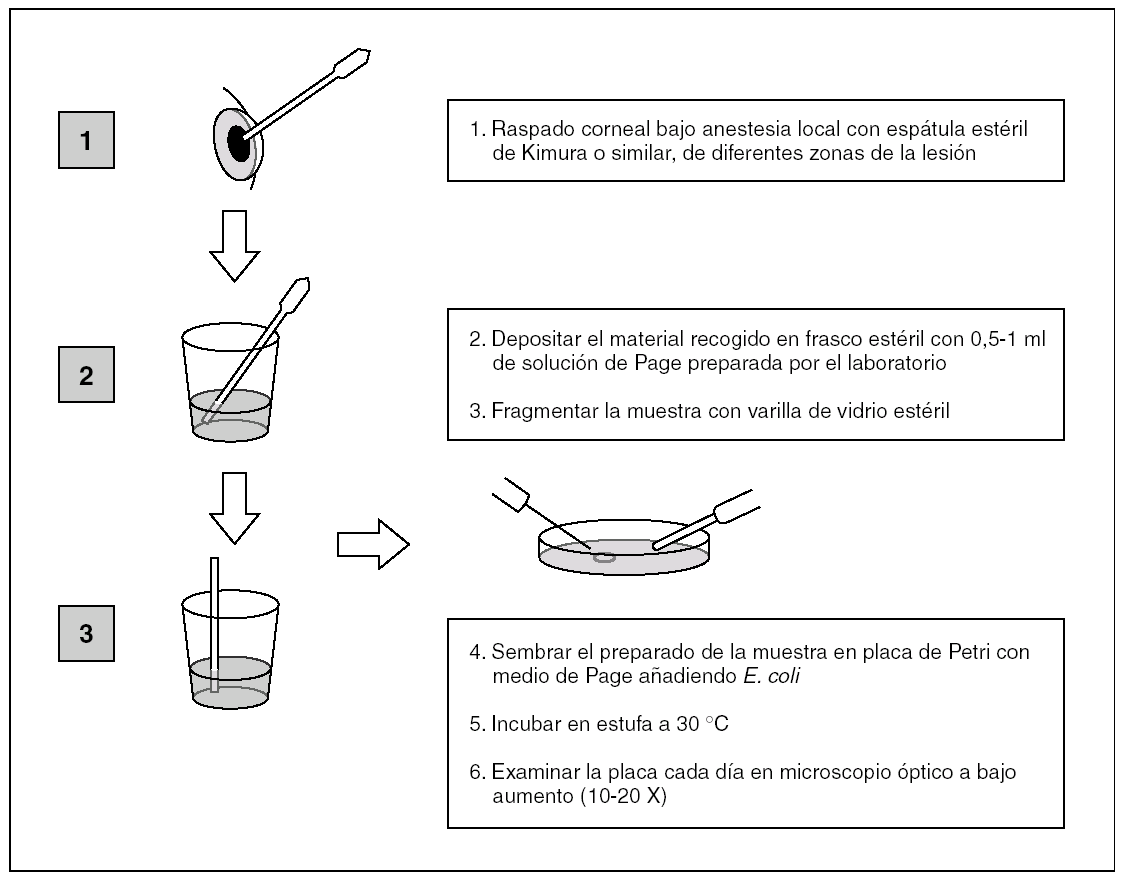
Una vez que la muestra del raspado corneal llega al laboratorio, se procederá como sigue:
Sacar de la nevera (4-8 °C) un frasco con solución de Page (SP) y atemperar; caso de almacenar esta solución concentrada (10x, 50x), se diluye con agua bidestilada estéril hasta 1x (solución de uso).
Sacar de la nevera y atemperar una placa de Petri con medio de Page (MP, con base de agar no nutritivo) o un tubo con el mismo medio (solidificado en posición inclinada). El cultivo en placa es quizás algo más sensible y detecta antes el crecimiento de Acanthamoeba, pero tiene el inconveniente de desecarse antes que el cultivo en tubo y por ello, necesita hidrataciones (con SP) y resiembras de E. coli más frecuentes (cada 1-2 días); por todo ello, la mejor opción es utilizar ambos.
Disponer, en un tubo estéril, 1 ml de la SP y emulsionar finamente 1-2 colonias de un cultivo de E. coli (o Enterobacter aerogenes), hasta obtener una turbidez homogénea. Conviene utilizar un cultivo reciente (18-24 h) bien identificado o una cepa de colección.
Mediante una varilla de vidrio (u otro material estéril), fragmentar las virutas corneales en el frasco de recogida o, previo paso de éstas a otro recipiente más idóneo, con 0,5-1 ml de SP, dependiendo de la cantidad de muestra, que normalmente es escasa y debe inocularse también en medios ordinarios para bacterias.
Inocular la placa de Petri (con medio de Page), con 0,2 ml de la solución de E. coli y con asa bacteriológica extender por toda la placa o por el medio inclinado, en caso de utilizar el tubo. Posteriormente, y con una pipeta tipo Pasteur, añadir un par de gotas de la solución con la muestra (virutas corneales disgregadas en SP) en el centro de la placa o dejando resbalar por el plano inclinado en el tubo. Esperar un tiempo para que se absorba y cerrar la placa con tira adhesiva porosa y el tubo con la tapa roscada floja para permitir una buena aireación. Luego, incubar ambos en estufa de 30 °C (fig. 1).
Figura 1. Esquema del cultivo de Acanthamoeba.
Si queda muestra, se puede realizar un examen directo en el microscopio óptico, utilizando objetivo seco de bajo aumento (× 10-20), y/o conservarla en nevera a 4-8 °C para estudios ulteriores, dependiendo de los resultados obtenidos en los cultivos previos. También es útil la tinción con fluorocromos (blanco de calcofluor o naranja de acridina) y el examen en microscopio de epifluorescencia, pues aumenta la sensibilidad del estudio.
Si, además de la muestra corneal, se dispone de las lentes de contacto se depositarán directamente en la placa o el tubo con MP previamente inoculados con SP más E. coli y si lo remitido es el medio de conservación, se realizará una centrifugación suave (200-300 × g) y posteriormente se llevará a cabo un examen directo y un cultivo del sedimento en MP, o mejor aún, se filtrará el líquido (dispositivos estériles de acetato o nitrocelulosa con 20-22 μm de poro) y se cultivará el filtro. En ambos casos (lentes de contacto y líquido de conservación), se aconseja la siembra en tubo inclinado, en cambio para el filtro es más rentable la siembra en placa 18,33,48,59-63.
Examen de los cultivos e identificación de Acanthamoeba
Los cultivos se deben examinar cada 24-48 h al principio (durante los primeros 7-8 días) y después cada semana, hasta un mínimo de 4-6 semanas porque, a veces, los quistes tardan en transformarse en trofozoítos y multiplicarse hasta alcanzar un número suficiente para ser detectados. Se debe examinar la placa en un microscopio óptico con objetivo seco de bajo aumento (× 10-20); en el caso del tubo, previa agitación, se toma una pequeña cantidad de la fase líquida (25-50 μl) con una pipeta estéril, se deposita en un portaobjetos y se observa igualmente con objetivo seco. En caso de positividad, se aprecian los trofozoítos o quistes de morfología característica 5,19,33,42,48,59,60.
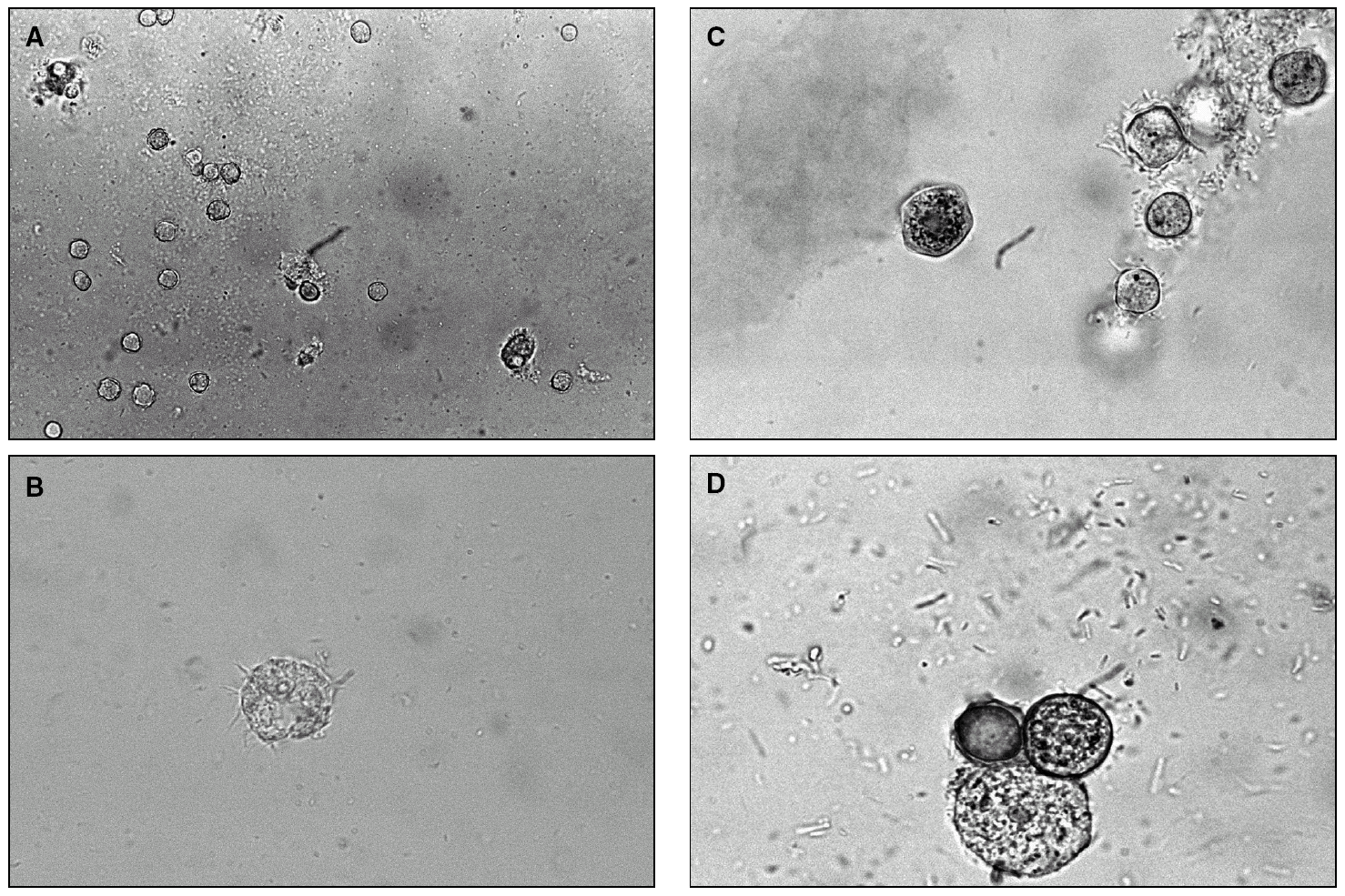
Los trofozoítos demuestran un movimiento lento típicamente ameboide, por contracciones y relajaciones del citoplasma, tienen un tamaño variable, de entre 15 y 45 µm, son tenues (hialinos), generalmente mononucleados y con una vacuola grande y visible, que se contrae y desaparece cada 50-90 s. Con más aumento (objetivo × 40) pueden observarse unas finas proyecciones citoplásmicas que parecen flagelos, pero que no lo son, que se extienden y retraen constantemente, denominadas acantopodios. Los quistes tienen un tamaño de 10-25 μm y, de forma característica, una doble pared: una externa, irregular y gruesa (ectoquiste), y otra interna redondeada, más fina y lisa (endoquiste). Cuando persisten las condiciones adversas, la pared interna del quiste va encogiéndose y adoptando formas geométricas, irregulares o estrelladas, con frecuencia en triángulo o pentágono 10,54,56,58,60,64 (fig. 2).
Figura 2. Examen en fresco de cultivo de Acanthamoeba. A) Quistes y trofozoítos (× 400). B) Trofozoíto; se aprecia el núcleo, la gran vacuola contráctil y los acantopodios (× 1.000). C) Quistes poligonales, algunos irregulares y de diferentes tamaños (× 1.000). D) Quistes en diferentes grados de involución; en el pequeño se aprecia claramente la doble pared (× 1.659). Contraste: Lugol/Kop-color.
Otras consideraciones
Si los cultivos son negativos a los 6-8 días, está indicado el subcultivo, sobre todo si lo han sido también los cultivos ordinarios para bacterias y hongos. Para ello, hay que tomar una porción de agar en forma de cuadrado de la placa de Petri, e introducirla en tubo con MP inclinado y previamente inoculado con E. coli, y con 0,3 ml de SP atemperada se debe mover de modo suave y reincubar en estufa. En caso de subcultivo a partir de un tubo, tomar 0,1 ml de la fase líquida, previamente bien agitada, e inocular un nuevo tubo con MP (con 0,3 ml de SP más E. coli). Se debe mantener los subcultivos un mínimo de 3 semanas antes de informarlos como negativos 54,58,60,64,65.
Para obtener cultivos ricos en trofozoítos, los mejores resultados se obtienen realizando subcultivos seriados en placa de Petri previamente inoculada con E. coli y humedecida con SP reciente, e incubar a 30 °C. Para mantener quistes viables es conveniente realizar subcultivos cada 1-2 meses en MP en tubo con E. coli y en estufa a 30 °C (reversiones a formas tróficas y sucesivas enquistaciones). La resiembra en medio de Page semisólido (0,5% de agar) nos ha aportado alguna ventaja, al aumentar el tiempo necesario entre pases, debido a una menor desecación.
El medio de Page es un medio de cultivo monoxénico (con una sola especie bacteriana, que hace de nutriente), clásico y con un buen rendimiento tanto para aislamiento primario como para mantenimiento; ha demostrado un alto porcentaje de éxitos en la recuperación de diversas AVL (66%, 2 tercios de los casos en que técnicas de hibridación o PCR, más sensibles, han sido positivas), pero también se han comunicado resultados similares con la utilización de medios axénicos (sin bacterias) enriquecidos, como el BCYE (charcoal yeast extract agar, en solucción tamponada) y medios con base de agar triptosa o agar peptona-extracto de levadura con sangre de conejo, cordero o caballo. Estos medios tienen la ventaja de estar comercializados (en placa, no en tubo) y por ello son una buena alternativa al MP para laboratorios con muy escasa demanda de estos estudios 59,60,64-68.
Tratamiento
El tratamiento de la queratitis por Acanthamoeba es, fundamentalmente, médico. Desde la revisión de Bacon et al hace más de 10 años, se sabe que los antiamebianos más eficaces, hasta la fecha, son las diamidinas y las biguanidas, estas últimas de primera elección, solas o asociadas a diamidinas (ambas son quisticidas). Entre las diamidinas disponibles se encuentran el isetionato de propamidina al 0,1% (Brolene, May and Baker, Dagenham, Reino Unido), y la hexamidina, también al 0,1% (Desomedine, Chauvin, Montpellier, Francia). Ambos preparados pueden obtenerse de estos países mediante solicitud de medicamentos extranjeros. Entre las biguanidas, las más activas son la clorhexidina (CHX, Ashton Chemicals Ltd., Aylesbury, Reino Unido) y la polihexametilenbiguanida (PHMB, Avecia HQ, Manchester, Reino Unido), ambas utilizadas en colirio al 0,02% y no disponibles comercialmente, por lo que deberán prepararse en la farmacia del hospital. La PHMB puede solicitarse al Moorfields Eye Hospital (Londres) ya que la obtención del principio activo puede resultar complicada 5,14,18,45,67,69.
Por lo general, es preferible un tratamiento combinado con una diamidina y una biguanida, intensivo al principio, para lograr una rápida lisis de los trofozoítos y que el menor número posible de ellos revierta a formas quísticas, más resistentes 48,51. Es aconsejable instilar una gota de ambos preparados cada hora, durante las primeras 48 h y luego una gota cada hora, sólo durante el día, en las siguientes 72 h. Posteriormente, es necesario bajar la dosis (p. ej., una gota de cada preparado cada 3 h) y adaptarla a cada paciente, puesto que es frecuente la aparición de fenómenos tóxicos, sobre todo asociados a las diamidinas a dosis altas; en este caso, es necesario suprimir la medicación durante 3 días y observar la evolución. Normalmente, la frecuencia de instilación puede reducirse a 4 veces al día en 3-4 semanas, pero debe mantenerse al menos 8 semanas más a partir de la resolución de la inflamación; por ello, en pacientes con buena/moderada respuesta, el tiempo medio de tratamiento es de 6 meses. La PHMB es menos tóxica que las diamidinas, y la clorhexidina, aunque falta experiencia, parece igualmente poco tóxica a estas dosis 14,33,42,58,60,64,69-72.
Otras alternativas por vía tópica son los aminoglucósidos (neomicina y paromomicina) y los imidazoles (miconazol y clotrimazol, ambos al 1%), aunque de menor actividad frente a los quistes. La neomicina en colirio está disponible en combinación con polimixina B y gramicidina (Oftalmowel, UCB, Barcelona, España). En cuanto al clotrimazol, se puede aplicar la pomada dermatológica al 1% (Canesten crema, Bayer), pero si no se tolera debe prepararse en farmacia un colirio a esta concentración 5,67,71.
En casos de inflamación persistente, puede ser útil la aplicación tópica de corticoides a dosis bajas (metilprednisolona al 0,5%, cuatro veces al día), teniendo la precaución de mantener los antiamebianos 2-3 semanas antes, durante, y otras 6-8 semanas después de administrar los corticoides. La limbitis y escleritis persistente (sobre todo los casos muy dolorosos o necrosantes de escleritis) pueden requerir tratamiento oral con antiinflamatorios no esteroideos, o incluso en el caso de la escleritis, pueden ser necesarios corticoides a dosis altas (prednisolona 1 mg/kg/día). En estos casos, puede ser útil el itraconazol por vía oral 45,48,51,69-71.
El tratamiento quirúrgico, con la excepción de la perforación corneal que requiere intervención urgente, se limita a corregir los efectos residuales que puedan quedar, cicatrices corneales o astigmatismo y se debe instaurar tras la erradicación de la infección, puesto que si se realiza una queratoplastia temprano no es infrecuente el fracaso del injerto 67,70,72.
Prevención
A partir de 1984, coincidiendo con el incremento del número de portadores de lentes de contacto, la incidencia de queratitis por Acanthamoeba aumentó de forma espectacular. En la actualidad, la incidencia parece haberse estabilizado, probablemente porque los factores de riesgo entre los usuarios de estas lentes se han identificado y evitado. Aun así, más del 90% de los casos que se observan podrían evitarse utilizando un sistema eficaz de desinfección, como el calor o el peróxido de hidrógeno de 2 pasos, el empleo de soluciones comerciales de suero fisiológico y la regular desinfección y limpieza del estuche de las lentes 42,45,72-74.
Correspondencia: Dr. J. Pérez-Irezábal.
Servicio de Microbiología y Parasitología. Hospital de Cruces.
Plaza de Cruces, s/n. 48903 Baracaldo. Vizcaya. España.
Correo electrónico: jperez-irezabal@hcru.osakidetza.net