Sr. Editor:Kingella kingae es el microorganismo más frecuentemente implicado en infecciones osteoarticulares en pacientes de entre 6 meses y 2 años de edad1–3. La mayoría de aislamientos se realizan mediante el cultivo de muestras de líquido articular y pus o tejido óseo del foco de osteomielitis en botellas de hemocultivo, ya que los métodos convencionales de cultivo habitualmente son ineficaces4–6. El presente estudio analiza la capacidad de crecimiento de K. kingae según las características de la botella de hemocultivo, la concentración del microorganismo y la presencia de sangre como suplemento nutritivo. Hay que tener presente que al realizar un hemocultivo, la sangre del propio paciente proporciona elementos nutricionales complementarios al medio de cultivo, circunstancia que no se produce cuando utilizamos este tipo de botellas para el cultivo de otro tipo de muestras clínicas.
Se han estudiado 12 cepas de K. kingae. A partir de una suspensión en suero fisiológico 0.5 McFarland se realizaron diluciones sucesivas denominadas A, B, C, D, E, F, con una concentración bacteriana aproximada de 108, 104, 103, 102, 10 y 1 unidades formadoras de colonias (ufc)/ml, respectivamente. Se realizaron controles de crecimiento/concentración de las diluciones y se inocularon 0,4 ml de cada una en dos botellas BacT/Alert SA y dos botellas BacT/Alert PF (con carbón activado). En una botella de cada tipo se añadió 1 ml de sangre humana estéril. Las botellas se incubaron en el procesador automático BacT/Alert (BioMérieux).
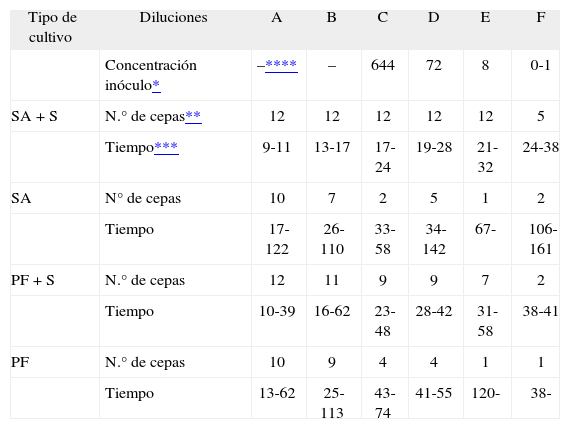
La tabla 1 resume la capacidad de aislamiento de las cuatro modalidades de cultivo.
Número de cepas aisladas y rango de tiempo de detección de crecimiento para cada dilución
| Tipo de cultivo | Diluciones | A | B | C | D | E | F |
| Concentración inóculo* | –**** | – | 644 | 72 | 8 | 0-1 | |
| SA + S | N.° de cepas** | 12 | 12 | 12 | 12 | 12 | 5 |
| Tiempo*** | 9-11 | 13-17 | 17-24 | 19-28 | 21-32 | 24-38 | |
| SA | N° de cepas | 10 | 7 | 2 | 5 | 1 | 2 |
| Tiempo | 17-122 | 26-110 | 33-58 | 34-142 | 67- | 106-161 | |
| PF + S | N.° de cepas | 12 | 11 | 9 | 9 | 7 | 2 |
| Tiempo | 10-39 | 16-62 | 23-48 | 28-42 | 31-58 | 38-41 | |
| PF | N.° de cepas | 10 | 9 | 4 | 4 | 1 | 1 |
| Tiempo | 13-62 | 25-113 | 43-74 | 41-55 | 120- | 38- |
SA: Botella de hemocultivo standard (formato pacientes adultos).
PF: Botella de hemocultivo con carbón activado (formato pacientes pediátricos).
+S: Suplemento de sangre añadido.
De los dos tipos de botellas utilizadas en este estudio, K. kingae mostró mayor capacidad de crecimiento y necesitó menos tiempo de incubación en las botellas SA + S (con suplemento de sangre). De hecho, se obtuvo crecimiento en todas las botellas hasta la suspensión E, y en la dilución F se obtuvo crecimiento en cinco cepas, que correspondía con la probabilidad teórica de inocular alguna bacteria. Por tanto, la capacidad de aislamiento de K. kingae en estas condiciones fue del 100%. La secuencia de tiempo de detección mantenía constante relación con la concentración del inóculo bacteriano y el rango de tiempo de detección de crecimiento para cada suspensión era muy estrecho, demostrando una gran homogeneidad en el crecimiento de todas las cepas. En las botellas PF con suplemento de sangre (PF + S) decreció la capacidad de aislamiento bacteriano al disminuir la concentración del inóculo y aumentó el tiempo de incubación para detectar el crecimiento. En las botellas SA y PF (sin suplemento de sangre), disminuye de forma importante la capacidad de aislamiento; en algunas cepas no se obtuvo crecimiento en ninguna dilución. Además, se observó discontinuidad de crecimiento en la secuencia de diluciones de diversas cepas.
En pediatría, entre uno y dos tercios de los casos con diagnostico clínico de artritis u osteomielitis no se consigue aislar el microorganismo responsable7,8. La reciente aplicación clínica de una técnica de reacción en cadena de la polimerasa (PCR) específica1 ha confirmado que, en los casos compatibles con el patrón habitual de la infección por K. kingae2,3, su implicación etiológica es superior a los casos confirmados por cultivo.
El escaso número de colonias obtenidas en los casos en que K. kingae se aisló a partir de siembra directa de la muestra en agar sangre9. La ineficacia de la tinción de Gram y las cuantificaciones realizadas directamente de muestras clínicas sugieren una baja concentración del microorganismo en el foco infeccioso3. Este dato es importante debido a que en nuestro estudio observamos que las diferencias más importantes en la capacidad de aislamiento se producían en inóculos con baja concentración bacteriana, y es en estas condiciones cuando la presencia de sangre y la ausencia de carbón activado es más determinante en el aislamiento del microorganismo. Por tanto, recomendamos la utilización de este método en botellas BacT/Alert SA10, aunque serían necesarios estudios realizados a partir de muestras clínicas para confirmar su utilidad práctica.