Recientemente, Kingella kingae (K. kingae) se ha descrito como el principal agente causal de infecciones osteoarticulares entre los 6 meses y 2 años de vida. Más excepcional es su presentación en forma de clúster de infección invasiva por K. kingae. Se describe la investigación del primer brote de 3casos de artritis séptica causada por K. kingae documentado en España en una guardería de Roses, Girona.
Pacientes y métodosEn diciembre del 2015, se realizó frotis faríngeo a todos los niños de la misma clase de la guardería. La muestra estaba compuesta por 9 lactantes (rango de edad: 16-23 meses), que incluía los 3casos índice. El estudio microbiológico se realizó mediante cultivo y RT-PCR específicos a K. kingae. Se administró amoxicilina y rifampicina profilácticas a todos los que presentaron colonización por K. kingae. Después de finalizar la profilaxis, se tomó un nuevo frotis faríngeo para confirmar la erradicación.
ResultadosSe detectó K. kingae por RT-PCR en los 3casos índices y 5/6 compañeros de clase. Los cultivos fueron negativos en todos los casos. Después de recibir profilaxis, 3lactantes aún presentaban positividad a K. kingae en RT-PCR.
ConclusionesK. kingae puede causar brotes de enfermedad invasiva en comunidades cerradas. Para una adecuada investigación, se requiere un mayor conocimiento de su existencia, así como una mejoría de la sensibilidad de las pruebas diagnósticas. En nuestra experiencia, la administración de profilaxis antibiótica puede erradicar parcialmente la colonización orofaríngea por K. kingae. Después de la profilaxis no se detectaron nuevos casos.
Recently, Kingella kingae (K. kingae) has been described as the most common agent of skeletal system infections in children 6 months-2 years of age. More exceptional is the clinical presentation in clusters of invasive K. kingae infections. We describe the investigation of the first outbreak of 3cases of arthritis caused by K. kingae documented in Spain detected in a daycare center in Roses, Girona.
Patients and methodsIn December of 2015 surveillance throat swabs obtained from all attendees from the same class of the index daycare center were assessed to study the prevalence of K. kingae colonization. The sample was composed of 9 toddlers (range: 16-23 months of age). Investigation was performed by culture and K. kingae-specific RT-PCR. Combined amoxicillin-rifampicin prophylaxis was offered to all attendees who were colonized by K. kingae. Following antimicrobial prophylaxis, a new throat swab was taken to confirm bacterial eradication.
ResultsK. kingae was detected by RT-PCR throat swabs in the 3index cases and 5of the 6daycare attendees. Cultures were negative in all cases. After administration of prophylactic antibiotics, 3toddlers were still positive for K. kingae-specific RT-PCR.
ConclusionsClusters of invasive K. kingae infections can occur in daycare facilities and closed communities. Increased awareness and use of sensitive detection methods are needed to identify and adequately investigate outbreaks of K. kingae disease. In our experience, the administration of prophylactic antibiotics could result in partial eradication of colonization. No further cases of disease were detected after prophylaxis.
Hasta la década de los 90, Kingella kingae (K. kingae) fue considerada un patógeno humano excepcional como agente etiológico infrecuente de infecciones osteoarticulares y endocarditis. En los últimos años, gracias a la mejoría de las técnicas de diagnóstico microbiológico y a la mayor concienciación en su reconocimiento, K. kingae está siendo más frecuentemente identificada como causa de enfermedad invasiva (EI) en niños1,2. De hecho, actualmente K. kingae es considerada como el primer agente causal de infecciones osteoarticulares en niños menores de 4 años3-5.
K. kingae forma parte de la flora comensal de la orofaringe. La colonización representa el primer paso en la patogénesis de la EI y está estrechamente relacionada con la edad, detectándose principalmente en niños entre 6 y 48 meses de vida. Presenta un patrón estacional, más frecuente en invierno y principios de primavera3,6,7.
Aunque la mayoría de los casos de EI por K. kingae son esporádicos, en las últimas 2décadas han sido detectados brotes en guarderías de Francia, Israel, Estados Unidos y Luxemburgo8.
Se describe la investigación del primer brote documentado en España, de 3casos de EI por K. kingae en forma de artritis séptica (AS) en una misma clase de guardería en Roses, Girona.
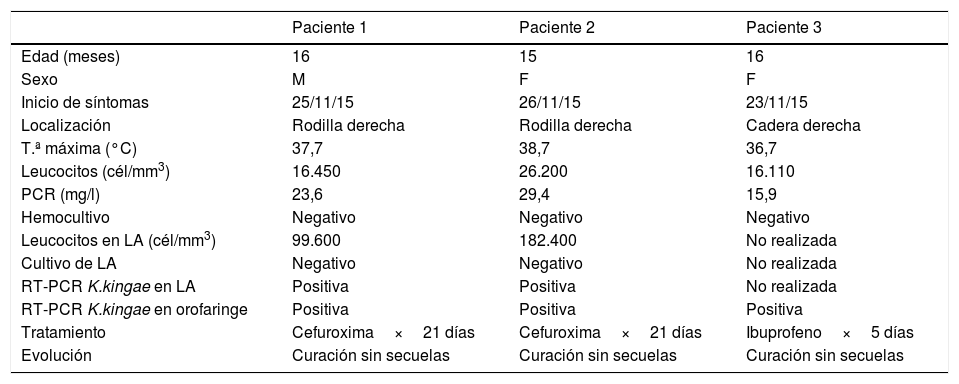
MétodosEntre el 23 y el 26 de noviembre del 2015 se diagnosticaron 2casos de AS por K. kingae en 2lactantes pertenecientes a una misma clase de una guardería en Rosas, Girona. En ambos casos el diagnóstico se llevó a cabo mediante RT-PCR positiva en líquido articular. Posteriormente, apareció un tercer caso probable de AS por K. kingae (clínica compatible y aislamiento mediante RT-PCR específica para K. kingae en frotis orofaríngeo) en una lactante de la misma clase. Dos de los 3casos presentaron el antecedente de una infección respiratoria alta los días previos al inicio del cuadro clínico. Las principales características demográficas y clínicas de los 3pacientes se encuentran resumidas en la tabla 1.
Características demográficas y clínicas de los pacientes con artritis séptica por K. kingae
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Edad (meses) | 16 | 15 | 16 |
| Sexo | M | F | F |
| Inicio de síntomas | 25/11/15 | 26/11/15 | 23/11/15 |
| Localización | Rodilla derecha | Rodilla derecha | Cadera derecha |
| T.ª máxima (°C) | 37,7 | 38,7 | 36,7 |
| Leucocitos (cél/mm3) | 16.450 | 26.200 | 16.110 |
| PCR (mg/l) | 23,6 | 29,4 | 15,9 |
| Hemocultivo | Negativo | Negativo | Negativo |
| Leucocitos en LA (cél/mm3) | 99.600 | 182.400 | No realizada |
| Cultivo de LA | Negativo | Negativo | No realizada |
| RT-PCR K.kingae en LA | Positiva | Positiva | No realizada |
| RT-PCR K.kingae en orofaringe | Positiva | Positiva | Positiva |
| Tratamiento | Cefuroxima×21 días | Cefuroxima×21 días | Ibuprofeno×5 días |
| Evolución | Curación sin secuelas | Curación sin secuelas | Curación sin secuelas |
F: femenino; M: masculino; T.ª: temperatura; RT-PCR: reacción en cadena de la polimerasa con transcriptasa reversa.
A raíz de la aparición de los casos conectados epidemiológicamente, se decidió investigar la prevalencia de colonización nasofaríngea por K. kingae en los 9 niños asistentes a la misma clase de la guardería. Como único criterio de exclusión se estableció el haber recibido antibióticos las 2semanas previas al inicio del estudio. Se obtuvo el consentimiento verbal de los padres para participar en el estudio, que quedó registrado en la historia clínica del paciente.
En diciembre del 2015, se llevó a cabo una entrevista clínica y toma de muestras de frotis faríngeo (FF) de todos los asistentes a la misma clase de guardería. Las muestras se enviaron para su estudio al laboratorio de Microbiología del Hospital Universitari Vall d’Hebrón. La presencia de K. kingae en FF se investigó mediante cultivo, utilizando medios no selectivos y selectivos para dicho microorganismo, y mediante RT-PCR específica de K. kingae. La clonalidad de K. kingae se estudió por multilocus sequence typing y secuenciación del gen que codifica la toxina RTX-A.
Una vez obtenido el resultado se ofreció profilaxis combinada con amoxicilina (80mg/kg/día) y rifampicina (20mg/kg/día) durante 2 días a todos los asistentes que presentaran colonización orofaríngea por K. kingae (cultivo o RT-PCR positivos). A los 14 días de finalizar la quimioprofilaxis secundaria (QS) se tomaron nuevas muestras de FF a aquellos colonizados para confirmar la erradicación bacteriana.
ResultadosTodos los niños estudiados presentaban edades comprendidas entre los 16 y 23 meses, con predominio del sexo masculino (6/9). Mediante RT-PCR se detectó K. kingae en FF de 8/9 niños investigados (tasa de colonización: 88,9%; tasa de ataque: 33,3%). Entre los niños colonizados, se encontraban los 3casos índice de AS y 5compañeros sanos de la misma clase. Todos los cultivos fueron negativos.
Los casos índice en tratamiento antibiótico no recibieron QS. Tanto el caso con RT-PCR negativa como el único caso que no quiso participar fueron excluidos del estudio.
La QS fue bien tolerada, sin presentar efectos adversos. A los 14 días de finalizarla, 2/4 contactos y 1/3 casos índice todavía presentaban RT-PCR positiva para K. kingae. Todos los cultivos fueron, de nuevo, negativos. La tasa de descolonización fue del 57%.
El estudio de clonalidad demostró que todos los contactos y casos eran genéticamente idénticos, concretamente pertenecían a la clona ST-25 y presentaban el alelo 1 del gen rtxA.
No se presentaron nuevos casos de EI por K. kingae en la clase de la guardería durante el año posterior de seguimiento.
DiscusiónEl primer brote documentado de AS por K. kingae en una guardería de España presentó una evolución satisfactoria, con una elevada tasa de colonización orofaríngea entre los asistentes de la misma clase de la guardería, como ha sido descrito previamente8,9.
La prevalencia global de colonización orofaríngea en niños de 2 años es alrededor del 9%, con una prevalencia de hasta un 35% entre los asistentes a guardería9. Diversos factores intervienen en la colonización y la diseminación de K. kingae en una comunidad cerrada: factores relacionados con el microorganismo (virulencia), factores inmunitarios y del huésped, y factores relacionados con el entorno (infección viral previa, ventilación, número de asistentes, grado de hacinamiento, tiempo diario en la guardería, época del año y edad de los asistentes). La edad parece ser el factor fundamental que condiciona la colonización de la orofaringe9,10.
En los últimos 16 años se han recogido en la literatura 22 brotes confirmados de EI por K. kingae en guarderías de Francia, Israel, EE. UU. y Luxemburgo. Se registraron un total de 59 casos, 45% casos confirmados por aislamiento del microorganismo en cultivo o PCR de muestra estéril8,9,11. La mayoría de los casos se presentaron en forma de infección osteoarticular (AS u osteomielitis), de localización única (62/70). La evolución con tratamiento fue favorable en la mayoría de los casos11.
Posterior a nuestro brote, se registró otro brote en Madrid en noviembre del 2016 de 2casos de AR cuyos datos no han sido publicados11,12.
En nuestro brote, 2/3 casos presentaban antecedente de infección respiratoria previa, que facilita la disrupción de la barrera mucosa de la orofaringe y el paso al torrente circulatorio de K. kingae, con especial tropismo por el tejido osteoarticular10.
El estudio de la clonalidad puso en evidencia que la clona ST-25, que presentaba el alelo 1 del gen rtxA, era la responsable del brote y su diseminación en nuestra guardería. Cuatro clonas de K. kingae de distribución intercontinental (ST-6, ST-14, ST-23 y ST-25) fueron las causantes de la mayoría de brotes documentados a nivel mundial y mostraron idéntico perfil genómico9,11,13.
En nuestro brote, la QS con rifampicina y amoxicilina fue correctamente tolerada y presentó una erradicación parcial a los 14 días, similar a la reportada en trabajos previos8,14-16. En consecuencia, su indicación continúa siendo controvertida. Por contra, después de la administración de QS no se detectaron nuevos casos en todos los brotes hasta la fecha8-11.
Nuestro trabajo presenta ciertas limitaciones. La no realización de terapia directamente observada en QS y la dificultad de obtención de crecimiento de K. kingae en el frotis faríngeo, limitando la diferenciación entre colonización y detección de material genético de bacteria no viable en orofaringe, podrían comprometer los resultados obtenidos en la erradicación posterior de la bacteria de la orofaringe.
Aunque no era el objetivo de nuestro trabajo, también consideramos que la evaluación de la transmisión intrafamiliar de K. kingae, particularmente entre hermanos de edades comprendidas entre 6 y 48 meses, podría ser interesante para conocer mejor la cinética de colonización orofaríngea por dicho microorganismo en otro entorno clave a esa edad.
En conclusión, K. kingae puede causar brotes de EI en comunidades cerradas. Para su correcta identificación e investigación se requiere una elevada sospecha diagnóstica y uso de métodos sensibles, fundamentalmente métodos moleculares. En nuestra experiencia, la administración de QS podría resultar en la parcial erradicación de la colonización orofaríngea por K. kingae. No se detectaron nuevos casos de EI por K. kingae en el año posterior de seguimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.