La infección urinaria (IU) nosocomial se relaciona fundamentalmente con la utilización de la sonda urinaria (SU). En este artículo se repasan los mecanismos patogénicos por los cuales los microorganismos alcanzan el tracto urinario, así como la capacidad de adhesión y de formación de biopelículas, lo cual depende tanto del microorganismo como del tipo de SU. En la etiología de la IU del paciente sondado intervienen múltiples microorganismos, lo cual dificulta la elección de un tratamiento empírico adecuado, especialmente si se sospecha infección por microorganismos multirresistentes. En el sondado las manifestaciones clínicas son menos características y el diagnóstico a menudo es difícil. La terapéutica deberá estratificarse según el tipo de IU: mientras la bacteriuria asintomática no requiere habitualmente tratamiento, en el paciente con shock séptico la cobertura deberá ser amplia. Se efectúa un amplio repaso de las medidas preventivas.
Nosocomial urinary tract infections (UTI) are mainly related to urinary catheterisation. In this paper we review the pathogenic mechanisms, particularly the route by which the microorganisms colonise the urinary tract, their adhesion ability, and their capacity to form biofilms, and are related not only to the microorganism but also to the type of urinary catheter. The aetiology of catheter related UTI is variable, and multiresistant microorganisms are often isolated, making empirical antibiotic therapy complex. Clinical findings are frequently atypical, and its diagnosis is difficult. The therapeutic management of catheter-related UTI should be stratified according to the type of UTI: asymptomatic bacteriuria should not be habitually treated, but patients with septic shock should receive a broad spectrum antibiotic. In this review, the value of the different preventive measures are discussed.
La infección del tracto urinario (ITU) de origen nosocomial está relacionada con la presencia de una sonda urinaria (SU) en más del 80% de los casos, y el resto se ha asociado con otras manipulaciones genitourinarias tales como cirugía urológica. Actualmente, entre el 15 y el 25% de los pacientes atendidos en hospitales de agudos (y más del 85% de los atendidos en unidades de cuidados intensivos) son portadores de SU. Las SU siguen siendo una de las causas más frecuentes de ITU nosocomial, aunque su frecuencia ha disminuido en los últimos años con la generalización de los sistemas de drenaje urinario cerrados. La prevalencia de SU nosocomial, que en la década de los sesenta era del 40%, se ha reducido progresivamente, y en los estudios realizados en nuestro medio, como el Estudio de Prevalencia de las Infecciones Nosocomiales en España (EPINE) en 1990 y en la actualidad (2011), las ITU fueron, respectivamente, el 27,7 y el 20,6% de todas las infecciones nosocomiales1-6.
Las ITU en pacientes portadores de SU constituyen un problema de salud pública, por su frecuencia y morbilidad (son una de las causas más usuales de bacteriemia nosocomial), tanto en el hospital como en centros de larga estancia1-5. Por otro lado, los pacientes portadores de SU son un importante reservorio de microorganismos multirresistentes, entre los que se incluyen los gramnegativos productores de betalactamasas de espectro extendido (BLEE) tanto en el hospital como en la comunidad7, lo cual dificulta su tratamiento empírico si la infección urinaria (IU) es grave.
La prevalencia de pacientes con SU en la comunidad se ha estimado entre el 0,02 y el 0,07%, porcentaje que aumenta al 4% en la población anciana asistida, hasta el 20% de internos en residencias geriátricas, y es superior al 35% si existe incontinencia urinaria asociada8. En este colectivo, la IU es una de las causas más frecuentes de fiebre, y el riesgo de bacteriemia es 60veces superior al de los pacientes no cateterizados8. Además, en nuestro país se estima una incidencia de 12 a 20 nuevos lesionados medulares por año, de los cuales el 15% lleva SU 5años después del accidente, y una proporción importante utiliza la cateterización intermitente. Por último, un porcentaje desconocido de pacientes ambulatorios son portadores transitorios de una SU. En estos colectivos la etiología y el patrón de resistencias difieren de las ITU comunitarias, asemejándose más a las ITU nosocomiales, por lo que en la actualidad se consideran como infecciones nosohusiales o asociadas al sistema sanitario, con un tratamiento empírico similar al de las nosocomiales.
Con respecto a las definiciones, se considera como ITU relacionada con el cateterismo urinario la que se presenta durante la permanencia de la SU o en las siguientes 72h tras su retirada. El término bacteriuria asociada al cateterismo urinario se refiere a la presencia de un recuento significativo de bacterias en el urocultivo, en ausencia de síntomas urinarios; es la forma más frecuente de ITU en estos pacientes.
Sistema de drenaje cerrado: se considera cuando no se produce ninguna desconexión entre la unión de la SU con el de la bolsa recolectora; en estos casos el vaciamiento de la bolsa recolectora se efectúa a través de una llave situada en la parte inferior de la bolsa. Para realizar un urocultivo no debe desconectarse la sonda; se pinzará y se realizará la extracción de la orina mediante jeringa y aguja puncionando directamente la sonda o un dispositivo específico a tal efecto.
Desde un punto de vista práctico tiene interés considerar la cateterización de corta duración y el cateterismo permanente (crónico), cuando la duración del mismo es superior a los 30días. Cateterismo único es cuando se realiza una sola inserción uretral sin dejar la sonda en la vejiga urinaria; suele realizarse para descartar obstrucción, para medir el volumen urinario o para obtener una muestra urinaria. Se considera cateterismo intermitente la realización de repetidas inserciones uretrales sin dejar la SU en la vejiga, generalmente en pacientes afectados de vejiga neurógena y con el objetivo de vaciarla.
EpidemiologíaCateterismo de corta duraciónLos pacientes hospitalizados son portadores de una SU una media de 2-4 días. La ITU suele ser monomicrobiana, y la incidencia de bacteriuria asintomática (BA) —definida como la presencia de un urocultivo positivo (>105UFC/ml) en ausencia de síntomas urinarios— e ITU sintomática se relaciona fundamentalmente con la duración de la cateterización. Con un sistema de drenaje abierto, la incidencia de BA a los 3 días es del 100%, mientras que con un sistema de drenaje cerrado oscila entre el 3 y el 6% por día1, y aproximadamente del 50% a las 2semanas5. En los pacientes con BA, la incidencia de ITU sintomática es de aproximadamente el 10%, y el de bacteriemia, entre el 0,5% y el 5%9,10; la bacteriemia se asocia fundamentalmente con la presencia de obstrucción urinaria o bien a hemorragia, asociada o no al recambio traumático de la SU5,10.
En un estudio prospectivo, la incidencia de supuesta ITU fue de 1,43 a 1,6 episodios por 100cateteres-día y la concordancia de los microorganismos aislados en el uro y hemocultivo de solo el 0,52%4. En las unidades de cuidados intensivos, menos del 3% de las bacteriemias se consideran relacionadas con la cateterización urinaria4.
Además de la duración de la cateterización, otros factores (tabla 1) se han asociado con un riesgo superior de BA e ITU sintomática. Las mujeres tienen un riesgo relativo 1,7 a 3,7 veces superior a presentar una ITU. Algunos de estos factores, como la técnica no estéril de inserción, los cuidados de la sonda y los errores de desconexión, son modificables, y por lo tanto la aplicación de medidas puede reducir las tasas de infección3.
Factores de riesgo de infección del tracto urinario en los pacientes con cateterización urinaria
| Duración de la cateterización |
| Sexo femenino |
| Edad superior a 50 años |
| Diabetes mellitus |
| Insuficiencia renal (creatinina >2mg/dl) |
| Enfermedad de base grave |
| Ingreso por enfermedad no quirúrgica |
| Ingreso en servicio de urología u ortopedia |
| Presencia de un catéter ureteral |
| Presencia de colonización uretral por uropatógenos |
| Colonización de la bolsa recolectora |
| Ausencia de urinómetro |
| Desconexiones inadvertidas o erróneas del sistema de drenaje cerrado del catéter |
| Cateterización después del sexto día de hospitalización |
| Inserción de la sonda sin técnica estéril |
| Cuidados inadecuados del sondaje urinario |
Por el contrario, la administración de antibióticos sistémicos o en la bolsa recolectora disminuye la incidencia de bacteriuria durante los primeros días pero a expensas de una mayor colonización por bacterias resistentes5, por lo que su aplicación no está indicada.
Además de la obstrucción y la hematuria, otros factores parecen incrementar el riesgo de bacteriemia, como las infecciones causadas por Serratia spp., el sexo masculino, la diabetes mellitus, la presencia de neoplasia, la terapia inmunosupresora y la administración de corticoides, así como la duración de la hospitalización3.
Cateterismo prolongado o permanenteEn los pacientes con SU permanente, la ITU sintomática, definida como la presencia de fiebre no atribuible a otra causa, se ha estimado entre 6 y 11 episodios por 1.000días de cateterización en ancianos institucionalizados y de 2 a 3,4 episodios en pacientes con asistencia domiciliaria5,11–14. El riesgo de bacteriemia durante el episodio febril oscila entre el 10 y el 24%, y puede llegar a ser 60 veces superior al paciente no sondado. La ITU sintomática se ha relacionado con la obstrucción de la sonda, los recambios traumáticos de la sonda, la presencia de piuria intensa (>50 leucocitos por campo) y la BA por Serratia marcescens8.
Las complicaciones a largo plazo de la SU permanente son la obstrucción de la sonda (50% de los casos), que es más frecuente en pacientes con orinas alcalinas14, la hematuria macroscópica (30% casos), y un mayor riesgo de pielonefritis crónica, epididimitis, prostatitis, absceso prostático, litiasis vesical o renal, y de cáncer vesical1,5,11.
Cateterismo único, cateterismo intermitenteLa tasa de bacteriuria tras un cateterismo único es del 3-5%, y la de IU sintomática es excepcional.
En los lesionados medulares, la cateterización intermitente es una alternativa que se asocia a unas tasas de bacteriuria inferiores al cateterismo permanente, aunque la prevalencia de bacteriuria es del 50%, igual para ambos sexos. Estos individuos presentan entre 18 y 24 episodios de nueva bacteriuria por persona-año. La IU está causada por un solo microorganismo, y el patógeno aislado con mayor frecuencia es Escherichia coli4.
En los lesionados medulares sometidos a cateterismo intermitente la incidencia de ITU sintomática es de 0,41 a 1,86 episodios por 100pacientes-día, con porcentajes similares a los tratados con catéteres-condón, cuyas tasas son de 0,36 por 100personas-año, y claramente inferiores a las de los pacientes con cateterismo permanente, con valores de 2,72 por 100pacientes-día4.
PatogeniaEn condiciones normales, el tracto urinario tiene unos mecanismos de defensa innatos que evitan la colonización de la vejiga urinaria. Entre ellos se incluyen la longitud de la uretra y la propia micción. En el paciente sondado el bulbo de la sonda impide el vaciamiento completo de la misma, quedando orina residual4. Por otro lado, el tracto urinario secreta inhibidores de la adhesión bacteriana como la proteína de Tamm-Horsfall y diversos mucopolisacáridos. Además, la osmolaridad urinaria y el pH inhiben el crecimiento urinario. Se ha observado que el cateterismo urinario interfiere con estos mecanismos de defensa.
Los microorganismos pueden alcanzar la vejiga urinaria por 3 mecanismos3: a)durante la inserción del catéter, que ocurre sobre todo en pacientes ancianos con colonización uretral por uropatógenos y es el mecanismo principal de infección en el cateterismo único e intermitente; b)por vía intraluminal, a través de la luz de la sonda, bien por ruptura del sistema de drenaje cerrado a nivel de las conexiones o por vía ascendente a partir de la bolsa recolectora; en estos casos, las ITU son causadas por microorganismos exógenos como resultado de una transmisión cruzada a partir de las manos del personal sanitario; c)por vía exoluminal, el mecanismo más frecuente, responsable de 2 tercios de las ITU asociadas a cateterización urinaria12. Los microorganismos proceden de la propia flora del tracto intestinal del paciente, colonizan el periné y ascienden a través del espacio entre la SU y la uretra; este mecanismo es más frecuente en la mujer por el hecho de poseer la uretra más corta y ancha; esta vía tiene importancia a partir de la primera semana de sondaje.
Aproximadamente el 15% de los episodios de bacteriuria de origen nosocomial ocurren en forma de brotes que se han asociado a una inadecuada higiene de manos por parte del personal sanitario3.
En la patogenia de la IU asociada a la SU son fundamentales 2 factores: la adhesión y la capacidad de formación de una biopelícula o biofilm, lo cual depende tanto del microorganismo como del tipo de SU3-5. En este sentido, los catéteres de silicona o recubiertos de hidrogel son más resistentes a la fijación de las bacterias que los de goma o látex; además, se ha observado que las SU recubiertas de plata, por sus propiedades bactericidas, o con lecitina, que convierte la superficie del catéter en hidrofóbica, retrasan la adhesión bacteriana2-5,12 y, por tanto, tardan más en obstruirse. Además, se ha constatado que los catéteres de silicona causan menos inflamación uretral y estenosis de la uretra3. Por otro lado, se ha constatado que el material desprendido de las sondas de látex siliconizado disminuye la actividad de los carbapenems sobre Pseudomonas aeruginosa debido a la inhibición reversible de la expresión de la porina OprD.
Una vez adheridas, las bacterias secretarán una serie de polisacáridos que en pocos días formarán una matriz extracelular llamada glucocalix o biofilm; en pacientes sin bacteriuria se observan biopelículas en una semana, mientras que en pacientes bacteriúricos este lapso se acorta a 3días. En el interior del biofilm el crecimiento bacteriano es más lento, probablemente por la falta de oxígeno y nutrientes, y las bacterias se vuelven más resistentes a la acción de los antimicrobianos, bien por dificultar su penetración, bien porque las bacterias presentes en el interior del biofilm tienen una menor capacidad de división (fase estacionaria); por tanto, los antibióticos que actúan sobre la pared bacteriana, como los betalactámicos, perderán actividad. Como consecuencia de ello, el tratamiento antibiótico de una IU asociada a una SU no suele erradicar la bacteria del biofilm, lo cual facilitará las recidivas. En un estudio prospectivo y aleatorizado reciente se ha demostrado que el recambio de la SU es eficaz en la prevención de las recidivas en pacientes con IU sintomática tratada con antimicrobianos14.
Por otro lado, determinados microorganismos, fundamentalmente Proteus spp. y otras especies de Proteeae, pero también bastantes cepas de Klebsiella pneumoniae, P.aeruginosa, S.marcescens y Corynebacterium urealyticum, por la acción de ureasas bacterianas, tienen la capacidad de hidrolizar la urea y dar lugar a la formación de depósitos de cristales de estruvita (fosfato amónico-magnésico) y apatita (fosfato cálcico), que ocluirán la sonda favoreciendo el desarrollo de bacteriemia1-5,14; ello sucede a partir de un pH de 6,7. A nivel práctico, un simple pH urinario puede orientar sobre el tiempo de recambio de la SU. Si el pH es bajo, la SU podría recambiarse cada 3meses o más, y si el PH es elevado (>6,7) el recambio debería efectuarse con mayor frecuencia, especialmente en pacientes con obstrucción de repetición.
Por otro lado, la motilidad de la bacteria puede ser un factor patogénico a considerar, ya que facilitará la ascensión de la bacteria por vía intra o extraluminal. Sin embargo, un factor fundamental en la patogenia de las ITU causadas por enterobacterias como es la presencia de fimbrias o pili con capacidad para adherirse a receptores uroepiteliales específicos, tiene un papel poco relevante en las ITU asociadas al cateterismo vesical. En este sentido se ha observado que, en las ITU invasivas de los pacientes asociadas a sondaje urinario, solo el 10% de las enterobacterias aisladas son portadoras de fimbrias o pili, concepto importante ya que algunas de las estrategias utilizadas en la prevención en las ITU recurrentes, como la administración de arándanos, son ineficaces dado su mecanismo de acción, que consiste en la inhibición de la unión de la fimbria al receptor uroepitelial específico.
Se ha observado que la microbiología del biofilm de la superficie de la sonda es un proceso dinámico en el cual continuamente se incorporan nuevos microorganismos y algunos de los existentes son reemplazados. Por lo tanto, no es infrecuente que la bacteriuria del sondado sea polimicrobiana.
Por último, recientemente se ha demostrado que en pacientes con BA recidivante por el mismo microorganismo, en los cuales se cambia la SU, el reservorio sería el propio tracto urinario, al haberse demostrado la capacidad de los microorganismos de sobrevivir en el interior de las células uroepiteliales, donde también formarían biofilms15-17.
EtiologíaLos microorganismos causales de la IU del sondado proceden de la propia flora del paciente, modificada con frecuencia (especialmente en el sondado permanente) por la presión antibiótica y la transmisión cruzada por las manos del personal sanitario.
La infección inicial en el paciente con cateterismo corto suele ser monomicrobiana y causada en la mayoría de las ocasiones por E.coli u otras enterobacterias. Con menor frecuencia se aísla P.aeruginosa, enterococos, Candida spp. o un microorganismo multirresistente.
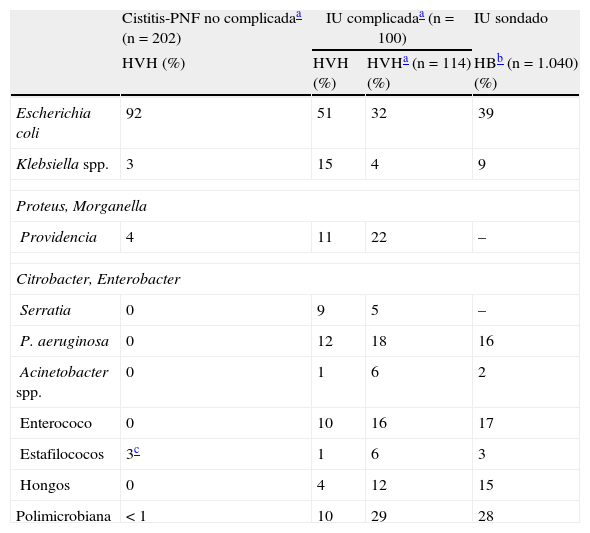
Si el cateterismo es prolongado, la IU suele ser polimicrobiana1 (15% en el sondado corto y hasta el 95% en el prolongado), aislándose una media de 3-5microorganismos. Como se observa en la tabla 2, y comparando con los pacientes con IU no complicada, aumenta la incidencia de infecciones por otras enterobacterias (Klebsiella spp., Proteus spp.), P.aeruginosa y enterococo (favorecido por la administración previa de cefalosporinas). Aunque en algunos países es relativamente frecuente el aislamiento de enterococos resistentes a la vancomicina, en nuestro medio su hallazgo es excepcional en pacientes con ITU nosocomial.
Etiología de la infección urinaria en distintos grupos de riesgo
| Cistitis-PNF no complicadaa (n=202) | IU complicadaa (n=100) | IU sondado | ||
| HVH (%) | HVH (%) | HVHa (n=114) (%) | HBb (n=1.040) (%) | |
| Escherichia coli | 92 | 51 | 32 | 39 |
| Klebsiella spp. | 3 | 15 | 4 | 9 |
| Proteus, Morganella | ||||
| Providencia | 4 | 11 | 22 | – |
| Citrobacter, Enterobacter | ||||
| Serratia | 0 | 9 | 5 | – |
| P. aeruginosa | 0 | 12 | 18 | 16 |
| Acinetobacter spp. | 0 | 1 | 6 | 2 |
| Enterococo | 0 | 10 | 16 | 17 |
| Estafilococos | 3c | 1 | 6 | 3 |
| Hongos | 0 | 4 | 12 | 15 |
| Polimicrobiana | < 1 | 10 | 29 | 28 |
HB: Hospital de Bellvitge; HVH: Hospital Vall d’Hebron; IU: infección urinaria; PNF: pielonefritis.
En el sondaje permanente, y especialmente en pacientes sometidos a tratamientos antibióticos múltiples y/o ingresados en centro sociosanitarios, es relativamente frecuente el aislamiento de gramnegativos multirresistentes, entre ellos Acinetobacter spp., y en nuestro medio particularmente por BLEE, que en E.coli alcanzaron, en 2006, cifras del 8% en el Hospital de Bellvitge, en Hospitalet de Llobregat (Barcelona, España). La prevalencia de BLEE es superior en las infecciones nosocomiales, de manera que si en bacteriemias comunitarias por E.coli podemos estar en un rango de prevalencias del 5 al 15%, en el caso de las nosocomiales sería del 10 al 25%18.
Los principales factores de riesgo para las infecciones por E.coli productor de BLEE se muestran en la tabla 3. La mayoría de los estudios realizados incluyen porcentajes elevados de pacientes con ITU, y uno de los principales factores de riesgo, tanto en la ITU comunitaria como en la nosocomial, es la presencia de SU y las ITU de repetición, por lo que es razonable pensar que estos factores de riesgo son aplicables principalmente a este tipo de infecciones. Otro factor de riesgo a considerar para sospechar una infección por BLEE es la utilización reciente de cefalosporinas de tercera generación y/o fluorquinolonas. Aunque todavía la mayoría de los pacientes con ITU, complicada o no, tienen uno o más factores de riesgo, el hecho de que las BLEE se estén diseminando en la población podría aumentar la probabilidad de que ocurran infecciones en personas sin factores de riesgo18.
Factores de riesgo para infección por E. coli productor de BLEE
| Infección comunitaria |
| Mayor edad |
| Diabetes mellitus |
| Infecciones urinarias de repetición |
| Sonda urinaria |
| Viaje reciente a zonas de alta prevalencia |
| Uso reciente de aminopenicilinas, cefalosporinas o quinolonas |
| Infección nosocomial |
| Mayor duración del ingreso |
| Sonda urinaria |
| Uso reciente de quinolonas y cefalosporinas |
Un problema creciente en nuestros hospitales, y sin relevancia clínica hace tan solo 7 años7, es la emergencia de bacteriemias por P.aeruginosa multirresistentes, cuyo foco de origen a menudo es el tracto urinario19. Ello complica aún más el tratamiento empírico del paciente grave con ITU nosocomial.
Además, en algunos países, como Grecia, se han extendido las infecciones por enterobacterias, especialmente por Klebsiella spp. productoras de carbapenemasas, cuyo origen con frecuencia también es el tracto urinario. Este preocupante problema, aun infrecuente en nuestro medio pero que ya hemos observado, sobre todo en pacientes con ITU nosocomial asociado a cateterismo urinario, es posible que en un futuro complique aún más el tratamiento empírico de la ITU nosocomial.
En el sondado no son infrecuentes las infecciones por Candida spp., cuya frecuencia aumenta en pacientes diabéticos y particularmente en pacientes sometidos a múltiples tandas de antibiótico20.
A pesar de que en nuestros centros sociosanitarios hasta el 30% de los pacientes están colonizados, la IU sintomática por S.aureus resistente a la meticilina (SARM) es muy poco frecuente, lo cual tiene implicaciones clínicas en el tratamiento empírico del paciente con ITU nosocomial21. En el sondado, el aislamiento de estafilococos coagulasa-negativos se asocia pocas veces con ITU sintomática.
Un aspecto importante es el hecho que en el sondado permanente la flora bacteriana cambia con frecuencia, por lo cual un urocultivo previo tomado semanas antes no permite orientar la terapia empírica si el paciente presenta una bacteriemia de origen urinario. Por último, los microorganismos procedentes de la orina vesical tras recambiar la SU pueden diferir de los aislados a partir del cultivo de la propia sonda, por lo que algunos autores recomiendan recoger el urocultivo una vez cambiada la SU, si esta es permanente.
Manifestaciones clínicasEn el sondado permanente la cistitis aislada es poco frecuente, ya que a menudo está afectado el tracto urinario superior. La cistitis puede observarse en sondajes de corta duración en pacientes sin enfermedad urológica previa, los cuales presentan tras la retirada de la sonda un síndrome miccional sin fiebre ni dolor lumbar. En el anciano, y particularmente en el lesionado medular, suelen faltar los síntomas de disuria, polaquiuria y frecuencia urinaria. En el lesionado medular, en ocasiones el único dato de ITU es un aumento de la espasticidad, signos de disreflexia (diaforesis o malestar abdominal) o inquietud.
Más difícil es establecer el valor clínico de una orina maloliente (debido a la transformación de la urea en amonio por la acción de las ureasas que producen determinadas bacterias) como signo guía de una IU, ya que no todos los pacientes con una orina maloliente tienen una ITU sintomática, ni todos los pacientes con ITU sintomática tienen una orina maloliente3.
En los pacientes con afectación del parénquima renal las manifestaciones clínicas son mucho menos específicas, ya que la mayoría de los pacientes sondados son individuos ancianos o parapléjicos, y en consecuencia con alteraciones en la sensibilidad. En los pacientes con pielonefritis, la fiebre sin clínica focal es el síntoma más común, aunque esta puede ser poco elevada. El dolor lumbar a menudo es poco manifiesto y localizado en el flanco o el hipogastrio. No es inhabitual que los pacientes consulten por un deterioro de su estado neurológico basal con delirio, por hipotensión, por un deterioro del estado general con astenia, apatía y deterioro funcional, o bien por la descompensación de una diabetes mellitus o una hepatopatía crónica8,22.
En ancianos que han fallecido llevando un catéter uretral permanente se documenta inflamación renal aguda hasta en el 38% de los casos, y en los varones con lesiones de la médula espinal es común la localización prostática. Por lo tanto, todo varón con ITU asociada a sondaje debe ser explorado en busca de supuración periuretral, un signo de infección de las glándulas periuretrales o de prostatitis, o de signos sugestivos de orquiepididimitis.
Por otro lado, la presencia de «molestias urinarias» en forma de síndrome miccional, dolor o irritación en el pene o la vagina son tan frecuentes en el paciente sondado sin IU (hasta en el 60% de los casos), a causa de la propia irritación que causa la sonda, que son de escasa utilidad clínica para etiquetar dichas manifestaciones como secundarias a una IU sintomática9.
Además, en el sondado con BA, la presencia de piuria es tan frecuente que carece de valor predictivo de infección clínica. Por otro lado, en un estudio prospectivo se observó que la presencia de piuria no predecía el desarrollo de BA en un porcentaje significativo de pacientes, especialmente en infecciones por grampositivos o Candida spp.23. Así mismo, en las IU causadas por bacterias productoras de ureasa el número de leucocitos puede ser normal, debido a que estas células pueden ser destruidas al ser centrifugadas.
Desde un punto de vista práctico, es importante intentar establecer cuál ha sido el mecanismo de la ITU febril (con o sin bacteriemia asociada), y nos hemos de plantear si el paciente tiene una pielonefritis o una prostatitis aguda, que requerirán de un tratamiento prolongado, o ha presentado un episodio transitorio de bacteriemia, como sucede tras el recambio traumático de la SU. En esta situación, que se asocia con la presencia de hematuria, la duración del tratamiento puede ser más corta (5-7días).
DiagnósticoEl diagnóstico de IU sintomática es difícil en el sondado, como se ha comentado anteriormente, por lo inespecífico de los síntomas clínicos —especialmente en pacientes de edad avanzada—, por el hecho que la propia SU puede causar un síndrome irritativo vesical, y por el escaso valor predictivo de infección clínica que tiene la presencia de piuria.
Para confirmar el diagnóstico, la mayoría de los autores requieren de la presencia de piuria, definida como más de 10 leucocitos por campo, y de un urocultivo positivo (presencia de bacteriuria). El grado de piuria no permite diferenciar entre el paciente con ITU sintomática o asintomática, tanto en el paciente con cateterización corta, prolongada o intermitente, y por tanto tiene escaso valor diagnóstico. Sin embargo, la ausencia de piuria en un paciente con síntomas urinarios debe sugerir un diagnóstico distinto al de ITU.
Dada la enorme variabilidad etiológica y la susceptibilidad antimicrobiana, antes de iniciar un tratamiento antibiótico, en cualquier ITU asociada a alguna modalidad de cateterización urinaria siempre debe solicitarse un urocultivo. En el paciente con cateterismo corto el urocultivo se ha de recoger sin abrir el circuito cerrado, puncionado la sonda o bien el dispositivo pertinente. En el paciente con cateterismo permanente se recomienda recambiar la sonda y posteriormente realizar el urocultivo para evitar la contaminación por microorganismos presentes en el interior del biofilm2,4. Nunca debe realizarse urocultivo a partir de orina recogida de la bolsa recolectora.
En la práctica, la presencia de más de 103UFC/ml (aunque habitualmente el recuento es superior a105UFC/ml) de un microorganismo uropatógeno se considera significativa2,8. Como criterio de BA se mantiene el valor de más de 105UFC/ml.
En el paciente que lleva varios días sondado, incluso con un sistema de drenaje cerrado, la presencia de bacteriuria es frecuente, por lo cual el valor predictivo de la prueba disminuye considerablemente. Además, el hallazgo en el urocultivo de más de un microorganismo, que habitualmente se consideraría una contaminación, debe ser interpretado con cautela, ya que en el sondado la ITU a menudo es polimicrobiana, especialmente en el cateterizado permanente. Por ello, el diagnóstico definitivo de una ITU en el paciente sondado requiere una evaluación clínica cuidadosa para descartar otros posibles focos de infección.
No existe un consenso sobre los criterios clínicos para establecer el diagnóstico de ITU sintomática. En una revisión reciente, el criterio más utilizado fue tan inespecífico como presencia en el urocultivo de más de 104UFC/ml asociada a signos y síntomas sistémicos23,24. En una conferencia de consenso del año 199125 se establecía como diagnóstico la presencia de 2 a 4 criterios: 1)fiebre, en ausencia de otra etiología; 2)dolor en el flanco o suprapúbico de nueva aparición; 3)cambios en el aspecto de la orina, y 4)deterioro del estado mental o funcional. En otra conferencia de consenso más reciente26, para establecer el diagnóstico se requería la presencia de disuria aguda o fiebre >37,9°C o aumento de 2grados por encima de la temperatura basal, en ausencia de otro diagnóstico asociado a uno de los siguientes: a)urgencia (nueva o que empeora); b)frecuencia miccional; c)dolor suprapúbico; d)hematuria franca; e)dolor en el ángulo costovertebral, o f)incontinencia urinaria.
Las guías recientes de la Sociedad Americana de Enfermedades Infecciosas (IDSA) concluyen, con un nivel de evidencia A-III, que son signos y síntomas «compatibles» con ITU la presencia de fiebre, los escalofríos, la alteración del estado mental, el mal estado general o la presencia de obnubilación sin otra etiología evidente; hematuria aguda; dolor en el flanco y/o en el ángulo costovertebral; y en pacientes en los cuales se ha retirado ya el catéter, la presencia de disuria, urgencia, polaquiuria y/o presencia dolor o molestias suprapúbicos. Además, en el lesionado medular un aumento de la espasticidad y signos de disreflexia autonómica son síntomas también compatibles con ITU2.
Por último, queremos remarcar que la tinción de Gram puede ser de utilidad en el enfoque terapéutico inicial, especialmente en el paciente grave, dada la naturaleza polietiológica de esta infección5,8. En este sentido, la presencia de cocos grampositivos establecería la necesidad de una cobertura antibiótica activa frente a estos microorganismos, y su ausencia probablemente la descartaría.
TratamientoLa decisión terapéutica se basará en la gravedad de las manifestaciones clínicas que presente el paciente, en el o los microorganismos más probables (la administración previa de cefalosporinas favorece la infección por enterococo), y en el o los patrones de resistencia de los principales microorganismos involucrados en la ITU. En este sentido en España, en la actualidad y globalmente, entre el 20 y el 25% de las ITU causadas por E.coli son resistentes a las fluorquinolonas, porcentaje que es mucho más elevado —alrededor del 50% según nuestra experiencia— en el paciente con ITU complicada y en el sondado, por lo que estos antibióticos no deben emplearse empíricamente en pacientes con ITU graves. Además, un porcentaje no despreciable de pacientes con ITU relacionada con el sondaje urinario tienen infecciones causadas por BLEE.
Así mismo, es fundamental, realizar una detallada historia clínica para determinar los antibióticos administrados recientemente. Se ha demostrado que la utilización de un determinado antibiótico en los 1-2meses previos aumenta significativamente la posibilidad de una ITU por un microorganismo resistente al mismo. Por último, debe considerarse el antecedente de colonización-infección previa por microorganismos resistentes del propio paciente; así, la colonización previa por SARM o BLEE deberá incluirse entre las posibilidades etiológicas.
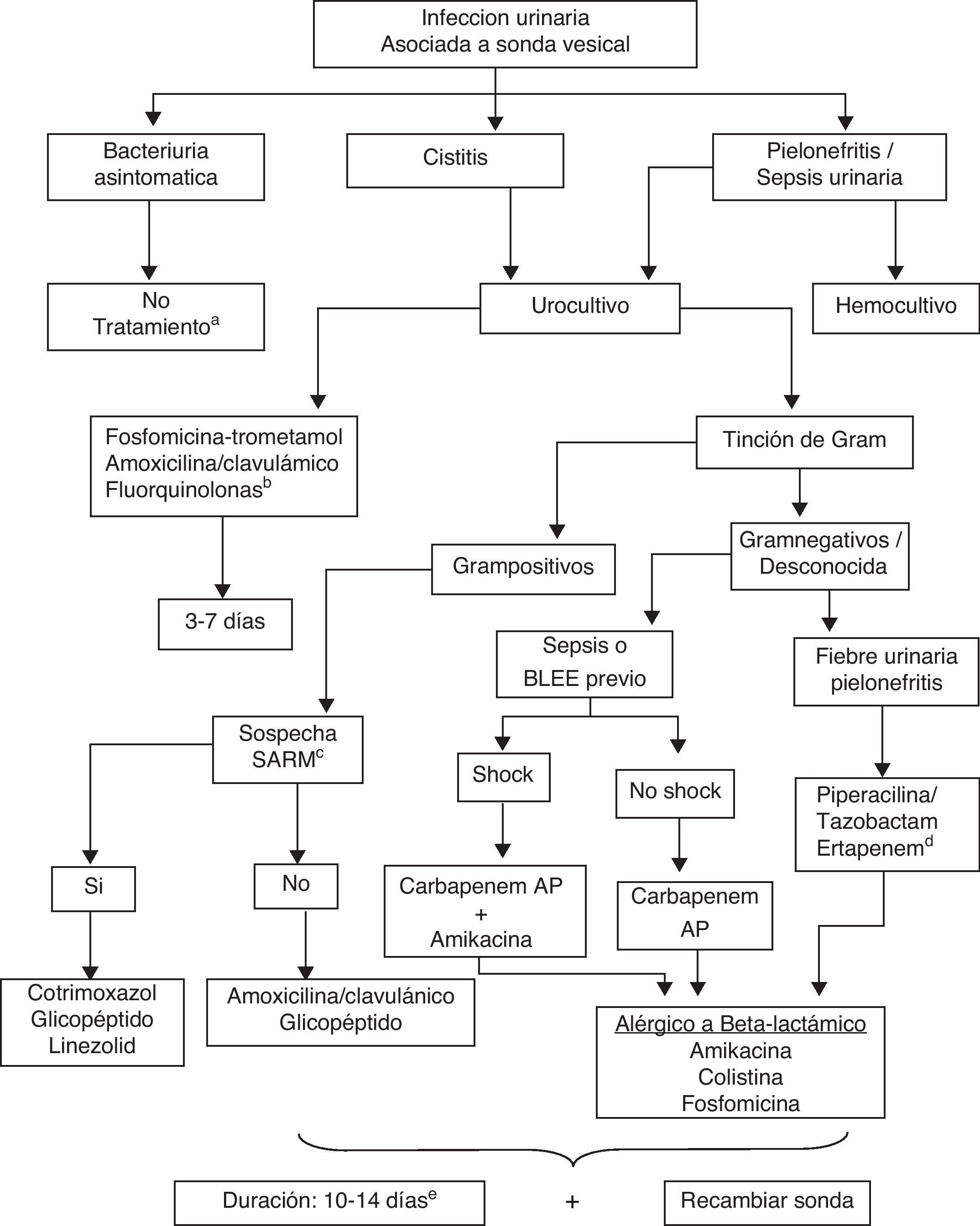
La actitud terapéutica en la ITU asociada a un cateterismo vesical ha de diferenciar si se trata de una BA, de una cistitis o de una pielonefritis/sepsis urinaria. En la figura 1 se muestra un algoritmo de actuación en cada una de estas situaciones.
Algoritmo de actuación en la infección urinaria asociada a catéter vesical.
AP: antipseudomónico; SARM: Staphylococcus aureus resistente a la meticilina (cloxacilina).
a Excepto cirugía urológica, embarazadas, bacteriuria persistente tras la retirada de la sonda, cirugía de prótesis de cadera o lumbar baja, neutropenia o trasplante renal.
b Evitar si se han administrado quinolonas recientemente.
c Las BLEE incluyen enterobacterias con betalactamasas de espectro extendido (o AMPc).
d Si hay bajo riesgo de Pseudomonas aeruginosa (infección comunitaria en sondaje intermitente o sondaje corto en paciente sin antibióticos previos).
e Si hay sepsis tras manipulación, acortar la duración a 5-7 días.
En el paciente sondado (corto, permanente o intermitente) no está indicada la detección sistemática de la presencia de BA, tanto si tiene o no piuria asociada. La detección de BA generalmente no requiere de tratamiento antibiótico, ya que: a)el riesgo de desarrollar una IU sintomática es bajo; b)la BA recurrirá a los pocos días; c)el tratamiento de la BA no reduce el porcentaje de episodios febriles de origen urinario con respecto a los pacientes no tratados, y d)la administración de antibióticos repetidos condicionará la selección de microorganismos resistentes, lo cual dificultará en un futuro el tratamiento de una ITU sintomática2,8,27.
Sin embargo, la BA deberá ser tratada antes de someter al paciente a cirugía urológica debido al elevado riesgo de bacteriemia (25-60%) y sepsis, y ante cualquier manipulación del tracto urinario con riesgo de sangrado de la mucosa urinaria (excepto en el recambio de sonda).
Algunos autores aconsejan tratar también la BA persistente tras la retirada de la SU en la mujer2,27, basándose en un estudio aleatorizado, realizado en mujeres con cateterismo de corta duración, en el cual la incidencia de ITU sintomática fue del 17% en el grupo no tratado versus el 0% en el grupo que recibió antibióticos28. Sin embargo, en las guías de la IDSA no se recomienda la detección sistemática de la presencia de BA tras retirar la SU.
En las embarazadas sometidas a cateterización urinaria se recomienda el tratamiento de la BA, dado el elevado riesgo de desarrollar pielonefritis y parto prematuro, aunque no se dispone de ensayos clínicos controlados al respecto2.
Aunque no hay suficiente evidencia científica que apoye el tratamiento de la BA en los pacientes que deben ser sometidos a cirugía ortopédica de cadera o fusión espinal de segmentos lumbares, en un estudio reciente realizado en pacientes sometidos a cirugía espinal, la detección y el tratamiento de la BA redujeron la incidencia de infección de la herida quirúrgica por gramnegativos29. Como es conocido, en estos pacientes los uropatógenos no son infrecuentes como causa de infección de la herida, especialmente en enfermos con incontinencia urinaria o en los sondados. Aunque en dichas cirugías no se recomienda descartar la presencia de BA, si detectamos una orina o un urinoanálisis patológico/s recomendamos realizar un urocultivo, y en caso de detectar >105UFC/ml, tratar la BA antes del procedimiento quirúrgico.
Aunque no hay recomendación específica, el tratamiento de la BA puede considerarse en los primeros 6 meses posteriores al trasplante renal y en el paciente neutropénico. Tampoco se recomienda la detección sistemática de la BA en este colectivo de pacientes.
En el paciente sondado tampoco está indicado el tratamiento de la candiduria asintomática, ya que en un estudio doble ciego de fluconazol versus placebo las tasas de erradicación fueron similares (61% vs 56%)30.
Infección urinaria sintomáticaEl tratamiento de la IU sintomática y el de la bacteriemia requieren la administración de antibióticos. El tratamiento empírico se seleccionará basándose en las tasas de resistencia locales, en la terapia antibiótica reciente y en la elección de un antibiótico con elevada eliminación urinaria; cabe recordar que la tigeciclina y el moxifloxacino tienen una escasa eliminación urinaria. Previamente debe realizarse siempre un urocultivo, dada la variabilidad etiológica y en la susceptibilidad antimicrobiana de los uropatógenos aislados.
La cistitis aislada es poco frecuente en el sondado permanente, ya que a menudo está afectado el tracto urinario superior. Puede observarse tras la retirada de la SU, en sondajes de corta duración, en pacientes sin patología urológica previa. La fosfomicina-trometamol a una dosis de 3g, por su elevada actividad frente a E.coli, P.aeruginosa y los grampositivos, es una buena opción terapéutica. La amoxicilina/clavulámico 500mg/8h puede ser una alternativa en unidades con bajo riesgo de infección por P.aeruginosa y en pacientes sin tratamiento antibiótico previo.
En la cistitis postsondaje se aconseja un tratamiento de 7 días, y aunque no se dispone de estudios con pautas más cortas, algunos autores recomiendan el tratamiento durante 3días en pacientes con síntomas leves. Si se emplea fosfomicina-trometamol, por su vida media prolongada, se aconseja administrar una dosis (pauta corta) o 2 dosis separadas 3 días, días uno y 4 en la pauta prolongada.
En los pacientes con pielonefritis y/o sepsis urinaria el tratamiento se iniciará por vía parenteral, generalmente en el medio hospitalario. El tratamiento antibiótico empírico ha de abarcar, además de las enterobacterias convencionales, a las productoras de BLEE, a P.aeruginosa y a enterococos. En esta situación la tinción de Gram puede ser de inestimable ayuda.
Si la tinción de Gram muestra microorganismos grampositivos y no se sospecha infección por un SARM, la amoxicilina/clavulánico 1gi.v./8h puede ser una buena opción terapéutica, ya que cubre tanto a enterococos como a S.aureus. En el paciente con sospecha de SARM (colonización previa) y en el alérgico a los betalactámicos se iniciará tratamiento con glucopéptidos (vancomicina, teicoplanina). El cotrimoxazol es una buena opción terapéutica en la infección por SARM.
En el paciente con sepsis grave asociada a infección nosocomial o relacionada con los cuidados sanitarios, o sondados con ITU comunitaria y factores de riesgo (colonización previa por multirresistentes, administración previa de cefalosporinas de segunda-tercera generación o fluoroquinolonas en los últimos 3meses o neutropenia), si no disponemos de la tinción de Gram o si la tinción de Gram muestra microorganismos gramnegativos, la opción más segura es un carbapenem antipseudomónico (imipenem, meropenem). La adición de un aminoglucósido, amikacina (15mg/kg/día), solo está justificada si el paciente presenta shock séptico o existen razones epidemiológicas que hagan sospechar resistencia a los carbapenems.
La necesidad de una cobertura empírica adecuada ha de hacerse compatible con un uso racional de los carbapenems, ya que un aumento considerable en su consumo puede condicionar un aumento de las resistencias a ellos. En nuestro entorno, donde las infecciones por AMPc son poco frecuentes, en el paciente no grave, como alternativa a los carbapenems antipseudomónicos podría utilizarse piperacilina/tazobactam 4g/6h, ya que es activa in vitro frente al 75-90% de las cepas de E.coli productoras de BLEE, y en un estudio reciente de pacientes con bacteriemia por BLEE la eficacia fue similar a los carbapenems, particularmente cuando la infección era del tracto urinario y la CMI a piperacilina-tazobactam inferior a 431.
En el paciente febril, no grave, con infección adquirida en la comunidad (p.ej., paciente con sondaje intermitente por vejiga neurógena) y sin factores de riesgo de organismos resistentes (ausencia de exposición antibiótica en los últimos 3meses), la prevalencia de enterococos y P.aeruginosa es inferior al 10%, por lo que el ertapenem (un carbapenem no antipseudomónico) podría considerarse una opción aceptable8. También podría utilizarse ertapenem en el tratamiento de la ITU nosocomial no grave en pacientes con sondaje corto y sin exposición reciente a antibióticos ingresados en un área de bajo riesgo de P.aeruginosa.
En el paciente claramente alérgico a los betalactámicos, la amikacina podría ser una alternativa. Por las bajas tasas de resistencia, la fosfomicina sódica, de la cual se dispone de escasa experiencia, podría ser una alternativa32, aunque en ITU con un elevado inóculo podrían seleccionarse mutantes resistentes.
Otra alternativa la constituiría la colistina, que además de ser nefro y neurotóxica, tiene el inconveniente de que, en la mayoría de nuestros hospitales, no se dispone de la determinación de los niveles séricos para poder ajustar la dosis; además, no es activa frente a Proteeae, S.marcescens y enterococos8.
El tratamiento antibiótico empírico será modificado por uno de espectro más reducido cuando se conozca la sensibilidad del agente etiológico.
En las infecciones por BLEE, los carbapenems son preferibles a las fluoroquinolonas y a la cefepima33,34. Si bien inicialmente se había sugerido que los betalactámicos/inhibidores de las betalactamasas tenían una eficacia inferior33,34, en estudios recientes constituyen una alternativa válida incluso en pacientes bacteriémicos31.
La tigeciclina puede fracasar en el paciente bacteriémico, debido a los bajos niveles sanguíneos, y es desaconsejable en el tratamiento de las ITU por su baja concentración urinaria33,34.
La colistina y los aminoglucósidos pueden ser una alternativa, por su elevada actividad in vitro frente a estos patógenos (en especial la amikacina), aunque hasta la fecha la experiencia clínica es escasa33,34. Aunque la fosfomicina es activa in vitro frente a los BLEE, disponemos de escasa experiencia clínica tanto con el preparado oral como con el parenteral32,35,36. Si bien la fosfomicina-trometamol parece eficaz, con tasas de curación del 78-93%35,36, en dichos estudios no se realizó urocultivo de control al mes para evaluar las tasas de recidiva microbiológica.
La duración de la terapia antibiótica no está bien establecida2-5,8. Si existe clínica (dolor lumbar, puñopercusión positiva) o sospecha de afectación del parénquima renal (pielonefritis), se aconsejan 10-14días de tratamiento, en función de la gravedad de la ITU. En el paciente sondado no se dispone de estudios con pautas cortas (7días con fluoroquinolonas). En los pacientes que presentan una sepsis urinaria secundaria a lesión de la mucosa urinaria (p.ej., recambio de sonda), y si no existe evidencia de pielonefritis o prostatitis subyacente, el tratamiento podría acortarse a 5-7días5,8.
En la cistitis por Candida spp. sensible se aconseja fluconazol 200mg/día durante 7-14días37. En la pielonefritis/sepsis urinaria se aconseja fluconazol 400mg durante 2 semanas. Si la candiduria recidiva tras el tratamiento, deberá descartarse mediante técnicas de imagen un «bola de hongos» a nivel renal. En las infecciones por Candida spp. resistente a los azoles la alternativa sería la anfotericina, ya que se dispone de escasa experiencia con equinocandinas, cuya eliminación urinaria es baja.
En los portadores de una SU con una duración de más de una semana se recomienda el recambio de la misma para evitar la recidiva de la infección relacionada con la persistencia de las bacterias adheridas a la sonda, en forma de biofilm (biocapa o glucocalix)2,5,8. Además, en un estudio prospectivo y aleatorizado en sondados permanentes, la sustitución de la sonda por una nueva antes de iniciar el tratamiento se asociaba a una menor duración de la fiebre y a una mejora de la situación clínica a las 72h38.
La administración de antibióticos profilácticos al recambiar una SU era una práctica habitual hace años, especialmente en los pacientes con sondaje permanente, que condicionó la selección de microorganismos resistentes. En la actualidad no se recomienda la administración profiláctica de antibióticos en el recambio de la SU, ya que el riesgo de sepsis grave es muy bajo2,5. Podría indicarse en el recambio de un sondaje traumático con hematuria, ya que en esta situación el riesgo de bacteriemia es superior.
PrevenciónEn relación a la prevención de las ITU relacionadas con la cateterización urinaria podemos actuar a distintos niveles, y existen factores de riesgo claramente modificables.
Debe recordarse que la mayoría de las bacteriurias relacionadas con el cateterismo son asintomáticas y, por lo tanto, las medidas que previenen la aparición de la bacteriuria tienen un impacto clínico mucho menor, ya que son pocos los pacientes que desarrollan una ITU sintomática, y menos aun los que presentan una ITU grave (bacteriemia); por ello, antes de aplicar una determinada medida deben evaluarse siempre los beneficios y los riesgos (efectos secundarios), así como su coste.
Evaluación de la necesidad de inserción y retirada precoz del catéterEs conocido que cerca del 50% de las cateterizaciones son innecesarias; cabe recordar que salvo circunstancias especiales (heridas o cirugía del área perineal) el sondaje vesical no está indicado para controlar una incontinencia urinaria. Por otro lado, su duración a menudo es excesiva, y además existen otras alternativas de drenaje vesical con menos riesgo de BA, como son la colocación de una sonda-condón en los varones y la cateterización intermitente en los lesionados medulares1-5,8. Aunque la cateterización suprapúbica reduce la bacteriuria y las complicaciones locales (erosión del meato, epididimitis, prostatitis) en los varones, su uso no se ha generalizado debido a la mayor complejidad de colocación y el riesgo, aunque mínimo, de complicaciones quirúrgicas (sangrado, etc.)39.
Por lo tanto, evitar la colocación de SU y acortar la duración del sondaje son medidas primordiales para reducir la IU nosocomial. En este sentido, una revisión reciente de la Cochrane concluyó que la retirada temprana de la sonda (a la medianoche) después de cirugía urológica se asoció con menor riesgo de IU y una estancia más corta, aunque supuso un tiempo más prolongado hasta la primera micción40. Estas medidas preventivas no son eficaces para prevenir la bacteriuria en el sondaje permanente. En esta situación, la prevención irá encaminada a evitar la obstrucción y la infección clínica.
Diversas estrategias, como el recordatorio por parte de las enfermeras u órdenes automáticas de retirada (si se cumplen determinados requisitos), que pueden ser realizadas por vía electrónica, son eficaces en la reducción de la duración de la cateterización y de las tasas de BA e ITU sintomática2. No existe evidencia de que la «rehabilitación vesical» antes de la retirada de la sonda tenga unas tasas de recateterización superior a la retirada directa de la sonda, acortando este último procedimiento la duración del sondaje2.
Inserción y cuidado del catéterLas medidas generales destinadas a prevenir la BA relacionada con un cateterismo de corta duración incluyen la utilización de un equipo estéril y una técnica aséptica en el momento de la inserción, reducir al mínimo las desconexiones de la SU con el sistema colector, asegurarse que este último esté en una posición declive respecto a la vejiga, y evitar que el tubo caiga por debajo de la bolsa de recogida2,5,8,41,42. Es importante el lavado de manos antes y después de vaciar el depósito de orina para minimizar la contaminación exógena del mismo y el riesgo de transmisión cruzada de microorganismos resistentes, en pacientes institucionalizados.
Los catéteres deben ser insertados por personal entrenado utilizando una técnica estéril. En la actualidad se desconoce si antes de la inserción de la sonda es mejor realizar el lavado del meato con agua estéril o con un antiséptico, ya que en un estudio comparativo con clorhexidina al 0,1% no se detectaron diferencias significativas en la incidencia de bacteriuria3.
En el paciente con cateterización intermitente se ha demostrado que una técnica de inserción estéril (guantes y talla estéril y lavado del área genital con antisépticos) no fue más efectiva en la prevención de la IU sintomática que la aplicación de una técnica limpia (lavado de manos con jabón, guantes no estériles y lavado genital con agua), y esta última es menos costosa2,43
Estrategias de prevención una vez colocada la sonda urinariaEl lavado diario del meato uretral y la aplicación periuretral de antisépticos o cremas de antibióticos son ineficaces en la reducción de la bacteriuria5. Por otro lado, la aplicación de antibióticos en la bolsa recolectora o los lavados vesicales con antibióticos o antisépticos locales, aunque pueden retrasar la aparición de la bacteriuria, no reducen el número de IU sintomáticas y tienen el inconveniente de facilitar el desarrollo de infecciones por microorganismos resistentes, ya que el circuito cerrado se transforma en abierto2,5,41,42.
Circuito de drenaje cerradoLa instauración de los sistemas de drenaje cerrado reduce la incidencia de bacteriuria e ITU sintomática en pacientes con cateterización corta o suprapúbica; sin embargo, la eficacia de esta medida en la prevención de ITU sintomáticas es menos clara en el paciente con cateterismo prolongado2. No se recomienda la utilización de sistemas de drenaje complejos, cuyo coste es superior y no reducen la incidencia de BA de forma significativa. Deben realizarse sesiones de formación periódicas para evitar violaciones del sistema de drenaje cerrado, como, por ejemplo, en la toma de un urocultivo que deberá obtenerse mediante punción de la sonda o del dispositivo pertinente, y nunca desempalmando la sonda de la bolsa recolectora2.
Antibióticos sistémicosVarios estudios, tanto observacionales como controlados, han demostrado que la administración de antibióticos sistémicos reduce la incidencia de BA e IU clínica en las primeras 2 semanas de cateterización2-5,8. Sin embargo, la administración de antibióticos sistémicos se asocia a un riesgo de colonización por microorganismos resistentes2-5,8. Dado que hasta el momento presente no haya podido demostrarse que la administración de antibióticos sistémicos reduzca la ITU grave (con bacteriemia), ni la mortalidad, no se recomienda su administración profiláctica, dados sus elevados costes, los posibles efectos adversos y la posibilidad de selección de microorganismos resistentes, tanto en el individuo como en la unidad hospitalaria correspondiente. Además, la sobreutilización de antibióticos puede favorecer la aparición de Clostridium difficile36. Aunque no está indicada la detección rutinaria de la presencia de BA en el paciente cateterizado37, si se detecta su presencia en pacientes de riesgo, como en embarazadas y en el paciente granulocitopénico, o previa cirugía urológica, deberá plantearse su tratamiento5,8, como se ha expuesto anteriormente.
En el sondado permanente tampoco existe evidencia de que el tratamiento de la BA reduzca las tasas de ITU sintomática8.
En el paciente con vejiga neurógena y cateterización intermitente, aunque la profilaxis con antibióticos reduce la incidencia de BA, no reduce de forma significativa la de ITU sintomática5,8 e incrementa el riesgo de resistencias. Aunque en un estudio reciente y observacional realizado en lesionados medulares con cateterización intermitente la administración cíclica semanal de antibióticos redujo la incidencia de ITU sintomática y los episodios febriles atribuidos a IU, así como el consumo de antibióticos44, se necesitan diseñar estudios prospectivos, aleatorizados y doble ciego para conocer los beneficios reales de esta actitud, evaluando especialmente la selección de microorganismos multirresistentes.
Aunque existe un riesgo de ITU sintomática tras la retirada de la sonda en pacientes quirúrgicos, y algún estudio ha demostrado una reducción de las tasas de ITU sintomática en los pacientes tratados con antibióticos, en otros trabajos no se ha podido demostrar dicho beneficio y las ITU fueron causadas por un microorganismo resistente al antibiótico administrado previamente45. En la actualidad no existe consenso sobre la necesidad de realizar tratamiento antibiótico tras la retirada de la SU2.
Sondas recubiertas con antimicrobianos o preparados de plataEn las últimas 2 décadas se han incorporado en las SU diversas sustancias a base de compuestos argénticos o antibióticos (minociclina-rifampicina, nitrofurazona) con el fin de evitar la adhesión de los microorganismos y la formación de biopelículas2-5,8.
Los catéteres recubiertos de óxido de plata fueron retirados por falta de eficacia46,47. Sin embargo, en una revisión del año 2004 realizada por la Cochrane, que incluía 8 estudios comparativos sobre sondas recubiertas de aleaciones de plata versus catéteres estándar, se observó que las sondas con aleaciones de plata reducían la incidencia de BA y de ITU sintomática, especialmente en la primera semana46. Por otro lado, en una revisión más reciente, que incluía 9 estudios, aunque se concluía que las sondas impregnadas con plata reducían la incidencia de BA47, era escasa la evidencia sobre su efecto en la incidencia de ITU sintomática, y especialmente en la prevención de la bacteriemia de origen urinario, la mortalidad, la resistencia antimicrobiana y la relación costes-beneficios. En la actualidad no hay evidencia suficiente para recomendar su utilización, y más teniendo en cuenta el riesgo de desarrollo de resistencia a la plata, ya descrita en unidades donde su utilización es amplia, como en las unidades de quemados2,41-48.
Aunque en estudios comparativos las sondas impregnadas con minociclina-rifampicina o con nitrofurazona también reducen la incidencia de BA en los pacientes con sondaje corto, tampoco se conoce su impacto en el desarrollo de ITU sintomática, de ITU bacteriémica ni en la mortalidad5,42,46,47, por lo que en la actualidad no se aconseja su uso, por sus costes superiores y por el riesgo a desarrollar resistencias.
A modo de resumen, las guías del 2010 de la IDSA concluyen que aunque la utilización de catéteres impregnados de antibióticos o de aleaciones de plata reduce la incidencia de BA, no se recomienda su uso al no haber suficiente evidencia sobre la reducción en la incidencia de ITU sintomática, tanto en el cateterismo corto como en el permanente.
ArándanosAunque existe cierta evidencia de la eficacia de los arándanos en la prevención de las ITU recurrentes (ITUR)5, por su mecanismo patogénico de acción, secundario a las proantocinadinas que contienen, que interfieren con la adherencia de las fimbrias de E.coli a las células uroepiteliales, hace poco probable a priori que los arándanos sean eficaces en el sondado con ITUR, ya que solo el 10% de los uropatógenos aislados en los episodios de ITU tienen fimbrias. En este sentido, 2 estudios preliminares, en lesionados medulares, sugieren que los arándanos no previenen las ITU, ni inhiben la formación de incrustaciones8,49. En un metanálisis de la Cochrane, que analizó 5 estudios comparativos (arándanos-placebo) en pacientes con ITUR asociadas a vejiga neurógena y sondaje intermitente, concluyó que los arándanos no reducían las recurrencias en los pacientes con vejiga neurógena (nivel 1b)50.
VacunasExiste experiencia, sobre todo, con la vacuna Uro-Vaxon (OM-89), compuesta de fracciones inmunoestimulantes de 18 serotipos de E.coli en ITU recurrentes en pacientes no sondados. En un reciente metaanálisis que incluía 5 estudios (480 pacientes), se observó que a los 6 meses de seguimiento la vacuna OM-89 redujo en más del 50% el número de ITUR. Como era de esperar, también se demostró una reducción en el consumo de antibióticos en el grupo vacunado y de infecciones vulvovaginales.
La experiencia en pacientes sondados es escasa. En un estudio no incluido en el metaanálisis, aleatorizado con placebo, que incluía 70 paciente lesionados medulares, a los 6 meses de seguimiento se observó que en el grupo vacunado con OM-89 se redujo significativamente la incidencia de bacteriuria, el número de ITUR y el consumo de antimicrobianos. Por lo tanto, en este colectivo de pacientes, donde los arándanos no son eficaces, las vacunas podrían ser una alternativa de primera línea cuando fracasa la profilaxis antibiótica51.
Irrigación del catéter, recambio rutinario de catéter y antibióticos tras el recambioYa se ha comentado anteriormente que la irrigación de la sonda o de la bolsa recolectora con antibióticos solo consigue la selección de microorganismos resistentes. La irrigación de la sonda con suero fisiológico, con la idea de evitar las incrustaciones, no reduce el número de obstrucciones ni de episodios febriles de origen urinario2.
Una práctica usual en el paciente con sondaje permanente es el recambio periódico de la sonda a intervalos de 1-3meses con el objetivo de anticiparse a su obstrucción. No hay evidencia de que tal práctica reduzca la incidencia de complicaciones, y las maniobras de recambio conllevan un riesgo de bacteriemia2. En la actualidad se recomienda un recambio individualizado; en algunos pacientes con sondas de silicona la sonda puede permanecer permeable más de 3meses, mientras que otros requerirán el recambio cada 15días por obstrucción.
Aunque entre el 4 y el 10% de los pacientes presentan bacteriemia tras el recambio de una SU, esta es pocas veces sintomática. En la actualidad solo se recomienda realizar profilaxis antibiótica al recambiar la sonda, cuando ha habido un traumatismo importante de la vía urinaria (evidenciado por la presencia de hematuria macroscópica) o si el paciente tiene antecedentes de ITU sintomáticas de repetición en los recambios previos2.
Otras estrategias preventivasEn la actualidad no se recomienda la acidificación de la orina con ácido ascórbico (vitaminaC) e hipurato de metenamina, ya que es difícil conseguir un pH persistentemente bajo, y la evidencia de su eficacia preventiva es escasa2.
Se está evaluando la eficacia de la denominada interferencia bacteriana con cepas avirulentas de E.coli, las cuales parecen reducir la incidencia de IU sintomática, en instilación intravesical o bien impregnando la sonda con dichas cepas, lo cual impediría la colonización del catéter por uropatógenos15.
Por último, y especialmente en los sondajes permanentes, se están intentando estrategias basadas en la prevención de la obstrucción de la sonda, lo cual evitaría la IU bacteriémica. En este sentido, se aconseja una ingesta diaria de 2-4l de líquidos para intentar disminuir la precipitación de cristales11.
Se ha intentado utilizar inhibidores de la ureasa, pero son tóxicos para el ser humano. La investigación, al igual que en otras infecciones, se dirige a evitar la formación o la progresión del biofilm, ya sea utilizando distintos tipos de materiales en las sondas44 (hidrogel-látex, silicona,etc.) o impregnándolos con diversas sustancias, como heparina, un biocida como el triclosán52, la N-acetilcisteína o el ácido acetilsalicílico15. De momento no disponemos de estudios clínicos, o estos son insuficientes para recomendar su utilización53.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Sección acreditada por el Consell Català de Formació Continuada de les Pro-fessions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion