La infección fúngica invasora (IFI) constituye una amenaza para el paciente trasplantado de órgano sólido (TOS), con una incidencia nada despreciable y una importante mortalidad. El manejo de esta patología en el paciente TOS conlleva una serie de recomendaciones específicas e individualizadas al tipo de trasplante y de paciente. La actual revisión es un resumen sobre epidemiología, diagnóstico, tratamiento y prevención de la IFI en el TOS. En función de los factores de riesgo de las diferentes IFI y según el tipo de trasplante, este trabajo recoge las principales recomendaciones, tanto publicadas como basadas en la opinión de sus autores, sobre profilaxis y tratamiento de estos pacientes, atendiendo a los cambios epidemiológicos de los últimos años y a la aparición de nuevos antifúngicos. Este documento se ha focalizado principalmente en Candidaspp. y Aspergillusspp., haciendo también mención especial al resto de hongos levaduriformes y filamentosos frecuentes en TOS.
Invasive fungal infections (IFI) represent a serious threat for patients undergoing solid organ transplantation (SOT). IFI in SOT has a significant incidence and mortality not due to negligence. The management of IFI in SOT involves specific recommendations and has been individualized to the type of transplant and patient. The current review presents an overview of epidemiology, diagnosis, treatment and prevention of IFI in TOS. Depending on risk factors for different IFIs and transplant type, this paper includes the main recommendations based on previous publications and on the opinion of the authors on the prophylaxis and treatment of these patients. These recommendations highlight epidemiology changes and the emergence of new antifungals. The current document has focused mainly on Candidaspp. and Aspergillusspp., with a special mention to the rest of yeasts and moulds that are common in SOT.
Las infecciones fúngicas invasoras (IFI) representan una amenaza importante para los pacientes sometidos a un trasplante de órgano sólido (TOS). En términos epidemiológicos, las IFI en esta población se puede dividir en 2 grupos: las producidas por hongos oportunistas o las producidas por hongos endémicos. Las IFI causadas por hongos oportunistas presentan una distribución universal y son causadas principalmente por Candidaspp., Aspergillusspp. y, en menor medida, Cryptococcusspp., hongos del orden Mucorales, así como otros hongos filamentosos. Las IFI producidas por hongos endémicos constituyen las micosis geográficas restringidas a causar infecciones primarias o reactivaciones en los pacientes que viven o visitan las zonas endémicas. Este documento analiza las IFI causadas por hongos oportunistas.
EpidemiologíaInfecciones por Candida spp. y otros hongos levaduriformesLos pacientes sometidos a TOS presentan un riesgo importante de IFI. Candidaspp. es el principal agente responsable. En los últimos años se ha observado una reducción en la incidencia de candidiasis invasora en el paciente con TOS, con cifras en torno al 2%, en comparación con el 4-6% descrito en las últimas décadas1,2. Sin embargo, esta incidencia varía según el órgano trasplantado, y es especialmente elevada en el trasplante hepático, en el pancreático y en el intestinal2. En estos pacientes el diagnóstico de esta infección implica una elevada morbilidad y una mortalidad entre el 30 y el 40% tanto en las series americanas como en la cohorte RESITRA (Red de Estudio de Infección en el Trasplante)3,4. En el trasplantado hepático, los principales factores de riesgo de candidiasis invasora son la insuficiencia renal (especialmente en pacientes sometidos a diálisis) y el retrasplante. También se ha descrito un incremento de riesgo en las siguientes situaciones: la hepatitis fulminante, la necesidad de requerimientos transfusionales altos, la realización de anastomosis biliar por coledocoyeyunostomía mediante técnica de Y de Roux y la necesidad de reintervención quirúrgica en el postrasplante inmediato5. En el trasplante pancreático, los factores de riesgo para el desarrollo de candidiasis invasora incluyen el drenaje vesical frente al entérico, la trombosis del injerto, la presencia de fístulas de líquido pancreático en el peritoneo, la infección por citomegalovirus y la edad del donante mayor que la del receptor6. Las infecciones por Candida pueden manifestarse en forma de candidemia, peritonitis, infección del tracto urinario, empiema, infección de la herida quirúrgica o de las anastomosis y esofagitis. La forma clínica más frecuente entre las formas invasoras de candidiasis es la candidemia.
En cuanto a la criptococosis, la incidencia en la cohorte americana TRANSNET representa el 8% (49 en 729 IFI) de todas las IFI, situándose como el tercer agente causal más frecuente después de la candidiasis y de la aspergilosis invasoras (49 en 633 TOS; 7,7%)3. Por el contrario, en nuestro país, en la cohorte RESITRA no se diagnosticó ningún episodio de criptococosis en el seguimiento prospectivo de 5.596 TOS en el periodo 2003-2006. La evidencia sugiere que la mayoría de las criptococosis en los receptores de TOS son el resultado de la reactivación de una infección subclínica7. Los pacientes que reciben altas dosis de corticoides o anticuerpos monoclonales, como el alemtuzumab y el infliximab, parecen ser los de mayor riesgo de desarrollar una criptococosis diseminada8. Los resultados de la cohorte TRANSNET muestran una supervivencia de la criptococosis del 73% a los 12 meses3. Se ha descrito una mejor evolución en pacientes que reciben como tratamiento inmunosupresor inhibidores de la calcineurina. Este efecto beneficioso probablemente es en parte atribuible a la actividad antifúngica in vitro de estos inmunosupresores contra Cryptococcus neoformans9 y, por otra parte, por la aparente sinergia existente entre estos fármacos y diferentes antifúngicos10.
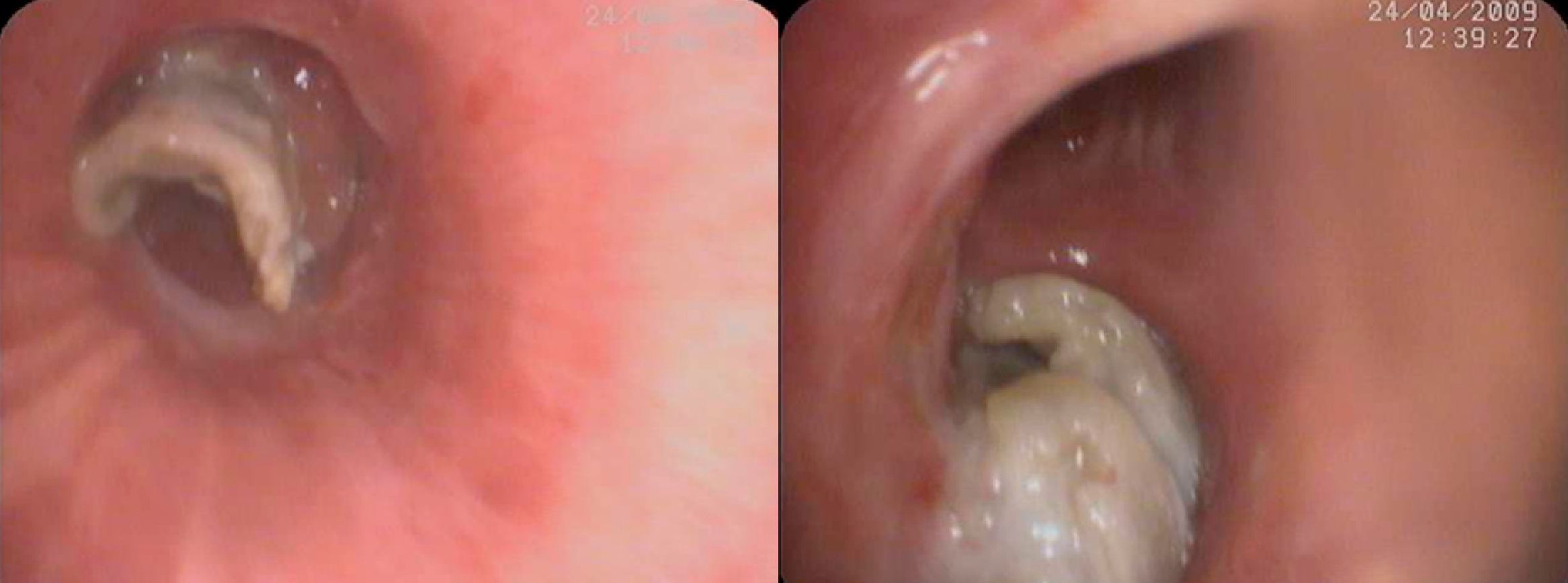
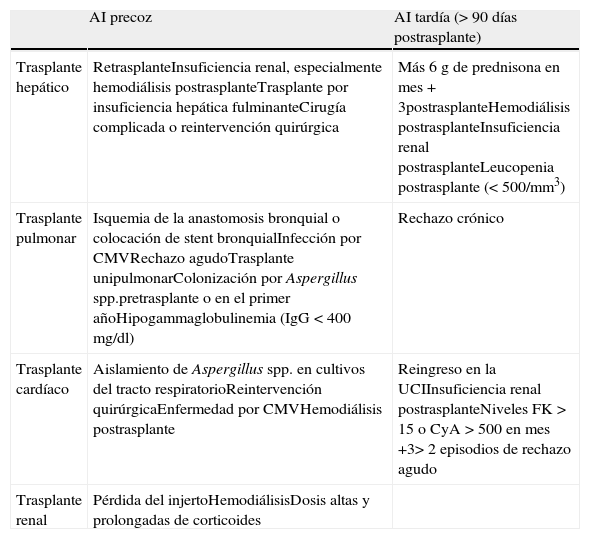
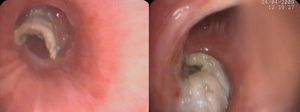
Infecciones por Aspergillus spp. y otros hongos filamentososEn la cohorte RESITRA la incidencia de aspergilosis invasora fue menor del 1% en los trasplantes de riñón, hígado y corazón (0,3-0,8%), del 1,8% en el trasplante de páncreas y del 3,9% en el trasplante de pulmón. Estas cifras son similares a las reportadas en una cohorte francesa de 4.542 TOS11. En ambas cohortes la mortalidad de esta infección se acercó al 60%12. Históricamente, la aspergilosis invasora (AI) ha sido considerada una complicación del periodo inmediatamente posterior al trasplante. Sin embargo, distintos estudios han puesto de manifiesto que la incidencia de la AI persiste elevada una vez superado dicho período13. Se ha demostrado que la AI se concentra en subpoblaciones específicas dentro de los receptores de TOS. Estos pacientes de alto riesgo son diferentes para cada uno de los órganos trasplantados (tabla 1). Sin embargo, existen una serie de factores comunes; el retrasplante, la enfermedad por CMV y la hemodiálisis aumentan significativamente el riesgo en lo que se considera una AI precoz o diagnosticada en los 3 primeros meses tras el trasplante. Para la aspergilosis tardía (>3 meses postrasplante) los factores de riesgo serían la insuficiencia renal o un mayor grado de inmunosupresión13. En los receptores de un trasplante hepático se ha descrito la hepatitis fulminante y la disfunción crónica del injerto por recidiva del VHC como factores específicos que incrementan el riesgo de padecer una AI13. La mortalidad por AI en el trasplante hepático oscila entre el 80 y el 90% de los estudios en la década de los noventa13 al 50 al 65% en estudios más recientes y en la cohorte RESITRA14. La incidencia de AI en el trasplante pulmonar es la más elevada entre los receptores de TOS y se sitúa entre el 4 y el 23,3%15. No obstante, un estudio realizado en RESITRA confirmó una incidencia, con profilaxis, del 3% entre los años 2003-200515. En la década de los noventa la mediana de aparición de la AI se situaba en los 120 días; actualmente, más de la mitad de los episodios suceden pasados los primeros 6 meses del trasplante15. La colonización de la vía aérea por Aspergillusspp. durante los 6 primeros meses tras el trasplante aumenta en 11 veces el riesgo de padecer la enfermedad. Otros factores que confieren un mayor riesgo a esta población son la isquemia de la anastomosis bronquial, el trasplante unipulmonar, la hipogammaglobulinemia, la colocación de una prótesis bronquial y la infección por CMV16. La mortalidad de la AI en el trasplante pulmonar depende de la presentación clínica. Los pacientes que padecen una traqueobronquitis tienen una mortalidad de alrededor del 25%, mientras que entre los que padecen una enfermedad pulmonar invasiva, es del 67 al 82%17. La forma clínica más frecuente de aspergilosis invasora es la pulmonar, con posterior diseminación. En los trasplantados pulmonares puede causar traqueobronquititis simple o invasiva en sus formas ulcerativa o nodular (fig. 1). También puede afectar a la anastomosis bronquial con riesgo de dehiscencia de esta.
Factores de riesgo de aspergilosis invasora (AI) en el trasplante de órgano sólido
| AI precoz | AI tardía (> 90 días postrasplante) | |
| Trasplante hepático | RetrasplanteInsuficiencia renal, especialmente hemodiálisis postrasplanteTrasplante por insuficiencia hepática fulminanteCirugía complicada o reintervención quirúrgica | Más 6 g de prednisona en mes + 3postrasplanteHemodiálisis postrasplanteInsuficiencia renal postrasplanteLeucopenia postrasplante (< 500/mm3) |
| Trasplante pulmonar | Isquemia de la anastomosis bronquial o colocación de stent bronquialInfección por CMVRechazo agudoTrasplante unipulmonarColonización por Aspergillus spp.pretrasplante o en el primer añoHipogammaglobulinemia (IgG < 400 mg/dl) | Rechazo crónico |
| Trasplante cardíaco | Aislamiento de Aspergillus spp. en cultivos del tracto respiratorioReintervención quirúrgicaEnfermedad por CMVHemodiálisis postrasplante | Reingreso en la UCIInsuficiencia renal postrasplanteNiveles FK > 15 o CyA > 500 en mes +3> 2 episodios de rechazo agudo |
| Trasplante renal | Pérdida del injertoHemodiálisisDosis altas y prolongadas de corticoides |
CyA: ciclosporina; FK; tacrolimus.
Tomada de Gavaldá et al.13.
El hemocultivo es el procedimiento diagnóstico de mayor rendimiento ante la sospecha clínica de candidemia. En ausencia de candidemia, el diagnóstico de candidiasis es más complicado y se basa en técnicas de tinción y cultivo de las muestras obtenidas.
Recientemente se han desarrollado técnicas diagnósticas basadas en la detección de antígenos manano, anticuerpos anti-manano y anti-micelio y de ácidos nucleicos. Hasta la fecha, aunque alguna de estas técnicas pueden ser de utilidad en el huésped inmunocompetente18, no existen datos sobre su rentabilidad en los receptores de un trasplante de órgano sólido, por lo que consideramos que no deberían utilizarse para el diagnóstico de la candidiasis invasora en el TOS.
La detección seriada del β-D-glucano ha puesto de manifiesto valores predictivos >90%, aunque este método no es específico para la candidiasis (el componente es panfúngico), es técnicamente difícil de aplicar y la experiencia en receptores de trasplante es limitada19.
El diagnóstico de la AI es a veces problemático debido al riesgo de colonización y contaminación y el bajo valor predictivo que presentan los cultivos de muestras respiratorias (principalmente esputo). La detección de galactomanano (GM), junto con la tomografía computarizada (TAC), son las pruebas no basadas en el cultivo que más han contribuido al diagnóstico de la AI. El GM ha demostrado una gran utilidad en la monitorización de pacientes con enfermedades hematológicas malignas20. En el trasplante de órgano sólido la sensibilidad es menor. El grupo del Hospital Ramón y Cajal encontró una sensibilidad del 56% para el diagnóstico de AI en receptores de trasplante hepático21. La especificidad del GM se ve reducida en relación a potenciales falsos positivos, generalmente asociados al uso de β-lactámicos22. La mayor parte de falsos positivos del GM acontecen durante la primera semana tras el trasplante hepático.
Un avance potencial en el diagnóstico de la AI es el uso de GM en el lavado broncoalveolar. En un estudio realizado en la Universidad de Pittsburgh, Husain et al.23 evaluaron el papel del GM en el lavado broncoalveolar de 116 receptores de pulmón. Para un punto de corte de GM de 0,5, estos autores encontraron una sensibilidad del 60% y una especificidad del 95%; cuando este punto de corte se elevó a 1,0, la sensibilidad fue del 60% y la especificidad del 98%. Del mismo modo, para un GM>1,0 en el lavado broncoalveolar de pacientes receptores de pulmón, un grupo de la Universidad de Florida (EE.UU.) encontró una especificidad, una sensibilidad, un valor predictivo positivo y un valor predictivo negativo de 100, 90,8, 41,% y 100%, respectivamente24.
En la aplicación de la PCR para Aspergillus fumigatus, la existencia de diferentes primers y de protocolos de extracción y amplificación hace difícil reproducir y validar los resultados entre laboratorios. Un estudio llevado a cabo en nuestro país confirmó que la detección seriada del A.fumigatus mediante PCR en suero o sangre tuvo una sensibilidad y una especificidad >90% en el diagnóstico de la AI en pacientes neutropénicos con neoplasias hematológicas, adelantándose con una media de 68 días al GM25,26. Un estudio reciente presentó resultados favorables al aplicar la PCR en tiempo real en la detección de ADN mitocondrial de Aspergillusspp. en receptores de un injerto hepático con títulos positivos de GM. La PCR fue positiva en 8 de cada 13 pacientes con aspergilosis probable o posible, y en ninguno de los 12 pacientes con GM falso positivo27.
La sensibilidad y la especificidad para la detección del antígeno de criptococo en suero y líquido cefalorraquídeo es muy alta (cerca del 100%). Junto a los hemocultivos, esta técnica es la principal herramienta diagnóstica en pacientes con sospecha de criptococosis, y entre ellos el receptor de TOS. Sin embargo, también se puede establecer el diagnóstico mediante tinción con tinta china de levaduras (por lo general en LCR) o por cultivo de muestras estériles.
TratamientoCandida spp.IntroducciónNo existen estudios de cohorte o aleatorizados para el tratamiento de la candidiasis invasora en receptores de TOS; por tanto, el enfoque terapéutico de estos pacientes se basa, en general, en grandes estudios aleatorizados de grupos heterogéneos de pacientes que incluyen una pequeña proporción de pacientes receptores de TOS28.
El tratamiento habitual de las infecciones por Candidaspp. en receptores de TOS no difiere de la de otros tipos de pacientes, aunque deben considerarse aspectos relacionados con las interacciones medicamentosas y a las posibles toxicidades relacionadas con el uso de los antifúngicos. La Sociedad Americana de Enfermedades Infecciosas (IDSA) y la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) han publicado recientemente unas guías para el tratamiento de la candidiasis, con una sección específica sobre el tratamiento en el paciente TOS1,29.
Existen algunas limitaciones específicas para el uso de ciertos antifúngicos en pacientes con TOS. La anfotericina B desoxicolato no debería utilizarse en el TOS por su nefrotoxicidad, en especial en los pacientes que toman anticalcineurínicos como tratamiento inmunosupresor30. Aunque los azoles permiten una buena biodisponibilidad tanto oral como intravenosa, presentan interacción con los fármacos anticalcineurínicos debido a que su metabolismo depende del citocromo P450, por lo que es muy importante determinar los niveles plasmáticos tanto de los azoles como de los inmunosupresores. Las candinas (caspofungina, anidulafungina y micafungina) en general tienen pocos efectos secundarios y menos interacciones en pacientes con TOS que el resto de los antifúngicos referidos, y además son ampliamente activas frente a cepas resistentes a azoles.
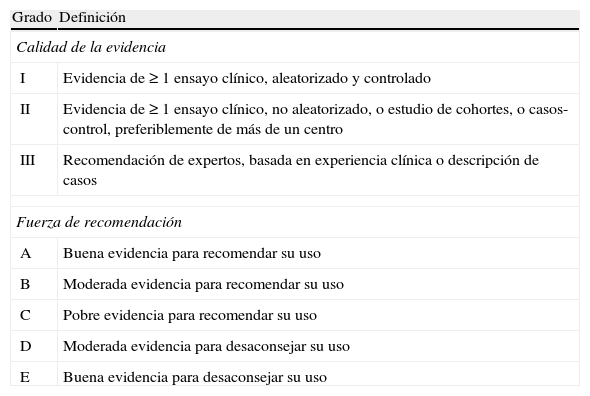
Recomendaciones (según nivel de evidencia; tabla 2)- •
Se aconseja la retirada del catéter venoso central con candidemia (A-II) aunque el aislamiento de Candidaspp. en la punta de un catéter venoso en pacientes sin fungemia no obliga necesariamente al uso de antifúngicos (A-II).
Tabla 2.Evidencia científica
Grado Definición Calidad de la evidencia I Evidencia de ≥ 1 ensayo clínico, aleatorizado y controlado II Evidencia de ≥ 1 ensayo clínico, no aleatorizado, o estudio de cohortes, o casos-control, preferiblemente de más de un centro III Recomendación de expertos, basada en experiencia clínica o descripción de casos Fuerza de recomendación A Buena evidencia para recomendar su uso B Moderada evidencia para recomendar su uso C Pobre evidencia para recomendar su uso D Moderada evidencia para desaconsejar su uso E Buena evidencia para desaconsejar su uso - •
En los pacientes con candidemia debe realizarse un examen oftalmológico y repetir hemocultivos en 48-72h.
- •
En pacientes con candidemia sin neutropenia o signos de gravedad clínica, en ausencia de daño hepático significativo y sin antecedentes de uso previo de azoles, las diferentes guías recomiendan el uso de fluconazol (12mg/kg la primera dosis, seguido de 6mg/kg/día) (A-III). En este punto debe tenerse en cuenta que, aunque el paciente no tenga signos de gravedad clínica, la candidiasis invasora acontece, en la mayoría de ocasiones, en el postrasplante inmediato de un injerto abdominal ingresado en la UCI, en ocasiones con insuficiencia renal o hemodiálisis y que ha podido necesitar algún tipo de reintervención quirúrgica. En esta situación, la dosificación de los anticalcineurínicos es difícil. En nuestra opinión, consideramos que el tratamiento con azoles, mayormente a estas dosis, puede condicionar problemas de toxicidad directa o secundaria a sus interacciones farmacológicas con los anticalcineurínicos, lo que hacen muy complicada su administración en este tipo de pacientes.
- •
Con el razonamiento anterior consideramos que ante el diagnóstico de candidiasis invasora nuestra recomendación sería iniciar tratamiento con candinas (A-III): caspofungina 70mg/día primera dosis seguido de 50mg/día (A-III), micafungina100mg/día (A-III) o anidulafungina 200mg primera dosis seguido de 100mg/día (A-III). En caso de no poder administrar dichos fármacos, recomendamos administrar anfotericina B liposomal (3mg/kg/día) (B-III). En el caso excepcional de la existencia de neutropenia (<500/mm3) recomendaríamos iniciar tratamiento con anfotericina B liposomal (3mg/kg/día) (B-III) y alternativamente una candina (A-III).
- •
Una vez aislada la especie de Candidaspp., es importante la realización de un antifungigrama. En caso de aislarse C.parapsilosis, se recomienda anfotericina B en formulación lipídica (B-III). En caso de aislarse C.glabrata o C.krusei es preferible administrar una candina (B-III). La duración del tratamiento para la candidemia sin complicaciones metastásicas es de 2 semanas tras la comprobación de que los hemocultivos se han negativizado y han desaparecido los datos clínicos atribuibles a la candidemia (A-III).
- •
Las equinocandinas difunden mal en la retina; por tanto, en endoftalmitis se recomienda el uso de anfotericina o fluconazol, combinado con cirugía en las formas graves (B-III).
- •
El tratamiento recomendado en las guías de la endocarditis continúa siendo la anfotericina B con o sin 5-flucitosina, durante al menos 4 semanas, o bien una candina. Probablemente, a partir de los datos de la eficacia de anidulafungina sobre las células de Candidaspp. que crecen en las biopelículas31 y su escasa toxicidad, este fármaco podría utilizarse como alternativa en el tratamiento prolongado en la endocarditis por Candidaspp. (B-III).
- •
En la pielonefritis se aconseja el uso de fluconazol a dosis de 3-6mg/kg/día durante 2 semanas (B-III).
No existen recomendaciones específicas para la criptococosis en el paciente con TOS, y el tratamiento debe ser similar al establecido para otros pacientes inmunodeprimidos, especialmente en aquellos con infección por VIH8.
Sin embargo, en el manejo de los receptores de trasplante con criptococosis existen 2 observaciones particulares a tener en cuenta: la interacción sinérgica entre los inhibidores de la calcineurina y el tratamiento antifúngico en esta población10 y el fenómeno de la reconstitución inmunológica que se da en el 5% de los pacientes trasplantados con criptococosis. Esta reconstitución se produce con una media de 5 semanas tras la reducción de la inmunosupresión y de iniciar el tratamiento antifúngico y supone un empeoramiento paradójico de los síntomas a pesar de presentar cultivos negativos8.
Las formulaciones lipídicas de anfotericina B más flucitosina son tan eficaces como la anfotericina B aislada (66-75% de respuesta), con menor toxicidad, siendo estos los tratamientos de elección en el TOS8.
Hongos filamentososAspergillus spp.IntroducciónEn la década de los noventa la aparición de las anfotericinas lipídicas comportó una mejoría en el pronóstico de la AI en el TOS. Sin embargo, los estudios con estos fármacos no son recientes y es difícil valorar la respuesta terapéutica.
El estudio CLEAR (siglas inglesas de «Intercambio colaborativo de investigación en antifúngicos») recoge los casos de 721 pacientes inmunodeprimidos con IFI tratados con anfotericina B lipídica. En este estudio se incluyen 109 TOS con AI y una respuesta favorable del 54%32. El voriconazol está aprobado para el tratamiento de la AI en TOS basándose en los resultados de un pequeño ensayo abierto, no comparativo33, y en otro que comparó voriconazol y anfotericina B deoxicolato como tratamiento inicial en pacientes oncohematológicos34. Sin embargo, en este estudio solo se incluyeron 11 receptores de TOS. Aunque la experiencia de los grupos de TOS con la utilización de voriconazol es importante, no son muchos los datos publicados35.
La caspofungina es la única equinocandina aprobada por la FDA y la EMEA para el tratamiento de la AI. En un estudio en 12 trasplantados torácicos se utilizó como tratamiento inicial con una eficacia del 86%36. Winkler et al.37, en un estudio observacional de 19 TOS con AI obtuvieron una respuesta favorable con caspofungina en primera línea del 78% en monoterapia y del 70% en combinación.
El papel del tratamiento combinado en el tratamiento de la AI en el TOS no está establecido. Un estudio multicéntrico analizó la evolución de 40 pacientes que fueron tratados con voriconazol y caspofungina como tratamiento inicial14, y se comparó con una cohorte histórica que había recibido una forma lipídica de anfotericina B. En este estudio la mortalidad a los 90 días fue del 67,5% en el grupo tratado con la combinación y del 51% en el grupo control. El tratamiento combinado reducía la mortalidad a los 90 días en el subgrupo de 18 pacientes con insuficiencia renal. De los pacientes tratados con la combinación, una cuarta parte presentaron hepatotoxicidad y el 45% incrementos significativos en las concentraciones de ciclosporina y tacrolimus. Dado que se trata de un estudio no controlado en que el grupo control es una cohorte histórica (diferentes pautas de inmunosupresión, técnica quirúrgica), el número de enfermos con insuficiencia renal es escaso y, considerando la toxicidad mostrada, creemos que no existen datos suficientes para recomendar esta combinación como tratamiento inicial de la AI en el TOS.
Hasta la fecha, la experiencia publicada con la utilización de posaconazol o micafungina para el tratamiento de la AI en TOS es reducida, aunque con resultados satisfactorios38. Con anidulafungina los datos son todavía muy aislados, aunque con buena experiencia entre expertos.
La AI en el trasplante de órgano sólido, más que una enfermedad, es un síndrome que comporta diferentes tipos de infecciones. De esta manera, no debe ser considerado igual el manejo de una AI en un receptor de un trasplante pulmonar con rechazo crónico, que la misma enfermedad en el postrasplante inmediato de un receptor de un injerto hepático. El tratamiento debe ser individualizado en virtud de la enfermedad de base, el tipo de trasplante, el tipo de infección y la inmunosupresión utilizada.
Los principios generales del tratamiento de la AI en el TOS son los mismos que en otras poblaciones. De todas formas, en los pacientes receptores de un TOS existen varias consideraciones de interés en el momento de afrontar el manejo de la AI. Primero, han de considerarse las posibles toxicidades inherentes a cada uno de los antifúngicos a la hora de prescribirlos. De esta manera, se ha de tener en cuenta la nefrotoxicidad de las anfotericinas B lipídicas ó la hepatotoxicidad de los nuevos triazoles (voriconazol y posaconazol, con mayor riesgo en el trasplante hepático). Segundo, deben valorarse las interacciones farmacológicas de los nuevos azoles (itraconazol, voriconazol, posaconazol) con la mayoría de los inmunosupresores (ciclosporina, tacrolimus, everolimus y sirolimus). Ello es debido a que inhiben el metabolismo hepático de la isoenzima CYP3A4 en el citocromo P450 que obligan al ajuste de dosis y monitorización de niveles en sangre, fundamentalmente reduciendo la posología en el caso de los inhibidores de la calcineurina, o imposibilitando su coadministración en el caso de los inhibidores de la m-TOR. Finalmente, se debe considerar el riesgo de selección de hongos emergentes asociado al uso prolongado de algunos antifúngicos, como voriconazol o caspofungina.
Recomendaciones- •
El inicio precoz del tratamiento antifúngico en pacientes con alta sospecha de AI debe ser iniciado lo antes posible y mientras se desarrolla toda la evaluación diagnóstica con el objetivo de confirmar una AI (A-II).
- •
El tratamiento debe ser individualizado en virtud de la enfermedad de base, el tipo de trasplante, el tipo de infección y la inmunosupresión utilizada (A-III).
- •
En el tratamiento primario de la AI, el voriconazol (4mg/kg/12h, con dosis de carga de 6mg/kg/12h) (A-III), o la anfotericina liposomal (3mg/kg/día) (A-III) constituyen el tratamiento recomendado en la mayoría de los pacientes (tabla 3). Si se utiliza voriconazol en pacientes graves, la formulación parenteral sería lo aconsejable para garantizar su biodisponibilidad. Si existe deterioro de la función renal o estabilidad clínica se aconseja pasar a la vía oral (200mg/12h). Siempre que se utilice voriconazol deberían monitorizarse sus concentraciones plasmáticas para que se mantengan en el intervalo entre 2 y 4μg/ml (B-III). En los pacientes sometidos a TOS la utilización de azoles debe ser individualizada y cuestionada en algunos casos, especialmente en trasplantados hepáticos. En los pacientes en los que la administración de voriconazol sea problemática (riesgo de hepatotoxicidad, interacción farmacológica grave, intolerancia o alergia a los azoles), se recomienda la utilización de anfotericina liposomal (A-III).
Tabla 3.Tratamiento de la aspergilosis invasora en el trasplante de órgano sólido
Inicio precoz, si sospecha clínica, en espera de pruebas diagnósticas (A-II)El tratamiento debe ser individualizado en virtud de la enfermedad de base, el tipo de trasplante, el tipo de infección y la inmunosupresión utilizada (A-III) Tratamiento de primera línea Voriconazol (A-III) En pacientes graves, recomendable por vía intravenosa. Pasar a vía oral en presencia de insuficiencia renal. Confirmar niveles séricos entre 2-5 g/ml (B-III) Anfotericina B liposomal (A-III) si: Riesgo de hepatotoxicidad incrementada con voriconazol. Interacción farmacológica asociada a voriconazol. Intolerancia a los azoles Tratamiento de rescate Anfotericina B complejo lipídico (B-II)Posaconazol (B-III) Itraconazol (B-III)Caspofungin (B-III)Micafungina (B-III) Combinación (B-III) - •
La monitorización de la respuesta terapéutica debe realizarse mediante el seguimiento clínico y la realización de una TAC de alta resolución de forma periódica. Debe tenerse en cuenta que la cavitación de las lesiones, que indica necrosis, no indica mala evolución. Asimismo, tampoco es indicativo de mala evolución un aumento discreto del volumen de las lesiones (A-III).
- •
El tratamiento de rescate, en el caso de AI, se refiere al tratamiento de pacientes infectados que son refractarios o no toleran el tratamiento inicial. El tiempo que debe transcurrir para considerarse fracaso terapéutico no está bien definido. Los siguientes hallazgos se asocian con mala evolución y pudieran ser considerados como fracaso terapéutico en ausencia de mejoría clínica: a)si aparece clínica de diseminación durante el tratamiento; b)si en la TAC realizada a los 7-10 días se evidencian nuevas lesiones, y c)si en la TAC a los 15-21 días las lesiones no han disminuido de tamaño. Ante la presencia de estos hallazgos es recomendable cambiar a un antifúngico de otra clase al utilizado en el tratamiento inicial (A-III). Los antifúngicos que han confirmado respuesta clínica para el tratamiento de rescate son la anfotericina B complejo lipídico (B-II), el posaconazol (B-III), el itraconazol (B-III), la caspofungina (B-III) y la micafungina (B-III).
- •
El papel del tratamiento combinado para la AI no está definido de forma definitiva. Hasta la actualidad no hay suficiente evidencia para su utilización en primera línea y se recomienda su aplicación en el tratamiento de rescate (B-III).
- •
El receptor de un trasplante de pulmón puede ser colonizado por diferentes hongos filamentosos y padecer diferentes formas de enfermedad. Los pacientes colonizados pueden recibir tratamiento de forma anticipada para prevenir el desarrollo de enfermedad invasora. En caso de no ser posible la administración de anfotericina B liposomal nebulizada puede administrarse voriconazol sistémico (B-II). El voriconazol asociado a la anfotericinaB liposomal nebulizada 25mg/24h es el tratamiento recomendado en el caso de diagnosticar una traqueobronquitis simple, nodular o ulcerativa (B-II). En caso de dehiscencia se requiere la resección quirúrgica y la colocación de una prótesis endobronquial, aunque los resultados no son excesivamente positivos. Es fundamental la realización de una broncoscopia completa para evaluar la extensión de la enfermedad y para limpiar los residuos necróticos y los nódulos o bolas fúngicas. Asimismo debe realizarse una TAC de alta resolución para descartar la extensión parenquimatosa. La duración del tratamiento dependerá de los signos observados en la evaluación broncoscópica y en la negativización de los cultivos de las secreciones respiratorias (C-III). Debe tenerse en cuenta que la utilización de voriconazol durante un periodo superior a 4 meses en los receptores de un trasplante de pulmón puede presentar hepatotoxicidad con una incidencia cercana al 40% y se ha descrito como factor de riesgo de cáncer cutáneo, sobre todo en zonas con un índice elevado de rayos ultravioleta.
- •
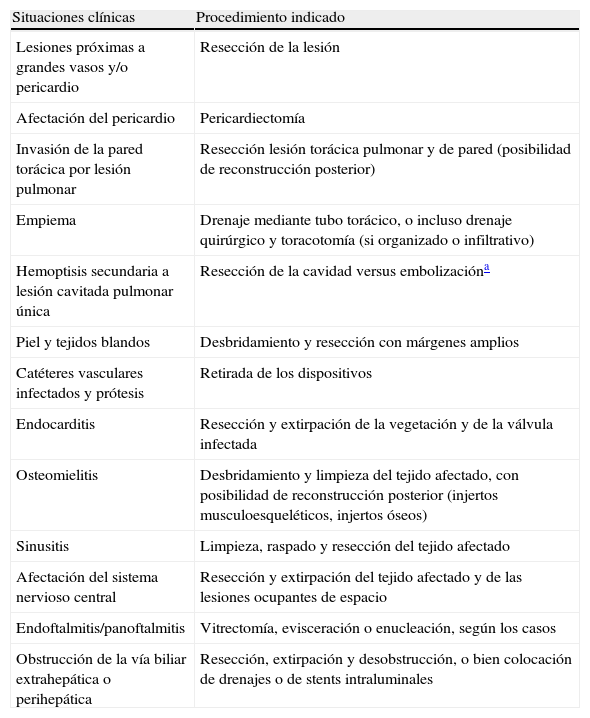
Se recomienda la resección quirúrgica en los casos de hemoptisis, cuando sea amenazante o secundaria a una lesión que se localice cerca de los grandes vasos, en la enfermedad sinusal, en la infiltración del pericardio, grandes vasos, hueso, tejido subcutáneo o SNC durante el tratamiento (B-III). En los casos de endocarditis, la cirugía con sustitución valvular es el tratamiento de elección (tabla 4).
Tabla 4.Situaciones clínicas y procedimiento quirúrgico indicado en la aspergilosis invasora y otros hongos filamentosos
Situaciones clínicas Procedimiento indicado Lesiones próximas a grandes vasos y/o pericardio Resección de la lesión Afectación del pericardio Pericardiectomía Invasión de la pared torácica por lesión pulmonar Resección lesión torácica pulmonar y de pared (posibilidad de reconstrucción posterior) Empiema Drenaje mediante tubo torácico, o incluso drenaje quirúrgico y toracotomía (si organizado o infiltrativo) Hemoptisis secundaria a lesión cavitada pulmonar única Resección de la cavidad versus embolizacióna Piel y tejidos blandos Desbridamiento y resección con márgenes amplios Catéteres vasculares infectados y prótesis Retirada de los dispositivos Endocarditis Resección y extirpación de la vegetación y de la válvula infectada Osteomielitis Desbridamiento y limpieza del tejido afectado, con posibilidad de reconstrucción posterior (injertos musculoesqueléticos, injertos óseos) Sinusitis Limpieza, raspado y resección del tejido afectado Afectación del sistema nervioso central Resección y extirpación del tejido afectado y de las lesiones ocupantes de espacio Endoftalmitis/panoftalmitis Vitrectomía, evisceración o enucleación, según los casos Obstrucción de la vía biliar extrahepática o perihepática Resección, extirpación y desobstrucción, o bien colocación de drenajes o de stents intraluminales - •
Es importante la reducción de la inmunosupresión como coadyuvante al tratamiento antifúngico pero sin poner en riesgo la viabilidad del injerto. Probablemente lo más relevante es la disminución de la dosis de corticoides Puede existir mayor riesgo de miopatía esteroidea con voriconazol y metil-prednisolona a dosis superiores a 20mg/día (B-III).
- •
La duración del tratamiento no está bien establecida, pero debe mantenerse hasta la desaparición de los signos radiológicos, habitualmente con un mínimo de 6 a 12 semanas.
Además de Aspergillusspp., en los últimos años se ha documentado una mayor incidencia de infecciones por otros hongos filamentosos en pacientes trasplantados39. La mayoría de estas están producidas por mucorales (zigomicosis), pero también son relevantes las infecciones por Fusariumspp. y Scedosporiumspp. Dos series americanas recientes de infecciones fúngicas en TOS han confirmado una frecuencia de zigomicosis inferior al 3% entre todas las IFI3,4. Por el contrario, en nuestro país, en la cohorte RESITRA no se diagnosticó ningún episodio de criptococosis en el seguimiento prospectivo de 5.596 TOS en el periodo 2003-2006.
No existen recomendaciones específicas para el manejo de estas infecciones en TOS, y se aplican las mismas utilizadas en otros pacientes inmunodeprimidos.
La insuficiencia renal, la diabetes y la administración previa de voriconazol o caspofungina son factores de riesgo40. La forma de zigomicosis más frecuente en TOS es la pulmonar40, con una elevada mortalidad. Como en otros pacientes inmunodeprimidos, el manejo de la zigomicosis en TOS se basa en tres puntos: a)tratamiento antifúngico con anfotericina B liposomal a dosis entre 5 y 10mg/kg/24h; b)resección quirúrgica, y c)reducción del grado de inmunosupresión del huésped.
La experiencia en el manejo de infecciones por Fusariumspp. y Scedosporiumspp. en los TOS es mucho más limitada. Para el tratamiento de Fusariumspp. se recomiendan dosis altas de anfotericinas lipídicas o voriconazol, junto con la retirada de catéteres infectados y la resección del material necrótico. El manejo de las infecciones por Scedosporiumspp. también se basa en la corrección de los factores de base. La cirugía puede mejorar las expectativas terapéuticas. El voriconazol es el tratamiento de elección, sobre todo en las infecciones por S.apiospermum. Por el contrario, S.prolificans es resistente a la mayoría de los antifúngicos.
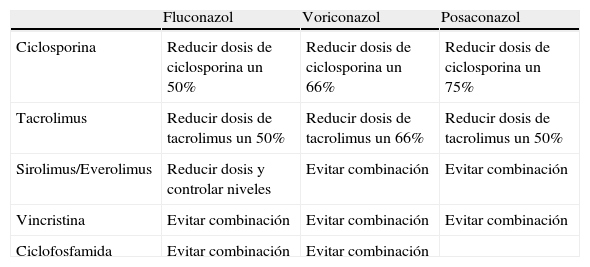
Interacciones farmacológicasLos triazoles son inhibidores muy potentes de las isoenzimas del complejo CYP34A hepático, por lo que incrementan de forma considerable las concentraciones séricas de los principales inmunosupresores (inhibidores de la calcineurina e inhibidores de la enzima m-TOR; everolimus y sirolimus)12,41. El itraconazol incrementa la concentración sérica de ciclosporina o tacrolimus entre un 40 y un 83%. En el caso de administrar voriconazol, se debe disminuir la dosis del inhibidor calcineurínico entre un 50 y un 60%41. La coadministración de voriconazol y sirolimus está formalmente contraindicada, aunque algunos autores lo han utilizado reduciendo la dosis de sirolimus entre un 75 y un 90%. La utilización de posaconazol obliga a disminuir la dosis de tacrolimus o ciclosporina entre un 60 y un 75%. Las equinocandinas tienen pocas interacciones farmacológicas. Fármacos como la rifampicina, la nevirapina, el efavirenz, la carbamacepina, la dexametasona y la fenitoína disminuyen las concentraciones de caspofungina. La administración de caspofungina reduce la concentración de tacrolimus en cerca del 20%, y la ciclosporina puede incrementar alrededor del 35% la concentración de caspofungina42. La micafungina es un inhibidor leve de la enzima CYP3A, con lo que puede incrementar las concentraciones de sirolimus un 20%. Los estudios farmacocinéticos de anidulafungina han demostrado que no necesita ajuste en su dosis cuando se administra con otros fármacos inmunosupresores (tabla 5).
Recomendaciones para el uso de azoles
| Fluconazol | Voriconazol | Posaconazol | |
| Ciclosporina | Reducir dosis de ciclosporina un 50% | Reducir dosis de ciclosporina un 66% | Reducir dosis de ciclosporina un 75% |
| Tacrolimus | Reducir dosis de tacrolimus un 50% | Reducir dosis de tacrolimus un 66% | Reducir dosis de tacrolimus un 50% |
| Sirolimus/Everolimus | Reducir dosis y controlar niveles | Evitar combinación | Evitar combinación |
| Vincristina | Evitar combinación | Evitar combinación | Evitar combinación |
| Ciclofosfamida | Evitar combinación | Evitar combinación |
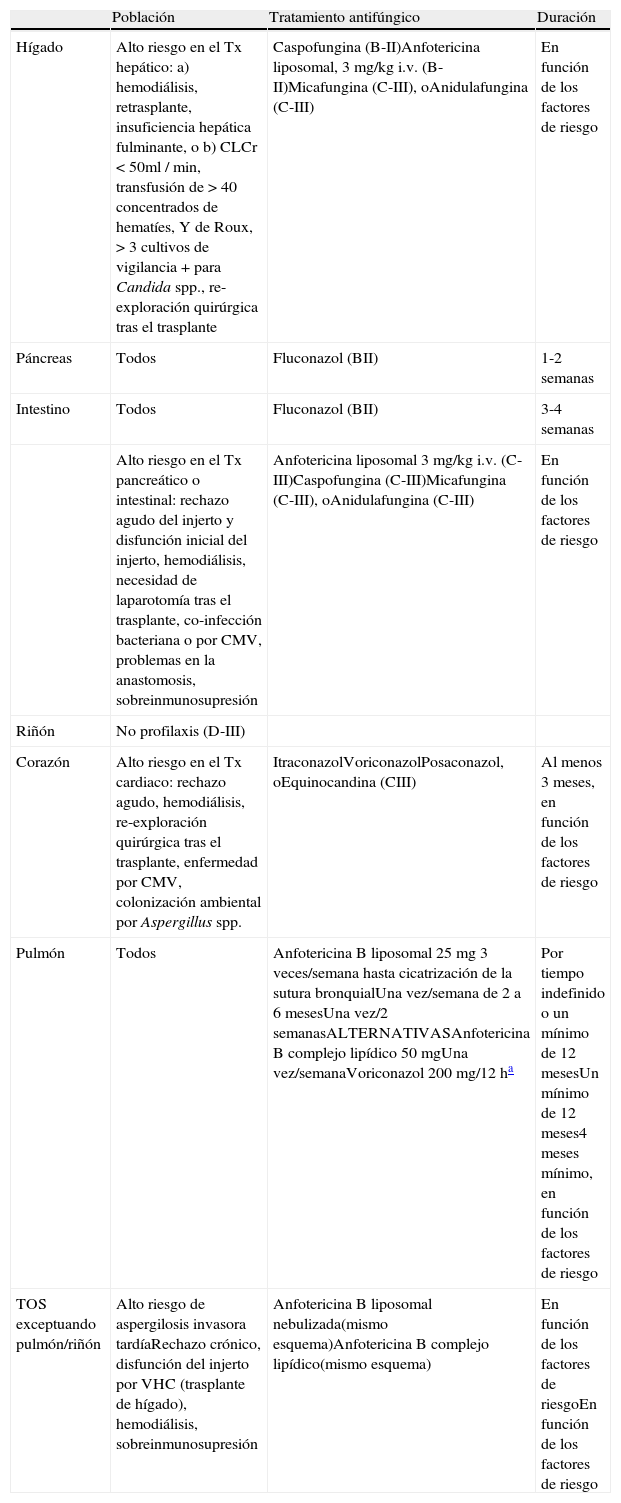
La ausencia de ensayos clínicos comparativos y las diferencias epidemiológicas en la IFI entre los diferentes programas de trasplante comportan que las recomendaciones actuales no puedan tener un elevado grado de evidencia para la prevención de la IFI en el TOS. La reducción en la incidencia de la IFI debe ser analizado junto con otros tipos de medidas, que pueden ser más importantes que el uso de la profilaxis con antifúngicos, como son la optimización de los procedimientos quirúrgicos, el manejo adecuado de la inmunosupresión y el control ambiental de ciertos hongos filamentosos. Todas estas medidas han sido recopiladas en las guías recientemente publicadas por SEIMC-GEMICOMED-REIPI12. La candidiasis invasora es la infección más frecuente en los receptores de hígado, páncreas e intestino; sin embargo, la AI condiciona una mayor morbilidad y mortalidad y, dado que comparten factores de riesgo, la prevención en estos pacientes debe ser combinada. Existe un grupo de pacientes de alto riesgo, entre los receptores de hígado, páncreas e intestino, que comparten factores de riesgo de candidiasis invasora y aspergilosis, en el que el antifúngico utilizado para evitar la IFI debe tener actividad frente a Aspergillusspp.43. En la tabla 6 se detallan las recomendaciones de la prevención de las IFI en el TOS.
Profilaxis de la infección fúngica invasora en el trasplante de órgano sólido
| Población | Tratamiento antifúngico | Duración | |
| Hígado | Alto riesgo en el Tx hepático: a) hemodiálisis, retrasplante, insuficiencia hepática fulminante, o b) CLCr < 50ml / min, transfusión de > 40 concentrados de hematíes, Y de Roux, > 3 cultivos de vigilancia + para Candida spp., re-exploración quirúrgica tras el trasplante | Caspofungina (B-II)Anfotericina liposomal, 3 mg/kg i.v. (B-II)Micafungina (C-III), oAnidulafungina (C-III) | En función de los factores de riesgo |
| Páncreas | Todos | Fluconazol (BII) | 1-2 semanas |
| Intestino | Todos | Fluconazol (BII) | 3-4 semanas |
| Alto riesgo en el Tx pancreático o intestinal: rechazo agudo del injerto y disfunción inicial del injerto, hemodiálisis, necesidad de laparotomía tras el trasplante, co-infección bacteriana o por CMV, problemas en la anastomosis, sobreinmunosupresión | Anfotericina liposomal 3 mg/kg i.v. (C-III)Caspofungina (C-III)Micafungina (C-III), oAnidulafungina (C-III) | En función de los factores de riesgo | |
| Riñón | No profilaxis (D-III) | ||
| Corazón | Alto riesgo en el Tx cardiaco: rechazo agudo, hemodiálisis, re-exploración quirúrgica tras el trasplante, enfermedad por CMV, colonización ambiental por Aspergillus spp. | ItraconazolVoriconazolPosaconazol, oEquinocandina (CIII) | Al menos 3 meses, en función de los factores de riesgo |
| Pulmón | Todos | Anfotericina B liposomal 25 mg 3 veces/semana hasta cicatrización de la sutura bronquialUna vez/semana de 2 a 6 mesesUna vez/2 semanasALTERNATIVASAnfotericina B complejo lipídico 50 mgUna vez/semanaVoriconazol 200 mg/12 ha | Por tiempo indefinido o un mínimo de 12 mesesUn mínimo de 12 meses4 meses mínimo, en función de los factores de riesgo |
| TOS exceptuando pulmón/riñón | Alto riesgo de aspergilosis invasora tardíaRechazo crónico, disfunción del injerto por VHC (trasplante de hígado), hemodiálisis, sobreinmunosupresión | Anfotericina B liposomal nebulizada(mismo esquema)Anfotericina B complejo lipídico(mismo esquema) | En función de los factores de riesgoEn función de los factores de riesgo |
Anidulafungina: 200mg i.v. el primer día seguido de 100mg i.v./24h.
Caspofungina: 70mg i.v. el primer día seguido de 50mg i.v./24h.
Fluconazol: 4-6mg/kg/24h.
Itraconazol: 400mg/24h vía oral.
Micafungina: 100-150mg i.v./24h; considerar 150mg i.v.
Voriconazol: 6mg/kg /12h i.v. el primer día, seguido de 4mg/kg/12h i.v. o 400mg/12h v.o., luego 200mg/12h v.o.
CLCr: aclaramiento de creatinina; CMV: citomegalovirus; i.v.: intravenoso;Tx: trasplante; v.o.: vía oral.
Tomada de Gavaldá et al.43.
Los avances en el conocimiento de la epidemiología de las IFI en los receptores de un TOS y la llegada de nuevos antifúngicos han condicionado la publicación de nuevas guías para el diagnóstico, el tratamiento y la prevención de las IFI en el TOS. En estas guías se destaca la importancia de las estrategias de prevención para evitar al máximo la aparición de este tipo de infecciones, que tienen una elevada morbilidad y mortalidad. Con todo ello, y a pesar de los avances de los últimos años, el diagnóstico y el tratamiento de las infecciones fúngicas invasoras en el receptor de un trasplante de órgano sólido sigue siendo, en ocasiones, un reto, por lo que se debe continuar la investigación para mejorar su pronóstico.
FinanciaciónLa Dra. Y. Meije tiene un contrato «Río Hortega» financiado por el Instituto de Salud CarlosIII (ISCIII) y la Fundación para la Investigación Biomédica del Hospital Ramón y Cajal.
Este estudio ha sido financiado por la Red Española de Investigación en Patología Infecciosa (REIPI), RD06/0008.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion